高中化学铝三角知识点总结
铝三角和铁三角(高一章节总结)

学方程式或离子方程式
(3)2Fe2++Cl2=2Fe3++2Cl(4)2Fe3++H2S=2Fe2++S+2H+ (5)FeO+C=Fe+CO (6)Fe2O3+3CO=2Fe+3CO2
铝和铁的化合物
总结:Fe→Fe2+加弱氧化剂,例如:S、H+(非氧化性酸、Cu2+等) Fe→Fe3+加强氧化剂,例如:Cl2、HNO3等 Fe2+主要体现还原性;Fe3+主要体现氧化性
铝和铁的化合物
例4、 0 +2 +3 Fe、 Fe 、 Fe 三者之间的相互转化关系,各举一例写出有关的化
学方程式或离子方程式
铝和铁的化合物
例4、 0 +2 +3 Fe、 Fe 、 Fe 三者之间的相互转化关系,各举一例写出有关的化 (1)Fe+2H+=Fe2++H2↑ (2)2Fe+3Cl2=2FeCl3
(6) AlO2- + 4H+ = Al3+ + 2H2O
铝和铁的化合物
例2 请同学们回忆下面两个我们曾经做过的实验 NaOH溶液 AlCl溶液 【要求】 1.A、B中的反应现 象是否相同?(用离 子方程式表示)
AlCl溶液 A
NaOH溶液 B
铝和铁的化合物
答案: (A)Al3++3OH- =Al(OH)3 ↓ Al(OH)3 + OH- = AlO2- + 2H2O
Fe3+,高锰酸钾溶液本身显紫色,故应选C。 注:学生容易忽视高锰酸钾的颜色。
人教版高中化学必修1课件 “铝三角”的转化关系

“铝三角”的转化关系
(2 ) 沉淀Al(OH)3物质的量为: 3.12g/78g/mol=0.04mol Al3+为0.05mol 1)若Al3+过量,耗NaOH 0.04×3=0.12mol a=2.4mol.l-1 2)若Al3+完全沉淀, Al(OH)3为0.05mol ;耗NaOH 0.15mol, 溶解0.01mol Al(OH)3需NaOH 0.01mol, 共需NaOH 0.16mol ∴a=3.2mol.l-1 从上面的解题过程可以看出,关键是明确化学原理,掌握Al3+ 与OH- 、AlO2-与H+量的相互关系,再进行综合分析。 可见Al3+、Al(OH)3 、AlO2-之间的应用非常广泛,但无论题型 怎样变化,只要掌握了它们之间的相互关系讲就能迎仞而解。
“铝三角”的转化关系 2、 Al(OH)3的制取问题
从“铝三角”可知,制取Al(OH)3的较好途径有:
Al3++3NH3· H2O = Al(OH)3↓+3NH4+
注:不能用强碱
AlO2- +CO2(过量) +2H2O = Al(OH)3↓+HCO3-
注:不能用强酸
“铝三角”的转化关系
例:某无色溶液可能由Ba(NO3)2、MgCl2、KOH、 KHS、Al2(SO4)3中的一种或几种混合而成,在此溶液中 逐滴加入稀HNO3,先产生白色沉淀,而后白色沉淀又会溶 解,则该溶液中所含的溶质是上述物质中的 溶于水得到的。其相互反应的离子方程式 是 。 【解析】由“溶液中逐滴加入稀HNO3,先产生白色沉淀, 而后白色沉淀又会溶解”可得溶液中含AlO2-,并由Al3+和过 量OH-反应得到,因此溶液中所含的溶质为KOH(过量) Al2(SO4) 反应的离子方程式是Al3++4OH-= AlO2-+2H2O
铝三角专题

2)向AlCl3溶液中逐滴加入氨水至过量 ) 现象:出现白色沉淀, 现象:出现白色沉淀,且沉淀不消失 Al 方程式: 方程式: 3++3NH3·H2O = Al(OH)3↓+3NH4+
Al(OH)3/mol
0
NH3·H2O/mol
3)向NaOH溶液中滴加 ) 溶液中滴加AlCl3溶液至过量 溶液中滴加 现象:先无现象,后出现沉淀, 现象:先无现象,后出现沉淀,且沉淀不消失 方程式: 方程式: Al3++4OH- = AlO2- +2H2O Al3++3Al02- +6H2O=4Al(OH)3↓
3).Na2CO3溶液和盐酸溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中 将其中一种溶液 逐滴加入另一种溶液b中, 逐滴加入另一种溶液 若立即有气泡,则 溶液、 为 若立即有气泡 则a Na2CO3溶液、b为盐酸 溶液; 若开始没有现象,后有气泡 则 为盐酸溶液、 若开始没有现象,后有气泡,则a为盐酸溶液、 b为Na2CO3溶液; 溶液; 为
9)向含有物质的量相等的MgCl2 、AlCl3、 )向含有物质的量相等的 滴加入NaOH至过量 混合溶液中逐 滴加入 至过量
4.互滴法鉴别的物质举例 互滴法鉴别的物质举例 1)AlCl3 溶液和 ) 溶液和NaOH溶液的鉴别 溶液的鉴别: 溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中, 将其中一种溶液 逐滴加入另一种溶液b中 逐滴加入另一种溶液 若立即产生沉淀,后来沉淀溶解 则 若立即产生沉淀 后来沉淀溶解,则aNaOH 后来沉淀溶解 溶液、 为 溶液、b为AlCl3溶液; 若开始没有沉淀,后来有沉淀 则 为 若开始没有沉淀 后来有沉淀,则a为AlCl3溶 后来有沉淀 溶液; 液、b为NaOH溶液; 为 溶液
铝三角习题分析

①过量OH— ②过量H + ③H + ④OH — ⑤H + ⑥OH — “铝三角”的图像分析及计算知识点一、铝三角1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系2、铝三角的应用①制取Al(OH)3常用弱碱与可溶的铝盐反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+也可以用偏铝酸盐与弱酸反应:AlO 2- + CO 2 + 2H 2O == Al(OH)3↓+ CO 32-知识点二、铝的化合物的有关图象1、基本图象①向铝盐溶液中逐滴滴加强碱性溶液直至过量 如若将强碱性溶液换成氨水又是怎样的图像?现象:先产生沉淀,后沉淀消失。
现象:Al 3+ + 3OH -= Al(OH)3↓ 离子方程式:Al(OH)3 + OH - = AlO 2-+2H 2O如若将强碱性溶液换成氨水又是怎样的图像?③向偏铝酸盐溶液中逐滴滴加强酸溶液直至过量 将强酸溶液换成弱酸(如通入CO 2)又是怎样的图像?现象: 现象:离子方程式: 离子方程式:Al 3+ Al(OH)3AlO 2—2、基本图象的拓展①若AlCl3溶液中混有MgCl2,向此溶液中逐滴滴加NaOH溶液直至过量,发生了什么反应?图象是怎样的?现象:开始产生沉淀,之后沉淀部分溶解写出涉及的离子方程式:Mg2+ + 2OH-= Mg (OH)2↓Al3+ + 3OH-= Al(OH)3↓Al(OH)3 + OH-= AlO2-+2H2O②若AlCl3溶液中除混有外MgCl2,还混有盐酸,向此溶液中逐滴滴加NaOH溶液直至过量,发生的反应有何不同,图象有什么样的变化?现象:开始无沉淀,之后产生沉淀,之后沉淀部分溶解H+ + OH-= H2OMg2+ + 2OH-= Mg (OH)2↓Al3+ + 3OH-= Al(OH)3↓Al(OH)3 + OH-= AlO2-+2H2O③若AlCl3溶液中除混有MgCl2和盐酸外,还混有NH4Cl,向此溶液中逐滴滴加NaOH溶液直至过量,发生的反应又有何不同,图象又有什么样的变化?现象:离子方程式:H+ + OH-= H2OMg2+ + 2OH-= Mg (OH)2↓Al3+ + 3OH-= Al(OH)3↓NH4++ OH-NH3·H2OAl(OH)3 + OH - = AlO 2-+2H 2O【变式训练1】Al 2(SO 4)3和MgSO 4混和,加适量水溶解,再加入KOH 溶液,析出的沉淀量(W)与KOH 溶液体积(V)的关系如图,则Al 2(SO 4)3和MgSO 4的物质的量之比是A . 2:1B . 1:2C . 1:1D . 1:3 【典型例题】例1 向30 mL 1 mol·L -1的AlCl 3溶液中逐渐加入浓度为4 mol ·L -1的NaOH 溶液,若产生0.78 g 白色沉淀,则加入的NaOH 溶液的体积可能为 ( )A .3 mLB . mLC .15 mLD . mL例2某无色溶液中,已知含有H +、Mg 2+、Al 3+等阳离子,逐滴加入NaOH(溶液),则消耗NaOH(溶液)体积(x 轴)和生成沉淀量(y 轴)之间的函数关系,可用下图表示,则下列图中正确的是 ( )例3 将0.1 mol 的镁、铝混合物溶于100 mL 2 mol ·L -1的H 2SO 4溶液中,然后再滴加1 mol ·L -1的NaOH 溶液。
重难点九 铝的化合物之间的相互转化—“铝三角”

重难点九 铝的化合物之间的相互转化----“铝三角”【要点解读】 1.Al 3+―→Al(OH)3(1)可溶性铝盐与少量NaOH 溶液反应: (2)可溶性铝盐与氨水反应:2.Al(OH)3―→Al 3+:Al(OH)3溶于强酸溶液: 3.Al 3+―→AlO 2-:可溶性铝盐与过量的强碱反应: 4.AlO 2-―→Al 3+:偏铝酸盐溶液与足量的盐酸反应: 5.AlO 2-―→Al(OH)3:偏铝酸钠溶液中加入少量盐酸: 6.Al(OH)3―→ AlO 2- :Al(OH)3溶于强碱溶液: 【温馨提示】三种物质相互转化注意反应条件,特别是Al(OH)3既能溶于强酸,又能溶于强碱。
【特别提醒】 1.两性化合物的概念指既能与酸反应,又能与碱反应的化合物。
与酸或碱反应生成的产物是盐和水的化合物才是两性化合物。
弱酸的铵盐、弱酸的酸式盐不属于两性化合物。
2.Al(OH)3的三种制备方法(1)用铝盐和氨水制备Al(OH)3,不选用强碱(如NaOH)溶液,是由于Al(OH)3溶于强碱溶液,而不溶于弱碱(如氨水)溶液。
(2)溶液中AlO 2-→Al(OH)3最好通入CO 2,而不是选用强酸,因为氢氧化铝溶于强酸,而不溶于较弱的酸。
3.常见的既能与酸反应又能与碱反应的物质 (1)金属单质:Al 等; (2)两性氧化物:Al 2O 3等; (3)两性氢氧化物:Al(OH)3 等;(4)弱酸的铵盐:(NH 4)2CO 3、CH 3COONH 4、(NH 4)2S 等; (5)弱酸的酸式盐:NaHCO 3、KHS 、NaHSO 3等。
【重难点指数】★★★★【重难点考向一】氢氧化铝的制取和性质探究【例1】实验室制取氢氧化铝的最佳方案是( )A.Al+H2O B.Al2O3+H2O C.AlCl3+NaOH D.Al2(SO4)3+NH3•H2O【重难点考向二】铝及其化合物性质探究【例2】某同学通过系统实验探究铝及其化合物的性质,操作正确且能达到目的是( ) A.向氯化铝溶液中滴加过氨水,最终得到澄清溶液B.等质量的铝分别与足量的盐酸和氢氧化钠溶液反应制得等质量的氢气C.常温下铝与浓硝酸反应制得大量的NO2D.AlCl3溶液加热蒸干得到无水氯化铝晶体【重难点考向三】铝三角之间的转化【例3】A、B、C、D、E五种化合物均含有同一种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E易溶于水.若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片)(1)写出化学式:A______,B________,C________,D________,E________;(2)写出下列反应的离子方程式:A→B:___________________________________________________;A→D:___________________________________________________。
铝三角知识点
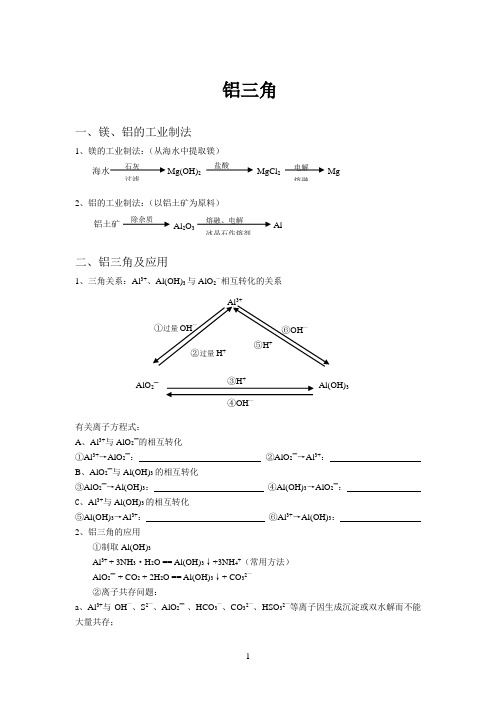
1①过量OH —②过量H+③H +④OH—⑤H + ⑥OH —铝三角一、镁、铝的工业制法1、镁的工业制法:(从海水中提取镁)2、铝的工业制法:(以铝土矿为原料)二、铝三角及应用1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系有关离子方程式:A 、Al 3+与AlO 2—的相互转化①Al 3+→AlO 2—: ②AlO 2—→Al 3+:B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3: ④Al(OH)3→AlO 2—: C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+: ⑥Al 3+→Al(OH)3: 2、铝三角的应用①制取Al(OH)3Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+(常用方法) AlO 2—+ CO 2 + 2H 2O == Al(OH)3↓+ CO 32—②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2—、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存;Al 3+Al(OH)3AlO 2— 石灰过滤 海水Mg(OH)2 盐酸 MgCl 2 电解 熔融Mg铝土矿 除杂质 Al 2O 3 熔融、电解冰晶石作熔剂 Al2 b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
三、铝的化合物的有关图象1、向AlCl 3溶液中逐滴滴入NaOH 溶液至过量(如图①) 有关反应:Al 3+ + 3OH —== Al(OH)3↓Al(OH)3 + OH — == AlO 2—+ 2H 2O 现象:先产生白色沉淀,后沉淀逐渐消失2、向AlCl 3溶液中逐滴滴入氨水至过量(如图②) 有关反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓ +3NH 4+ 现象:产生白色沉淀,继续加氨水,沉淀不消失。
高中化学 3.2《几种重要的金属化合物》铝三角的关系及应用 新人教版必修1

• A、向AlCl3溶液中逐滴加入NaOH溶液至过量 • B、向AlCl3溶液中逐滴加入氨水至过量 • C、向NaAlO2溶液中逐滴加入盐酸至过量 • D、向NaAlO2溶液中通入CO2至过量 • E、向NaOH溶液中逐滴加入AlCl3溶液至过量
(4)物质鉴别
• 不用任何其他试剂(包括水),只用试 管和滴管,鉴别AlCl3溶液和NaOH溶液
铝三角的关系及应用
1、铝三角的关系
显酸性 Al3+
4OH4H+
AlO2显- 碱性
3OH- 3H+
H+ OH-
Al(OH)3 显 两性
2、铝三角的实质
• 定性:铝三角的转化依溶液的酸碱性 不同而进行
• 定量:铝三角的转化依电荷数或酸碱 用量配平
3、铝三角的应用
• (1)判断溶液的酸碱性 • 现有等物质的量浓度的下列溶液,AlCl3、
A、①②③④ B、①③④⑤
C、①②③⑤ D、②③④⑤
现Na有OH甲,、若乙将两11瓶0m溶l甲液和,3分0 别ml是乙A混l2合(S或O4把)3和30ml 甲和110ml乙混合,均能生成3.12克沉淀,若 将30ml甲和100ml乙混合则生成6.24克沉淀。 则:
(1)甲
,乙
。
(2)两瓶溶液的浓度
为
,
。
(3)若将上述三种悬浊液混合在一起,要把 沉淀全部溶解,至少需要0.2mol/L由大 到小顺序排列
(2)判断离子共存
• 判断以下各组离子能否共存 • A、Al3+ 、OH• B、Al3+ 、H+ • C、AlO2-、OH• D、AlO2-、H+ • E、AlO2-、Al3+
化学一轮复习热点突破用数形结合思想理解“铝三角”

热点突破5 用数形结合思想理解“铝三角"[解题策略] Al3+、Al(OH)3、AlO错误!之间的转化关系(“铝三角”)写出上述转化的离子方程式:(1)①Al3++3NH3·H2O===Al(OH)3↓+3NH错误!;②Al3++3AlO错误!+6H2O===4Al(OH)3↓;③Al3++3OH-===Al(OH)3↓;(2)Al(OH)3+3H+===Al3++3H2O;(3)Al3++4OH-===AlO错误!+2H2O;(4)AlO-,2+4H+===Al3++2H2O;(5)①AlO错误!+CO2+2H2O===Al(OH)3↓+HCO错误!;②AlO -,2+H++H2O===Al(OH)3↓(6)Al(OH)3+OH-===AlO错误!+2H2O授课提示:对应学生用书第45页角度一借助图像理解“铝三角"(四个基本图像)1.可溶性铝盐溶液与NaOH溶液反应的两个图像操作向可溶性铝盐溶液中逐滴加入NaOH溶液至过量向NaOH溶液中逐滴加入可溶性铝盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→消失无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不消失图像离子方程式Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO错误!+2H2OAl3++4OH-===AlO错误!+2H2O,3AlO错误!+Al3++6H2O===4Al(OH)3↓2.偏铝酸盐溶液与盐酸反应的两个图像操作向偏铝酸盐溶液中逐滴加入稀盐酸至过量向稀盐酸中逐滴加入偏铝酸盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→无沉淀(有但即溶)→出现沉淀→渐多→最多消失→沉淀不消失图像离子方程式AlO错误!+H++H2O===Al(OH)3↓,Al(OH)3+3H+===Al3++3H2OAlO错误!+4H+===Al3++2H2O,Al3++3AlO-2+6H2O===4Al(OH)3↓题组训练1.模仿上述图像,画出“向MgCl2、AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液至过量”的V(NaOH)沉淀图像.解析:NaOH溶液逐滴滴入含Mg2+、Al3+、H+的溶液时,OH-先与H+反应,然后再与Mg2+、Al3+同时反应生成Mg(OH)2、Al(OH)3,Mg2+和Al3+同时沉淀完全后溶解Al(OH)3。
