绪论 热力学基础
大学物理热力学基础

大学物理热力学基础热力学是物理学的一个分支,它研究热现象中的物理规律,包括物质的热性质、热运动和热转化。
在大学物理课程中,热力学基础是物理学、化学、材料科学、工程学等学科的基础课程之一。
热力学基础主要涉及以下几个方面的内容:1、热力学第一定律热力学第一定律,也称为能量守恒定律,是指在一个封闭系统中,能量不能被创造或消除,只能从一种形式转化为另一种形式。
这个定律说明,能量在传递和转化过程中是守恒的,不会发生质的损失。
2、热力学第二定律热力学第二定律是指热量只能从高温物体传递到低温物体,而不能反过来。
这个定律说明,热量传递的方向是单向的,不可逆的。
这个定律对于理解能源转换和利用具有重要意义。
3、热力学第三定律热力学第三定律是指绝对零度下,物质的熵(表示物质混乱度的量)为零。
这个定律说明,在绝对零度下,所有物质的分子和原子都处于静止状态,没有热运动,因此熵为零。
这个定律对于理解物质在低温下的性质和行为具有重要意义。
4、理想气体状态方程理想气体状态方程是指一定质量的气体在恒温条件下,其压力、体积和密度之间的关系。
这个方程对于理解气体在平衡状态下的性质和行为具有重要意义。
5、热容和焓热容和焓是描述物质在加热和冷却过程中性质变化的物理量。
热容表示物质吸收或释放热量的能力,焓表示物质在恒温条件下加热或冷却时所吸收或释放的热量。
这两个物理量对于理解和分析热现象具有重要意义。
大学物理热力学基础是物理学的重要分支之一,它为我们提供了理解和分析热现象的基本理论工具。
通过学习热力学基础,我们可以更好地理解能源转换和利用的原理,为未来的学习和职业生涯打下坚实的基础。
在无机化学的领域中,化学热力学基础是理解物质性质、反应过程和能量转换的重要工具。
本篇文章将探讨化学热力学的基础概念、热力学第一定律、热力学第二定律以及热力学第三定律。
一、化学热力学的基础概念化学热力学是研究化学反应和相变过程中能量转换的科学。
它主要涉及物质的能量、压力、温度和体积等物理量之间的关系。
物理化学-热力学第一定律
❖ 小结:
➢ W和Q是系统与环境间交换能量的两种形式;不是能量存在 的形式,而是能量传递的形式;
➢ 不能说系统某个状态具有多少热、多少功; ➢ 计算W和Q一定要与系统与环境间发生热交换的过程联系; ➢ 系统内部的能量交换不可能是热或功。
➢ W和Q 不是状态函数,其数值与变化途径有关,为途径函数;
➢ Q和W的微小变化用符号 δ 而不能用d表示。即:δQ和δW
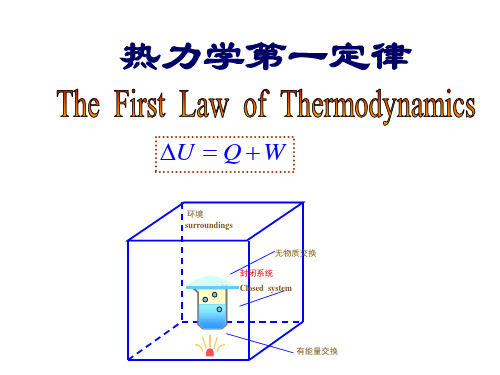
热力学第一定律
U Q W
环境 surroundings
无物质交换 封闭系统 Closed system
有能量交换
第一章 热力学第一定律
§1.1 §1.2 §1.3 §1.4 §1.5
热力学绪论 热力学基本概念 热力学第一定律 可逆过程与体积功 焓
§1.6 热容
§1.7 热力学第一定律的应用
§1.8 热化学 §1.9 化学反应热效应的计算 §1.10 能量代谢与微量量热技术简介
§1.1 热力学绪论
➢ 机械运动——物体的空间位置发生变化。 ➢ 热运动——由大量无规则运动的分子所组成的宏观物质以热现象
为主要标志的运动。
➢ 热现象——物质物理性质随温度变化的现象。 ➢ 热学——研究物质热现象、热运动规律以及热运动同其它运动形
式之间转化规律的一门学科。
➢ 热学理论两种方法——热力学方法和统计物理学方法
适用条件:封闭系统。
能量守恒定律
Joule(焦耳)和 Mayer(迈耶尔)自1840年起, 历经 20 多年,用各种实验求证热和功的转换关系, 得到了一致的结果。
即: 1 cal = 4.1840 J
3.化学过程 过程:系统发生了一个从初态到末态的变化,
称为系统发生了一个热力学过程。 途径:从初态到末态的具体步骤。
第1章 绪论

体积,V----volume, m3 (或l, ml) 压力,p----absolute pressure, MPa (atm,) 能量,E----energy, Joule, J(Nm)
化学工业出版社
化学工业出版社
推算这些性质,需要输入物质的基 础数据,如分子量、正常沸点、临界参 数、蒸汽压甚至混合物的共沸点等性质。 教材的附录中列出了部分物质的基础数 据。
化学工业出版社
●热力学基本概念回顾 热力学基本概念回顾
▲系统与环境→物质与能量的交换 封闭系统 敞开系统 孤立系统 ▲ 强度性质与容量性质 与系统的物质量无关的性质称为强度性质, 如系统的温度T、压力P等。反之,与系统中 物质量的多少有关的性质称为容量性质,如 系统的总体积Vt、总内能Ut等。单位质量的容 量性质即为强度性质。
面向21世纪课程教材 面向 世纪课程教材
化工热力学
陈新志、蔡振云、胡望明等编
化学工业出版社
绪论 Introduction
●化工热力学的目的、意义和范围
▲Thermo-dynamics,是讨论热与功的转化规律。经 典热力学建立在热力学三个基本定律之上。运用数 学方法,可以得到热力学性质之间的关系。 ▲本课程的主要目的是运用经典热力学原理来解决如 下实际问题: (1)过程进行的可行性分析和能量有效利用; (2)平衡状态下的热力学性质计算。即流体的性质随 着温度、压力、相态、组成等的变化。 计算机的广泛应用为化工过程设计所需热力学 数据的获取,以及模型化提供了强有力的基础。
化学工业出版社 ห้องสมุดไป่ตู้
●热力学基本量纲
关于热力学SI(International System of Units) Time , t----second, s Length, l----meter, m Mass, m----kilogram, Kg Force, F----newton,N (F=ma) Temperature,T----Kelvin tem., K (temperature,t---- Celsius tem., ℃ Fahrenheit tem., ℉) T(K)=t(℃)+273.15 t(℉)=1.8t(℃)+32
绪论、导热的基本概念和定律

q tw1 - tw2
A
三、导热系数( Thermal conductivity )
傅利叶定律给出了导热系数的定义 :
q / gradt w/m·℃
导热系数在数值上等于单位温度梯度作用下 单位时间内单位面积的热量。导热系数是物性 参数,它与物质结构和状态密切相关,例如物 质的种类、材料成分、温度、 湿度、压力、密 度等,与物质几何形状无关。它反映了物质微 观粒子传递热量的特性。
t t
x
dydz
t x
2t x 2
dx dydz
△x= x-x+dx
2t x 2
dxdydz
d τ时间内、沿 x 轴方向导入微元体净热量
x
x
- xdx
2t x 2
dxdydz
d τ时间内、沿 y 轴方向导入微元体净热量
夏天人在同样温度(如:25℃)的空气和水中的感觉 不一样。为什么?
在下列技术领域大量存在传热问题
动力、化工、制冷、建筑、环境、机械制 造、新能源、微电子、核能、航空航天、 微机电系统(MEMS)、新材料、军事科 学与技术、生命科学与生物技术…
§1-2热量传递的三种基本方式
热量传递基本方式: 热传导——两个不同温度的物体相接触或 同一物体不同温度的各部分之间,由物质 微粒热运动传递的热量。 热对流——随着流体微团位移,将热量从 一处带往另一处。 热辐射——物体将本身的内能转化为辐射 能,向外发射电磁波。
t+Δ t t t-Δ t
二、 导热的基本定律
1.付立叶定律 Ф =qA=- Agrad t q =- grad t
2024版傅献彩物理化学电子教案课件

01绪论Chapter物理化学概述物理化学的定义01物理化学的研究范围02物理化学在化学科学中的地位03物理化学的研究对象与任务研究对象研究任务实验方法通过实验手段观测和记录物质的物理现象和化学变化,获取实验数据。
理论方法运用数学、物理学等理论工具对实验数据进行处理和分析,揭示物质的基本规律。
计算方法利用计算机模拟和计算等方法,对物质的性质、结构和变化规律进行预测和研究。
物理化学的研究方法030201物理化学的学习方法与要求学习方法学习要求02热力学基础Chapter热力学基本概念与术语热力学系统状态与状态函数过程与途径热力学平衡态热力学第一定律能量守恒定律能量不能创造也不能消灭,只能从一种形式转化为另一种形式。
热力学能系统内能的变化等于传入系统的热量与外界对系统做功之和。
焓定义为系统的热力学能与体积的乘积,用于描述等压过程中的能量变化。
热力学第二定律热力学第二定律表述热力学温标熵增原理热力学函数与基本方程热力学函数热力学基本方程麦克斯韦关系式热力学在化学中的应用化学反应的热效应化学平衡相平衡03化学动力学基础Chapter化学反应速率的概念与表示方法化学反应速率表示方法摩尔浓度变化率、质量浓度变化率、气体分压变化率等化学反应速率理论简介碰撞理论过渡态理论01020304浓度越高,反应速率越快。
反应物浓度温度越高,反应速率越快。
温度催化剂可以降低反应的活化能,从而加快反应速率。
催化剂对于有气体参与的反应,压力的变化会影响反应速率。
压力影响化学反应速率的因素复杂反应动力学简介平行反应竞争反应连续反应根据反应条件(如温度、压力、浓度等)预测反应的速率。
预测反应速率通过调整反应条件(如温度、压力、催化剂等)来优化反应速率和选择性。
优化反应条件通过分析反应速率与各种因素的关系,可以推断出反应的机理和过渡态的性质。
研究反应机理化学反应速率理论的应用04电化学基础Chapter电化学基本概念与术语电化学电极电解质电离电导率将化学能转变为电能的装置。
第15讲热力学基础——基本概念热力学第一定律及其运用内容6

第15讲:热力学基础——基本概念热力学第一定律及其运用
内容:§6-1,§6-2,§6-3,§6-4
1.热力学绪论(10分钟)2.物态参量和平衡过程、理想气体的物态方程(20分钟)3.热力学过程
4.内能、功和热量(20分钟)5.热力学第一定律(20分钟)6.热力学第一定律在等体和等压过程中的应用(30分钟)
要求:
1.了解描述气体的物态参量和平衡过程的概念;
2.掌握理想气体的物态方程;
3.理解准静态过程的概念;
4.掌握内能、功和热量的概念;
5.掌握定压摩尔热容和定容摩尔热容的概念;
6.掌握热力学第一定律;
7.掌握热力学第一定律在等体和等压过程中的应用。
重点与难点:
1.理想气体的物态方程;
2.热力学第一定律;
3.热力学第一定律的应用。
作业:
问题:P218:1,2,5,6
习题:P220:2,5,9,11
预习:§6-5,§6-6
物态参量之间的关
在热力学系统所经过的绝热过程(包括非静态的绝热过程)中,外界对系统所作的功仅取决于系统的初态和终态。
《高等化工热力学》课件

目录
• 绪论 • 热力学基础 • 化学平衡 • 相平衡 • 热力学在化工过程中的应用 • 结论与展望
01
绪论
热力学的定义与重要性
总结词:基本概念
详细描述:热力学是一门研究热现象的物理学分支,主要关注能量转换和传递过程中的基本规律和性 质。在化工领域,热力学是核心理论基础之一,对于化工过程的优化、设计和改进具有重要意义。
反应过程的优化提供理论支持。
加强与环境、能源等领域的交叉研究,探索化工过程 的绿色化、低碳化、资源化发展路径,为可持续发展
提供科技支撑。
针对复杂化学反应体系的热力学性质和传递特 性进行研究,发展适用于复杂体系的热力学模 型和计算方法。
结合人工智能、大数据等先进技术,发展智能化 的热力学分析和优化工具,提高化工过程的效率 和效益。
谢谢观看
化工过程的节能与减排
节能技术
利用热力学原理,开发和应用节能技术,降低能耗和减少温室气体排放。
减排措施
通过改进工艺和采用环保技术,减少化工过程对环境的污染和排放。
06
结论与展望
高等化工热力学的重要性和应用价值
高等化工热力学是化工学科中的重要分支,它涉及到化学反应、传递过程和热力学的基本原理,是实 现高效、低耗、安全、环保的化工生产的关键。
03
化学平衡
化学平衡的基本概念
化学平衡的定义
在一定条件下,可逆反应的正逆 反应速率相等,反应体系中各物 质的浓度不再发生变化的状态。
平衡常数
在一定温度下,可逆反应达到平衡 时各生成物浓度的系数次幂的乘积 与各反应物浓度的系数次幂的乘积 之比。
平衡态的描述
平衡态是系统内部各组分浓度和能 量达到相对稳定的状态,可以用状 态方程和热力学函数来描述。
热工理论及应用

绪论及第一章基础知识一、名词解释工程热力学传热学泵风机热力系边界外界高温热源低温热源热机工质平衡状态准平衡过程可逆过程不可逆过程二、填空1. 传热学是研究规律的一门学科。
2. 火力发电厂的热动装置是由锅炉、、、给水泵等热力设备组成,依次进行定压吸热、、和绝热压缩等热力过程。
3. 与外界既无能量交换也无物质交换的热力系称为热力系。
与外界有物质交换的热力系称为_______;与外界没有________交换的热力系称为孤立系。
4. 热力系通过边界与外界的相互作用可能有____ __交换和______交换两种情况。
5. 根据热力系通过边界与外界发生作用的情况,将热力系分为:闭口系、、绝热系、系。
常采用的热力系有___、___、__、___。
6. 如果热力系处于状态,则不能在状态参数坐标图上表示。
7. 火力发电厂的能量转换顺序是:化学能→→→电能。
8. 火力发电厂应用的工质应具有良好的_________性和_________性,常用的工质是_________。
9. 火电厂热力部分的热源是__________,冷源是__________,热机是__________。
10. 热量与膨胀功都是量,热量是通过差而传递的热能,膨胀功是通过差传递的机械能。
11. 做功的动力是压差,用这一状态参数的变化表示热力系与外界有否做功;传热的动力是,用熵这一状态参数表示热力系与外界是否传热。
12. 工质的热力学基本状态参数是________、________、________。
13. 状态参数只取决于,而与无关。
不可逆循环的 ds 0。
14. 从数学上讲,工质的状态参数是___函数,设状态参数x自初态1变化到终态2,则它的积分可表示为____。
15. 使系统实现可逆过程的条件是:(1)______________,(2)__________(3)______________。
16. 760mmHg=_______mmH2O=_______Pa。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、开口系统
系统与外界之间不仅有热 量和功量的交换,而且还有物 质交换的系统称之为开口系统。
如图所示,研究汽轮机内部的热力过程,取机器 内部和进出口微元为研究系统,工质源源不断地流入 设备dm1,对外输出轴功dws后,由流出出口dm2,系 统不仅由热量Q和功量Ws的交换,也有工质的流入流 出,所以,该系统就是开口系统。
当工质从某一状态出发,经 过一系列的中间热力过程又回 到原来状态时,就完成了一个 封闭的热力过程,我们把经过 一系列中间过程,又回到原点 的热力工程称为热力循环。
p
p
4
3
2
1
0
0
1
2
3
4
5
6
7
8
v
8
7
6
5
4
3
2
1
0
0
1
2
3
4
5
6
7
8
v
四、功与热量
热力学中工质的能量交换有功和热量 两种形式。 1、功:是力和在力的方向上发生的位移的乘积。 功用W来表示,W=F*x . 对于热力学工质来 讲,F代表活塞上的作用力。 在F力作用下,活 塞发生单位位移变化的微元功dw=Fdx.
1、能量的种类:
机械能、热能、电能、化学能、核能、辐射能。
2、能源的利用形态:
一次能源:凡自然界中现存的、可直接取得而不改变其 基本形态的能源。 如,煤、天然气、水能、生物质能、地热 能、风能、太阳能等。
二次能源:由一次能源经加工或转换而成的另一种形态 的能源。 如,电力、蒸汽、焦碳、煤气、沼气、氢气、石 油制品等; 生产过程排出的余热(高温烟气、可燃废气、 排放有压流体等)。
创造和消灭,但可以转换和转移。 当能量发生形式转换和在物体间转移时,能量的
总和保持不变。 热力学第一定律:
在热能与其他形式的能的互相转换过程中能量 的总和保持不变。即是能量转换与守恒定律在工程 热力学中的应用。
对于一个系统来讲: 进入系统的能量—离开系统 的能量=系统存储能量的变化量。
热力学能量:
们要节约能源。 能源问题:再生能源的利用技术,新能源的开发利
用。 节能和环保成为当今世界的主题和热点。
3、热 能
①、热能发生途径: 直接产生——如地热能、海洋热能 通过能量形式转换产生——化学能的转换: 燃烧放热反应,生成CO2和水 电能转换:焦耳效应。 辐射能转换:热辐射 核能转换:核裂变和核聚变中释放出大量的热 机械能的转换:摩擦生热
5、熵
熵是表示单位质量物质,在某一温度下, 发生单位热量传递时,转化为工质内部低级 能量的数量,其单位是 j/K.kg。
熵是一个导出的状态量,用s来表示。
ds dQ T
熵是一个状态量,给定一定量的工质, 就有一定的熵值。
6、焓
焓是流动工质所具有的能量。常用H表示: H=U+pV 焓的物理意义是一定量的工质,流入或
教学大纲
课程教学目标: 通过该课程的学习,应掌握热力循环的基础知识;
熟练掌握热力发动机的主要循环特点、基本工作原 理;熟知发动机混合气形成与燃烧技术,实验理论 与方法。 主要内容:
热力学基础知识;发动机个性能指标;发动机的 主要循环;燃料特性;换气过程分析;混合气的组 织与燃烧;发动机的燃料供给与调节;发动机的使 用与匹配。
热力学:是一门研究物质的能量、能量传递 和转换以及能量与物质性质之间普遍关系的 科学。
工程热力学:是研究热能与其他形式能量之 间转换规律及其工程应用的科学。
学习目的:为学习发动机原理提供必要的基 础理论和分析方法。
第一节 热功转换基础
一、能量与能源
能量是物质运动状态的量度。 能源是指能够直接或间接提供能量的资源。
②、热能的利用方式:热利用和动力利用 热利用:加热物体,取暖、做饭、烘干、冶炼等。 动力利用:通过燃烧,将化学能——热能——机械能。 汽轮机:化学能——蒸汽的热能——经汽轮机转换为机械能; 内燃机:化学能——燃气的热能——经活塞连杆机换为机械能。
热能利用实例
热能的应用在国民经济中的重要地位:
•电力工业——火力发电或核发电,均应用热能转换。 •钢铁工业——炼钢、轧钢、高炉炼铁等均用热能; •有色金属工业——铝、铜等有色金属的冶炼用热能; •化学工业——酸、碱、合成氨的生产过程 •石油工业——采油、炼制、输送等用热能; •建材工业——建材的生产过程用热能。如水泥、陶瓷等; •机械工业——铸造、锻压、焊接等用热能; •轻纺工业——造纸、制糖、化纤、印染等用热能 •交通运输——汽车、火车、船舶、飞机等的动力来之热能; •农业及水产养殖业——电力灌溉、温室培植、鱼池加温等 •生活需要——供暖、空调、烹饪。
3、压力p
压力是气体对单位面积容器壁面所施加的垂直作用力p。 分子运动论认为气体的压力是大量气体分子向壁面撞击 的统计量。分子撞击平均动能越大,撞击的个数越多气体 压力越高。
压力的基本单位是Pa,按定义Pa=N/m2。 工程上由于Pa的单位太小,常用kPa和MPa。
绝对压力:气体作用于容器表面的实际压力值称为绝
汽车发动机原理
吉林大学珠海学院 主讲:邓宝清
电话:7510002
学时分配
绪 论
(4学时)
第1章性能指标与影响因素(4学时)
第2章发动机工作循环(4学时)
第3章发动机燃料特性(2学时)
第4章换气过程(4学时)
第5章混合气形成和燃烧(8学时)
第6章燃料供给与调节(5学时)
第7章使用特性与匹配(3学时)
能U、焓H、熵S。其中T、p、v可以直接测量。
1、热力系统
热力系统:热力学中把某一宏观尺寸范围内的工质作为研究
对象称为热力系统。 与系统有相互作用的其他系统称为外界。包围系统的封闭表
面称为界面。界面可以是真实的,也可以是假设的。
热力系统的分类:
开口系统、封闭系统、绝热系统和孤立系统。
开口系统:系统与外界有能量传递和转换的同时有工质交换。 封闭系统:系统与外界有能量传递和转换但无工质交换。 绝热系统:系统与外界既无热量传递又无工质交换。 孤立系统:系统与外界既无能量传递和转换又无工质交换。
• ③、规定系统对外做工, 既体积膨胀做工为正,外
界对系统做工为负功。 dv
4、热量Q
热量是系统之间能量传递的另一种形式。 热量的传递是由于分子热运动导致的,它包括
热传导、热辐射以及电磁辐射等。
热量传递的动力是分子运动的激烈程度不同,即温度 差,只要纯在温差就会发生传热。系统吸热为正,放 热为负,热量的计算式为: q=tds
绪论
发动机的地位: 发动机是汽车的动力源,发动机的性能
指标直接影响到汽车的性能、可靠性以及 寿命。 本课程主要目标:
汽车发动机原理是以提高发动机性能 为主要研究目标,深入到工作过程的各个 阶段,分析影响性能的规格因素,研究提 高性能指标的具体措施及努力方向。
热力学基础
汽车发动机 〈 往复活塞式内燃机 〈 内燃机 〈 热机:符合热力学过程
2、温度T
温度是表示物体的冷热程度。 分子运动论认为气体的温度是气体内部分子
不规则运动激烈程度的量度,分子无规则平均 动能越大,气体温度越高。
热力学温度T是国际基本单位制,既SI制中的基本 温度,单位是K。并选取水的相变点温度为基本标定 点温度,规定其温度为273.15K。
摄氏温度t与热力学温度的关系:K=t+273.15 *只有热力学温度才是状态参数。 温度的测量仪器是什么? 测量原理是什么?实质是什么?
则该闭口系统的能量守恒方程为:
Q-W= U2-U1
闭口系统能量守恒定律
由闭口系统能量方程 Q-W= U2-U1可得: 1kg工质的能量守恒定律为:
q-w=u2-u1;或q=u2-u1+w 对于一个较小的微元过程有:
dq=du+dw 以上各式均为热力学第一定律在闭口系统 内的不同表达形式。 ①、公式适用于任何热力工程,任何工质; ②、热、功、内能均为带数值,符号按定义; ③、如果dw=pdv,则dq=du+pdv
1、闭口系统
系统与外界之间仅 有热量和功量的交换, 没有物质交换的系统称 之为闭口系统。
如图所示,取封闭在活塞和汽缸内的工质为研究 对象,由1状态变化到2状态,系统与外界之间仅有热 量Q和功量W的交换,没有物质交换因此,该系统就 为闭口系统。如研究内燃机的压缩和做工过程。
对于该系统,加入系统的总能量为Q,系统对外输 出的能量为W,系统内的能量变化量为U2-U1。
2
w12 1 pdv
从功的计算表达式可以看出,功是工质宏观运 动,包括体积变化,工质与外界传递的能量。
3、体积功的性质
由体积功的表达式可以看出: w12
2
pdv
1
• ①、体积对压力的积分既过程功,即为P-V图
中压力过程曲线与V轴围成的曲线面积。
• ②、由1到2的过程是不唯一的,因此,过程曲 线积分是不唯一的,既功是过程量,即便初始 状态和终了状态相同,不同的过程,所完成的 过程功是不同的。
工质由状态1变化到状态2的体积膨胀功,应 积功
作用在活塞上的压强为p,活塞面积为S, 则活塞顶所受的力:F=p*s; 则在F力下所做 的功:dw=Fdx=p*sdx=pdxs=pdV。 对于单位工质所做的功:dw=pdv 单位工质由状态1变化到状态2所做的功:
能源再生性:
一次能源又分为:再生能源和非再生能源。 再生能源:不断再生并有规律地得到补充的能源。
如水能、太阳能、风能、海洋能、地热等。 地球表面吸收的太阳能约为:8.6万兆瓦 非再生能源:经亿万年形成短期内不能再生的能源。
如煤炭、石油、天然气、核燃料等。 两次石油危机,非再生能源储量日益减少,需要我
同理,由状态1经过热力过程变化 到状态2,系统与外界交换的热量 可以由下式计算,也等于t-s图中温 度曲线与横坐标围成的图形面积。
