(完整word版)原电池正负极判断的方法
判断原电池正负极方法

判断原电池正负极方法
判断电池的正负极是非常重要的,因为电池在正常使用过程中必须正
确连接正负极才能提供电力。
以下是一些常见的方法来判断电池的正负极。
1.外观标识法:一般来说,电池上会有标识正负极的符号。
正极通常为"+"号,负极通常为"-"号。
有些电池还会用红色表示正极,用黑色表示
负极。
因此,当你观察到这样的标志时,你就可以轻松地判断出电池的正
负极。
2.电池塞举法:如果电池上没有外观标识,你可以试试用手指或者钳
子夹住电池两侧的金属塞子,然后用舌头轻轻舔一下。
如果你感到了一丝
微弱的电击感,那么塞子所在的一侧就是正极。
3.电池切割法:这是一种非常直接的方法,但需要一件尖锐的工具,
比如刀片。
你可以小心地切割电池外壳,然后观察内部。
一般情况下,正
极是与电池底部的金属片相连的,而负极是与电池顶部的金属片相连的。
4.磁性测试法:有些电池正极是磁性的,而负极则不是。
因此,你可
以使用一个小磁铁来测试电池的正负极。
如果磁铁吸附在电池上,那么吸
附的一侧就是正极。
5.借助仪器法:如果你有一台万用表或者电压表,你可以直接使用它
来测试电池的正负极。
将万用表的两个引脚分别与电池的两个极端接触,
然后观察万用表的读数。
如果读数为正数,那么相应引脚接触的就是正极。
原电池正负极判断的六种方法

原电池正负极判断的六种方法活泼金属做负极,惰性电极做正极。
下面是小编为大家整理的原电池正负极判断的六种方法,仅供参考,欢迎阅读。
原电池正负极判断的六种方法篇1判断正负极的方法方法一:根据两极材料判断。
一般活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极;方法二:根据电极现象判断。
一般情况下电极逐渐溶解为负极,电极增重可放出气体的为正极;方法三:根据电子液动方向来判断。
电子流出的为负极、电子流入的为正极或电流流出的正极、电流流入的负极;方法四:根据原电池里电解质溶液内离子的定向移动方向判断。
阴离子流向的为负极、阳离子流向的为正极;方法五:根据原电池两极发生的变化来判断。
失去电子发生氧化的是负极、得到电子发生还原反应是正极;方法六:根据电解质溶液来判断电极。
能与电解质溶液反应的电极为负极,不能与电解质溶液反应的为正极。
例如:镁、铝为电极,氢氧化钠溶液为电解质溶液,虽然镁比铝活泼,但是由于镁不与氢氧化钠溶液反应,铝能与氢氧化钠溶液反应,所以铝为负极、镁为正极。
原电池是什么把化学能转化为电能的装置。
流经整个体系的电流是由金属导体中的自由电子和溶液中离子的迁移以及电极和溶液界面上伴随发生的氧化、还原反应而进行的。
所以,根据定义,普通的干电池、蓄电池、燃料电池都可以称为原电池。
构成原电池的条件1、活动性不同的两种金(或一种金属,一种为能导电的非金属)作为两个电极;2、两个电极必须以导线相连或直接接触;3、电极插入电解质溶液中形成闭合回路。
原电池正负极判断的六种方法篇2一、原电池、电解池的两极电子从负极通过导线流向正极,电子的定向移动形成电流,电流的方向是正极到负极,这是物理学规定的。
阴极、阳极是电化学规定的,失去电子的极即氧化极,也就是阳极;得到电子的极即还原极,也就是阴极。
原电池中阳极失去电子,电子由阳极通过导线流向阴极,阴极处发生得电子的反应,由于原电池是一种化学能转化为电能的装置,它作为电源,通常我们称其为负极和正极。
原电池正负极判断方法

原电池正负极判断方法电池正负极判断方法:一、外观观察:1. 由正负极标识方便判断:有些电池侧面有正负极标识,大多正极标有十字形,负极边有圆齿状符号,可以直接看上面的标志清楚的区分正负极。
2. 根据电池的形状判断:圆柱电池,两端其中一端有小孔,是负极;另一端平整平滑无小孔,则是正极。
板条电池,大多一端是平整面,另一端有横截面凹入,则横截面凹入那端为正极,另一端即为负极。
二、接触点判断:1. 圆柱电池:正极接触点外形浮凸,而负极接触点外形凹进;2. 板条电池:正极接触点外形空心十字凹槽,负极接触点为实心圆形接触点;3. 螺钉形电池:正极以两个涡纹螺纹连接,负极以一个涡纹螺纹连接;三、颜色判断:1. 大部分电池极性根据颜色可以进行判断,不同厂家和产品颜色稍有不同,一般都是蓝色为正极,红色或黑色为负极;2. 板条电池:有些板条电池极性标记有不同的颜色,容易分清正负极;四、电压测量:1. 利用万用表电压测量:选择万用表的相应通道,将正极和钳头以及负极连接万用表,可以测试出电池的电压,电压大的是正极,电压小的是负极;2. 利用灯泡测量:把灯泡的一端接正极,另一端接负极,当电池正确接线时,灯泡发出亮光,则为正极,灯泡没有发光,则为负极;五、其他方法:1.用小钳夹触摸电池外壳,如果出现脉冲,常用此法测试正负极;2.用电位器测试:用电位器量出电池正负极之间的电位差,电位差大的被确定为正极;3.试验路成看:从电路分析电池正极和负极的联接情况,正极的负端通常接地,负极的正端接直流电源,负极的负端接地,正极侧面接反向阻断元件;4.电路示意图:无论多么简单的电路,均有一个标准示意图,示意图会有大量的线条,有些线条用箭头表示电源输入方向,箭头朝着电池正极,另外也会用文字标识,表明电池是正极和负极;5.用火花放电装置测量:用火花测量仪将正负极极板接在导体上,测量正极和负极的火花放电量,火花的强度放电量越大,就代表正极,越小则代表负极。
原电池和电解池知识点总结

原电池和电解池.1原电池和电解池的比较:2原电池正负极的判断:⑴根据电极材料判断:活泼性较强的金属为负极,活泼性较弱的或者非金属为正极。
⑵根据电子或者电流的流动方向:电子流向:负极T正极。
电流方向:正极T负极。
⑶根据电极变化判断:氧化反应T负极;还原反应T正极。
⑷根据现象判断:电极溶解T负极;电极重量增加或者有气泡生成T正极。
⑸根据电解液内离子移动的方向判断:阴离子T移向负极;氧离子T移向正极。
3 电极反应式的书写:负极:(1)负极材料本身被氧化:n+2+①如果负极金属生成的阳离子与电解液成分不反应,则为最简单的:M-n e- =M 如:Zn-2 =Zn (如果阳离子与电解液成分反应,则参与反应的部分要写入电极反应式中:如铅蓄电池,Pb+S042--2e-=PbS04⑵负极材料本身不反应:要将失电子的部分和电解液都写入电极反应式,如燃料电池CH4-02(C作电极)电解液为KOH:负极:CH4+10OH-8 e-=C032-+7H2O正极:(1)当负极材料能自发的与电解液反应时,正极则是电解质溶液中的微粒的反应,+H2SO4 电解质,如2H+2e=H2 CuS电解质:Cu2++2e= Cu⑵当负极材料不与电解质溶液自发反应时,正极则是电解质中的O2反正还原反应-①当电解液为中性或者碱性时,H2O比参加反应,且产物必为OH,如氢氧燃料电池(KOH电解质)O2+2H2O+4e=4OH+②当电解液为酸性时,H比参加反应,产物为H2OO2+4O2+4e=2H2O4.化学腐蚀和电化腐蚀的区别6.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法①外加电源的'阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
(完整版)原电池和电解池知识点总结
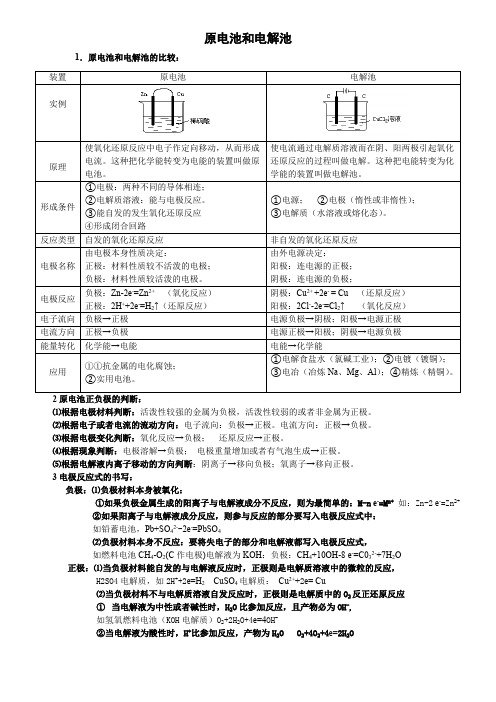
i nt he i rb ei n ga re go od fo rs 原电池和电解池1.原电池和电解池的比较:2原电池正负极的判断:⑴根据电极材料判断:活泼性较强的金属为负极,活泼性较弱的或者非金属为正极。
⑵根据电子或者电流的流动方向:电子流向:负极→正极。
电流方向:正极→负极。
⑶根据电极变化判断:氧化反应→负极; 还原反应→正极。
⑷根据现象判断:电极溶解→负极; 电极重量增加或者有气泡生成→正极。
⑸根据电解液内离子移动的方向判断:阴离子→移向负极;氧离子→移向正极。
3电极反应式的书写:负极:⑴负极材料本身被氧化:①如果负极金属生成的阳离子与电解液成分不反应,则为最简单的:M-n e -=M n+ 如:Zn-2 e -=Zn 2+②如果阳离子与电解液成分反应,则参与反应的部分要写入电极反应式中:如铅蓄电池,Pb+SO 42--2e -=PbSO 4⑵负极材料本身不反应:要将失电子的部分和电解液都写入电极反应式,如燃料电池CH 4-O 2(C 作电极)电解液为KOH :负极:CH 4+10OH-8 e -=C032-+7H 2O 正极:⑴当负极材料能自发的与电解液反应时,正极则是电解质溶液中的微粒的反应,H2SO4电解质,如2H ++2e=H 2 CuSO 4电解质: Cu 2++2e= Cu⑵当负极材料不与电解质溶液自发反应时,正极则是电解质中的O 2反正还原反应①当电解液为中性或者碱性时,H 2O 比参加反应,且产物必为OH -,如氢氧燃料电池(KOH 电解质)O 2+2H 2O+4e=4OH -②当电解液为酸性时,H +比参加反应,产物为H 2O O 2+4O 2+4e=2H 2O装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
原电池正负极的判断依据汇总

1.据组成原电池的两极材料判断一般情况下,较活泼的金属为负极,较不活泼的金属为正极。
例如:锌、铜和稀H2SO4构成的原电池中,由于锌比铜活泼,所以锌为负极,铜为正极。
但是,要特别注意电解质溶液对正负极的影响。
如:镁、铝和稀H2SO4形成的原电池:由于镁和铝在稀H2SO4中镁失电子能力要强,所以镁为负极,铝为正极。
而在镁、铝和NaOH溶液形成的原电池:由于电解质溶液为NaOH溶液,铝要溶解而镁不溶解,所以铝为负极,镁为正极。
2.据电流方向或电子流动方向判断电流是由正极流向负极,电子是由负极流向正极。
3.据电解质溶液里离子的定向移动方向判断在原电池的电解质溶液里,阳离子移向的极是正极,阴离子移向的极是负极。
4.据两极发生的反应判断原电池的负极总是失去电子发生氧化反应,正极总是得到电子发生还原反应。
5.根据电极产生的现象判断(1)据电极质量的变化判断原电池工作一段时间后,若某电极的质量增加,说明溶液中的金属阳离子在该电极上放电,该电极活泼性较弱为正极。
反之,若某电极的质量减小,说明该极金属溶解,该电极活泼性较(2原电池工作时,若某电极上有气泡产生,是因为该电极上有H2析出,说明该极为正极,活泼性较弱。
(3)据电极附近pH的变化判断析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,若某电极附近溶液的pH增大了,说明该电极活泼性较弱为正极。
6.据原电池反应方程式判断原电池反应均为可自发进行的氧化还原反应。
在原电池反应方程式中,先判断出氧化剂和还原剂,则总是还原剂(氧化剂)失(得)电子为负(正)极。
例如:某原电池总反应式为:Cu+2Fe3+=Cu2++2Fe2+,从离子方程式中我们可以看出铜失去电子被氧化成为正二价的铜离子,所以铜为负极。
7.据与原电池相连的用电器判断与原电池相连的不同的用电器,会产生不同的现象,根据用电器所产生的现象可判断原电池的正负极。
(1)若连有电流表,则可根据电流表指针的偏转方向判断原电池的正负极.(2)若连接电解池,则可根据电解池两极上固体质量的变化、气体的产生、附近溶液颜色的变化、溶液中有色带电粒子的移动趋势等判断原电池的正负极。
高一化学必修2_知识总结:原电池正负极的确定

原电池正负极的确定
原电池
原电池正负极的确定:将铜锌两种金属放在电解质溶液中,用导线连接,便构成原电池的两极,如图。
由于Cu、Zn两种金属电势高低不同,所以存在着电势差。
电子总是从低电势的极流向高电势的极。
电势的高低一般可根据金属的活泼性确定:金属越活泼其电极电势就越低,金属越不活泼其电极电势就越高。
由于锌比铜活泼,所以电子总是从锌极流向铜极。
电化学上把电子流出的极定为负极,流入的极定为正极。
如图所示,锌为负极,铜为正极。
1/ 1。
原电池正负极判断的方法

原电池正负极判断的方法河北省宣化县第一中学栾春武在中学化学中判断原电池的正负极一般有如下几种方法:一、由组成原电池的两极材料判断一般来说,较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
但具体情况还要看电解质溶液,如镁、铝电极在稀硫酸中构成原电池,镁为负极,铝为正极;但镁、铝在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生了反应,失去了电子,因此铝为负极,镁则为正极。
再如铝、铜和氢氧化钠溶液构成的原电池中,铝为负极;而若把氢氧化钠溶液换为浓硝酸,则铜为负极。
二、根据外电路电流的方向或电子的流向判断在原电池的外电路,电流由正极流向负极,电子由负极流向正极。
三、根据内电路离子的移动方向判断在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。
四、根据原电池两极发生的化学反应判断原电池中,负极总是发生氧化反应,正极总是发生还原反应。
因此可以根据总的化学方程式中化合价的升降来判断。
五、根据电极质量的变化判断原电池工作后若某一电极质量增加,说明溶液中的阳离子在该电极上放电,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为负极,活泼性较强。
六、根据电极上产生的气体判断原电池工作后,如果一电极上产生气体,通常是因为该电极发生了析出氢气的反应,一说明该电极为正极,活动性较弱。
七、根据某电极附近pH的变化判断析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,该电极附近的pH增大了,说明该电极为正极,金属活动性较弱。
例题分析Cu + Zn2+,那么该原电池的正确组合为:【例题1】某原电池发生的总的离子方程式为:Zn + Cu2+===解析:原电池的电极反应不仅跟电极材料有关,还与电解质溶液的性质有关。
该题考查了原电池的组成,一般来说活泼金属为负极,且能与电解质溶液自发地发生氧化还原反应。
答案:C、D【例题2】某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:根据表中的实验现象完成下列问题:(1)实验1、2中Al所作的电极是否相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原电池正负极判断的方法
在中学化学中判断原电池的正负极一般有如下几种方法:
一、由组成原电池的两极材料判断
一般来说,较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
但具体情况还要看电解质溶液,如镁、铝电极在稀硫酸中构成原电池,镁为负极,铝为正极;但镁、铝在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生了反应,失去了电子,因此铝为负极,镁则为正极。
再如铝、铜和氢氧化钠溶液构成的原电池中,铝为负极;而若把氢氧化钠溶液换为浓硝酸,则铜为负极。
二、根据外电路电流的方向或电子的流向判断
在原电池的外电路,电流由正极流向负极,电子由负极流向正极。
三、根据内电路离子的移动方向判断
在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。
四、根据原电池两极发生的化学反应判断
原电池中,负极总是发生氧化反应,正极总是发生还原反应。
因此可以根据总的化学方程式中化合价的升降来判断。
五、根据电极质量的变化判断
原电池工作后若某一电极质量增加,说明溶液中的阳离子在该电极上放电,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为负极,活泼性较强。
六、根据电极上产生的气体判断
原电池工作后,如果一电极上产生气体,通常是因为该电极发生了析出氢气的反应,一说明该电极为正极,活动性较弱。
七、根据某电极附近pH的变化判断
析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,该电极附近的pH增大了,说明该电极为正极,金属活动性较弱。
