高二化学原电池练习题
【高二特训】新型原电池(解析版)

【高二特训】新型原电池一、单选题1.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。
其中一种镁原电池的反应为:放电Mg x Mo3S4,下列说法错误的是( )xMg+Mo3S 4充电A.放电时,负极反应为Mg﹣2e﹣═Mg2+B.放电时,正极反应为Mo3S4+2xe﹣+xMg2+═Mg x Mo3S4C.放电过程中Mg2+向正极迁移D.放电时,Mo3S4发生氧化反应【答案】D【详解】A.放电时,负极上镁失电子发生氧化反应,电极反应式为:Mg﹣2e﹣=Mg2+,故A正确;B.放电时,正极上Mo3S4得电子发生还原反应,正极反应为Mo3S4+2xe﹣+xMg2+═Mg x Mo3S4,故B正确;C.放电时,阳离子向正极移动,即镁离子向正极迁移,故C正确;D.放电过程中正极反应为Mo3S4+2xe﹣+xMg2+═Mg x Mo3S4,发生的是还原反应,故D 错误;答案选D。
2.一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:--3--VB+16OH-11e=VO+2B(OH)+4H O该电池工作时,下列说法错误的是2442A .负载通过0.04 mol 电子时,有0.224 L(标准状况)O 2参与反应B .正极区溶液的pH 降低、负极区溶液的pH 升高C .电池总反应为3222444VB 11O 20OH 6H O 8B(OH)4VO ---+++=+D .电流由复合碳电极经负载、VB 2电极、KOH 溶液回到复合碳电极【答案】B【分析】根据图示的电池结构,左侧VB 2发生失电子的反应生成3-4VO 和-4B(OH),反应的电极方程式如题干所示,右侧空气中的氧气发生得电子的反应生成OH -,反应的电极方程式为O 2+4e -+2H 2O=4OH -,电池的总反应方程式为4VB 2+11O 2+20OH -+6H 2O=8-4B(OH)+43-4VO ,据此分析。
高二化学原电池的设计和电极方程式的书写

10月13日练习1事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是() A.C(s)+H2O(g)=CO(g)+H2(g) △H>0B.2H2(g)+O2(g)=2H2O(1) △H<0C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<02、下列化学反应在理论上能够设计成原电池的是()A.CaO+H2O= Ca(OH)2 B.CO2在高温下与C化合生成COC.4Al+3O2=2Al2O3 D.2Fe3++Cu=2Fe2++Cu2+3、下列各装置中(见下图)能构成原电池的写出电极反应式;不是原电池的说明原因()4、请用铝、镁、稀硫酸、氢氧化钠溶液设计两个正负电极材料不相同的原电池。
5、请用铝、镁、硫酸、氢氧化钠溶液设计两个正负电极材料不相同的原电池,指出正负极,并写出电极反应方程式6、请用铜和氯化铁溶液的反应,设计成可以获得稳定电流的原电池7、将铜和铝用导线连接,放入浓硝酸中,请判断正负极,并写出电极反应方程式第二节化学电源电极、电池反应式的书写练习一、一次电池1.碱性锌锰电池:总反应式:Zn+2MnO2+2H2O= 2MnOOH + Zn(OH)2负极:PH变化正极:PH变化2.锌银电池总反应式:Ag2O+ Zn +H2O =Zn(OH)2+ 2Ag负极:负极反应:_______________正极:正极反应:_____________________二、二次电池1、铅蓄电池Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l)①放电时负极:PH变化正极:PH变化放电后整个溶液PH变化②充电:反应是上述反应的逆过程,则电极反应:阴极:;阳极:;三、燃料电池:1、电池总反应式2H2+O2===2H2O以硫酸为电解质溶液电极材料:电极反应负极:正极:2、电池总反应式2H2+O2===2H2O以氢氧化钾为电解质溶液。
高二化学练习——以史为镜之高考热点专题电化学基础----原电池

以史为镜之——高考热点——电化学基础之原电池(共39题)1、2013—江苏—9.Mg-H 2O 2电池可用于驱动无人驾驶的 潜航器。
该电池以海水为电解质溶液,示意图如下。
该电池工作时,下列说法正确的是A.Mg 是该电池正极B.H 2O 2在石墨电极上发生氧化反应C.石墨电极附近溶液的pH 增大D.溶液中Cl -向正极移动2、2013—海南—4.Mg-AgCl 电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+ Mg = Mg 2++ 2Ag +2Cl -。
有关该电池的说法正确的是A .Mg 为电池的正极B .负极反应为AgCl+e-=Ag+Cl -C .不能被KCl 溶液激活D .可用于海上应急照明供电3、2013—安徽—10.热激活电池可用作火箭、导弹的工作电源。
一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl 混合物受热熔融后,电池即可瞬间输出电能。
该电池总反应为:PbSO 4+2LiCl+Ca =CaCl 2+Li 2SO 4+Pb 。
下列有关说法正确的是A .正极反应式:Ca+2Cl - - 2e - =CaCl 2B .放电过程中,Li+向负极移动C .每转移0.1mol 电子,理论上生成20.7gPbD .常温时,在正负极间接上电流表或检流计,指针不偏转4、2013—新课标2—11.“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl 2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误的是 A.电池反应中有NaCl 生成B.电池的总反应是金属钠还原三价铝离子C.正极反应为:NiCl 2+2e -=Ni+2Cl -D.钠离子通过钠离子导体在两电极间移动5、2013—新课标1—10.银质器皿日久表面会逐渐变黑,这是生成了Ag 2S 的缘故,根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,下列说法正确的是 A 、处理过程中银器一直保持恒重B 、银器为正极,Ag 2S 被还原生成单质银C 、该过程中总反应为2Al+3Ag 2S=6Ag+Al 2S 3D 、黑色褪去的原因是黑色Ag 2S 转化为白色AgCl6、2013—新课标1—27.锂离子电池的应用很广,其正极材料可再生利用。
高中化学原电池练习题

高中化学原电池练习题原电池,是指由两种不同金属电极和相应电解质组成的电池。
原电池是化学反应生成电流的简单装置,其工作原理基于金属的离子间的电子传递。
在高中化学中,对原电池的理解是十分重要的知识点。
下面将给出几道高中化学原电池练习题,帮助同学们巩固对原电池的理解。
1. 下列反应中,哪一个能够组成原电池?A. 2H₂ + O₂ → 2H₂OB. Zn + Cu²⁺ → Zn²⁺ + CuC. Fe + 2H⁺ → Fe²⁺ + H₂D. Mg + 2Cl → MgCl₂2. 以下哪一个金属能够用于制作原电池中的阴极?A. 铝B. 锌C. 铜D. 锡3. 如果想要构建一个氢气电极,应该选择下列哪一种金属?A. 铜B. 银C. 铝D. 镍4. 在一个铜原电池中,下列哪一种粉末的溶液可以作为电解质?A. 氢氧化铁(III)溶液B. 铝氧化物溶液C. 硫酸铜溶液D. 碳酸镁溶液5. 当镍棒浸泡在硫酸镍的溶液中,同时有一个金片浸泡在硫酸铁的溶液中,连接两者后形成的电池是什么电池?A. 镍电池B. 铁电池C. 镍铁电池D. 锌铜电池6. 在铅板浸泡的硝酸铅溶液中,铁片浸泡在硫酸铁的溶液中,下列哪一种连接方式可以构成最简单的原电池?A. 铅板与铁片直接连接B. 铅板与铁片通过电解液连接C. 铅板通过导线连接铁片D. 铅板与铁片间没有联系7. 如果我们想要增加原电池的电动势,下列哪一种操作是可行的?A. 增加电解质浓度B. 更换阳极和阴极的金属C. 减小电解质浓度D. 加热电池中的电解液8. 下列哪一项不是原电池的特点?A. 金属电极必须有差异B. 电解液是电解质C. 电池产生电流的原理是化学反应D. 电解质中必须含有阴离子9. 原电池中,金属电极上的反应为氧化还是还原?A. 氧化B. 还原10. 在原电池中,正极电极对应于哪一个位置?A. 当电池放电时,正极为阳极B. 当电池放电时,正极为阴极C. 当电池充电时,正极为阳极D. 当电池充电时,正极为阴极通过这些练习题的答题学习,相信同学们对于高中化学中的原电池知识有了更深入的了解。
高二化学 原电池习题
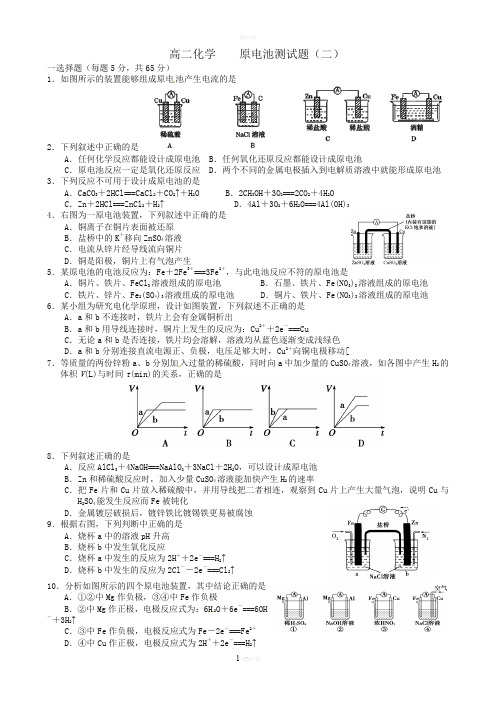
高二化学原电池测试题(二)一选择题(每题5分,共65分)1.如图所示的装置能够组成原电池产生电流的是2.下列叙述中正确的是A.任何化学反应都能设计成原电池 B.任何氧化还原反应都能设计成原电池C.原电池反应一定是氧化还原反应 D.两个不同的金属电极插入到电解质溶液中就能形成原电池3.下列反应不可用于设计成原电池的是A.CaCO3+2HCl===CaCl2+CO2↑+H2O B.2CH3OH+3O2===2CO2+4H2OC.Zn+2HCl===ZnCl2+H2↑ D.4Al+3O2+6H2O===4Al(OH)34.右图为一原电池装置,下列叙述中正确的是A.铜离子在铜片表面被还原B.盐桥中的K+移向ZnSO4溶液C.电流从锌片经导线流向铜片D.铜是阳极,铜片上有气泡产生5.某原电池的电池反应为:Fe+2Fe3+===3Fe2+,与此电池反应不符的原电池是A.铜片、铁片、FeCl3溶液组成的原电池 B.石墨、铁片、Fe(NO3)3溶液组成的原电池C.铁片、锌片、Fe2(SO4)3溶液组成的原电池 D.铜片、铁片、Fe(NO3)3溶液组成的原电池6.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是A.a和b不连接时,铁片上会有金属铜析出B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===CuC.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动[7.等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,如各图中产生H2的体积V(L)与时间t(min)的关系,正确的是8.下列叙述正确的是A.反应AlCl3+4NaOH===NaAlO2+3NaCl+2H2O,可以设计成原电池B.Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率C.把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化D.金属镀层破损后,镀锌铁比镀锡铁更易被腐蚀9.根据右图,下列判断中正确的是A.烧杯a中的溶液pH升高B.烧杯b中发生氧化反应C.烧杯a中发生的反应为2H++2e-===H2↑D.烧杯b中发生的反应为2Cl--2e-===Cl2↑10.分析如图所示的四个原电池装置,其中结论正确的是A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为:6H2O+6e-===6OH-+3H2↑C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+D.④中Cu作正极,电极反应式为2H++2e-===H2↑11.氢氧燃料电池以KOH 溶液为电解质溶液,下列有关该电池的叙述不正确的是A .正极反应式为:O 2+2H 2O +4e -===4OH -B .工作一段时间后,电解液中KOH 的物质的量浓度不变C .该燃料电池的总反应方程式为:2H 2+O 2===2H 2OD .用该电池电解CuCl 2溶液,产生2.24 L Cl 2(标准状况)时,有0.2 mol 电子转移12.6、对于锌-铜-稀H 2SO 4组成的原电池装置中,当导线中有1mol 电子通过时,理论上的电极变化( )①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出了1g H 2 ④铜片上析出1molH 2 A. ①③ B. ①④ C ②③ D. ②④13.原电池电极的“正”与“负”不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是A .由Fe 、Cu 和FeCl 3溶液组成的原电池中,负极反应式为:Cu -2e -===Cu 2+B .由Al 、Cu 和稀硫酸组成的原电池中,负极反应式为:Cu -2e -===Cu 2+C .由Al 、Mg 和NaOH 溶液组成的原电池中,负极反应式为:Al +4OH --3e -===AlO -2+2H 2OD .由Al 、Cu 和浓HNO 3溶液组成的原电池中,负极反应式为:Al -3e -===Al 3+14.(12分)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。
高二化学原电池电解池氧化还原反应综合练习6(附答案)

高二化学原电池电解池氧化还原反应综合练习一、单选题1.下列说法中不正确的是( )A.化学电池是将化学能转变成电能的装置B.化学电池的种类包括一次电池、二次电池和燃料电池等C.化学电池供能稳定可靠,可以制成各种形状和大小,使用方便,易于维护D.废旧电池可以随意丢弃2.A 、B 、C 是三种金属,根据下列①、②两个实验:①将A 与B 浸在稀硫酸中用导线相连,A 表面有气泡逸出,B 逐渐溶解;②电解物质的量浓度相同的A 、C 混合盐溶液时,阴极上先析出C (使用惰性电极)。
A 、B 、C 的还原性强弱顺序为( )A .A >B >C B .B >C >A C .C >A >BD .B >A >C3.为使反应Cu +2H 2O=Cu(OH)2+H 2↑能够发生,下列设计方案正确的是( )A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池B.用铜片作电极,外接直流电源电解硫酸铜溶液C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液D.用铜片作阴、阳电极,电解稀硫酸4.电解装置如图所示,电解槽内装有KI 及淀粉溶液,中间用阴离子交换膜隔开。
在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
已知:---2323I +6OH =IO +5I +3H O下列说法不正确的是( )A.右侧发生的电极反应式:--222H O+2e =H +2OH ↑B.电解结束时,右侧溶液中含有-3IOC.电解槽内发生反应的总化学方程式:232KI+3H O KIO +3H ↑通电D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变5.关于铅蓄电池的说法正确的是( )A.在放电时,正极发生的反应是()()()2--44Pb s +SO aq PbSO s +2e = B.在放电时,该电池的负极材料是铅板C.在充电时,电池中硫酸的浓度不断变小D.在充电时,阳极发生的反应是()-2-44=Pb(s)+S PbSO s O +2e (aq) 6.热激活电池可用作火箭、导弹的工作电源。
2023北京重点校高二(上)期末化学汇编:原电池
2023北京重点校高二(上)期末化学汇编原电池A .电池工作时,H 在电极上发生的反应为:H 2e 2H -+-=A.锌既是电极材料,也是离子导体B.盐桥中的+移向ZnSO溶液2-++2Fe,指针向右偏转注:a、b均为石墨电极A.锌电极上发生氧化反应C .电子从锌片经电流计流向铜片D .铜电极上发生反应:2Cu 2e Cu +-+=12.(2023秋·北京西城·高二北京八中校考期末)北京冬奥会赛区内将使用氢燃料清洁能源车辆,某氢氧燃料电池工作示意图如图。
下列说法中,不正确...的是A .电极a 为电池的负极B .电极b 表面反应为:O 2+4e -+2H 2O=4OH -C .电池工作过程中OH -向正极迁移D .氢氧燃料电池将化学能转化为电能的转化率高于火力发电,提高了能源利用率 13.(2023秋·北京房山·高二统考期末)甲烷燃料电池的工作原理如图,下列说法正确的是A .a 极为正极B .K +从a 极经溶液流向b 极C .工作一段时间后,b 极附近的pH 会减小D .a 极的电极反应为CH 4+6OH --8e -=23CO -+5H 2O 二、原理综合题 14.(2023秋·北京大兴·高二统考期末)2CO 减排能有效降低温室效应,同时2CO 也是一种重要的资源,因此2CO 捕集与转化技术研究备受关注。
I .2CO 催化加氢制甲醇(1)已知:()()()()222CO g H g CO g H O g +=+ 1Δ41H =+ kJ⋅mol 1-()()()23CO g 2H g CH OH g += 2Δ90H =- kJ⋅mol 1-则2CO 催化加氢制甲醇的热化学方程式为 。
若反应⋅为慢反应(活化能高),下列图中能体现⋅.离子液体聚合物捕集CO结合图1和图2分析:电池捕集CO图4是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和⋅.Me CO(4)A极为该电池的极(填“正”或“负”)。
高二化学原电池试题
高二化学原电池试题1.下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:卡片上的描述合理的是()A.①②③B.③④⑤C.①⑤⑥D.②③④【答案】B【解析】构成原电池的正极是Cu,负极是Zn,故①错误;电子从负极Zn流出,流向正极Cu,H+向正极移动,在Cu上得电子:2H++2e-H2↑,故②错误,③④正确;此原电池负极上发生的反应是Zn-2e-Zn2+,⑥错误;总反应方程式:Zn+2H+Zn2++H2↑,当有1 mol电子通过时,产生H2为0.5 mol,故⑤正确。
【考点】原电池2.为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是A.正极的电极方程式为:O2+2H2O+4e-===4OH-B.将石墨电极改成Mg电极,难以观察到铁锈生成C.若向自来水中加入少量NaCl(s),可较快地看到铁锈D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快【答案】D【解析】A.在钢铁的吸氧腐蚀中,Fe是负极,C作正极,正极的电极方程式为:O2+2H2O+4e-=4OH-,正确;B.若将石墨电极改成Mg电极,由于金属活动性Mg>Fe,Mg作负极,首先被腐蚀,所以难以观察到铁锈生成,正确;C.若向自来水中加入少量NaCl(s),由于溶液中离子的浓度增大,导电性增强,所以可较快地看到铁锈,正确;D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得慢,错误。
【考点】考查钢铁的吸氧腐蚀原理的知识。
3.(10分)如图所示3套实验装置,分别回答下列问题。
(1)装置1中的Cu是极(填“正”或“负”),该装置发生的总反应的离子方程式为。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。
反应一段时间后,停止通电。
向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
【同步测控 优化设计】高二人教版化学选修四练习:4.1原电池 Word版含答案[ 高考]
第四章电化学基础第一节原电池A组1.有关原电池的下列说法中正确的是()A.在外电路中电子由正极流向负极B.在原电池中负极发生还原反应C.阳离子向正极方向移动D.原电池中正极一定是不活泼金属解析:在外电路中,电子从负极流向正极;原电池中负极发生氧化反应;随着反应的进行,阳离子在正极被还原,所以电解质溶液中的阳离子向正极移动;原电池中一般正极金属比负极金属活泼性差,但不一定是不活泼金属。
答案:C2.理论上不能设计为原电池的化学反应是()A.CH4(g)+2O2(g)CO2(g)+2H2O(l)ΔH<0B.HNO3(aq)+NaOH(aq)NaNO3(aq)+H2O(l)ΔH<0C.2H2(g)+O2(g)2H2O(l)ΔH<0D.2FeCl3(aq)+Fe(s)3FeCl2(aq)ΔH<0解析:原电池反应均是自发进行的放热的氧化还原反应,选项A、C、D均属氧化还原反应,理论上可以设计成原电池,而选项B是非氧化还原反应,不能设计成原电池。
答案:B3.某同学制作一个原电池,电池总反应离子方程式为Zn+Cu2+Zn2++Cu,它的组成是()A.Cu为正极,Zn为负极,CuCl2为电解质溶液B.Cu为正极,Zn为负极,ZnCl2为电解质溶液C.Zn为正极,Cu为负极,CuCl2为电解质溶液D.Zn为正极,Cu为负极,CuSO4为电解质溶液解析:根据原电池中正负极的判断方法,可以分析在将反应Zn+Cu2+Zn2++Cu设计为原电池时,由于锌发生了氧化反应,因而负极材料应选择锌;正极材料选择比锌不活泼的金属或者非金属;而电解质溶液中要含有Cu2+。
答案:A4.如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是()A.外电路的电流方向为:X→外电路→YB.若两电极分别为Zn和石墨棒,则X为石墨棒,Y为ZnC.若两电极都是金属,则它们的活动性为X>YD.X极上发生的是还原反应,Y极上发生的是氧化反应解析:由图可知,电子的流动方向是X→外电路→Y,则电流的方向就为Y→外电路→X;X 为原电池的负极,Y为正极,X的活动性比Y的强;X极应发生氧化反应,Y极应发生还原反应。
高中化学(新人教版)选择性必修一课后习题:原电池的工作原理(课后习题)【含答案及解析】
第四章化学反应与电能第一节原电池第1课时原电池的工作原理课后篇素养形成必备知识基础练1.下列装置不可以组成原电池的是()中的装置不能形成闭合回路。
2.如图所示装置,下列说法正确的是()A.Cu为正极,Cu片上发生还原反应B.Cu为正极,Cu片上发生氧化反应C.Cu为负极,Cu片上发生还原反应D.Cu为负极,Cu片上发生氧化反应,活动性较弱的金属一般作正极,正极上发生还原反应。
3.下列反应不可用于设计成原电池的是()A.CaCO3+2HCl CaCl2+CO2↑+H2OB.2CH3OH+3O22CO2+4H2OC.Zn+2HCl ZnCl2+H2↑D.4Al+3O2+6H2O4Al(OH)3A项为非氧化还原反应,不能设计成原电池。
4.下列说法正确的是()A.原电池中,负极上发生的反应是还原反应B.原电池中,电流的方向是负极—导线—正极C.双液原电池中的盐桥也可以用金属导线代替D.在原电池中,阳离子移向正极,阴离子移向负极项,原电池负极上发生氧化反应;B项,电流的方向应是正极—导线—负极;C项,盐桥不能用导线代替。
5.某原电池反应的离子方程式为Fe+2H+Fe2++H2↑,则下列说法正确的是()A.用稀硝酸作电解质溶液B.用锌作原电池正极C.用铁作负极,铁的质量不变D.用铜作原电池正极解析根据原电池反应可以确定原电池负极为Fe,电解质溶液可以为稀盐酸或稀硫酸等,但不能为稀硝酸,若为稀硝酸,则原电池反应为3Fe+8H++2N O3-2NO↑+3Fe2++4H2O。
6.关于锌、铜和稀硫酸构成的原电池的下列说法正确的是()A.锌是正极,铜是负极B.电子从铜片经导线流向锌片C.负极的反应式为2H++2e-H2↑D.反应一段时间后,溶液的pH升高7.右图是某同学设计的原电池装置,下列叙述正确的是()A.电极Ⅰ上发生还原反应,作原电池的负极B.电极Ⅱ的电极反应为Cu2++2e-CuC.该原电池的总反应为2Fe3++Cu Cu2++2Fe2+D.盐桥中装有含氯化钾饱和溶液的琼胶,其作用是传递电子解析A项,该原电池中,电极Ⅱ为负极,负极发生氧化反应,电极反应为Cu-2e-Cu2+,A、B两项均错误;C项,正极反应为2Fe3++2e-2Fe2+,电池总反应为2Fe3++Cu Cu2++2Fe2+,C项正确;D项,盐桥的作用是形成闭合回路,通过阴、阳离子的移动平衡两溶液中的电荷,故传递的是阴、阳离子,而不是电子,D项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高二化学原电池练习题 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
高二化学原电池练习题
一、选择题(每题有1个选项符合题意共50分)
1.对于原电池的电极名称,下列叙述中错误..
的是()
A .电子流入的一极为正极
B .发生还原反应的一极为正极
C .电子流出的一极为负极
D .发生氧化反应的一极为正极
2.某原电池2Fe 3++Fe=3Fe 2+不能实现该反应的原电池是()
A .正极Cu 负极Fe 电解质溶液FeCl 3
B .正极
C 负极Fe 电解质溶液Fe(NO 3)3
C .正极Pt 负极Fe 电解质溶液Fe 2(SO 4)3
D .正极Ag
负极Fe 电解质溶液CuSO 4
3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中
一段时间,以下叙述正确的是()
A .两烧杯中铜片表面均无气泡产生
B .甲中铜片是正极,乙中铜片是负极
C .两烧杯中溶液的pH 均增大
D .产生气泡的速度甲比乙慢
4.X 、Y 、Z 、W4块金属分别用导线两两相连浸入稀硫酸中组成原电池。
X 、Y 相连时,X 为负极;Z 、W 相连时,电流方向是WZ ;X 、Z 相连时,Z 极上产生大量气泡;W 、Y 相连时,W 极发生氧化反应。
据此判断4种金属的活动顺序是
AX >Z >W >YBZ >X >Y >W
CX >Y >Z >WDY >W >Z >X
5.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag 2O 和Zn ,电解质溶液为KOH 溶液,放电时锌极上的电极反应是:Zn+2OH --—2e --==Zn(OH)2;氧化银电极上
的反应式为:Ag 2O+H 2O+2e --==2Ag+2OH --,总反应式为:Ag 2O+H 2O+Zn==Zn(OH)2+2Ag 。
下列说法正确的是()
A .锌是负极,氧化银是正极
B .锌发生还原反应,氧化银发生氧化反应
C .溶液中OH —向正极移动,K +、H +向负极移动
D .随着电极反应的不断进行,电解质溶液的pH 逐渐减小
7.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO 2(s)+H 2O(l)==Zn(OH)2(s)+Mn 2O 3(s)
下列说法错误..
的是()
A .电池工作时,锌失去电子
B .电池正极的电极反应式为:2MnO 2(s)+H 2O(1)+2e —=Mn 2O 3(s)+2OH —(aq)
C .电池工作时,电子由正极通过外电路流向负极
D .外电路中每通过电子,锌的质量理论上减小6.5g
8.一种新型的燃料电池,它以多孔镍板为电极插入KOH 溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C 2H 6+7O 2+8KOH====4K 2CO 3+10H 2O ,有关此电池的推断正确的是()
A .正极反应为14H 2O +7O 2+28e -====28OH -
B .放电一段时间后,负极周围的pH 升高
C .每消耗1molC 2H 6,则电路上转移的电子为28mol
D .放电过程中KOH 的物质的量浓度不变
9.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。
锂离子电池放电时的电极反应式为
负极反应:C 6Li -xe -=C 6Li 1-x +x Li +(C 6Li 表示锂原子嵌入石墨形成复合材料) 正极反应:Li 1-x MO 2+x Li ++xe -=LiMO 2(LiMO 2表示含锂的过渡金属氧化物)
下列有关说法正确的是
A.锂离子电池充电时电池反应为C6L i+Li1-x MO2=LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属铅所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+x Li++xe-=C6L i
10.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。
放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。
下列说法正确的是 A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e=Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e=Li
二、填空题(共50分)
11(10分).铅蓄电池是最普通的二次电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。
工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断(1)蓄电池的负极是,其电极反应方程式为。
(2)蓄电池的正极是,其电极反应方程式为_____。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”、“不变”)。
12(8分)从铜、铁及碳棒中选取合适的电极材料设计一个原电池,实现反应:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
负极为,电极反应方程式为,
正极应选,电极反应方程式为。
13(6分)熔融盐燃料电池具有高的发电效率因而受到重视。
可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池。
完成有关的电池反应式:阳极反应式:2CO+2CO32-=4CO2+4e
阴极反应式:
总电池反应式:
14(9分)一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。
如2Fe3++Cu=2Fe2++Cu2+可以写成:氧化反应:Cu-2e =Cu2+;还原反应:2Fe3++2e=2Fe2+。
1根据以上信息将反应3NO2+H2O=2H++2-
NO+NO拆分为两个“半反式”:氧化反应:;
3
还原反应。
2-+7H2O;4H2O+2O2+8e=8OH,则2已知某一反应的半反应式为CH4+10OH-8e=CO
3
总反应为。
15(3分)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为____________________________________________。
16.(9分)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为______________,,
该电池总反应的离子方程式为____________________________________。
17(5分)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。
参考答案
一、选择题
二、填空题
11.(1)PbPb-2e-+SO42-=PbSO4
(2)PbO2PbO2+4H++SO42-=PbSO4+2H2O
(3)增大
12.Cu3Cu–6e-=3Cu2+石墨8H++6e-+2NO3-=4H2O+2NO↑
2-2CO+O高温2CO2。
13.O2+2CO2+4e=2CO
3
14.(1)2NO2+2H2O+2e=2-
NO+4H+NO2+2H++2e=NO十H2O
3
(2)CH4+2O2+2OH=CO32-十3H2O。
