物理化学实验报告 偏摩尔体积
溶液偏摩尔体积的测定实验报告

溶液偏摩尔体积的测定实验报告
实验目的:
测定溶液的偏摩尔体积。
实验原理:
溶液的偏摩尔体积是指在一个特定温度下,溶质在溶液中单位摩尔体积的变化量。
偏摩尔体积可以通过对溶液稀释的实验来测定,根据实验数据可以绘制出摩尔体积随溶液浓度变化的曲线。
实验步骤:
1. 准备一定浓度的溶液A,并称取一定体积的溶液A。
2. 先称取一定体积的纯溶剂B,随后将溶液A定量加入纯溶剂B中,制备一系列不同浓度的溶液。
3. 分别测量不同浓度的溶液的摩尔体积,记录浓度和对应的摩尔体积数据。
4. 根据实验数据绘制摩尔体积随浓度变化的曲线。
实验数据:
溶液浓度 / mol/L 摩尔体积 / mL
0.1 50
0.2 48
0.3 45
0.4 42
0.5 40
实验结果:
根据实验数据绘制的摩尔体积随浓度变化的曲线如下:
实验讨论:
根据曲线可以看出,随着溶液浓度的增加,摩尔体积逐渐减小,这说明溶质在溶液中占据的体积随着浓度的增加而减小。
这可能是由于溶质分子在溶液中的相互作用力导致的。
结论:
本实验测定了溶液的偏摩尔体积,实验结果显示溶质在溶液中占据的体积随着溶液浓度的增加而减小。
物化实验偏摩尔体积测定
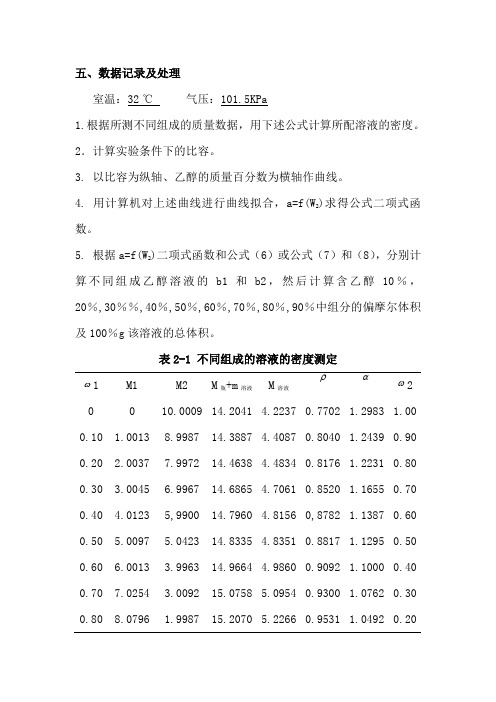
五、数据记录及处理室温:32℃气压:101.5KPa1.根据所测不同组成的质量数据,用下述公式计算所配溶液的密度。
2.计算实验条件下的比容。
3. 以比容为纵轴、乙醇的质量百分数为横轴作曲线。
4. 用计算机对上述曲线进行曲线拟合,a=f(W2)求得公式二项式函数。
5. 根据a=f(W2)二项式函数和公式(6)或公式(7)和(8),分别计算不同组成乙醇溶液的b1和b2,然后计算含乙醇10%,20%,30%%,40%,50%,60%,70%,80%,90%中组分的偏摩尔体积及100%g该溶液的总体积。
表2-1 不同组成的溶液的密度测定ω1 M1 M2 M瓶+m溶液M溶液ραω20 0 10.0009 14.2041 4.2237 0.7702 1.2983 1.00 0.10 1.0013 8.9987 14.3887 4.4087 0.8040 1.2439 0.90 0.20 2.0037 7.9972 14.4638 4.4834 0.8176 1.2231 0.80 0.30 3.0045 6.9967 14.6865 4.7061 0.8520 1.1655 0.70 0.40 4.0123 5,9900 14.7960 4.8156 0,8782 1.1387 0.60 0.50 5.0097 5.0423 14.8335 4.8351 0.8817 1.1295 0.50 0.60 6.0013 3.9963 14.9664 4.9860 0.9092 1.1000 0.40 0.70 7.0254 3.0092 15.0758 5.0954 0.9300 1.0762 0.30 0.80 8.0796 1.9987 15.2070 5.2266 0.9531 1.0492 0.200.90 9.0142 1.10129 15.3134 5.3330 0.9725 1.0283 0.10 1.00 10.0012 015.4641 5.4837 1.0000 1.0000图1 溶液的比容—质量百分数关系Y=1.0097+0.1713X+0.1098Xαω21β2βk 1.0000 0 1.0000 1.2056 0.1713 1.0283 0.10 1.0108 1.2500 0.1933 1.0492 0.20 1.0074 1.2656 0.2152 1.0762 0.30 1.0047 1.2893 0.2372 1.1000 0.40 0.9987 1.3096 0.2591 1.12950.500.99091.32820.28111.1387 0.60 0.9578 1.3215 0.30311.1655 0.70 0.9393 1.3557 0.32501.2231 0.80 0.9469 1.3663 0.34701.2439 0.90 0.9114 1.3540 0.36891.2983 1.00 0.9083 1.2983 0.3909六、注意事项1.实际需配制9份溶液,可用移液管加液,但乙醇含量根据称重算得。
2021年实验二溶液偏摩尔体积的测定实验报告思考题绘图

试验二 溶液偏摩尔体积测定一、试验目偏摩尔量是溶液中一个关键参数, 有很多性质都与偏摩尔数量相关。
本试验是测定溶液偏摩尔体积。
1. 掌握用比重瓶测定溶液密度方法;2. 利用密度法测定指定组成乙醇—水溶液中各组分偏摩尔体积;3. 学会恒温槽使用。
4. 了解偏摩尔量物理意义。
二、 预习要求1.复习课堂讲授内容, 真正了解偏摩尔量物理意义。
2.了解摩尔体积—摩尔分数图与比容—质量百分数图之间关系。
三、 试验原理在多组分体系中, 某组分i 偏摩尔体积定义为,,,()j i m i T p n i j V V n ≠⎛⎫∂= ⎪∂⎝⎭ (1) 若是二组分体系, 则有21,1,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (2) 12,2,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (3) 体系总体积V=n1V1, m +n2V2。
m (4)将(4)式两边同除以溶液质量W1,2,1212m mV V W W V W M W M W=+(5) 令 1,2,12,,m m V V V W W Wααα=== (6) 式中α是溶液比容; α1, α2分别为组分1、 2偏质量体积。
将(6)式代入(5)式可得:α=W1%α1+W2%α2=(1-W2%)α1+W2%α2 (7)将(7)式对W2%微分:122122,%%W W αααααα∂∂=-+=+∂∂即 (8) 将(8)代回(7), 整理得121%%W W ααα∂=-∂ (9) 和 212%%W W ααα∂=+∂ (10)所以, 试验求出不一样浓度溶液比容α, 作α—W2%关系图, 得曲线CC′(见图15.1)。
如欲求M浓度溶液中各组分偏摩尔体积, 可在M点作切线, 此切线在两边截距AB和A′B′即为α1和α2, 再由关系式(6)就可求出V1,m 和V2,m 。
四、 仪器与药品1.仪器恒温设备1套; 分析天平(公用); 比重瓶(10mL)2个; 工业天平(公用); 磨口三角瓶(50mL)4个。
溶液偏摩尔体积的测定.

实验十五 溶液偏摩尔体积的测定一、实验目的1.掌握用比重瓶测定溶液密度的方法。
2.测定指定组成的乙醇—水溶液中各组分的偏摩尔体积。
二、预习要求1.复习课堂讲授内容,真正理解偏摩尔量的物理意义。
2.理解摩尔体积—摩尔分数图与比容—质量百分数图之间的关系。
三、实验原理在多组分体系中,某组分i 的偏摩尔体积定义为,,,()j i mi T p n i j V V n ≠⎛⎫∂= ⎪∂⎝⎭ (1) 若是二组分体系,则有21,1,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (2) 12,2,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (3) 体系总体积V=n1V1,m +n2V2。
m (4)将(4)式两边同除以溶液质量W1,2,1212m mV V W W V W M W M W=+(5) 令1,2,12,,m m V V VW W Wααα=== (6) 式中α是溶液的比容;α1,α2分别为组分1、2的偏质量体积。
将(6)式代入(5)式可得:α=W1%α1+W2%α2=(1-W2%)α1+W2%α2 (7)将(7)式对W2%微分:122122,%%W W αααααα∂∂=-+=+∂∂即 (8) 将(8)代回(7),整理得121%%W W ααα∂=-∂(9) 和 212%%W W ααα∂=+∂ (10)所以,实验求出不同浓度溶液的比容α,作α—W2%关系图,得曲线CC′(见图15.1)。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为α1和α2,再由关系式(6)就可求出V1,m 和V2,m 。
四、仪器与药品1.仪器恒温设备1套;分析天平(公用);比重瓶(10mL)2个;工业天平(公用);磨口三角瓶(50mL)4个。
2.药品95%乙醇(分析纯),纯水。
五、实验步骤调节恒温槽温度为(25.0±0.1)℃。
以95%乙醇(A)及纯水(B)为原液,在磨口三角瓶中用工业天平称重,配制含A质量百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液,每份溶液的总体积控制在40mL 左右。
实验4 偏摩尔体积测定

实验4 偏摩尔体积测定【实验目的】1.掌握测定二组分溶液偏摩尔体积的方法;2.加深对偏摩尔量概念的认识。
【实验原理】A 、B 二组分溶液的容量性质Y =f (T , p ,A n ,B n ),等温等压下:B n P T BA n P T A dn n Ydn n Y dY AB,,,,)()(∂∂+∂∂= (4.1) 定义Bn P T AA n Y Y ,,)(∂∂≡; AnP T BB n Y Y ,,)(∂∂≡ 则B B A A dn Y dn Y dY += (4.2)A Y 、B Y -为物质A 、B 的某种容量性质Y 的偏摩尔量。
由此定义A 和B 的偏摩尔体积为:Bn P T AA n V V ,,)(∂∂= AnP T BB n V V ,,)(∂∂= (4.3) 有 B B A A dn V dn V dV += (4.4) 而 )(p T n n V V B A 、、、= (4.5) T 、p 一定:ABn P T BB n P T A A n Vn n V n V ,,,,)()(∂∂+∂∂= 即 A A B B V n V n V =+ (4.6) 则 B B B B A A A A dn V dV n dn V dV n dV +++= (4.7) (4.7)与(4.4)比较、整理得:0=+B B A A dV n dV n Gibbs —Duhem (4.8)1-=-=-=B B AB AB BA x x x x n n dV dV (4.9)由式(4.9)可见,V A 与V B 彼此不是独立的,之间存在着函数关系。
V A 的变化将引起V B 的变化,若V A 不变,V B 也保持不变,x B 为一定值,即溶液浓度一定时,d V A 一定,dV B 也就一定了。
偏摩尔体积的物理意义:可从两个角度理解,一是在温度、压力及溶液浓度一定的情况下,在一定量的溶液中加入极少量的A 时,系统体积的改变量与所加入A 的物质的量之比。
偏摩尔体积的测定

北京理工大学物理化学实验报告偏摩尔体积的测定班级:09111101实验日期:2013-4-23一、 实验目的及要求1) 配制不同浓度的NaCl 水溶液,用密度瓶测定各溶液的密度。
2) 计算溶液中各组分的偏摩尔体积。
二、原理设体系有二组分A,B,体系的总体积V 是n A , n B 、温度、压力的函数,即V=f(n A ,n B ,T ,P )组分A 、B 的偏摩尔体积定义为B n P T A A n V V ,,)(∂∂= A n P T BB n V V ,,)(∂∂=吉布斯-杜亥姆(Gibbs-Duhem )方程如下:n A dV A +n B dV B =0在B 为溶质、A 为溶剂的溶液中,设V A *为纯溶剂的摩尔体积;V φ,B 定义为溶质B 的表观摩尔体积,则BA A Bn V n V V *-=,φV= n A V A *+n B V φ,Bb B 为B 的质量摩尔浓度(b B =n B /(n A M A );V φ,B 为B 的表观摩尔体积;ρ、ρA*为溶液及纯溶剂A 的密度;M A 、M B 为A 、B 二组分的摩尔质量。
可得ρρρρρϕB AB A BM b V +-=**,据德拜-休克尔(Debye —Huckel )理论,NaCl 水溶液中NaCl 的表观偏摩尔体积V φ,B 随B b 变化呈线性关系,A n P T BBB A AA b V b M V V ,,,23)(2∂∂-=*φA n P T BBB B B b V b V V ,,,,)(2∂∂+=φφ配制不同浓度的NaCl 溶液,测定纯溶剂和溶液的密度,求不同b B 时的V φ,B ,作V φ,B ~B b 图,可得一直线,从直线求得斜率A n P T BB b V ,,,)(∂∂φ。
从而可以计算V A 、V B 。
三、仪器与试剂分析天平、恒温槽、烘干器、比重瓶、磨口塞锥形瓶(50ml )、烧杯(50ml 、250ml )、洗耳球、量筒50ml 、NaC1(A.R.)四、实验步骤1)调节恒温槽至设定温度,33℃。
偏摩尔体积的测定实验报告

一、实验目的1. 掌握用比重瓶测定溶液密度的方法。
2. 运用密度法测定指定组成的乙醇-水溶液中各组分的偏摩尔体积。
3. 学会恒温槽的使用。
4. 理解偏摩尔量的物理意义。
二、实验原理在多组分体系中,某组分i的偏摩尔体积定义为在等温等压下,往无限大的体系中加入1mol其它组分,体系体积的变化量;或往有限的体系中加入微量的其它组分而引起该体系体积的变化。
对于二组分体系,溶液中有组分1、组分2两种组分。
偏摩尔体积的测定基本原理维持等温等压并保持溶液中组分2的物质的量n2不变,测定溶液体积V关于组分1的物质的量n1的实验曲线,从实验曲线的斜率中可计算出组分1的偏摩尔体积V1,m。
三、实验仪器与试剂1. 仪器:分析天平、比重瓶、磨口三角瓶、恒温槽、温度计、滴定管、量筒、移液管、滴定管夹、滴定管架、洗瓶等。
2. 试剂:无水乙醇(95%)、纯水、标准液(蒸馏水或去离子水)。
四、实验步骤1. 配制不同浓度的乙醇-水溶液。
以95%无水乙醇为原液,在磨口三角瓶中用工业天平称重,配制含质量百分数为1%、2%、3%、4%、5%的乙醇-水溶液。
2. 用分析天平称取比重瓶的质量m0。
3. 用移液管将配制好的不同浓度的乙醇-水溶液分别移入比重瓶中,确保溶液体积与比重瓶标示体积相同。
4. 用洗瓶将比重瓶冲洗干净,然后用分析天平称取比重瓶和溶液的总质量m1。
5. 将比重瓶放入恒温槽中,待溶液温度稳定后,用分析天平称取比重瓶和溶液的总质量m2。
6. 重复步骤4和5,直至连续两次称量结果之差小于0.1mg。
7. 计算不同浓度乙醇-水溶液的密度ρ,公式如下:ρ = (m1 - m0) / (m2 - m0)8. 将不同浓度乙醇-水溶液的密度ρ与其质量百分比浓度w1绘制成曲线。
9. 在曲线上找到各浓度溶液的切线,计算切线斜率k。
10. 根据公式V1,m = k 1000,计算各组分的偏摩尔体积V1,m。
五、实验结果与分析1. 通过实验,成功配制了不同浓度的乙醇-水溶液,并测定了其密度。
偏摩尔体积测定

同理:
VB,m=M B. BP
……………(6)
测得不同浓度乙醇溶液的比容 V 比, 作 W 乙醇 与 V 比比容的曲线, 即可按上式求出各种浓度下的偏摩尔体积。
三 仪器与药品
恒温槽,100mL 磨口锥形瓶,10mL 比重瓶,10mL 量筒。 乙醇和蒸馏水若干。
四 实验步骤
1.比重瓶体积的测定 将比重瓶洗净烘干,精确称其重量,然后,装满蒸馏水,塞紧瓶塞。在 298.2K 下恒温,比重瓶内液体 由瓶塞的毛细管孔逸出,约 15min 后,取出并擦干比重瓶表面上的水滴,然后称重。 2 不同浓度溶液比容的测定 按(2)式计算,配制乙醇的重量百分数分别为 20%,40%,60%,80%,100%的溶液 50ml(四组用)。
W A =WA%=
WA W A WB
=
nA M A …………………………(2) n A M A nB M B
设溶液的比容为 V 比,则溶液的总体积 V 可写为 V (W A WB )V比 =(nAM A+nBMB)V 比……(3) 根据偏摩尔体积定义,用(2)与(3)式可得:
V V WB V A, m M AV比 (n A M A nB M B ) 比 n A T , p , nB W B T , P n A nB
六 注意事项
恒温槽的温度应比室温略高些, 槽内的水面不要没过比重瓶的磨口处, 比重瓶每次要用待测液润洗两次。
七 思考题
1 我们用的方法测密度由几位有效数字?实验的重复性如何?产生误差的原因有哪些? 2 比重瓶的构造如何改进可使实验的准确度提高? 3 为什么恒温槽的温度要高于室温? 4 偏摩尔量是强度性质还是容量性质?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学实验报告
偏摩尔体积的测定
1.实验目的及要求:
(1)配制不同浓度的NaCI水溶液,测定各溶液的密度
(2)计算溶液中各组分的偏摩尔体积
(3)学习用密度瓶测定液体的密度
2.实验原理:
根据热力学概念,体系的体积V为广度性质,其偏摩尔量则为强度性质。
设体系有两组分A,B,体系的总体积V是温度,压力n A和n B的函数,即:
V=f(n A, n B,T,P)
组分A,B的偏摩尔体积定义为:
V A=(∂V
∂n A )T,P,n
B
V B=(∂V
∂n B
)T,P,n
A
在恒定温度和压力下:
dV=(∂V
∂n A )T,P,n
B
d n A+(∂V
∂n B
)T,P,n
A
d n B
dV=V A d n A+ V B d n B
偏摩尔量是强度性质,与体系浓度有关,而与体系总量无关。
体系总体积可积分得到:
V=n A V A+n B V B
恒温条件下在进行微分:
dV=n A dV A+V A d n A+n B dV B+ V B d n B
得吉布斯—杜亥姆方程:
n A dV A+n B dV B=0
在B为溶质,A 为溶剂的溶液中,设V A∗为纯溶剂的摩尔体积;V∅,B定义为溶质B的表观摩尔体积,则:
V∅,B=V−n A V A∗
n B
V=n A V A∗+n B V∅,B 在恒定T,P及n A条件下,将上式对n B偏微分,可得:
V B=(∂V
∂n B
)T,P,n
A
=V∅,B+n B(
∂V∅,B
∂n B
)T,P,n
A
V A=1
n A
(n A V A∗+n B V∅,B−n B V B)结合以上两式得:
V A=V A∗−n B2
n A
(
∂V∅,B
∂n B
)
T,P,n A
b B为B的质量摩尔浓度(b B=n B/(n A M A); V∅,B为B的表观摩尔体积;ρ,ρA∗为溶液及纯溶剂A的密度;M A,M B为A.B两组份的摩尔质量。
可得:
V∅,B=
1
b B
(1+b B M B
ρ
−1
ρA∗
)
V∅,B=ρA∗−ρ
b BρρA∗
+
M B
ρ
本实验测定NaCI水溶液中NaCI和水的偏摩尔体积,根据德拜—休克尔理论,NaCI水溶液中NaCI的表观偏摩尔体积V∅,B随√b B变化呈线性变化关系,因此作如下变换:
(∂V∅,B
∂n B
)T,P,n
A
=
1
n A M A
(
∂V∅,B
∂b B
)T.P,n
A =
1
n A M A
(∂V∅,B
∂√b B
∗∂√b B
∂b B
) T.P,n A
最终得到:
V A=V A∗−M A b
B
3
2
2
(
∂√b B
)T,P,n
A
V B=V∅,B+√b B
2
(
∂V
∂√b B
)T,P,n
A
配制不同浓度的溶液,测定纯溶剂与溶液的密度,做出V∅,B—√b B图,可得到一直线,求出直线斜率。
计算溶质和溶剂的偏摩尔体积。
3.实验仪器与试剂
分析天平恒温槽
烘干器密度瓶
磨口塞锥形瓶量筒
洗耳球无水乙醇
药匙
NaCI
4.实验过程
(1)调节恒温槽至25摄氏度。
(2)配制不同组成的NaCI:先称量锥形瓶的质量,在称量加入药品后的质量,最后加入水称量质量,注意每次称量都要将瓶塞盖上。
最后求出他们确切的质量分数。
(3)使用密度瓶测定溶液密度
首先称量空瓶质量m0。
用水充满密度瓶,盖上磨口塞,置于恒温槽中,恒温十分钟,用滤纸吸取从毛细管溢出的液体。
取出密度瓶并擦干,在天平上称量,记为m1
倒掉水后烘干,装入待测溶液,用同样方法,最后记录称量质量为m2。
根据公式ρ=m2−m0
m1−m0ρ
水
计算出液体密度。
重复上述步骤对其他浓度的溶液进行测定。
5实验数据及处理
√(b_B )
V _(,B )
数据分析:第二组数据在表观摩尔体积一项中偏高,根据其推出公式
V ∅,B =ρA ∗−ρb B ρρA
∗+M B ρ
可以分析出值偏大的原因可能是因为b B 偏大,即使偏差值并不大,但是由于其在分母上,
而且值本身非常小,所以极易带来最终结果的偏差,虽然也有可能是溶液密度测定不精确所导致,但是根据其他组测定值相比可以推测出密度的偏差应该较小,其偏差不应能给实验结果造成这么大偏差,所以最终结果还是在b B 的测定上出现了误差。
综上,第二组数据是有问题的。
6思考题
(1)偏摩尔体积可能是负数么?
答:应该是可以的,某些物质在特定的条件下继续加入少量该物质,如果体积减小,偏摩尔体积就是负的。
(2)如何减小称量过程中的误差
答:在称量密度瓶的时候,要将表面的水分擦拭干净。
在读取分析天平的读数时应该等到天平示数稳定在读数,防止因震动给天平示数造成波动。
在称量空仪器时要保证仪器的干燥和清洁。
