液态活检研究进展及技术平台简介
液体活检发展现状

液体活检发展现状液体活检是一种新兴的医疗技术,它通过分析人体体液中的分子和细胞来检测疾病的存在和发展情况。
与传统的组织活检相比,液体活检无需进行手术切取组织样本,不仅减少了患者的痛苦,而且具有更高的安全性和可行性。
近年来,液体活检在肿瘤临床诊断和治疗中得到了广泛的应用和研究,取得了令人瞩目的进展。
一方面,液体活检主要通过分析血液中的细胞自由DNA (cfDNA)和循环肿瘤细胞(CTC)来诊断和监测肿瘤。
cfDNA可以通过血液中的胎儿基因、肿瘤相关突变基因等一系列分子标记物,预测肿瘤的存在和发展趋势。
通过分析cfDNA的染色体改变、突变基因热点等信息,可以帮助医生评估患者的病情和治疗效果。
而CTC的检测则可以通过抽取患者的血液样本,利用免疫学技术或微流控芯片等方法捕获肿瘤细胞,帮助医生判断肿瘤的侵袭性、转移性和复发风险。
另一方面,液体活检在肿瘤治疗中的应用也越来越广泛。
例如,通过分析患者术前或术后血清中的肿瘤标志物,可以评估手术切除肿瘤的效果以及患者的预后情况。
同时,液体活检还可以用于监测肿瘤的治疗反应和药物耐药性。
通过定期采集患者的血液样本,分析其中的cfDNA或CTC,可以及时发现肿瘤的变异基因和治疗相关的分子标志物,以指导治疗策略的调整。
随着液体活检的不断发展,其应用范围将进一步扩大。
例如,液体活检在早期肺癌筛查中的应用已经取得了一定的突破。
目前已经有研究表明,通过检测患者的血清中的肿瘤相关标志物,可以实现对早期肺癌的敏感和特异性诊断。
此外,液体活检还可以应用于其他疾病的诊断和监测,如心血管疾病、感染性疾病等。
然而,液体活检仍面临一些技术和临床应用上的挑战。
首先,液体活检的灵敏度和特异性仍需要进一步提高,以提高诊断准确性和预测价值。
其次,液体活检的标准化和规范化也面临一些困难,需要建立统一的检测方法和质量控制标准,以确保结果的可靠性和可重复性。
此外,液体活检还需要进一步验证其在大规模临床样本中的可行性和实用性,以促进其在临床实践中的推广应用。
液体活检前景

液体活检前景液体活检(liquid biopsy)是一种非侵入性的肿瘤检测方法,通过检测血液、尿液等体液中的循环肿瘤标志物,来评估肿瘤的存在、分期和治疗效果。
与传统的肿瘤活检相比,液体活检具有更多的优势和应用前景。
首先,液体活检不需要进行手术或穿刺,避免了传统活检过程中可能出现的并发症和不适感。
只需要从患者体内采集少量的体液样本,即可进行肿瘤标志物的检测,大大减少了对患者的不适和痛苦。
其次,液体活检具有更高的时效性和灵敏度。
与传统活检需要等待肿瘤长大到一定程度才能进行不同,液体活检可以随时进行,帮助医生实时了解患者的病情。
此外,液体活检可以检测到细胞碎片、循环肿瘤DNA(ctDNA)、循环肿瘤细胞(CTC)等多种肿瘤标志物,相比传统活检更加灵敏。
再者,液体活检具有更广泛的应用前景。
目前,液体活检主要用于肿瘤早期筛查、肿瘤分子学诊断和治疗监测等方面。
早期筛查是液体活检最为重要的应用之一,通过检测早期肿瘤标志物,可以帮助医生早期发现患者的肿瘤,并进行相应的治疗,提高治疗效果和生存率。
肿瘤分子学诊断可以通过检测肿瘤标志物,来确定肿瘤的类型、突变信息和驱动因子,为患者精准治疗提供依据。
治疗监测是液体活检的另一个重要应用,通过检测治疗期间的循环肿瘤DNA和循环肿瘤细胞,可以实时了解肿瘤的变化情况,及时调整治疗方案。
液体活检作为一种新兴的肿瘤检测方法,具有巨大的市场潜力和发展前景。
随着科技的不断进步,液体活检技术不断完善,其在肿瘤早期筛查、分子学诊断和治疗监测等领域将得到更广泛的应用。
同时,液体活检还可以与其他肿瘤检测方法相结合,构建更全面、精确的肿瘤诊断和治疗方案。
因此,液体活检有望在未来的肿瘤诊断和治疗中发挥越来越重要的作用。
肿瘤的液体活检研究进展

Chinese Journal of Nature Vol. 42 No. 2 REVIEW ARTICLE108doi:10.3969/j.issn.0253-9608.2020.02.006肿瘤的液体活检研究进展巢昱清①,朱小立②,陈桂芳②†①上海大学 钱伟长学院,上海 200444; ②上海大学 生命科学学院/分子识别与生物传感研究中心,上海 200444摘要 癌症是影响人类寿命的主因之一。
与临床上常用的组织活检技术相比,液体活检作为癌症的一种检测手段,具有非侵入性、准确性高、取样简便、价格低廉等多种显著优势。
液体活检在多种癌症,包括肺癌、宫颈癌、前列腺癌等的早期检测、动态监测和靶向治疗上均表现出很大的潜力,为癌症的检测和治疗提供了新的技术手段和研究思路。
液体活检常常采用循环肿瘤DNA、循环肿瘤细胞和外泌体作为检测癌症病程的标志物,以PCR、NGS、ELISA等生命科学研究中常用的技术为基础方法,利用多种指标作为评判癌症病程的依据。
文章综述了循环肿瘤DNA、循环肿瘤细胞和外泌体作为肿瘤液体活检标志物的检测原理,以及它们在临床应用方面近5年的研究进展。
关键词 液体活检;循环肿瘤DNA;循环肿瘤细胞;外泌体†通信作者,研究方向:分子诊断新方法。
E-mail:**************.cn癌症是导致全球人类死亡的主要原因之一。
尽管近年来癌症生物学、肿瘤学和外科技术取得了巨大进步,但癌症的总体存活率仅略有提高[1]。
截至2018年,世界上91个国家中,癌症已成为70岁以下死亡人口中占比排名前三的原因之一[2]。
根据地域划分并统计癌症发病率和死亡率的结果显示,亚洲由于占世界人口比例最大,因此癌症发病人数占全球癌症发病人数的近50%,且发病率高于死亡率[3]。
根据中国国家癌症中心发布的2014年恶性肿瘤发病和死亡资料分析,全国恶性肿瘤发病率和死亡率分别为278.07/10万和167.89/10万,估计2014年新诊断恶性肿瘤病例为380.4万,报告恶性肿瘤死亡229.6万[4]。
肿瘤“液体活检”研究进展

灶 逃 避 免 疫 识 别 后 才 能成 为 转移 灶 。C T C亦 能够
再 次 回到 原 发部 位 , 叫 做 “回 巢 ” 。 研 究 发 现 , C T C上 携 带 的 肿 瘤 坏 死 因 子 ( T NF ) 可 以通 过 “回 巢” 杀灭部 分原 发灶肿瘤 细胞 , 亦 可 称 为“以癌 抗 癌” [ 5 1 。 目前 主 要 通 过 上 皮标 志 如 E P C AM 和 角 蛋 白来 识 别 C T C t 。然 而 , 如 果 发 生 上 皮 间质 转 化
数 结合 在一起 的C e l l S e a r c h系 统 已被 美 国食 品和 药 品管理 局( F D A) 批准应 用 于乳腺 癌 、 结 直 肠 癌 及前 列腺癌 等预后评 估 , 该 系 统 特 异 度 高但 敏 感 度较 低 , 且 对 于 肺 癌 的检 测 效 能 较 差 。 近 年 来 , C y t o p l o R a r e ( 格诺) 通 过 免 疫 磁 珠 负 向富 集 靶 向配 体P C R技 术 在 肺 癌 C T C检 测 中仅 需 3 ml 血样 , 即
覆 医疗 领 域 的 技 术 之 一 , 使 临 床 诊 治 产 生 质 的 飞
跃 。 目前 , 液 体 活 检 技 术 主 要 涵 盖 循 环 肿 瘤 细 胞 ( C T C) 、 c t DNA及 外 泌 体 三 个 领 域 , 本 文 拟 对 其 各 自特 点 、 检 测技 术 、 临 床应 用 等方 面做 一 简要 综述 。
北京 大学gs _ 医院肿瘤化疗与放射病科 , 北京 1 0 0 1 9 1
摘要 : “ 液体活检” 不仅使肿瘤基因型的非侵袭性检查变为可能, 而且很好地克服了肿瘤的时空异质性, 为实 现 精准 医疗 提供 了高效 工具 。 发展 前 景 十分; - N o近 年来 , “ 液体 活 检” 技 术 已经 逐渐 渗 透 到 了临床 肿瘤 的诊 治 过程, 但 由于其 价格 昂贵和 检测 标准 不统 一等 限制 因素 , 临床应 用 尚在 起步 阶段 。本文 就肿瘤 领 域 目前 最主要 开 展研发的 C T C、 c t DNA及外 泌体 3 个对 象作一 简要综述 。
液体活检(LiquidBiopsy):无创肿瘤检测新手段

液体活检(LiquidBiopsy):无创肿瘤检测新手段来源|药明康德临床诊断部癌症病人血液中会存在少量游离的循环肿瘤细胞(Cycling Tumor Cells,CTC)且坏死的癌细胞亦会释放少量的循环肿瘤DNA (circulating tumor DNA,ctDNA)到血液中,因此可通过检测从肿瘤原发或转移部位释放到血液中的CTC和ctDNA来检测癌症,即液体活检(Liquid Biopsy)。
与手术活检和穿刺活检不同,液体活检直接从血液、唾液等体液中检测肿瘤细胞或肿瘤核酸,操作简便,且能重复取样。
液体活检是MIT科技综述(MIT Technology Review)杂志公布的2015年度十大突破技术之一。
ctDNA和蛋白类标记物相比,前者的检测更灵敏,很少出现假阳性,可跟踪肿瘤的消失、扩散和复发。
只需从受检者体内抽取外周血,根据受检者血液中是否含有某种肿瘤特异的游离DNA及数量的多少,精准的确认相应基因的突变频率,达到早期筛查、监控、监测疗效的目的。
液体活检对于癌症的早期诊断、用药监控、预后判断等作用已经得到多个研究的证实。
•早期检测是癌症研究和治疗的关键,液体活检可以识别和监控较早期阶段出现的肿瘤,未来液体活检可能为大多数癌症患者提供一种筛查方法,并且检测ctDNA的血清水平可以为癌症类型和是否扩散提供线索。
•液体活检通过检测ctDNA可以实现癌症分型和检测治疗产生的耐药情况,为癌症复发提供早期预警,为药物治疗时产生耐药提供依据。
如美国Dana-Farber肿瘤研究所的Geoff Oxnard博士在临床癌症研究(Clinical Cancer Research)杂志上发表的文章所述,应用微滴式数字PCR技术检测肺癌和黑色素瘤患者血浆中ctDNA的EGFR、KRAS和BRAF突变实现肿瘤基因的分型,监控肿瘤对治疗的应答和耐药进程。
药明康德临床诊断部和韩国三星医学中心的安明株教授合作的研究结果显示,通过检测血浆ctDNA中EGFR的突变,实现了无创监测EGFR抑制剂的疗效并可更早的发现耐药性突变。
癌症检测新方向-液体活检
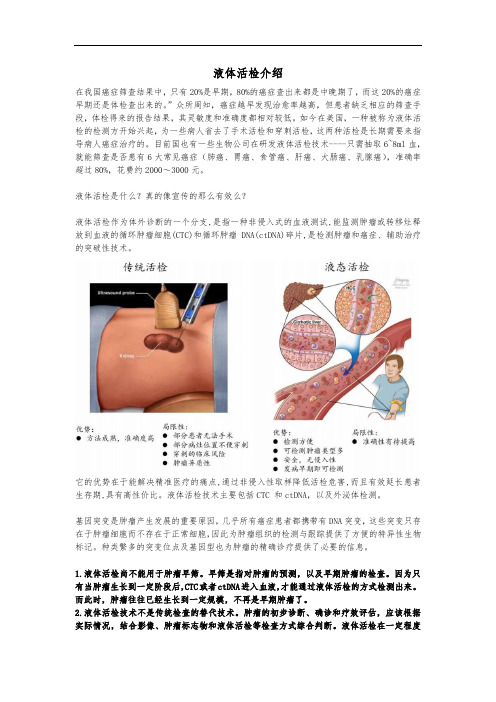
液体活检介绍在我国癌症筛查结果中,只有20%是早期,80%的癌症查出来都是中晚期了,而这20%的癌症早期还是体检查出来的。
”众所周知,癌症越早发现治愈率越高,但患者缺乏相应的筛查手段,体检得来的报告结果,其灵敏度和准确度都相对较低。
如今在美国,一种被称为液体活检的检测方开始兴起,为一些病人省去了手术活检和穿刺活检,这两种活检是长期需要来指导病人癌症治疗的。
目前国也有一些生物公司在研发液体活检技术----只需抽取6~8ml血,就能筛查是否患有6大常见癌症(肺癌、胃癌、食管癌、肝癌、大肠癌、乳腺癌),准确率超过80%,花费约2000~3000元。
液体活检是什么?真的像宣传的那么有效么?液体活检作为体外诊断的一个分支,是指一种非侵入式的血液测试,能监测肿瘤或转移灶释放到血液的循环肿瘤细胞(CTC)和循环肿瘤DNA(ctDNA)碎片,是检测肿瘤和癌症、辅助治疗的突破性技术。
它的优势在于能解决精准医疗的痛点,通过非侵入性取样降低活检危害,而且有效延长患者生存期,具有高性价比。
液体活检技术主要包括CTC 和ctDNA,以及外泌体检测。
基因突变是肿瘤产生发展的重要原因,几乎所有癌症患者都携带有DNA突变,这些突变只存在于肿瘤细胞而不存在于正常细胞,因此为肿瘤组织的检测与跟踪提供了方便的特异性生物标记。
种类繁多的突变位点及基因型也为肿瘤的精确诊疗提供了必要的信息。
1.液体活检尚不能用于肿瘤早筛。
早筛是指对肿瘤的预测,以及早期肿瘤的检查。
因为只有当肿瘤生长到一定阶段后,CTC或者ctDNA进入血液,才能通过液体活检的方式检测出来。
而此时,肿瘤往往已经生长到一定规模,不再是早期肿瘤了。
2.液体活检技术不是传统检查的替代技术。
肿瘤的初步诊断、确诊和疗效评估,应该根据实际情况,结合影像、肿瘤标志物和液体活检等检查方式综合判断。
液体活检在一定程度上解决了传统技术的部分局限性,但尚不足以替代传统检测技术。
一、液体活检介绍1. 循环肿瘤细胞(circulating tumor cells,CTCs)循环肿瘤细胞(circulating tumor cells,CTCs)是游离于血液循环系统中的肿瘤细胞,来源于原发肿瘤组织,是肿瘤细胞转移的重要方式,也是肿瘤患者术后复发的重要原因,同事还是激发癌症致死机制的重要因素。
液体活检-肿瘤防治利器

➢ 特别是对于年迈体弱的病人,或所取组织在关键器官或部位附近,风险就更高, 比如在活 检过程中可能误伤器官或大血管。
活检需要重复做吗?--在癌症的治疗过程中,很多情况需要重复活检。
➢ 癌症对某种药物产生了耐药性,这时需要重复活检来看一下是否有新的靶点可以针对治疗。 ➢ 癌症几年后产生了复发,也需要重复活检来确认是同一种癌症还是另外一个类型(这在乳腺
内容页
液体活检,分子医学的入口 —— “三驾马车”:CTC、ctDNA 和外泌体
超用复 早药发 预指监 警导控
CTC、ctDNA 和外泌体的差异
• ctDNA • 死细胞释放,杀伤性治疗
效果的实时监控指标 • ctDNA是一组Panel,癌变
标志物,没有组织特异性 和无癌症分期的区分 • 不稳定,含量较低,受干 扰因素多
者无法取样或取样不足。 治疗/复发转移监测: • 影像学:结果普遍存在滞后性。 • 血清标志物:较灵敏,但是特异性不足;有些类型癌症没有合适的血清标志物。
传统的肿瘤诊断存在的问题
组织活检存在问题:
➢ 活检指的是通过介入或手术的手段,取一小块人体组织,目的是对此进行病理的分析。 ➢ 没有一个实体癌症是可以不通过活检确诊的。
• 含量少且变化大 cfDNA中多数野生背景,不同ctDNA片段的含量从0.01%到10%;
• 超早期、高肿瘤特异性,但缺少组织和器官特异性
CTC v.s. ctDNA —互相排斥还是互为补充?
CTCs
ctDNA
1. 细胞形态结合分子标记,特异性高;
1.可能来源于非肿瘤组织,特异性低;
2. 血液中数量稀少,检测难度大;
超声波检测(B超) X射线断层扫描术(XRAY, CT) 核磁共振成像(MRI) 正电子成像术(PET-CT) 内窥镜(Endoscope)
液体活检在肿瘤领域的研究进展

近年来兴起的液体活检技术克服了传统组织活检的侵入性、取样困难以及难以监测等局限性,使肿瘤的实时动态监测成为可能。
液体活检技术主要针对循环肿瘤核酸(circulating tumor DNA ,ctDNA )、细胞外囊泡(extracellu⁃lar vesicles ,EVs )及循环肿瘤细胞(circulating tumor cells ,CTCs )等标志物的检测分析,具有非侵入性、重复性强等优势,在肿瘤早期诊断、治疗决策、疗效评估和耐药监测中具有巨大的发展潜力与临床应用前景。
此外,液体活检还可反映肿瘤的基因谱,对肿瘤诊治的精准化进程具有推进性意义,因此本文将对上述液体活检的三大检测标志物的生物学特性、主要检测方法以及临床应用进行简要综述,为证明其临床有效性和实用性提供思路,对指导基础实验研究和液体活检的临床实践有重要意义。
1循环肿瘤DNA (ctDNA )肿瘤患者外周血游离DNA (cell free DNA ,cfDNA )浓度比健康人群高10~100倍,其中ctDNA 可来源于凋亡或者坏死的肿瘤细胞、CTCs 和外泌体。
ctDNA 长度约为150~200bp ,其存在形式包括单链DNA 、双链DNA 及DNA-蛋白复合体,半衰期为15min ~2h 。
虽然ctDNA 仅占全部cfDNA 的0.01%~1%,但ctDNA 的遗传信息和肿瘤组织有良好一致性,可以动态反映肿瘤基因谱特征。
ctDNA 的检测包括浓度变化和结构改变两个方面。
因ctDNA 占cfDNA 总量的比例较低,且ctDNA 与体细胞凋亡释放的核酸相比可能仅有一个或数个碱基的微小差别,故对其检测技术灵敏度要求极高。
以选择性扩增为核心的技术包括荧光定量PCR 、液滴式数字PCR [1]、cold⁃PCR [2]、ARMS⁃PCR [3]、高分辨溶解曲线分析技术[4]等,这类方法灵敏度较高,但易发生偏向性扩增,且只可检测已知突变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
液态活检之循环肿瘤细胞(CTC)研究进展及技术平台简介1.CTC基础知识1.1.CTC的基本概念1869年,澳大利亚学者Ashworth在一例转移性肿瘤患者血液中首次观察到从实体肿瘤中脱离并进入血液循环的肿瘤细胞,并首次提出了循环肿瘤细胞(CTC)的概念。
1976年,Nowell将CTC的定义修正为:来源于原发肿瘤或转移肿瘤,获得脱离基底膜的能力并入侵通过组织基质进入血管的肿瘤细胞。
上世纪90年代,科学家开始对CTC的临床意义进行研究。
2000后,CTC日益成为临床上液态活检标志物的研究热点,并在临床越来越广泛的应用。
1.2.CTC的特点i.可能是单个细胞从病灶脱落进入外周血,也可能是成簇脱落;ii.不同CTC在形态上有较大差别;iii.CTC有很强的异质性,不同类型的肿瘤CTC差别很大,即使同一病人来源的不同CTC 细胞表所表达的标志物种类及表达量也有差异;iv.CTC可能在循环过程中发生上皮间质转化(EMT)逐渐丧失上皮标志物;v.血液中存在可检测CTC的患者比例随癌症类型的不同而不同。
比如结直肠癌、卵巢癌和乳腺癌大约是50-70%,而非小细胞肺癌则低至30%;vi.CTC活力强,有抗脱巢凋亡活性;vii.CTC有侵袭和转移潜能。
图1. CTC的特点2.CTC检测技术血液中大部分成分是白细胞和红细胞,CTC所占的比例相对较少。
每10mL血液中,含有1亿个白细胞和500亿个左右红细胞,而CTC的数目可能仅有几个到几十个。
想要准确地检测CTC细胞数目依赖非常灵敏的检测手段。
近年来随着现代医学研究技术的进步和CTC临床应用价值凸显,许多研究机构和研发团队都在推出不同的CTC检测技术。
CTC检测技术包括CTC的富集(分离)和CTC的分析鉴定(识别)等。
2.1.CTC富集(分离)1.1 免疫亲和法建立在免疫亲和原理上的CTC富集方法,利用特异性抗体与细胞表面抗原进行特异性结合来富集CTC。
基于免疫亲和的方法也分为很多种:1.1.1免疫磁珠法:以CellSearch®法为代表,在磁珠上包被细胞表面粘附分子EpCAM,来捕获CTC。
临床研究证明该方法检测出的CTC数目与肿瘤的预后密切相关。
FDA已批准CellSearch®检测的CTC数目用于预测转移性乳腺癌,前列腺癌,结直肠癌的预后。
1.1.2微流体法:Nagrath和Toner的团队研发了一种用于捕获CTC的微流体。
上面有78,000个微柱与EpCAM的抗体相结合,可直接捕获全血中的CTC。
整个微流体共有970 mm2的表面积,在2mL/hour的通量下,CTC捕获效率>60%,特异性在50%左右。
在多种转移肿瘤中该方法已被证明有较高的CTC捕获效率。
1.1.3纳米结构基体:Wang et al等人将EpCAM抗体结合在硅质的纳米基体上,进行CTC捕获。
1mL/hour的通量下,可以达到95%以上的捕获效率。
一项研究利用该方法对26例前列腺癌进行检测,CTC的检出率为20/26,明显高于CellSearch®系统(8/26)。
1.1.4微量离心管:由Hughes et al研制,在微量离心管上包被EpCAM及PSMA的抗体,4.8mL/hour的通量下,捕获率可达50%,特异性达66%。
用该方法对14例转移性肿瘤患者进行CTC检测,检出率为100%,明显高于CellSearch®系统(9/14)。
1.1.5体内富集:将结合EpCAM的装置从前臂静脉插入病人体内,并停留30min,从而进行体内CTC富集。
临床实验证明这种方法对乳腺癌和肺癌的CTC细胞均有较高的捕获效率。
1.1.6白细胞去除法:属于阴性富集法。
用特异性抗体CD45,CD14等与白细胞结合,从而去除全血中的白细胞。
该方法比其它富集方法捕获效率更高,但特异性明显低于其它方法。
利用抗原抗体相互作用原理的CTC富集方法可得到较高的纯度。
但捕获效率对细胞表面抗原的表达情况依赖较明显。
对于依赖EpCAM的捕获方法,CTC捕获效率与细胞表皮抗原的表达情况密切相关,一些CTC可能由于EMT过程中表皮抗原发生变化而未被捕获。
另外EpCAM法仅限于对上皮来源的CTC进行检测。
相对于其它方法,免疫亲和法对CTC 的富集效率偏低。
1.2 物理特性富集法依据CTC的物理特性,如密度、大小、可变形性及表面电荷等进行富集。
1.2.1密度梯度离心:非常廉价高效的CTC分离方法,可将CTC与白细胞和红细胞分离。
目前市场上有较多的依赖密度梯度离心进行CTC富集的试剂盒,如Ficoll-Paque®solution (PharmaciaFine Chemicals, Uppsala, Sweden),OncoQuick®(Grenier BioOne, Frickenhausen, Germany)等。
临床实验证明,密度梯度离心富集CTC比CellSearch®系统效率更高。
1.2.2微孔过滤:依据CTC体积大于血细胞的特性,对CTC进行捕获。
该技术已在转移性肝癌,肺癌,前列腺癌,黑色素瘤等肿瘤中被证明有效。
捕获效率高于CellSearch®系统。
1.2.3微流控芯片:最初由Tan和Lim团队研发,针对CTC的体积和可变形性,CTC 的捕获率和特异性均可达到80%以上。
在Tan和Lim研究的基础上,研究者们又发展了不少改进型的微流控芯片。
1.2.4介电电流:由于CTC与血细胞所携带的电荷不同,在双向电泳的条件下,可将CTC 有效捕获(95%)。
目前该技术主要对细胞株进行研究,临床标本的研究相对较少。
物理特性富集法操作简单,成本低廉,不依赖细胞表面抗元的表达,捕获效率较高,但相比其它方法,所富集的CTC纯度较低。
图2. CTC分离、富集及检测2.2.CTC分析鉴定利用免疫亲和或物理特性法可富集到CTC,这只是研究CTC的第一步,还需要结合有效的下游分析方法。
一方面由于目前CTC捕获技术不能保证百分之百的纯度,需要对所得到的细胞进行鉴定,以进一步确定CTC细胞的数目,以减少CTC数目判定的假阳性率和假阴性率。
另一方面在肿瘤的发生发展过程中,不仅CTC的数目在动态的变化,CTC所携带的分子标志物也在变化,通过对CTC表面标志物检测,能够反应肿瘤发生发展的动态变化,是研究肿瘤发生发展机制的有效策略,并能很好地指导临床治疗。
常用的CTC分析鉴定技术如免疫荧光、PCR、FISH及高通量测序等。
2.2.1.免疫荧光法(IF)IF可用于检测CTC表面分子标志物的表达情况。
CellSearch®系统应用了免疫荧光对CTC进行鉴定。
EpCAM +、CK +、DAPI+、CD45 -的细胞被判定为CTC,而EpCAM +、CK +、DAPI+、CD45 +的细胞不被判定为CTC。
在科研方面有非常多的免疫荧光法结合CTC的研究案例。
Baccelli等在各自的研究中对富集的CTC进行干细胞相关标志物CD44,CD24, CD133,ALDH1等的检测。
Armstrong等在各自的研究中对富集的CTC进行表皮间质细胞相关标志物,TWIST, AKT2, PIK3α,N-cadherin and vimentin等进行检测。
Ignatiadis等用IF检测了乳腺癌CTC中HER2的表达。
Shaffer 等分别检测了前列腺癌中EGFR和AR基因的表达。
2.2.2.荧光原位杂交(FISH)FISH技术亦可以与CTC非常好的结合,不仅可以检测CTC表面标志物,亦可以检测CTC细胞内部的标志物及核型等。
I-FISH CTC检测系统利用白细胞去除法富集CTC 后,用FISH法对细胞的核型进行判断,将异倍体阳性,表面EpCAM阳性,和DAPI阳性的细胞定义为CTC。
Attard G等6,对89例乳腺癌患者进行研究,在治疗过程中每个月提取一次CTC,并用FISH技术检测TMPRSS2-ERG融合基因,AR和PTEN拷贝数变化,该研究发现CTC表面标志物与组织活检有高度的一致性,并最终分析出在前列腺癌治疗过程中,上述基因的动态变化。
另一个典型的例子是Pailler E等7发表在J Clin Oncol上的一项研究。
研究对象是18例组织检测ALK融合基因阳性和14例组织检测ALK融合基因阴性的肺癌患者。
结果表明组织检测ALK融合基因阳性患者体内可检测到ALK融合基因阳性的CTC,这些ALK融合基因阳性的CTC在融合位点方面有很强的异质性,各种类型的CTC 所占比例在crizotinib治疗过程中动态变化。
2.2.3.基于PCR的检测方法CTC富集结合RT-PCR可同时对若干个基因的表达进行检测。
Sieuwerts等8对50例转移性乳腺癌患者进行研究,术前采集CTC,其中CTC数目的大于5的患者为32例。
接下来用RT-PCR法检测55个mRNA和10个miRNA,依据这些基因的表达情况,将转移性乳腺癌患者分成四类,每类患者的恶性程度和预后是不同的。
这种分类方法比依赖HER2和ER进行分类能更好地指导临床。
Chang K等对75例前列腺癌患者进行研究,统计外周血中CTC的数目,并检测CTC所含的干细胞相关基因(ABCG2,PROM1,PSCA)和EMT 相关基因(TWIST1和vimentin)的表达情况,经统计分析发现,CTC中干细胞相关基因的表达情况可作为前列腺癌的预后指标。
位点特异性PCR技术可用于检测CTC携带的驱动基因的突变情况。
例如,MaheswaranS等9对接受酪氨酸激酶抑制剂(TKI)治疗的非小细胞肺癌患者进行CTC检测,在统计CTC的数目的同时,对CTC携带的EGFR激活突变进行检测,统计结果表明,携带T790M突变CTC的患者表现出明显的TKI耐药,且无进展生存期明显低于不携带T790M突变CTC的患者(7.7 months vs 16.5months, p<0.001)。
2.2.4.高通量单细胞测序随着新一代测序技术的发展,对单个CTC细胞进行测序具有了可行性。
CTC单细胞测序首先依赖于单细胞扩增技术。
比较有代表性的是哈佛大学谢晓亮团队研发的多重退火和成环循环扩增技术(MALBAC)。
该技术能从一个细胞的基因组中,分离出来自单细胞的DNA,然后添加称作引物的短DNA分子。
这些引物可与DNA的随意部分互补,从而使得它们能够附着到DNA链上,充当DNA复制起点。
MALBAC可以有效地降低PCR扩增偏倚,使得单细胞中93%的基因组能够被测序。
这种方法使得检测单细胞中较小的DNA序列变异变得更容易,因此能够发现个别细胞之间的遗传差异10。
这样的差异可以帮助解释癌症恶化的机制,生殖细胞形成机制,甚至是个别神经元的差异机制。
