二元系相图基本类型介绍及分析(自己整理)
第六章二元相图

2、多相平衡的公切线原理
若G = mAxA+ mBxB,且mi与i 组元含量有关,则可导出:在任意一相的 G - x曲线上,每一点的切线,其两端分别与纵坐标相截,与每一组元的 截距表示该组元在固溶体成分为切点成分时的化学势
说明:
冷却速度越慢,越接近平衡条件,测量结果越准确 纯金属在恒温下结晶,冷却曲线应有一段水平线
其它测定相图的方法:
热膨胀法:利用材料在发生转变时伴随有体积变化的特性,通
过测量试样长度随温度的变化得到临界点,从而作出相图
电阻法:利用材料电阻率随温度的变化来建立相图的 这两种方法适用于测定材料在固态下发生的转变
自由能 ~ 成分关系
(假设A、B组元原子半径相同,晶体结构相同,且无限互溶,则两组元混合前后体积不变; 只考虑最近邻原子间的键能;只考虑两组元不同排列方式的混合熵,不考虑振动熵) xA、xB — A、B组元的摩尔分数,
— 相互作用参数, N A z e AB
x A xB 1
i n i T , P ,r
G
(代表体系内物质传输的驱动力; 等温、等压及其它组元数量不变 的情况下,每增加单位摩尔i 组 元,体系自由能的变化)
组元i 的化学势: (偏摩尔自由能)
ji
如果某组元在各相中的化学势相同,就没有物质的传输,体系处于平衡状态
若体系包含有a,b,……相,对每个相自由能的微分式可写成:
材料组成的层次
组元
加一点盐 完全溶解
材料科学基础-8-二元相图(2)
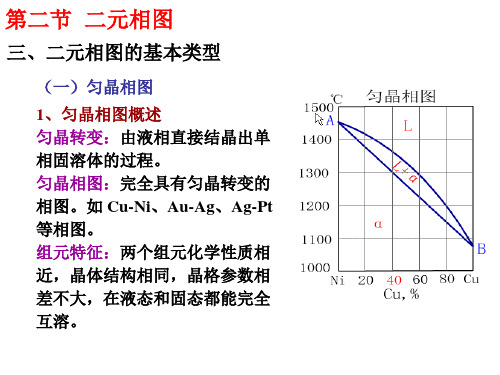
第二节 二元相图
(一)匀晶相图
2、固溶体的平衡凝固
(3)固溶体的结晶规律
c.固溶体的凝固过程与纯金
属一样,也包括形核与长大
两个阶段
e. 平衡凝固得到的固溶体显
微组织和纯金属相同,除了
晶界外,晶粒之间和晶粒内
部的成分却是相同的。
d.合金结晶形核时需要能量
起伏和成分起伏
a. 固溶体的结晶与纯金属不同,它不在
(2)压力加工性:压力加工合金通常是相图上单相固溶体
成分范围内的单相合金或含有少量第二相的合金。
——单相固溶体合金切削加工性能
不够好,而具有两相组织的合金切
削加工性一般比较好。
(4)热处理性:
相图上无固态相变或固溶度变化的
合金不能进行热处理。
孔等缺陷。
——我国20世纪60年代开始研制Pt-Ag合金,但至今无法批量
稳定发展
——国内外通过添加Pd(钯)制成Pt-Pd-Ag三元合金,虽综合
性能不如Pt-Ag合金,但加工性能得以改善。
第二节 二元相图
(三)包晶相图
2、包晶合金的凝固及其平衡组织
(1)ω (Ag)为42.4%的Pt-Ag合金(合金I)
′
% =
× %
第二节 二元相图
1186℃
A
LP+αC ↔ βD
(三)包晶相图
f=2-3+1=0
包晶点
• 1、包晶相图
• 包晶转变:由一个固相与
液相作用生成另一个固相
的过程。
• 包晶相图:两组元在液态
无限互溶,固态下有限互
溶,并发生包晶反应的二
元系相图。
第二节 二元相图
2、包晶合金的凝固及其平衡组织
二元体系相图

三、简单二元水盐相图的标绘
首先,应从溶解度手册中查出该体系的相平衡数 据。现以NaNO3—H2O体系为例。
相图的标绘完全符合连续原理和相应原理。 一般应按下述步骤进行。
NaNO3-H2O二aNO3%
0
平衡固相
ice
2
-5
第三节 二元水盐相图的两个规则和化工过程 一、相的定性关系——直线规则 直线规则是指在一定温度下,系统分成两部分,这 两部分的图形点与系统点比处在同一直线上,且系 统点居中。
G:G1:G2=M1M2:MM2:MM1
二、相的定量关系——杠杆规则
系统总质量与组成系统两部分点之间的距离长度成正比;而部 分量与部分长度相对应,但部分量对应的线段是与它们遥相对 应的一段,而不是紧邻的一段。 杠杆规则又称直线反比规则。应注意组成系统部分的图形点的 位置可在百分组成坐标横轴方向上的任何一点上,即不一定在 端点上。两个部分的图形点之间的长度代表系统的总量。其次, 杠杆长度只代表系统或各部分物料的质量之间的相对比例关系, 而不是代表物料的绝对量,有时也会出现代表部分量的线段长 于代表整体线段长度的情况。 杠杆规则只适用于用百分数表示的组成单位的相图。 杠杆规则适用于二至五元体系。
要求: 1、分析KNO3-H2O二元体系相平衡数据。(注意饱 和溶液对应的平衡固相) 2、建立坐标系。 3、编号标点。 4、连溶解度曲线。 5、确定有关固相的位置。 6、划分相区
课堂练习2:绘制简单KCl-H2O体系相图
温度
液相组 固相 成
温度
液相组 固相 成
0 -2.3 -5.0 -7.6 -10.0 -10.8 -5 0 10 20 40
例题:(NH4)2SO4-H2O二元体系
二元系相图基本类型介绍及分析(自己整理)

②形成不连续固溶体的二元系统相图
溶质只能以一定的限量溶入溶剂,超过限度便会出现第二相,这种固溶体称 为不连续(也称部分互溶或有限互溶)固溶体。在 A,B 两组元形成有限固溶体 系统中,以 SA(B)表示 B 组元溶解在 A 晶体中所形成的固溶体,SB(A)表示 A 组元 溶解在 B 晶体中所形成的固溶体。根据无变量点性质的不同,这类相图又可以 分为具有“低共熔点”和具有“转熔点”两种类型。 1)具有“低共熔点”的有限固溶体的二元系统相图(共晶体系)
G1 M 2 M G2 M 1M
此关系式与力学上的杠杆很相似,如图上图所示,M 点相当于杠杆的支点, M1 和 M2 则相当于两个力点,因此称为杠杆规则。可以看出,系统中平衡共存的 两相的含量与两相状态点到系统总状态点的距离成反比。即含量愈多的相,其状 态点到系统总状态点的距离愈近。 使用杠杆规则的关键是要分清系统的总状态点, 成平衡的两相的状态点,找准在某一温度下,它们各自在相图中的位置。
液-固两相的成分将偏离平衡相图中的液相线和固相线,即发生不平衡析晶,产 生偏析现象。 为了描述偏析, 引入分布系数 K0。 分布系数表示溶质在固相中的浓度 CS 与 在液相中的浓度 CL 的比值,即
K0 CS CL
K0 是浓度的函数。溶质使体系熔点降低者,K0<1,如图 2 中的(a) ,例如掺 Nd3+ 的 YAG 体系属此种情况(YAG 为钇榴石) 。溶质使体系熔点升高者,K0>1,如 图 2 中的(b) ,例如掺 Cr3+的 Al2O3 系统(即红宝石)属这种情况。对于固、液 同成分点,K0=1。
(1)相图的表示方法
二元体系相图wqc

为351.28K,含乙醇95.57 。
最高恒沸混合物
处在最高恒沸点时的混合 物称为最高恒沸混合物(high -boiling azeotrope)。
T
2)A – B二元体系结晶过程
M
a
L
S1 T1 L1
S2
L2
A+L
SE d
ME
E B+L
A+B
A
C
T > T1, 组成为M熔体,处于液相区, f = 2 – 1 + 1 = 2,变量:T, c
T = T1, A饱和而析出,固液两相平衡, f = 2 – 2 + 1 = 1,变量:T 或c
T降低时,液相组成沿aE变化, 固相a量增加。
t/oC
20 40 60 80 100 120 132.8
水相wB% 8.5 7.0 6.4 7.2 9.3 14.0 37 醇相wB% 83.6 81.6 79.0 75.2 70.2 61.5 37
a,b (L’,L”): 共轭溶液 (conjugate solution)
tc: 临界溶解温度 (critical solution temperature) 汇溶温度 (consolute temperature) Akb ----汇溶线 K ---- 分层消失临界点
K
tc
L
a
b
L’ + L”
A wB%
B
二元炉渣相图
CaO-SiO2相图
CaO-SiO2体系中含有四种化合物:
材料科学基础4-2二元相图及其类型

2016
液相线:
2020
组成
2017
凝固过程:
2021
后退
2018
合金1:
下页
01
04
02
03
如图所示
后退
下页
伪共晶 在非共晶成分处获得100%的共晶组织,只能在非平衡条件下得到。
不平衡凝固
后退 下页
不平衡共晶
m点以左,n点以右合金不平衡凝固时出现的共晶组织 。
01.
后退
02.
后退
下页
(2)共晶转变 在三相共存水平线men上,两条液相线汇交于e点。e点以上是液相区,e点下方是α+β两相共存区。这说明,相当于e点成分的液相,当冷至三相共存线men时会同时结晶出成分为m的α相与成分为n的β相。
三个单相区:
三个两相区:
后退
下页
共晶反应:
固相线:
2019
水的状态示意图
P
T
水
冰
气
其中f为系统的自由度数,C为组元数,P为自由度数等于组元数与相数之差再加上2。所谓自由度,即指独立可变的因
素,包括各组成相的成分、数量及温度、压力等。在金属及合金的制造和应用过程中,一般都是在常压下进行的,因此常把压力看成一个常数,相律的表达式可写成
相图基本知识
利用相图可以获取的信息 不同成分的材料在不同温度下存在哪些变化 各稳定相的相对量是多少 成分与温度变化时所可能发生的变化
第二节 二元相图及其类型
了解相图的分析和使用方法后,就可以了解合金的组织状态,进而预测合金的性能。另外,可以根据相图来制订合金的锻造和热处理工艺。
组元——组成材料最基本的、独立的物质。
第七章二元系相图

7.1二元系相图
7.1.1相图的表示和测定方法 7.1.2相图热力学的基本要点 7.1.3 二元相图分析
7.1.1相图的表示和测定方法
一、相图的表示法
由于通常所研究的金属或合金的相变都 是在常压下进行的,所以在相图表示时一般 可以不考虑压力因素的影响,只需考虑温度 和成分两个因素的影响。
1.二元系相图的表示法 由于二元合金的凝固是在一个大气压下 进行,所以二元系相图的表示多用一个温度 坐标和一个成分坐标表示,即用一个二维平 面表示。
计算机的问世使这种想法成为可能,目前 借助计算机用热力学计算法,已能建立简单 的相图。用热力学计算法建立相图,是通过 计算各合金相的自由能-成分曲线来建立相 图的。
一、溶体的自由能-成分曲线
这里溶体是指组元组成的溶液和固溶 体。由热力学可知溶体的自由能 G = H-TS 式中:H是溶体的热焓,S是溶体的熵。 由于在等压条件下热焓和熵都是温度T和 溶体成分的函数,即 H=f(T,X),S=f(T,X)。 因此只要得出热焓和熵与温度和成分的 关系曲线,就不难得到溶体的自由能-成分 曲线。
第七章二元系相图及其合金的凝固
7.1二元系相图
7.1二元合金相图
由于工业上广泛使用的金属材料绝大多 数是合金,因此要想合理的使用合金材料, 就必须进一步了解合金的凝固过程。
合金相图是反映合金在加热和冷却时, 合金中各种组织形成与变化规律的重要资 料,它是研究合金材料的重要工具之一,也 是许多理论研究和制定实际生产工艺的重要 依据,所以掌握好合金相图,对于从事合金 材料研究的科技人员是十分重要的。
三、混合物的自由能和杠杆法则
1.混合物的自由能
可以看出公式(7.6)为线性方程。 即混合物的自由能Gm和α相、β相的自由能 Gα和Gβ在同一直线上,它们的成分分别为x1, x,x2并且x位于x1和x2之间,所以合金以α、
二元相图的基本类型与分析

§4-2二元相图的基本类型与分析一、匀晶相图匀晶相图:组元在液态、固态均能无限互溶所形成的相图。
例如:Cu-Ni Fe-Cr W-Mo相图。
1、点、线、区的意义2、合金K的结晶过程1点以上, 合金为液相L。
1-2之间, 合金发生匀晶反应:L→α,2点以下, 合金全部结晶为α固溶体最终室温组织:单相 固溶体。
3、枝晶偏析固溶体结晶时如果冷却较快, 原子扩散不能充分进行。
先结晶的树枝晶轴含高熔点组元较多, 后结晶的树枝晶枝干含低熔点组元较多。
结果造成在一个晶粒内化学成分的分布不均。
这种现象称为枝晶偏析。
枝晶偏析对材料的机械性能、抗腐蚀性能、工艺性能都不利。
生产上为了消除其影响,常把合金加热到高温(低于固相线100℃左右), 并进行长时间保温, 使原子充分扩散,获得成分均匀的固溶体, 这种处理称为扩散退火。
二、共晶相图共晶相图:两组元在液态下无限溶解,在固态下不能无限溶解,并有共晶转变的相图。
例如:Al-Si Al-Sn Pb-Bi等相图分析:相:α相:Sn溶于Pb中的有限固溶体。
β相:Pb溶于Sn中的有限固溶体。
主要点、线的含义:d点:共晶点cde水平线:共晶反应线cf线:Sn在Pb中的溶解度线(或α相的固溶线)。
合金从高温冷却时,碰到此线,从α相中析出β相。
从固态α相中析出的β相称为β。
IIeg线: Pb在Sn中溶解度线(或β相的固溶线)。
合金从高温冷相。
却时,碰到此线,从β中析出αII1、平衡结晶过程①成分在fc’之间的合金I的平衡结晶过程1点以上:合金为液相L1-2之间:合金发生匀晶反应: L →α,2-3之间:合金全部结晶为α固溶体3点以下:由于Sn 在α中的溶解度沿cf 线降低, 从α中析出βII合金室温组织: α+βII②成分为e 点的合金II 的平衡结晶过程合金冷却到1点温度(T d ):共晶反应:一种液相在恒温下同时结晶出两种固相的反应叫做共晶反应。
共晶反应条件(d 点的含义):温度T d = 183℃ 共晶温度液体成分Sn ﹪ = 61.9﹪ 共晶成分共晶反应产物:(αc + βe )为共晶体;是两相混合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
G1 M 2 M G2 M 1M
此关系式与力学上的杠杆很相似,如图上图所示,M 点相当于杠杆的支点, M1 和 M2 则相当于两个力点,因此称为杠杆规则。可以看出,系统中平衡共存的 两相的含量与两相状态点到系统总状态点的距离成反比。即含量愈多的相,其状 态点到系统总状态点的距离愈近。 使用杠杆规则的关键是要分清系统的总状态点, 成平衡的两相的状态点,找准在某一温度下,它们各自在相图中的位置。
图5
具有低共熔点的有限固溶体的二元系统相图
如图 5 所示。图中 aE 线是与 SA(B)与液相平衡的线。bE 线是与 SB(A)与液相 平衡的线,aC 和 bD 是两条固相线,E 点是低共熔点,在该点对应下的 AB 组分 时,SA(B)和 SB(A)有一个共同的熔化温度。 从 E 点液相中将同时析出组成为 C 的 SA(B)和组成为 D 的 SB(A)固溶体,其 相平衡方程为:
LE S A(B) (C) SB(A) (D)
aCF 是不同温度下,B 在 A 中的溶解度曲线,bDG 是不同温度下,A 在 B 中的溶解度曲线。C 点表示了组元 B 在组元 A 中的最大固溶度,D 点则表示了 组元 A 在组元 B 中的最大固溶度。相图中的六个相区里有三个单相区和三个二 相区。 将熔体 M 冷却到 T1 温度,液相对固溶体 SB(A)饱和,并从 L1 液相中析出组 成为 S1 的溶体 SB(A)。继续冷却,液相点沿着液相线向 E 点移动,固相点沿着固 相线从 S1 向 D 点移动。 当到达低共熔温度 TE 时,进行“低共熔过程”,从液相 LE 中“同时”析出 组成为 C 的固溶体 SA(B)和组成为 D 的固溶体 SB(A),系统进入三相平衡状态, P=3。根据二元相图中的相律 F=3-P 可知,此时 F=0,系统的自由度(组分,温 度,压力等)为零,体系没有可变因素,即温度不能变,液相的组分也不能变。 而现在系统中有相的数目为 3 个(液相 LE,固相 SA(B),和固相 SB(A)) 。因
相图的四个普适定律:
①相律:对于一个达到相平衡的系统而言,定有: F C P n ②杠杆定理:计算两相区内平衡存在的两个相的相对质量。 ③相平衡定律:体系中各相的数量并不影响这些相的平衡组成和性质。 ④质量作用定律:单位时间从相(1)转化到相(2)的分子数应当与该组分在相 (1)中的有效浓度成正比;反向转化的分子数应当与它在相(2)中的有效浓度 成正比。
液-固两相的成分将偏离平衡相图中的液相线和固相线,即发生不平衡析晶,产 生偏析现象。 为了描述偏析, 引入分布系数 K0。 分布系数表示溶质在固相中的浓度 CS 与 在液相中的浓度 CL 的比值,即
K0 CS CL
K0 是浓度的函数。溶质使体系熔点降低者,K0<1,如图 2 中的(a) ,例如掺 Nd3+ 的 YAG 体系属此种情况(YAG 为钇榴石) 。溶质使体系熔点升高者,K0>1,如 图 2 中的(b) ,例如掺 Cr3+的 Al2O3 系统(即红宝石)属这种情况。对于固、液 同成分点,K0=1。
二元系统相图的基本类型
相图中用途最大,研究得最多的就是二元相图。某些多元复杂体系,在一定 程度上也可以简化成“赝二元体系”来处理,因此我们在这里对二元体系做一个 简单介绍。
相图中有点、线、面,他们分别有如下含义:
①点:表示平衡相中某相的“温度”与“成分” ,亦称相点。如:同成分点、临 界点、共晶点、包晶点; ②线: 相转变时温度与“平衡相成分”的关系。如:固相线、液相线、固溶度线、 汇溶线、水平反应线; ③面:相型相同的一种状态区域。如:单相区、两相区、三相区;
差别,应加以注意。 相图中的任意一点既代表一定的组成又代表系统所处的温度,如 M 点表示 组成为 30%的 A 和 70%的 B 的系统处于 T1 温度。 由于在二元凝聚系统中温度和 组成一定, 系统的状态就确定了,所以相图中的每一点都和系统的一个状态相对 应,即为状态点。
(2)杠杆规则
如果一个相分解为两个相, 则生成的两个相的数量与原始相的组成点到两个 新生相的组成点之间的线段成反比。注意: 1)对任何两相平衡共存都可以适用; 2)对两相结合为一相的过程,杠杆定律也适用。
图 1 形成连续固溶体的二元系统相图
溶质和溶剂能以任意比例相互溶解的固溶体称连续(也称完全互溶或无限 互溶)固溶体,其二元系统相图如上图 1 所示。 由于组元 A 和 B 在固态和液态下(注意是固态和液态都可以)都能以任意 比例互溶而不生成化合物, 在相图中没有低共熔点也没有最高点,因而液相线和 固相线都是平滑连续曲线。A 和 B 形成的连续固溶体用 S 表示。整个相图分为 三个相区。图中曲线 a-L1-b 是液相线,曲线 a-S3-b 是固相线。液相线和固相线上 都是液相和固溶体两相平衡共存, P=2, F=1。 液相线以上是 “高温熔体单相区” , 固相线以下是“固溶体的单相区”,处于液相线与固相线之间的相区则是液相与 固溶体平衡共存的二相区。 在单相区内, F=2, 在二相区内 F=1。 由于此系统内只有液相和固溶体两相, 不可能出现三相平衡状态, 因此,这种类型相图的特点是没有一般二元相图上常 常出现的二元无变量点。 高温熔体 M 冷却到 T1 温度时开始析出组成为 S1 的固溶体,随后液相组成 沿液相线向 L3 变化,固相组成沿固相线向 S3 变化。冷却到 T2 温度,液相点到达 L2 点, 固相点到达 S2 点, 系统的状态点则在 O 点。 根据杠杆规则, 此时液相量: 固相量=OS2∶OL2。冷却到 T3 温度,固相点 S3 与系统的状态点重合,意味着最 后一滴液相在 L3 消失,液相消失,结晶结束。所以熔体 M 的结晶结束点在 L3 点,结晶产物是单相的固溶体。 在液相从 L1 到 L3 的析晶过程中,固溶体的组成从 S1 变化到 S3,连接同一 温度下成平衡的两相组成点的线段称为“结线”, 如图中的 L1S1 线、 L2S2 线等。 由结线可以看出,在互成平衡的两相中,液相总是含有较多的低熔点组元,而固 相则含有较多的高熔点组元。 固溶体的凝固依靠组元的扩散, 在析晶过程中固溶体要不断地调整组成以便 与液相保持平衡,而固溶体是晶体,原子的扩散迁移速度很慢,不像液态溶液那 样容易调节组成,要达到“平衡凝固”,只有冷却的过程足够缓慢,在相变过程 中有充分的时间进行组元间的扩散,以达到平衡相的成分。 但在工业生产中冷却速度往往很快, 在每一温度下不能保证足够的扩散时间, 这使得凝固过程中偏离了平衡条件,这称为“非平衡凝固”。在非平衡凝固中,
图 2 生成连续固溶体的二元系统分布系数示意图(a)K0<1;(b)K0>1
在形成连续固溶体的系统中,任一组成的熔体的凝固点都介于两个纯组元 的凝固点之间。因此可以从熔体中把两组元分离获得纯粹的 A 和 B。
图 3 分步结晶法示意图
将某熔体 M 冷却到 1 点, 系统由固溶体 S1 和液相 L1 两部分组成。 这时 S1 中 A 的百分含量比原熔体 M 中的 A 百分含量多(横坐标中越靠近 A 点,A 含 量越高) ,L1 中 B 的百分含量比原熔体中 B 的百分含量多。将 L1 分离出来并冷 却到 3 点,则可获得 L3 液相且其 B 的百分含量又比 L1 中 B 的百分含量多。如 此重复,可获得纯 B(确切地讲比较纯的 B) ;另一方面,将 S1 重新熔化,然后 再冷却到2点获得固溶体 S2, 其中 A 的百分含量比 S1 多。 重复几次可得比较纯 的 A。这种办法叫做分步结晶法,可以把固溶体中两组元分离开。 在连续固溶体相图中还有两种特殊情况即具有“最高熔点”和“最低熔点” 的系统, 见图 4。 这两种相图可以看成是由两个简单连续固溶体二元相图构成的。 体系中的平衡关系可由子相图来分析,也可以把相图中的最高熔点 C 和最低熔 点 M 看成是“同成分熔点”/“同成分点” 。
二元相图中的几何规律:
①在二元系相图中,除点接触外相邻相区的相数差永远是 “1”(相区接触法则) ; ②在三相点处的相线曲率, 必须使其延长线所表示的亚稳相位于其他两条平衡相 线之间,而不是任意的(曲率原则) ; ③三相区的形状是一条水平线, 其上三点是平衡相的成分点 (如何分析这 3 点很 重要! ) ; ④若两个三相区中有 2 个相同相,则两条水平线间必是由这两相组成的两相区;
图 4 二元连续固溶体相同的两种特殊情况(a)具有最高熔点的二元连续固溶体相 图; (b)具有最低熔点的二元连续固溶体相图
②形成不连续固溶体的二元系统相图
溶质只能以一定的限量溶入溶剂,超过限度便会出现第二相,这种固溶体称 为不连续(也称部分互溶或有限互溶)固溶体。在 A,B 两组元形成有限固溶体 系统中,以 SA(B)表示 B 组元溶解在 A 晶体中所形成的固溶体,SB(A)表示 A 组元 溶解在 B 晶体中所形成的固溶体。根据无变量点性质的不同,这类相图又可以 分为具有“低共熔点”和具有“转熔点”两种类型。 1)具有“低共熔点”的有限固溶体的二元系统相图(共晶体系)
(3)二元系相图的主要类型
二元系可发生熔融、析晶、多晶转变、转熔、生成化合物或化合物分解、形 成各类固溶体及液相分层。其可以分成以下几种类型:
①连续固溶体(无限互溶)的二元相图
固溶体有两种类型: 1)置换型-两种组分粒子(分子、原子、离子)大小接近,在晶格中互相取代 而形成。如 Au-Ag,Ni-Cu。只有置换型固溶体才能完全互溶。 2)间隙型:两种组分的粒子尺度相差较大,由小粒子镶嵌在大粒子晶格的空隙 里而形成,如 Fe – C,Ni - C 等。
对于相律的几个注意点:
①相律推导的条件是平衡状态,故相律是各种相平衡体系都必须遵守的规律; ②相律是热力学推论,有普适性和局限性;
③相律只表示体系中组分和相的数目,不能指明组分和相的类型、结构、含量以 及之间的函数关系等; 如相律可以告诉我们在某一平衡条件下, 指定系统中有 几个相(只是一个数值) ,却不能指出是哪些具体的物相,这些物相究竟是什 么只能用实验去测得; ④自由度的值不得小于零; ⑤不能预告反应动力学(即反应速度) 二元系统是含有二个组元 (C=2) 的系统, 如 CaO-SiO2, Na2O-SiO2 系统等。 根据相律 F=C-P+2=4-P, 由于所讨论的系统至少应有一个相 (P≥1) , 所以系统最 大自由度数为 3,即独立变量除温度、压力外,还要考虑组元的浓度。对于三个 变量的系统,必须用三个坐标的立体模型来表示。但是在通常情况下,对于凝聚 系统可以不考虑压力的改变对系统相平衡的影响, 此时相律可用 F=C-P+1 表示。 在后面所要讨论的二元、三元、四元系统,如果没做特别说明都是指凝聚系统。 对于二元凝聚系统,则 C=2,其相律为: F=C-P+1=3-P 当 Pmin=1 时,Fmax=2;当 Fmin=0 时,Pmax=3。可见,在二元凝聚系 统中平衡共存的相数最多为 3, 最大自由度数为 2。 这两个自由度就是指温度 (T) 和两组元中任一组元的浓度 (x) 。 因此二元凝聚系统相图仍然可以用平面图来表 示,即以温度组成图表示。
