3电化学腐蚀热力学
第三章 电化学腐蚀的基本原理

宏观腐蚀电池
铜铆钉
1. 异种金属相接触 如 电偶腐蚀 2. 浓差电池 (1)金属离子浓度不同,
铝板
浓度低电位低,容易腐蚀 (2)氧浓度不同 氧浓度低电位低,更容易腐蚀 3. 温差电池 如金属所处环境温度不同,高温 电位低,更容易腐蚀
粘 土 沙 土
微观腐蚀电池
(1)材料本身的不均匀性
化学成分不均匀
平衡电极电位
当金属电极上只有一个确定的电极反应,并且该反应处于动态平衡,即金属 的溶解速度等于金属离子的沉积速度,在此平衡电极过程中,电极获得一个 不变的电位值,该值被称为平衡电极电位(可逆电极电位)。
Fe Fe2 2e Fe2 2e Fe
Fe Fe 2+
Fe 2+ Fe
电荷平衡: ia = ic
金属在25℃时的标准电极电位 e (V,SHE)
电极反应
K=K++e Na=Na++e
e,伏
-2.925 -2.714 -2.37 -1.66 -1.63
电极反应
Ni=Ni2++2e Mo=Mo3++3e
e,伏
-0.250
-0.2 -0.136 -0.126 -0.036 0.000 +0.337 +0.521 +0.189
组织结构不均匀
微观腐蚀电池
金属表面的物理状态不均匀
金属表面膜的不完整
(2)液相不均匀性
离子浓度(质子或氧离子浓度)
(3)系统外界条件不均匀性
温差、光照等分布不均匀
3.3 电极与电极电位
电极
电极的概念——电子导体(金属等)与离子导体(电 解质)相互接触,并有电子在两相之间迁移而发生氧 化还原反应的体系。 电极一般分为单电极和多重电极 单电极是指电极的相界面上发生唯一的电极反应 多重电极则可能发生多个电极反应
第二章电化学腐蚀热力学要点

2.3.2微观腐蚀电池
• 在金属外表上由于存在许多极微小的电极 而形成的电池称为微电池。微电池是因金 属外表的电化学的不均匀性所引起的,不 均匀性的原因是多方面的。
图2.4 腐蚀电池
图2.5铜锌接触形成腐蚀电池示意图
图2.6铸铁形成腐蚀电池示意图
• 单个金属与溶液接触时所发生的金属溶解 现象称为金属的自动溶解。这种自溶解过 程可按化学机理进展,也可按电化学机理 进展。金属在电解质溶液中的自动溶解属 于电化学机理。
图2.7金属锌在稀酸溶液中的腐蚀
2.2.4金属腐蚀的电化学历程
• 金属腐蚀反响体系是一个开放体系。在反响过程 中,体系与环境既有能量的交换又有物质的交换。
金属腐蚀反响一般都是在恒温和恒压的条件下进 展的,用体系的热力学状态函数吉布斯(Gibbs)自
由能判据来判断反响的方向和限度较为方便。吉 布斯自由能用G表示,对于等温等压并且没有非
体积功的过程,腐蚀体系的平衡态或稳定态对应
• Zn2++ 2OH- → Zn(OH)2 ↓ • 这种反响产物称为腐蚀次生产物,也称腐蚀产物。某些情
况下腐蚀产物会发生进一步的变化。例如铁在中性的水中 腐蚀时Fe2+离子转入溶液遇到OH-离子就生成Fe(OH)2, Fe(OH)2又可以被溶液中的溶解氧所氧化而形成Fe(OH)3。
• 4 Fe(OH)2+O2+H2O→ 4Fe(OH)3: • 随着条件的不同(如温度、介质的pH及溶解的氧含量等)也
• 从上面讨论的腐蚀电池的形成可以看 出,—个腐蚀电池必须包括阴极、阳极、 电解质溶液和连接阴极与阳极的电子导体 等几个组成局部,缺一不可。这几个组成 局部构成了腐蚀电池工作历程的下三个根 本过程。
电化学腐蚀热力学剖析

电化学腐蚀热力学剖析概述电化学腐蚀是金属在与混合电解质接触时产生的一种可逆或不可逆的化学反应,主要是通过产生原子或离子,在这一过程中,通常会产生电子和阳离子或阴离子,这样金属就会被氧化,这种反应有时也叫做“原电池”。
在电化学腐蚀过程中,腐蚀后沉积物是由金属离子和阴、阳离子的复合物组成的,这个复合物的成分、结构、形态和物理化学性质,与电化学反应的热力学特性息息相关。
电位和电动势在电化学腐蚀过程中,金属表面被氧化而形成的离子产生了电动势,可以用电位的概念来描述。
电位是指一个试验电极在电解质中相对于标准电极势的电势差。
标准电极势是未受化学反应影响时所产生的电位,一般为0 V。
根据电位的大小可以判断金属是否会被电化学腐蚀,以及会被腐蚀的程度。
理论上,电动势是由离子在电解质中的迁移产生的。
在系统中,电子和阳、阴离子之间的迁移是通过氧化还原反应活动发生的。
电极间差电势就是金属接触电解液所造成的电荷分布而产生的电势差。
电化学腐蚀的热力学特性电化学腐蚀的热力学特性主要是通过反应自由能来描述的。
反应自由能是所考虑的化学反应的反应热和熵变的差值。
对于一个化学反应来说,自由能越小,其越倾向于发生。
在电化学腐蚀中出现氧化还原反应,如下所示:Fe→Fe2++2e−O2+2H2O+4e−→4OH−通过上述反应可以看出,当发生氧化还原反应的时候,反应物和产物之间的自由能差,将会决定反应是否会发生,也就是反应的方向性。
如果自由能差大于0,反应就会向反方向发生,这就会导致电化学腐蚀。
影响电化学腐蚀的因素电化学腐蚀是由于环境因素和材料特性的相互作用而引起的。
以下是一些影响电化学腐蚀的主要因素:环境因素1.电解质的浓度:电解质浓度越高,电势差越大,腐蚀越严重。
2.离子活性:离子活性越高,电位越负,金属表面的腐蚀程度越大。
3.温度:温度越高,电化学反应速度越快,腐蚀越严重。
材料特性1.金属组成:不同的金属在相同的环境下会产生不同的电位和反应特性。
电化学腐蚀热力学

电极组成电池,所测得相对平衡电位。 标准氢电极电位定义为0。
3.非平衡电极电位
非平衡电极电位— 电极反应达到电荷交换平衡可逆,物质交 换不平衡可逆:
阳极反应 Fe Fe 2+ + 2 e ( ia)
阴极反应 2H+ + 2e H2 ( ic)
质中易腐蚀;
+1.229 < Eϴ M ,贵金属,热力学完全稳定;(但有络合剂氧化物也会腐蚀)
根据 pH=7时,: E H/H+ = -0.414 V, E O2/ OH = +0.815 V pH=0时,: E H/H+ = 0.00 V, E O2/ OH = +1.229 V
分组判断金属材料的腐蚀热力学稳定性
iI > 0
腐蚀不可能发生。
例1:Zn在酸性溶液中: Zn + 2H+ = Zn2+ + H2
0 0 -35184 0 G = iI = -35184 Cal
例2: Ni在酸性溶液中 Ni + 2H+ Ni2+ + H2
0 0 -11530 0 G = -11530 Cal
例3:Au在酸性溶液中: Au + 3H+ Au3+ + 3/2H2
金属在电解质溶液中的腐蚀是电化学过程,这是绝大多数金 属腐蚀过程的本质。
如Fe在HCl中,可观察到铁的腐蚀溶解,并析出氢气:
阳极反应:Fe Fe2+ +2e 阴极反应:2H+ +2e H2
金属腐蚀破坏的短路原电池
腐蚀 第2章 腐蚀热力学
Fe Fe2++2e
i corr
lg i
平衡电位 – 热力学, E0 H2/H+ , E0 Fe/Fe2+ …. 非平衡电位 – 动力学/测量, 腐蚀电位,混合电位或偶合电位
2.2 金属在介质中的腐蚀倾向
2.2.1 腐蚀倾向热力学判断
从热力学可知,判断化学变化的方向和限度,对于不同 的条件,有不同的热力学判据。 对于孤立体系可用熵变判据; 对于等温等容下的体系,可用亥姆霍兹自由能判据; 在等温等压条件下,可用吉布斯自由能判据: 自发过程
+
i — i 组分内电位 i — i 组分外电位 I — i 组分表面电位
i= i + i 电功 i
相
当两相电化学位相等,电化学平衡建立:
Me Men+ + ne 对应电位差为平衡电极电位
Fe Fe 2+ + 2e Fe 2+ + 2e Fe
电荷平衡: ia = ic 物质平衡: M = Mn+
化学热力学- 化学位不同 相间粒子转移,粒子自发地从高化学位相转入低化学 位相,直到两相化学位相等。 iI = 0 在电场作用下,两相电化学位不同 相间粒子转移,带电粒子自发的从高电化 学位相转入低电化学位相,直到两相的电化学位相等。 iI = 0 电化学位与化学位关系: i= I + nFI = 化学功 + 电功
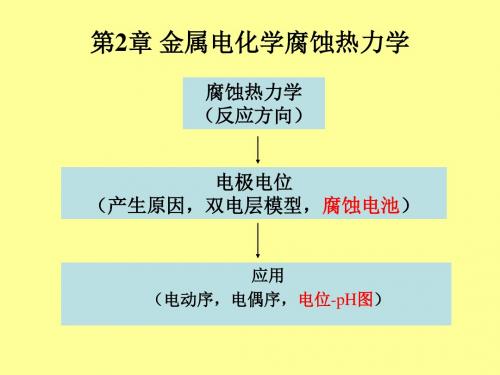
腐蚀热力学 (反应方向) 电极电位 (产生原因,双电层模型,腐蚀电池)
应用 (电动序,电偶序,电位-pH图)
2.1 电极体系和电极电位
2.1.1 双电层
腐蚀总是发生在相间界面,重要概念-电极电位,即电极各 相间电位差之和。双电层普遍存在-相间电位差本质原因
金属腐蚀电化学热力学

金属腐蚀电化学热力学1 介绍金属腐蚀是制约金属材料使用寿命的一个主要因素。
它会导致金属物质的质量和性能损失、破坏金属结构的完整性和功能等问题。
解决金属腐蚀问题,对于约束生产和军事用途等领域的安全和可靠性具有重要意义。
电化学热力学是研究金属腐蚀和防护的基础理论,它提供了热力学和动力学方面的基本概念和方法。
2 金属腐蚀金属腐蚀是一种从金属材料表面开始发生的化学反应。
根据腐蚀介质的种类不同,可以分为很多种腐蚀类型,例如在酸性或碱性环境中发生的化学腐蚀、在高温环境下发生的热腐蚀、在海水中发生的海洋腐蚀等等。
3 电化学热力学基础电化学热力学研究了在电化学反应中发生的能量转化和物质转化,研究对象包括纯物质和混合介质。
电化学反应既包括氧化还原反应,也包括非氧化还原反应。
例如,金属在水溶液中发生腐蚀就是非氧化还原反应,而重金属的还原则属于氧化还原反应。
根据能量守恒的原则,电化学反应必须满足能量自由度平衡和物质计量平衡两个条件,这些条件可以通过电动势(电化学电流)和吉布斯自由能来表达。
吉布斯自由能的变化可以用来描述反应的驱动力和平衡状态。
4 符号约定为了方便处理涉及电化学热力学的问题,约定如下的符号:- E:电势(电位)- G:吉布斯自由能(或被称为“自由焓”)- S:熵(系统的随机程度)- H:焓(能量加上压强的乘积)- T:温度- F:法拉第常数(电子和离子的相互作用参量)- n:反应中电子的数目- Q:电化学电量(电荷量)5 电化学反应驱动力发生在电化学反应中的物质转化和能量转化是由自由能的变化所驱动的。
该变化可通过称为“电电势差”(电势差、电位差或电压)的物理量来测量,其单位为“伏特(V)”。
电电势差可以表示为如下的方程式:E = (G_final - G_initial)/nF其中,G_final表示反应结束时的吉布斯自由能,G_initial则表示反应开始时的自由能,n是电子数,F则是法拉第常数。
该式子描述了反应的驱动力的大小和方向,反应是自发的,当E>0时则有外部电源参与。
3-电化学腐蚀热力学.ppt

(1)氢电极 H2 ⇔ 2H ++2e (2)氧电极 O2+4e+2H2 O
⇔
4OH-
3.氧化还原电极(简称氧还电极) 将金属—溶液界面上只有电子可以交换和迁移 的金属电极称为氧化还原电极,亦称惰性金属电 极.
二. 双电层 1.双电层的建立 (1)水化的力量能克服金属晶格中金属正离子 和电子之间的引力 --金属表面的一些金属正离子脱离金属,进入 溶液而成为水化离子→→金属表面积累了过剩的电 子,使金属表面带负电.
2.金属组织不均匀性构成的微电池 .
多晶体材料,晶界的电位通常比晶粒内部要低- -微电池的阳极 。
3.金属物理状态的不均匀性引起的微电池
金属各部分变形、加工不均匀、晶粒畸变,都会导致形成微观 电池。 一般形变大、内应力大部分为阳极区,易遭受腐蚀。此外,温 差、光照等不均匀,也可形成微观电池。
4 4.金属表面膜不完整引起的微电池
1.阳极过程--金属进行阳极溶解
[n+ n+ −
2.阴极过程 --还原反应:
ne + [ D ] → D ⋅ ne
− −
3.电流的流动
二.腐蚀原电池的类型 两大类:宏观腐蚀电池 微观腐蚀电池 宏观腐蚀电池、微观腐蚀电池 宏观腐蚀电池 (一)宏观腐蚀电池
2.只与PH值有关而与电极电位无关 Fe 2+ +2H2O ⇔ Fe(OH)2+2H+ (沉淀反应) Fe 3++ H2O ⇔ Fe(OH)2++H+ (水解反应)
在电位-pH图上为平衡与纵轴的垂线 ,图c。
3. 既与电极电位有关,也与PH有关,在电位-PH图上 为一斜线.图b 。例如:
电化学腐蚀热力学

过电位
01
定义:把某一极化电流密度下的电极电位与其平衡电位之差称为该电极反应的过电位。
腐蚀原电池定义:只能导致金属材料破坏而不能对外界作有用功的短路的原电池。
含杂质Cu的Zn板在盐酸中的演化实验
在混合电位下有如下规律:
01
02
多电极反应耦合系统
当一个孤立电极上有N>2个电极反应同时进行,且外电流等于0,这些电极反应组成了多电极反应耦合系统。 规律:
2-4 金属电化学腐蚀倾向的判据
金属及其化合物的热力学能量变化示意图
自由能判据 GT,P=0,平衡 GT,P<0,自发 GT,P>0,不可能发生
虚线(b)表示O2(分压 =10135Pa)和H2O的平衡关系,即:O2 +4H+ +4e → 2H2O
0 0 0 0
Fe3+
腐蚀
Fe2O3
钝态
Fe3O4
腐蚀 HFeO2-
稳定Fe
铁——水体系简化电位——PH平衡图 三种区域的划分
第二章 金属电化学热力学
2
1
5
本章重要知识点:
☼电极电位
☼腐蚀原电池、混合电位、交换电流密度、过电位
4
☼金属腐蚀倾向的热力学判据
3
☼平衡电极电位与非平衡电极电位
6
☼电位-pH图
问题的提出
电化学腐蚀是如何产生的?
腐蚀产生的条件是什么?为什么有些情况下产生腐蚀,而另外一些则不会?
1
2
3
4
5
6
非平衡电极电位
01
当金属电极上同时存在两个或两个以上不同物质参与的电化学反应时,电极上不可能出现物质交换和电荷交换均达到平衡的情况,这种情况下的电极电位称为非平衡电极电位,或不可逆电极电位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电极系统和电极电位
n 电子导体 在电场作用下,向一定方向移动的电荷粒子是电
子或带正电荷空穴。 如金属、半导体
n 离子导体 在电场作用下,向一定方向移动的电荷粒子是带
正电荷或负电荷的离子。 如电解质溶液或熔融盐
n相 由化学性质和物理性质一致的物质所组成而与系
统中其他部分之间有界面隔开的集合体。
电极系统和电极电位
2 第二类金属的电极反应 Ag+Cl-=AgCl+e
3 气体电极反应 2H++2e=H2 (Pt)
4 氧化还原电极反应 Fe2+=Fe3++e
电极反应的特点 :
n 金属材料是电极反应进行的场所和参与 者。
n 金属电极是腐蚀电池的阳极反应。
n 气体电极反应和氧化还原电极反应都可 能作为腐蚀电池的阴极反应。
电极电位
n 电极电位
金属和溶液两相之间的电位差叫做电极
系统的绝对电极电位,简称电位,记为
=m s
n 内电位
= +
n 双电层
由于金属和溶液的内电位不同,在电极系统的金属相 和溶液相之间存在电位差,因此,两相之间有一个相界区, 叫做双电层。
电极系统中发生电极反应,两相之间有电荷转移,是 形成双电层的一个重要原因。 例如:Zn/Zn2+,Cu/Cu2+
n 标准电位只取决于电极反应的本性,而平 衡电位还与参与电极反应各组分的活度(或 分压),以及温度有关。
金属在25度时的标准电极电位EO(V,SHE)
腐
电极反应
K=K++e Na=Na++e Mg=Mg2++2e Al=Al3++3e Ti=Ti2++2e Mn=Mn2++2e Cr=Cr2++2e Zn=Zn2++2e Cr=Cr3++3e Fe=Fe2++2e Cd=Cd2++2e Mn=Mn3++3e Co=Co2++2e
Eo
-2.925 -2.714 -2.37 -1.66 -1.63 -1.18 -0.913 -0.762 -0.74 -0.440 -0.402 -0.283 -0.277
电极反应
Ni=Ni2++2e Mo=Mo3++3e Sn=Sn2++2e Pb=Pb2++2e Fe=Fe3++3e H2=2H++2e Cu=Cu2++2e Cu=Cu++e 2Hg=Hg22++2e Ag=Ag++e Hg=Hg2++2e Pt=Pt2++2e Au=Au3++3e
Eo
-0.250 -0.2 -0.136 -0.126 -0.036 0.000 +0.337 +0.521 +0.189 +0.799 +0.854 +1.19 +1.50
蚀 热 力 学 返回
电动序
将各种金属的标准电位E0 的数值从小到大排 列起来,就得到 “电动序” 。
EFS可以清楚地表明各种金属转变为氧化状 态的倾向。在氢之前的金属的E0为负值,称负电性 金属;在氢之后的金属的E0为正值,称正电性金属。 ※电动序可以用来粗略地判断金属的腐蚀倾向
n 氢电极反应构成了最基本的参考电极:
标准氢电极。
返回
n 印度日报2009年3月1日报导,海德拉巴德(Hyderabad)的一家公司的研 究人员预言2012年地球和太阳的磁极将发生逆转。地球磁极逆转是指地 球磁场的北极和南极发生对调,在这个过程中地球将经历在某个时间点 上没有磁场的状态,地球磁场的磁力为零高斯(高斯为磁感应单位)。”
紧密双电层模型:
1
Helmholtz
10-10 m
n 由于双电层厚度很小,故双电 层内电场强度很大,因而对电 极反应产生很大的影响。
电极电位
n 电位的绝对值 无法测量。
n 电极电位的相对值可以测量。 n 电极电位的相对值记为E。 n 参比电极:各项参数保持恒定、参与电极反应的有
关物质的化学位保持恒定且处于平衡状态的电极系 统
n 电极系统 由电子导体(金属)和离子导体(电解质溶液)
组成的系统,且电荷从一个相通过两相界面转移到 另外一个相。 n 电极反应
伴随两个非同类导体之间的电荷转移而在两相 界面上发生的化学反应。 Cu(金属相)=Cu2+(液相)+2e(金属相)
★电极反应和化学反应区别
常见的电极反应类型
1 第一类金属的电极反应 Zn=Zn2++2e
非平衡电位
非平衡电位
当电极反应偏离平衡状态,电极 系统的电位称为非平衡电位。
过电位:η=E-Ee η=0
H2 2H+ +2e
η>0 阳极反应方向进行 ia η<0 阴极反应方向进行 ik
返回
偏离平衡的原因:
(1)有外电流流入或流出,使平衡状态被打破。
n 国际定义是氢标电位E(vs SHE). 但 SHE使用不方便. n 实验室常用SCE。 n 工程常用Cu/CuSO4 ※用不同参考电极测量的电位相对值是不同的。
电极电位必须注明参考电极
返回
平衡电位和Nernst公式
n 平衡电位
当电极反应达到平衡时,电极系统的电位 称为平衡电位,记为Ee
当电极系统处于平衡电位时,电极反应的正 逆方向速度相等,净反应速度为零。在两相之间 物质的迁移和电荷的迁移都是平衡的。
第二章 金属电化学腐蚀热力学
l电极电位
u电极系统和电极反应 u电极电位 u平衡电位和Nernst公式 u非平衡电位
l电化学腐蚀倾向的判断
u自由焓准则 u电位比较准则
u形成腐蚀电池的原因
l腐蚀电池的形成原因 l腐蚀电池的种类
l电位-PH平衡图
u什么是电位-PH平衡图 u电位-PH平衡图的绘制 u电位-PH平衡图上的区域 u电位-PH平衡图的应用 u电位-PH平衡图的局限性和发展
高阻电压表
盐桥
H2
试 样
介质
KCL溶液
表面镀
铂
铂黑
片
H2(l am)
待测电极
测量电极电位的原理电路
HCl 参比电极(SHE)
使用高阻电压表的目的是保证测量回路中电流极小,
盐桥作用是消除液接电位差,防止溶液污染。
标准氢电极(SHE)
电极反应
(Pt) H2 = 2H+ + 2e
规定标准氢电极的标准电位为零。
交换时
ik ia i0
平衡金属电极不发生腐蚀没有腐蚀
•Nernst公式
电极反应 aR = bO + ne
平衡电位的计算公式是
Ee (R / O)
E0
RT nF
Ln
[O]a [R]b
标准电位
n 电极反应的各组分活度(或分压)都为1,温 度为25C时,平衡电位Ee等于E0,E0称为标 准电位。
