配合物的应用PPT演示文稿
合集下载
【原创课件】配合物的应用gyb
*波尔是怎样保存金质奖章的呢?
(王水:V(浓HCl):V(浓HNO3) = 3:1的混合酸) Au+ NO3– + 4H+ + 4Cl– = AuCl4– + NO↑ + 2 H2O
(四氯合金酸根离子)
[P79 活动与探究]
[实验1]
5% AgNO3溶液
逐滴加入2mol/L NH3·H2O
先有白色↓生成且逐渐增 多,后白色↓逐渐溶解至 恰好全部溶解。
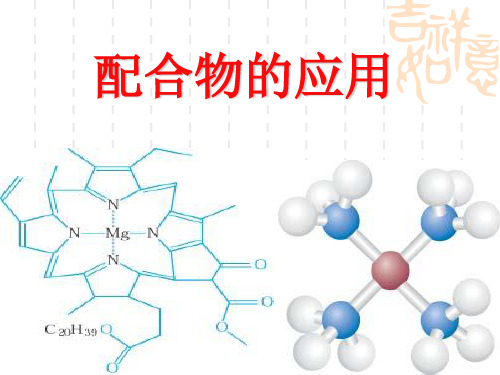
配合物的应用
战争结束后,波尔 著名丹麦物从理溶学液家中波还尔原提取出金 在二战期间并被重迫新离铸开成被诺贝尔奖章。 德国占领重的新祖铸国成,的为奖了章更加灿烂 保护他的夺诺目贝,尔因奖为章它,凝聚着波尔 他将奖章溶对入祖王国水的中无。限热爱。
纳粹分子闯入波尔家,那瓶溶 有奖章的王水就在他们的眼皮
底下,丝毫没有被发现。
[P79 活动与探究]
[实验2]
3mL2% FeCl3溶液
2~3滴2%KSCN溶液
Fe3+ + 3SCN– = Fe(SCN)3 (血红色)
溶液由棕黄色 变为血红色
检验Fe3+
➢如何检验Fe2+ ?
先加KSCN溶液,无明显现象,再加氯水,如果 溶液出现血红色,则说明原溶液中含有Fe2+ 。
[P80 活动与探究]
二、配合物的应用
1、银镜反应
AgNO3 + NH3·H2O == AgOH↓+ NH4NO3
AgOH + 2NH3·H2O == [Ag(NH3)2]OH + 2H2O
CH2OH(CHOH)4CHO + [Ag(NH3)2]OH 水浴加热 CH2OH(CHOH)4COONH4 + 2Ag↓+ 3NH3 + H2O
第五节配合物的应用-PPT课件

第八章 配位化合物
第五节
结束
谢谢!
3.冶金工业方面
制备高纯金属——采用羰基化精炼技术
如 高纯铁粉的制取
Fe+5CO2200M0℃Pa[Fe(CO)5] 200~250℃5CO+Fe
(细粉)
(高纯)
提取贵金属
如 在NaCN溶液中,使Au被氧化形成 [Au(CN)2]-而溶解,然后用Zn粉置换出Au。
无机化学多媒体电子教案
第五节结束
1.分析化学方面 离子的分离
Zn2+、 Al3+ 过量NH3·H2O
[Zn(NH3)4]2+ 无色
Al(OH)3 白色
1.分析化学方面 离子的掩蔽
Co2+(含Fe3+)
丙酮 KSCN
在分析化学上,这种排除干扰 的[作Co用艳(N称蓝C为色S)掩4]2蔽- 干效扰应。[Fe(N血C红S)色n]3-n 为消除所干用扰的, 先配加位入剂足称量为N掩H蔽4F剂(或。NaF)
无机化学多媒体电子教案
第五节配合物的应用
第八章 配位化合物
第五节
配合物的应用
1.分析化学方面
形成有色配离子
离子的鉴定
Cu2+ + 4NH3 → [Cu(NH3)4]2+ 深蓝色
Fe3+ + nSCN- → [Fe(NCS)n]3-n 血红色
形成难溶有色配合物
Ni2+ + 丁二肟 → 二丁二肟合镍(Ⅱ) 鲜红色
Fe3+ + 6F- → [FeF6]3- (无色)
2.配位催化方面
配位催化 在有机合成中,利用配位反应,而 产生的催化作用。即反应分子先与催化剂 活性中心配合, 然后在配位界内进行反应。
第五节
结束
谢谢!
3.冶金工业方面
制备高纯金属——采用羰基化精炼技术
如 高纯铁粉的制取
Fe+5CO2200M0℃Pa[Fe(CO)5] 200~250℃5CO+Fe
(细粉)
(高纯)
提取贵金属
如 在NaCN溶液中,使Au被氧化形成 [Au(CN)2]-而溶解,然后用Zn粉置换出Au。
无机化学多媒体电子教案
第五节结束
1.分析化学方面 离子的分离
Zn2+、 Al3+ 过量NH3·H2O
[Zn(NH3)4]2+ 无色
Al(OH)3 白色
1.分析化学方面 离子的掩蔽
Co2+(含Fe3+)
丙酮 KSCN
在分析化学上,这种排除干扰 的[作Co用艳(N称蓝C为色S)掩4]2蔽- 干效扰应。[Fe(N血C红S)色n]3-n 为消除所干用扰的, 先配加位入剂足称量为N掩H蔽4F剂(或。NaF)
无机化学多媒体电子教案
第五节配合物的应用
第八章 配位化合物
第五节
配合物的应用
1.分析化学方面
形成有色配离子
离子的鉴定
Cu2+ + 4NH3 → [Cu(NH3)4]2+ 深蓝色
Fe3+ + nSCN- → [Fe(NCS)n]3-n 血红色
形成难溶有色配合物
Ni2+ + 丁二肟 → 二丁二肟合镍(Ⅱ) 鲜红色
Fe3+ + 6F- → [FeF6]3- (无色)
2.配位催化方面
配位催化 在有机合成中,利用配位反应,而 产生的催化作用。即反应分子先与催化剂 活性中心配合, 然后在配位界内进行反应。
【公开课课件】配合物的形成和应用

(1)下列说法正确的是 BD
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(2)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+
配离子.已知NF3与NH3的空间构型都是三角锥形,但
[AlF6]3[Fe(CN)6] 3-
[Cr(NH3)4Cl2]+的几何异构体的数目是: 2 。
Cl
+
Cl
+
H3N
NH3
H3N
Cr NH3
Cl
NH3 Cl
Cr
NH3
NH3
NH3
NH3 Pt
Cl
7. 有两种化合物,
A:CoCl3·5NH3·H2O; B:CoCl3·5NH3·H2O,根据 下面的实验结果,确定它们的络离子、中心离子和配体。
Cu2+ +4NH3 = [Cu(NH3)4]2+ 提出你的设想。
[Cu(NH3)4]2+ 的结构简式为:
NH3中的N提供孤电子 对, Cu2+提供空轨道
形成配位键。
N
2+
H3
CHu3 NH3
N N
一、配合物的形成
1、配合物: 由提供孤电子对的配位体与接受孤
电子对的中心原子以配位键结合形 成的化合物。
+
Cl
Cl Cl
Co
NH3
NH3
NH3
顺式
+ Cl
Cl H3N
Co
NH3
NH3
Cl
反式
配合物ppt课件

少量 AgNO3 溶液
氨水
NaCl 溶液
AgCl 沉淀
Ag++Cl -= AgCl ↓
AgCl(s)
AgCl + 2NH3 = [Ag(NH3)2]++Cl-
kf kf
澄清
Ag+(aq) + Cl-(aq)
kr kr +
2NH3
=
+ 二氨合银离子: H3N Ag NH3
[Ag(NH3)2]+
3、配合物的应用 (1)在生产生活中的应用
[Cu(H2O)4]2+ + 4NH3
[Cu(NH3)4]2+ +4H2O
结论2:配位键的强弱有大有小,配合物更易转化为稳定性更强的配合物。
反应③:深蓝色晶体为[Cu(NH3)4]SO4·H2O
【P104实验活动】简单离子和配离子的区别
实验步骤
实验现象
解释
少
两滴
两滴
量
FeCl3(aq) KSCN(aq)
Cu2+ + 4H2O +
Fe
=
Cu+Fe2+
结论1:配离子也可以电离,存在电离平衡。
探寻到了CuSO4溶液中的铜离子,情境1目标达成!
【课堂练习1】 请根据给出的配合物完成下表
配合物
内界
外界 中心粒子 配体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
[Ag(NH3)2]+ OH- Ag+
NH3 2
【课堂练习2】
下列物质中,不能作为配合物的配位体的是( B )
A、NH3
B、NH4+
铜配合物ppt课件

23
•三星,LG等电子业巨头分别推出了 自己的大尺寸OLED电视,目前全球 OLED年市场份额己达数百亿美元, 这个新兴的市场已经开始规模化。
24
以发光机理划分,发光材料又可分为荧光材料和磷光材料。目前用于OLED的磷 光材料主要包括过渡金属配合物,如铱(Irlll)、铂(Ptll)、钌(RuⅡ)配合物等 。但这些过渡金属都属于价格昂贵的贵金属,制约着OLED的商业化。
39
同时又合成了一种新型三元1, 10- 菲咯啉- 苏氨酸- 铜(Ⅱ) 配合物,该配合物对HL-60 和 SGC-7901 肿瘤细胞都显示出明 显的体外细胞毒活性,且在多 数的实验浓度范围内其抗肿瘤 活性强于顺铂。
40
铜元素是普遍存在于动植物中的,生命必需的微量元素之一,在生 命过程中起着重要作用。许多金属酶和金属蛋白的活性部位均含有双 核铜(Ⅱ)结构单元,铜化合物具有多变的配位结构和活化小分子的催 化特性,常被用作双取代过氧化物分解的催化剂。此外,铜的配位环 境易于调变,其结构的易变性合成了多种单核或多核的铜配合物。
34
铜锌超氧化歧化酶(SOD)的活性 中心是一个咪唑桥基连接一个 Cu(II)离子和一个Zn(II)离子, Cu(II)离子与四个组氨酸残基和 一个水分子结合,Zn(II)离子与 一个天冬氨酸和三个组氨酸残基 结合,SOD能够保护细胞免受过 氧化物的伤害。
35
•科学家合成出如图的化合物模拟SOD,配体是一个 带有羟乙基的单一冠醚,配体具有了一定的刚性和 韧性可适应Cu(II)和Zn(II)离子的不同需求,由于 羟乙基存在可以模拟天然SOD酶中H20分子的作用, 络合物的ESR光谱显示三角椎型单核Cu(II)络合物特 征峰,能够歧化超氧化合物,具有较高的SOD催化活 性。
•三星,LG等电子业巨头分别推出了 自己的大尺寸OLED电视,目前全球 OLED年市场份额己达数百亿美元, 这个新兴的市场已经开始规模化。
24
以发光机理划分,发光材料又可分为荧光材料和磷光材料。目前用于OLED的磷 光材料主要包括过渡金属配合物,如铱(Irlll)、铂(Ptll)、钌(RuⅡ)配合物等 。但这些过渡金属都属于价格昂贵的贵金属,制约着OLED的商业化。
39
同时又合成了一种新型三元1, 10- 菲咯啉- 苏氨酸- 铜(Ⅱ) 配合物,该配合物对HL-60 和 SGC-7901 肿瘤细胞都显示出明 显的体外细胞毒活性,且在多 数的实验浓度范围内其抗肿瘤 活性强于顺铂。
40
铜元素是普遍存在于动植物中的,生命必需的微量元素之一,在生 命过程中起着重要作用。许多金属酶和金属蛋白的活性部位均含有双 核铜(Ⅱ)结构单元,铜化合物具有多变的配位结构和活化小分子的催 化特性,常被用作双取代过氧化物分解的催化剂。此外,铜的配位环 境易于调变,其结构的易变性合成了多种单核或多核的铜配合物。
34
铜锌超氧化歧化酶(SOD)的活性 中心是一个咪唑桥基连接一个 Cu(II)离子和一个Zn(II)离子, Cu(II)离子与四个组氨酸残基和 一个水分子结合,Zn(II)离子与 一个天冬氨酸和三个组氨酸残基 结合,SOD能够保护细胞免受过 氧化物的伤害。
35
•科学家合成出如图的化合物模拟SOD,配体是一个 带有羟乙基的单一冠醚,配体具有了一定的刚性和 韧性可适应Cu(II)和Zn(II)离子的不同需求,由于 羟乙基存在可以模拟天然SOD酶中H20分子的作用, 络合物的ESR光谱显示三角椎型单核Cu(II)络合物特 征峰,能够歧化超氧化合物,具有较高的SOD催化活 性。
金属配合物在中药中的应用 ppt课件

配体L1, L2, L3以及 由其合成的15种配合 物的抑菌率
1.配体L1对大肠杆菌、蜡状芽孢杆菌、枯
草芽孢杆菌的抑菌活性较差,但是L1 的配 合物1和2对于这三种菌均有较好的抑菌效
L1
果;
2.配体L2对藤黄八叠球菌、枯草芽孢杆菌
有较差的抗菌作用,然而L2的配合物 4、5、
L2
6、8 对于这两种细菌都有很高的抑菌率,
ቤተ መጻሕፍቲ ባይዱ• “太阳当空照,花儿对我笑,小鸟说早早早……”
CONT目 E录 NTS
1 酸碱Lewis理论 2 中药配位化学简介 3 金属配合物在中药中的应用 4 参考文献
酸碱Lewis理论
➢ Lewis酸(Lewis acid):指能作为电子对接受体的原子,
分子或离子;
➢ Lewis碱(Lewis base):指能作为电子对给予体的原子,
参考文献
[1]李玉贤. 配位化学在中药研究中的应用进展[A]. 中国药学会中药与天然药物专业委员会.第十届 全国中药和天然药物学术研讨会论文集[C].中国药学会中药与天然药物专业委员会:,2009:3. [2]谭明雄,陈振锋,罗旭健,朱林,梁宏. 天然药物有效成分的金属配合物研究进展[J]. 林产化学与 工业,2008,28(06):93-99. [3]何军,梁国刚. 配位化学在中药研究中的应用[J]. 中国实验方剂学杂志,2008,14(12):77-80. [4]周发阳,徐翊雯,孙宇,梁海珍,冀娇娇,董洁,赵爽,王贝贝,刘永刚. 中药配位化学研究进展[J]. 中国现代中药,2015,17(05):502-508. [5]刘亚杰. 川芎嗪衍生物的合成及其抗菌活性的研究[D].广东药科大学,2016. [6]郭明,伍周玲,王春歌,高小艳. 黄芩苷-金属配合物的合成及其抗肿瘤活性研究[J]. 药学学 报,2014,49(03):337-345. [7]M. Prddotohl, U.S. Schubert, W. Weigand, M. Gottschaldt, Metal complexes of curcumin and curcumin derivatives for molecular imaging and anticancer therapy, Coordination Chemistry Reviews (2015),
《配位键和配合物》课件

05
配合物的发展前景
配合物在理论研究中的发展
配合物的合成与结构研究
随着实验技术和理论计算方法的不断进步,人们对于配合物的合成和结构的研究越来越深入,能够更加精准地预 测和设计配合物的结构和性质。
配合物的反应机理研究
对于配合物的反应机理研究有助于深入理解反应过程,为新材料的合成和应用提供理论支持。
配合物的定义
配合物是由金属离子或原子与一定数目的配位体通过 配位键结合形成的复杂化合物。
配位键
配位键是一种特殊的共价键,由配位体中的孤对电子 与中心原子空轨道形成。
配位数
中心原子与配位体之间形成的配位键数目称为配位数 。
配合物的物理性质
颜色
01
配合物通常具有特殊的颜色,这是由于配位体和中心原子的电
配合物在工业生产中的应用
01
02
03
石油工业
在石油工业中,配合物被 广泛应用于提高石油采收 率和油品质量。
化学工业
在化学工业中,配合物可 以作为催化剂、稳定剂、 萃取剂等,提高生产效率 和产品质量。
制药工业
在制药工业中,配合物可 以作为药物载体、药物稳 定剂等,提高药物的疗效 和稳定性。
配合物在生物医学领域的应用
03
现代合成方法通常需要使用特殊的设备和条件,但可
以大大提高配合物的合成效率和纯度。
绿色合成方法
01
绿色合成方法是基于环保和可 持续发展的理念发展起来的, 旨在减少或消除化学合成对环 境的负面影响。
02
这些方法包括使用绿色溶剂、 催化剂和试剂,以及优化反应 条件等。
03
绿色合成方法不仅可以减少环 境污染,还可以降低能源消耗 和提高经济效益。
配合物在应用领域的发展
化学课件《配合物》优秀ppt 人教课标版

四、配合物的组成 配合物通常由被称为内界和外界的两部分组成 内界具有稳定的复杂结构单元,表示在方括号内.
在配离子内,金属离子处于 中心位置,通常称为中心离子 或配离子的形成体. 配合物在形成过程中,中心离子与 配位体之间的结合不符合经典的共价 键理论,而是一种特殊的共价键— 配位键
四、配合物的组成 1.中心离子(M)
② 先阴离子配体,后阳离子和中性配体;
K[PtCl3NH3] 三氯· 氨合铂(Ⅱ)酸钾 配体数目(一、二、三等) →配体名称→合→中心 离子名称(氧化态Ⅰ、Ⅱ、Ⅲ等)
【例1】 写出下列配合物的名称
① ② ③ ④ ⑤ ⑥ ⑦
[Fe(CN)6]4K4[Fe(CN)6] [Cu(NH3)4]SO4 Na3[Ag(S2O3)2]
三、配合物的形成条件
中心原(离)子必须存在空轨道,配位体存在孤对电子。
中心原(离)子用能量相近的空轨道杂化,与配位体形成配 离子。过渡金属元素特别是过渡金属元素的离子都有接受 孤对电子的空轨道,一般都能与可提供孤对电子的分子或 离子以配位键结合形成的配合物。 常见的有Fe、Co、Ni、Cu、Zn、Ag、Au、Pt等金属元素的 离子(或原子)与X—(卤素)、OH—、H2O、NH3、CN—、 SCN—等分子或离子形成配合物。
六氰合铁(Ⅱ)配离子
六氰合铁(Ⅱ)酸钾
硫酸四氨合铜(Ⅱ) 二硫代硫酸根合银(I)酸钠 硫酸三乙二胺合钴(Ⅲ) 三羟水乙二胺合铬(Ⅲ) 四羰基合镍
[Co(en)3]2(SO4)3
[Cr(OH)3H2O(en)]
Ni(CO)4
轨道杂化类型与配位个体的几何构型 配位数 杂化类型 几何构型 实例 [Ag(NH3)2]+ 2 sp 直线形 3 sp2 sp3 dsp2 dsp3 等边三角形
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C.BeCl2与BF3
D.C2H2与C2H4
2. 下列分子或离子中都存在着配位键的是 ( ) B A.NH3、H2O C.N2、HClO B.NH4
+
、 H 3O +
D. [Cu(NH3) 4]2+ 、PCl3
3. 对SO2与CO2说法正确的是( A.都是直线形结构
D
)
B.中心原子都采取sp杂化轨道 C. S原子和C原子上都没有孤电子对
配合物的应用
Байду номын сангаас
活动与探究(P72) :
• [实验1]
• [实验2] • [实验3]
配合物的应用
• 检验金属离子 • 分离物质 • 定量测定物质的组成 • 应用于染色、电镀、硬水软化、金属冶炼等领域
阅读P73~74
• 配合物在生命体中的作用 • 药物中的配合物 • 配合物与生物固氮
练习:
1. ( 下列分子中的中心原子杂化轨道的类型相同的是 B ) A.CO2与SO2 B.CH4与NH3
三角锥形
.. ..
.. ..
平面三角形
..
..
(3)CS2 :
SP
SP3
直线形
V形
..
..
D. SO2为V形结构, CO2为直线形结构
4. 下列各种说法中错误的是( D )
A. 形成配位键的条件是一方有空轨道一方有孤电子对。
B. 配位键是一种特殊的共价键。 C. 配合物中的配体可以是分子也可以是阴离子。 D. 共价键的形成条件是成键里粒子必须有未成对电子。
5. 写出下列分子的路易斯结构式(是用短线表示成键 电子对,小黑点表示未成键的价电子的结构式)并指出 中心原子可能采用的杂化轨道类型,并预测分子的几 何构型。 (1)PCI3 (2)BCl3 (3)CS2 解析: .. .. .. (1) PCI3: CI SP3 . . P CI .. CI .. .. CI (2)BCl3 : . . B . . SP2 CI Cl .. .. .. .. .. S . . =C =S .. .. .. .. (4) C12O: Cl .. O . . CI .. .. (4) C12O
