乙酸乙酯制备现象
热点实验探究十乙酸乙酯的制备

第九章
重要的有机化合物
BC 。 (2)上述实验中饱和Na2CO3溶液的作用是________ A.中和乙酸和乙醇 B.中和乙酸并吸收部分乙醇 C.减小乙酸乙酯的溶解度,有利于其分层析出 D.加速乙酸乙酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因之一是温度过高会
发生副反应,另一个原因是 反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物 ______________________________________________________
第九章
重要的有机化合物
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在大试管A中配制反应混合液;②按图甲所示连接好装置
(装置气密性良好),用小火均匀加热大试管5~10 min;③待试 管B收集到一定量产物后停止加热 ,撤去导管并用力振荡 ,然后
静置待分层;④分离出乙酸乙酯层,洗涤、干燥。
已知乙醇可以和氯化钙反应,生成微溶于水的 CaCl2· 6C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。
会降低原料的利用率。
第九章
重要的有机化合物
(5)用CaCl2除去少量的乙醇,用无水硫酸钠除去少量的水。不
能选择P2O5、碱石灰和NaOH等干燥剂,以防乙酸乙酯在酸性
(P2O5遇水生成酸)或碱性条件下发生水解。(6)比较两套装置
的不同之处:图乙装置有温度计、分液漏斗、冷凝管,答题时 抓住这三个方面即可。d项不正确,因为容纳液体的量多在本 题中并不能体现出其优点。
(4)①从表中可以看出,同一反应时间60 ℃时的转化率远大于
40 ℃而接近80 ℃,所以60 ℃时最合适,而以同一反应温度下
的不同时间来看,4小时转化率已较高,接近6小时的转化率,故
实验8 反应精馏法制备乙酸乙酯

实验八反应精馏法制备乙酸乙酯一、实验目的1.了解反应精馏是既服从质量作用定律又服从相平衡规律的复杂过程,是反应和分离过程的复合,了解反应精馏技术比常规反应技术在成本和操作上的优越性。
2.了解玻璃精馏塔的构造和原理,掌握反应精馏操作的原理和步骤,学习反应精馏玻璃塔的使用和操作。
3.学习用反应工程原理和精馏塔原理,对精馏过程做全塔物料衡算和塔操作的过程分析。
4.根据化学平衡原理和反应精馏原理,学习体验反应精馏配方、反应条件、精馏条件的制定及其相互影响。
5.了解与常规精馏的区别,掌握反应精馏法所适宜的物系。
6.应用气相色谱分析进行定量和定性分析,学会求取液相分析物校正因子及计算含量的方法和步骤。
二、实验原理1. 反应精馏原理反应精馏是随着精馏技术的不断发展与完善而发展起来的一种新型分离技术。
通过对精馏塔进行特殊改造或设计后,采用不同类型的催化剂,可以使某些反应在精馏塔中进行,并同时进行产物和原料的精馏分离,是精馏技术中的一个特殊领域。
在反应精馏操作过程中,由于化学反应与分离同时进行,产物通常被分离到塔顶,从而使反应平衡被不断破坏,造成反应平衡中的原料浓度相对增加,使平衡向右移动,故能显著提高反应原料的总体转化率,降低能耗。
同时,由于产物与原料在反应中不断被精馏塔分离,能得到较纯的产品,减少了后续分离和提纯工序的操作和能耗。
此法在酯化、醚化、酯交换、水解等化工生产中得到应用,而且越来越显示其优越性。
反应精馏过程不同于一般精馏,它既有精馏的物理相变之传递现象,又有物质变性的化学反应现象。
两者同时存在,相互影响,过程更加复杂。
在普通的反应合成、酯化、醚化、酯交换、水解等过程中,反应通常在反应釜内进行,而且随着反应的不断进行,反应原料的浓度不断降低,产物的浓度不断升高,反应速度回会越来越慢。
同时,反应多数是放热反应,为了控制反应温度,也需要不断地用水进行冷却,造成水的消耗。
反应后的产物一般需要进行两次精馏,先把原料和产物分开,然后再次精馏提纯产品。
天津大学 实验一 反应精馏法制乙酸乙酯

实验一反应精馏法制乙酸乙酯一、实验目的1.了解反应精馏是既服从质量作用定律又服从相平衡规律的复杂过程。
2.掌握反应精馏的操作。
3.能进行全塔物料衡算和塔操作的过程分析。
4.了解反应精馏与常规精馏的区别。
5.学会分析塔内物料组成。
二、实验原理1.实验仪器和药品:气相色谱仪GC−910及计算机数据采集和处理系统:载气1柱前压:0.05MPa桥电流:100mA 讯号衰减:32柱箱温度:125℃气化室温度:100℃检测器温度:125℃进样量:0.2μL无水乙醇( 分析纯) ,含量99. 0% ( 质量分数,下同) ; 冰乙酸( 分析纯) ,含量99. 0%; 浓硫酸( 化学纯) ,含量> 98. 0%2.反应精馏原理:反应精馏过程不同于一般精馏,它既有精馏的物理相变之传递现象,又有物质变性的化学反应现象。
反应精馏对下列两种情况特别适用:(1)可逆平衡反应。
一般情况下,反应受平衡影响,转化率只能维护在平衡转化的水平;但是,若生成物中有低沸点或高沸点物质存在,则精馏过程可使其连续地从系统中排出,结果超过平衡转化率,大大提高了效率。
(2)异构体混合物分离。
通常因它们的沸点接近,靠一般精馏方法不易分离提纯,若异构体中某组分能发生化学反应并能生成沸点不同的物质,这时可在过程中得以分离。
反应精馏存在以下优点:1.破坏了可逆反应平衡,增加了反应的选择性和转化率,使反应速度提高,从而提高了生产能力2.精馏过程可以利用反应热,节省了能量3.反应器和精馏塔合成一个设备,节省投资4.对某些难分离的物系,可以获得较纯的产品3.主要物质物性:4.汽液色谱法原理:采用气液色谱测定无限稀释溶液活度系数,样品用量少,测定速度快,仅将一般色谱仪稍加改装,即可使用。
目前,这一方法已从只能测定易挥发溶质在难挥发溶剂中的无限稀释活度系数,扩展到可以测定在挥发性溶剂中的无限稀释活度系数。
因此,该法在溶液热力学性质研究、气液平衡数据的推算、萃取精馏溶剂评选和气体溶解度测定等方面的应用,日益显示其重要作用。
乙酸乙酯的制备实验报告

乙酸乙酯的制备实验报告乙酸乙酯的制备实验报告报告使用范围很广。
按照上级部署或工作计划,每完成一项任务,一般都要向上级写报告,反映工作中的基本情况、工作中取得的经验教训、存在的问题以及今后工作设想。
下面是为大家带来的乙酸乙酯的制备实验报告,希望能帮助到大家!乙酸乙酯的制备实验报告乙酸乙酯的合成一、实验目的和要求1、通过乙酸乙酯的制备,加深对酯化反应的理解;2、了解提高可逆反应转化率的实验方法;3、熟练蒸馏、回流、干燥、气相色谱、液态样品折光率测定等技术。
二、实验内容和原理本实验用乙酸与乙醇在少量浓硫酸催化下反应生成乙酸乙酯:副反应:由于酯化反应为可逆反应,达到平衡时只有2/3的物料转变为酯。
为了提高酯的产率,通常都让某一原料过量,或采用不断将反应产物酯或水蒸出等措施,使平衡不断向右移动。
因为乙醇便宜、易得,本实验中乙醇过量。
但在工业生产中一般使乙酸过量,以便使乙醇转化完全,避免由于乙醇和水及乙酸乙酯形成二元或三元共沸物给分离带来困难,而乙酸通过洗涤、分液很容易除去。
由于反应中有水生成,而水和过量的乙醇均可与乙酸乙酯形成共沸物,如表一表示。
这些共沸物的沸点都很低,不超过72℃,较乙醇的沸点和乙酸的沸点都低,因此很容易被蒸馏出来。
蒸出的粗馏液可用洗涤、分液除去溶于其中的乙酸、乙醇等,然后用干燥剂去除共沸物中的水分,再进行精馏便可以得到纯的乙酸乙酯产品。
表一、乙酸乙酯共沸物的组成与沸点三、主要物料及产物的物理常数表二、主要物料及产物的物理常数四、主要仪器设备仪器100mL三口烧瓶;滴液漏斗;蒸馏弯头;温度计;直形冷凝管;250mL分液漏斗;50mL锥形瓶3个;25mL梨形烧瓶;蒸馏头;阿贝(Abbe)折光仪;气相色谱仪。
试剂冰醋酸;无水乙醇;浓硫酸;Na2CO3饱和溶液;CaCl2饱和溶液;NaCl饱和溶液。
五、实验步骤及现象表三、实验步骤及现象实验装置图:六、实验结果与分析由粗产品洗涤、蒸馏后得三瓶分馏产物,均为无色果香味液体,其质量如下:1.前馏分(温度稳定以前):43.38g-35.15g(1号锥形瓶质量)=8.13g;2.中馏分(温度稳定在76℃时):39.72g-32.67g(2号锥形瓶质量)=7.05g;3.后馏分(温度迅速下降后):34.28g-31.25g(3号锥形瓶质量)=3.08g。
试验室制取乙酸乙酯

实验室制取乙酸乙酯反应原理:一、乙酸乙酯是由一分
子乙醇和一分子乙酸在浓硫酸作催化剂作用下加热反应知
得的。
1、反应方程式:O O
浓硫酸O
-C-O-CHCHCHC-O-H +H-O-CHCH+ HCH223 3323
、断键原理:乙酸分子中羧基中的羟基与乙醇分子中羟基中
的2 氢原子结合生成水。
O
O
浓硫酸CH-C-O-CHCH+ HO
O-CHCCH-O-H +H-CH23 32233
口诀:酸脱羟基醇脱氢同位素示踪法3、检验断键原理的
方法:18OHO,方法:将乙醇分子中的氧标记为检验其生成的
产物,生成物21816,而乙酸乙酯中有OO。
中全部为O O
浓硫酸1818O
CH+ HCHO-CH-O-H +H-CCH-C-CHO-CH2323 233
实验装置图:二、.
玻璃导管防倒吸装置浓硫乙 1、加入试剂的顺序:乙醇
原因:浓硫酸密度比乙醇的大,如果先加浓硫酸,密度小的乙酸会在浓硫酸上层,浓硫酸放热会使乙醇沸腾而溅出。
2、防倒吸装置的使用:避免反应过程中因试管中乙醇挥发压强减小而发生倒吸现象。
三、实验现象:
1、试管中有气泡产生(乙酸蒸气经过导管进入试管与NaCO反应生成CO气体)232
2、有香味溢出(酯的一般特性)
四、各试剂及装置的作用:
1、浓硫酸的作用:催化剂、吸水剂
2、饱和NaCO的作用:中合乙酸,溶解乙醇,便于闻酯的气味;32降低乙酸乙酯在水中的溶解度。
3、玻璃导管的作用:冷凝回流、导气。
五、小结:本节课的重点是掌握其反应原理和实验现象,学会使用防倒吸装置,弄清断键原理及和浓硫酸NaCO 的使用作用。
32.。
2019年高考化学考点一遍过考点53 乙酸乙酯的制备 含解析
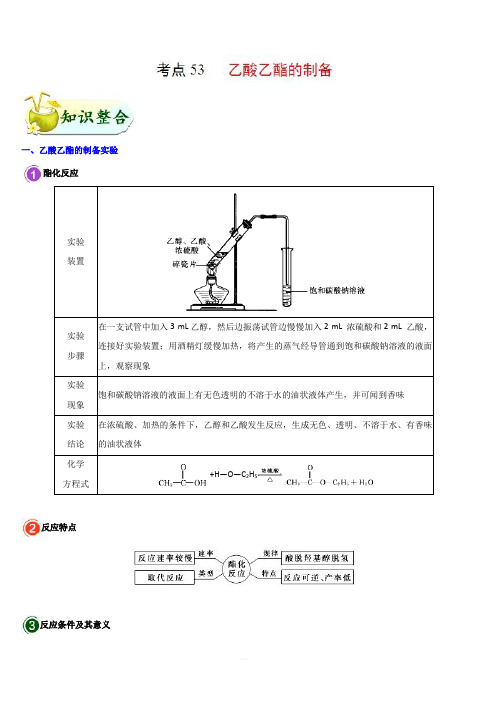
一、乙酸乙酯的制备实验酯化反应+H —O —C 2H 5反应特点反应条件及其意义(1)加热,主要目的是提高反应速率,其次是使生成的乙酸乙酯挥发而方便收集,使平衡向正反应方向移动,提高乙醇、乙酸的转化率。
(2)浓硫酸一方面作催化剂,提高反应速率;另一方面作吸水剂,提高乙醇、乙酸的转化率。
(3)饱和Na2CO3溶液的作用①挥发出的乙酸与Na2CO3反应生成易溶于水的盐,乙醇易溶于Na2CO3溶液,有利于乙酸乙酯与乙酸、乙醇的分离。
②乙酸乙酯在饱和Na2CO3溶液中的溶解度较小,与饱和Na2CO3溶液混合时易分层,可用分液法分离。
注意事项(1)浓硫酸溶于乙醇或乙酸时会放出大量的热,因此,将乙醇、乙酸、浓硫酸混合时,一般先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸。
(2)浓硫酸的作用:催化剂、吸水剂。
(3)为防止试管中液体在实验时暴沸,加热前应采取的措施:在试管中加入几块碎瓷片或沸石。
(4)玻璃导管的末端不要插入饱和Na2CO3溶液中,以防液体倒吸。
(5)开始时要用小火均匀加热,加快反应速率,减少乙醇和乙酸的挥发;待有大量产物生成时,可大火加热,以便将产物蒸出。
(6)装置中的长导管起导气兼冷凝作用。
(7)欲提高乙酸的转化率,可采取的措施:①用浓H2SO4吸水,使平衡向正反应方向移动;②加热将酯蒸出;③可适当增加乙醇的量,并加装冷凝回流装置。
二、如何辨析羧基和酯基羧基和酯基两种官能团结构相似,但性质不同。
羧基和酯基对比官能团代表物质表示方法羧基乙酸—COOH或酯基乙酸乙酯—COOR或(R不能为氢原子)羧基(1)羧基的结构羧基的结构可用下图表示,其中含有四个共价键,即羧基碳原子与其他原子(如碳原子或氢原子)形成的共价键(①号位置),碳氧双键(②号位置),碳氧共价键(③号位置),氢氧共价键(④号位置)。
(2)羧酸的酸性①电离方程式:RCOOH RCOO− + H+。
由此可见,羧酸分子中表现酸性的是羧基(—COOH),即羧基中的氢电离产生氢离子。
反应精馏制乙酸乙酯
反应精馏制⼄酸⼄酯实验⼀反应精馏法制⼄酸⼄酯⼀、实验⽬的1.了解反应精馏是既服从质量作⽤定律⼜服从相平衡规律的复杂过程。
2.掌握反应精馏的操作。
3.能进⾏全塔物料衡算和塔操作的过程分析。
4.了解反应精馏与常规精馏的区别。
5.学会分析塔内物料组成。
⼆、实验原理反应精馏过程不同于⼀般精馏,它既有精馏的物理相变之传递现象,⼜有物质变性的化学反应现象。
反应精馏对下列两种情况特别适⽤:(1)可逆平衡反应。
⼀般情况下,反应受平衡影响,转化率只能维护在平衡转化的⽔平;但是,若⽣成物中有低沸点或⾼沸点物质存在,则精馏过程可使其连续地从系统中排出,结果超过平衡转化率,⼤⼤提⾼了效率。
(2)异构体混合物分离。
通常因它们的沸点接近,靠⼀般精馏⽅法不易分离提纯,若异构体中某组分能发⽣化学反应并能⽣成沸点不同的物质,这时可在过程中得以分离。
对于本实验来说,适于第⼀种情况,但但该反应若⽆催化剂存在,单独采⽤反应精馏存在也达不到⾼效分离的⽬的,这是因为反应速度⾮常缓慢,故⼀般都⽤催化反应⽅式。
酸是有效的催化剂,常⽤硫酸。
本实验是以⼄酸和⼄醇为原料,在催化剂作⽤下⽣成⼄酸⼄酯的可逆反应。
反应的⽅程式为:CH3COOH + C2H5OH ? CH3COOC2H5+H2O实验的进料有两种⽅式:⼀是直接从塔釜进料;另⼀种是在塔的某处进料。
前者有间歇和连续式操作;后者只有连续式。
可认为反应精馏的分离塔也是反应器。
若采⽤塔釜进料的间歇式操作,反应只在塔釜内进⾏。
由于⼄酸在⽓相中有缔合作⽤,除⼄酸外,其它三个组分形成三元或⼆元共沸物。
⽔-酯,⽔-醇共沸物沸点较低,醇和酯能不断地从塔顶排出。
由于⼄酸的沸点较⾼,不能进⼊到塔体,故塔体内共有3组分,即⽔、⼄醇、⼄酸⼄酯。
本实验采⽤间歇式进料⽅式,物料衡算式和热量衡算式为:(1)物料衡算⽅程对第j块理论板上的i组分进⾏物料衡算如下(2)⽓液平衡⽅程对平衡级上某组分i的有如下平衡关系:每块板上组成的总和应符合下式:(3)反应速率⽅程(4)热量衡算⽅程对平衡级进⾏热量衡算,最终得到下式:三、实验装置及实验流程⽰意图实验装置如图2所⽰。
乙酸乙酯的制备实验报告
用饱和NaCI溶液洗涤?是否能用水代替?
答:用饱和CaCI:溶液洗涤是为了除去乙酸乙酯 中溶入的少量乙醇。用饱和NaCI溶液洗涤是为了除 去过量的Na:CO,,否则在下一步用饱和CaCl2溶液洗
涤时会产生絮状的CaCO,沉淀。 不能用水代替。因为乙酸乙酯在水中有一定的 溶解度,加入NaCI可以减小乙酸乙酯的溶解度,也就
g
无水硫酸镁干燥30 rain,粗底物无色澄清透亮,MgS04 沉于锥形瓶底部,将底物滤入50 mL圆底烧瓶,加入 沸石,安装好蒸馏装置,水浴加热,收集73~78℃馏 分,液体沸腾,70℃有液体馏出,此时体积很少,液体
稍显浑浊,73℃开始换锥形瓶收集。长时间稳定于
74~76℃,升至78℃后下降。
这些共沸物的沸点都很低,不超过72℃,较乙
引用本文格式:周楚薇 乙酸乙酯的制备实验报告[期刊论文]-实验教学与仪器 2015(11)
g。
g一31.25 g
生成,使产量降低。 2.该实验中多次用到“洗涤”操作,请问碳酸钠
饱和溶液、饱和食盐水、饱和氯化钙溶液分别除去的 是原蒸馏液中的什么成分? 答:用碳酸钠饱和溶液除去醋酸、亚硫酸等酸性 杂质后,碳酸钠必须洗去,否则下一步用饱和氯化钙 溶液洗去乙醇时,会产生絮状的碳酸钙沉淀,从而造 成分离的困难。为减少酯在水中的溶解度(每17份 水溶解1份乙酸乙酯)。可以用饱和食盐水洗碳酸钠。 (指导教师:湖南省长沙市长郡中学荣耀) 点评:合成乙酸乙酯有多种方法,最传统的就是 以浓硫酸为催化剂.用乙醇和乙酸通过酯化反应合 成。然而,该方法中所用的浓硫酸对设备腐蚀严重,
同学通过乙酸乙酯的制备实验报告,让大家了解羧酸 与醇合成酯的一般原理和方法.以及进一步掌握蒸
馏、用分液漏斗萃取液体、干燥等基本操作。 (点评教师:湖南省长沙市长郡中学荣耀)
有机化学实验报告
有机化学实验报告有机化学试验报告1试验名称:乙酸乙酯的制备一、试验目的:1、了解酯化反应原理和酯的制备方法。
2、学习回流、蒸馏、洗涤和过滤等有机合成操作技术。
二、仪器直形冷凝管、5ml、10ml圆底烧瓶、微型蒸馒头、蒸馏头、分液漏斗、玻璃漏洞、长滴管、离心管、10ml锥形瓶、5ml量筒2个、沸石、无水乙醇、玻塞、玻璃钉、温度计(包括玻璃套管、胶管)、台秤、药匙三、药品无水乙醇、冰醋酸、浓硫酸、无水硫酸钠、饱和碳酸钠溶液、饱和氯化钠溶液、饱和氯化钙溶液等。
四、试验原理醇和羧酸在少量酸性催化剂(如浓硫酸)的存在下,发生酯化反应生成有机酸酯。
增加酸或醇的浓度,或出去生成的水,都可以增加酯的产量。
五、试验步骤及数据记录试验步骤1、合成。
试验现象现象分析将 4.0ml无水乙醇(68.6mmol)和3.0ml冰醋酸(51.4mmol)加入到10ml原地烧瓶中,再当心加入3滴浓硫酸(每加完一种试剂最好用玻璃塞塞住瓶口,以免挥发)。
混合匀称后加入一粒沸石,装上直形冷凝管,在石棉网上小火加热,回流20min。
装置如图。
稍冷却后,补加一颗沸石,装上微型蒸馒头用水浴加热蒸馏。
在整流过程中,不断用长滴管将微型蒸馒头承接阱内的溜液吸至分液漏斗内。
蒸馏至承接阱内无溜液。
2、精制①。
将2ml的饱和碳酸钠溶液渐渐加入分液漏斗内,盖上玻塞,轻轻振摇几次,然后旋转活塞放气,静置,分层后弃去下层液体。
再将2ml饱和氯化钙溶液加至分液漏斗中,振摇分层,弃去下层液体。
将小半药匙无水硫酸钠固体加入10ml的锥形瓶内,再将分液漏斗内留下的乙酸乙酯经分液漏斗上口倒入锥形瓶,盖上玻塞轻摇5min。
3、精制②。
取玻璃漏斗,用玻璃钉填塞漏斗颈部,漏斗下面用一个干燥的5ml圆底烧瓶作接液瓶。
将锥形瓶内的`酯倒至漏斗内,让液体渐渐流入烧瓶内。
加入一粒沸石,按图装好蒸馏装置(用已称重的离心管做接收器),水浴上加热蒸馏,收集73℃-78℃的馏分,称重,计算产率。
实验二反应精馏法制乙酸乙酯实验讲义(学生版)
实验二反应精馏法制乙酸乙酯实验讲义(学生版)反应精馏法制乙酸乙酯一、实验目的1.了解反应精馏是既服从质量作用定律又服从相平衡规律的复杂过程。
2.掌握反应精馏的操作。
3.能进行全塔物料衡算和塔操作的过程分析。
4.了解反应精馏与常规精馏的区别。
5.学会分析塔内物料组成。
二、实验原理1.实验仪器和药品:气相色谱仪及计算机数据采集和处理系统:载气1柱前压:,氢气流量80ml/min桥电流:柱箱温度:气化室温度:检测器温度:进样量:无水乙醇(分析纯),含量99.0%(质量分数,下同);冰乙酸(分析纯),含量99.0%;浓硫酸(化学纯),含量>98.0%2.主要物质物性:性质物质分子式分子量g/mol熔点(共)沸点水溶性g/l闪点密度g/ml乙醇C2H6O46.07-114oC78.3oCMISCIBLE12oC0.789乙酸C2H4O260.0516-16.5oC117-118oCMISCIBLE40oC1.048乙酸乙酯C4H8O288.11-83.5oC77oC83(20oC)-4oC0.902水/乙醇/乙酸乙酯70.3(0.601酯)3.反应精馏原理:反应精馏过程不同于一般精馏,它既有精馏的物理相变之传递现象,又有物质变化的化学反应现象。
反应精馏对下列两种情况特别适用:(1)可逆平衡反应。
一般情况下,反应受平衡影响,转化率只能维持在平衡转化的水平;但是,若生成物中有低沸点或高沸点物质存在,则精馏过程可使其连续地从系统中排出,结果超过平衡转化率,大大提高了效率。
(2)异构体混合物分离。
通常因它们的沸点接近,靠一般精馏方法不易分离提纯,若异构体中某组分能发生化学反应并能生成沸点不同的物质,这时可在过程中得以分离。
反应精馏存在以下优点:1.破坏了可逆反应平衡,增加了反应的选择性和转化率,使反应速度提高,从而提高了生产能力2.精馏过程可以利用反应热,节省了能量3.反应器和精馏塔合成一个设备,节省投资4.对某些难分离的物系,可以获得较纯的产品4.实验过程原理本实验中硫酸是有效的催化剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙酸乙酯制备现象
乙酸乙酯,化学式为CH3COOCH2CH3,是一种常用的有机溶剂和香料。
其制备方法有多种,其中较为常见的是通过酯化反应制备。
酯化反应是指在催化剂存在下,酸和醇反应生成酯的过程。
乙酸乙酯的制备就是通过乙酸和乙醇进行酯化反应得到的。
具体操作步骤如下:
1. 在反应釜中加入适量催化剂(通常使用硫酸或盐酸),并加入适量的乙醇。
2. 搅拌均匀后,慢慢地加入适量的浓度为99%的冰乙酸(也可以使用浓度为98%或80%的冰乙酸)。
3. 反应开始后会产生大量热量,需要不断地搅拌,并且要控制温度不超过60℃。
4. 反应结束后,将产物分离出来,经过蒸馏、净化等步骤后即可得到纯净的乙酸乙酯。
在实验室中进行该反应时,可以观察到以下现象:
1. 反应开始后会产生大量热量,反应液体温度会升高。
2. 反应物中的乙醇和冰乙酸会发生化学反应,产生气体(通常为二氧
化碳),可以听到气泡声。
3. 反应结束后,反应液由于生成的乙酸乙酯密度较大,会沉淀在底部,上层为水和未反应的乙醇。
总之,通过以上步骤可以制备出高纯度的乙酸乙酯,并且该反应具有
简单、快速、效率高等优点。
