乙酸乙酯的制备(课堂PPT)
合集下载
乙酸乙酯PPT课件

水层 乙酸、乙醇、Na2CO3
有机层 乙酸乙酯、乙醇、乙醚、水、Na2CO3(微量)
饱和 NaCl 洗
水层 Na2CO3
有机层 乙酸乙酯、乙醇、乙醚
饱和 CaCl2 洗
分离提纯
水层 乙醇、CaCl2
有机层 乙酸乙酯、水(微量)、 乙醚
无水 Na2SO4 干燥除水
蒸馏 除乙醚 第26页/共40页 纯乙酸乙酯
H2SO4 C2H5OH
C2H5OC2H5 + H2O
C2H5OH H2SO4 CH2=CH2 +
第2页/共40页
反应机理
..
O
H+
C
H3C
OH
O+H .. HOC2H5
C
H3C
OH
HO
..
H3C C OH
H5C2O+_ H
..
+
O
_ H+
OH
_ H2O
C
H3C
OC2H5
C
H3C
OC2H5
质子转移
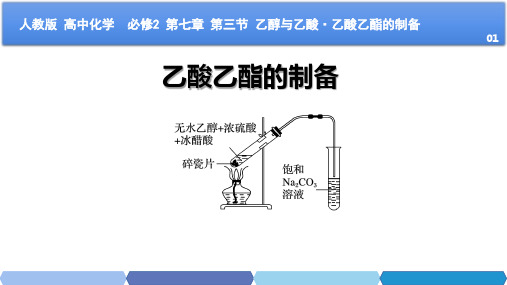
乙酸乙酯的制备
目的与要求:
掌握实验室制备羧酸酯的方法,加深对酯化 反应机理的理解。
掌握蒸馏、萃取操作,学会使用分液漏斗。 培养严谨求实的科学态度。 提高观察能力、主动思考能力。
第1页/共40页
乙酸乙酯的制备
+ 浓硫酸
CH3COOH C2H5OH
+ CH3COOC2H5
H2O
2 CH3CH2OH14浓0 ~H125S0O℃4 CH3CH2OCH2CH3 + H2O
实验步骤
•
在 50 mL的圆底烧瓶中加入 10 mL 的 95%乙醇和 6 mL的醋酸,再小心加入
乙酸乙酯的制备PPT课件
照片
第9页/共16页
实验步骤
第10页/共16页
实验结果
第11页/共16页
注意事项
1,控制反应温度在120—125℃,控制原料滴加速度。 2,洗涤时注意放气,有机层用饱和NaCl洗涤 后,尽量将水相分干净。 3,用CaCl2溶液洗之前,一定要先用饱和NaCl溶液洗,否则会产生沉淀,给分液带来困难。
第2页/共16页
实验目的
• 1,通过乙酸乙酯的制备,加深对酯化反应的理解。 • 2,熟悉酯的性质,掌握该实验的操作,特别是对实验中一些要点的理解和掌握。 • 3,了解乙酸乙酯的分离提纯的方法。
第3页/共16页
• 4,了解由醇和羧酸制备羧酸酯的原理和方法。 5,学习液体有机物的蒸馏、洗涤和干燥等基本操作。
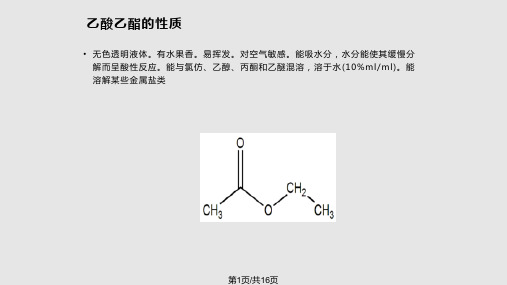
乙酸乙酯的性质
• 无色透明液体。有水果香。易挥发。对空气敏感。能吸水分,水分能使其缓慢分 解而呈酸性反应。能与氯仿、乙醇、丙酮和乙醚混溶,溶于水(10%ml/ml)。能 溶解某些金属盐类
第1页/共16页
• (如氯化锂、氯化钴、氯化锌、氯化铁等)。相对密度。熔点-83℃。沸点77℃。 折光率。闪点7.2℃(开杯)。易燃。蒸气能与空气形成爆炸性混合物。半数致 死量(大鼠,经口)。有刺激性。
第14页/共16页
第15页/共16页
感谢您的观看!
第16页/共16页
第6页/共16页
实验仪器和试剂
• 仪器: • 2L三口烧瓶,回流冷凝管,滴液漏 斗,干燥球,加热套,搅拌器,烧杯,滴管,
锥形瓶,玻璃棒,抽滤瓶,布氏漏斗,温度计,蒸馏头,量筒 • 试剂: • 叔丁醇钾,乙酸乙酯,稀盐酸,水,饱和食盐水,无水硫酸镁,ph试纸
第7页/共16页
实验装置
第8页/共16页
乙酸乙酯制取实验课件-高一下学期化学人教版(2019)必修第二册
①在甲试管(如图)中加入2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液。②按图连 接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5 min。③待试管 乙收集到一定量产物后停止加热,撤出试管乙,并用力振荡,然后静置待分层。④ 分离出乙酸乙酯层,洗涤、干燥。(1)配制该混合溶液的主要操作步骤为________; 反应中浓硫酸的作用是________。(2)试管甲中发生反应的化学方程式为________, 属于________反应类型。(3)上述实验中饱和碳酸钠溶液的作用是(填字母)________。
浓H2SO4
CH3COOCH2CH3+ H2O
CH3COOH + HOCH2CH3
CH3COOH+NaOH=CH3COONa+H2O
CH3COOCH2CH3+ NaOH
CH3COONa + HOCH2CH3
归纳乙酸的化学性质
官能团的结构决定物质的化学性质
1.乙酸是一元弱酸,表现酸性时断
键的位置是: c
一、课前回顾
2. 乙酸的化学性质
酸性
乙酸能使紫色石蕊溶液变 红
与Na反应: 2CH3COOH+2Na → 2CH3COONa +H2↑
与Na2O反应: 2CH3COOH+Na2O→2CH3COONa+H2O
与NaOH反应: CH3COOH+NaOH→ CH3COONa+H2O
与CaCO3反应: 2CH3COOH+CaCO3→ (CH3COO)2Ca+H2O+CO2↑
四、课堂小结
酯化反应中的“一原理”“两作用” 1.一原理 在酯化反应中,有机羧酸断C—O,醇分子断O—H,即“酸脱羟基醇脱氢”, 表示如下:
2.两作用
(1)浓硫酸的作用:
浓H2SO4
CH3COOCH2CH3+ H2O
CH3COOH + HOCH2CH3
CH3COOH+NaOH=CH3COONa+H2O
CH3COOCH2CH3+ NaOH
CH3COONa + HOCH2CH3
归纳乙酸的化学性质
官能团的结构决定物质的化学性质
1.乙酸是一元弱酸,表现酸性时断
键的位置是: c
一、课前回顾
2. 乙酸的化学性质
酸性
乙酸能使紫色石蕊溶液变 红
与Na反应: 2CH3COOH+2Na → 2CH3COONa +H2↑
与Na2O反应: 2CH3COOH+Na2O→2CH3COONa+H2O
与NaOH反应: CH3COOH+NaOH→ CH3COONa+H2O
与CaCO3反应: 2CH3COOH+CaCO3→ (CH3COO)2Ca+H2O+CO2↑
四、课堂小结
酯化反应中的“一原理”“两作用” 1.一原理 在酯化反应中,有机羧酸断C—O,醇分子断O—H,即“酸脱羟基醇脱氢”, 表示如下:
2.两作用
(1)浓硫酸的作用:
高中化学精品系列 实验:乙酸乙酯的制备 课件

温度计水银球的位Байду номын сангаас应与支管底口下缘位于同一水平线上
77.1
温度计为什么要插 入液面以下?
锥形瓶内含有哪些 物质?如何除杂?
粗产品的纯化
除去乙酸
1.在馏出液中加入饱和碳酸钠溶液,直到不产生气泡。
2.将混合液移入分液漏斗中,静置,分出水层。 除去乙醇 3.在分液漏斗中的酯先用等体积的饱和食盐水洗涤, 再用饱和氯化钙溶液洗涤。 除去碳酸钠 4.最后用无水硫酸镁干燥。 常用于干燥 有机试剂
思考:反应中,可能会发生怎样的副反应? 副反应: 写出方程式?
H2SO4 2CH3CH2OH CH3CH2OCH2CH3 + H2O o 140 C H2SO4 CH3CH2OH CH2 CH2 + H2O 170oC
温度应控制在110℃~125℃之间
制取乙酸乙酯的装置
CH3COOH + C2H5OH
本节目标
1.通过制备乙酸乙酯,加深对酯化反应的认识
2.掌握蒸馏、洗涤和干燥液态有机物的基本操作 3.了解制备有机物的方法和注意事项
酯化反应
乙酸与乙醇在浓硫酸做催化剂和加热条件下,发生的酯化反应
浓 H SO 2 4 CH COOC H + H O CH3COOH + C2H5OH 3 2 5 2 120℃
回顾:1.反应液混合的顺序? 浓H2SO4
先加乙醇,再加浓硫酸,混合后最后加冰醋酸 120℃ 酯化反应是一个可逆反应。根据化学平衡原理, 2.浓硫酸的作用? 思考哪些措施可以提高产率? 催化剂和吸水剂 1.浓硫酸的吸水性 3.指出图中错误的一处? 导管为什么 混合液 不深入液面 2.加入过量的廉价乙醇 4.饱和碳酸钠溶液的作用? 3.蒸出乙酸乙酯 吸收乙醇和乙酸 5.应加入沸石,为什么? 减小酯在水中的溶解度 饱和Na NaOH CO 溶液 溶液
乙酸乙酯的制备ppt

能否用氢氧化Байду номын сангаас代替?
六、实验步骤
1. 在干燥的100 mL三颈烧瓶中加入3 mL 的冰醋 酸,在冷水冷却下,边摇边慢慢加入3 mL浓硫 酸,加入几粒沸石;在滴液漏斗中加入15.5 mL 的乙醇和14.3 mL冰醋酸,摇匀。按装置图1组 装仪器。滴液漏斗的末端和温度计的水银球必 须浸到液面以下,但不要接触瓶底。
2. 由于酯化反应是可逆反应,为提高酯的产 率,采用增加冰醋酸的用量及不断将产物 酯和水蒸出的措施,使平衡右移。
本实验可能有哪些副反应?主要副反应是哪个?
?
副反应:
浓H2SO4 2CH3CH2OH 140℃
C2H5OC2H5 + H2O
浓H2SO4 CH3CH2OH 170℃
CH2
CH2 + H2O
2. 滴加速度不能太快,否则温度很快下降,会使 醇和酸来不及反应而被蒸出,影响酯的收率。
3. 碳酸钠用饱和食盐水洗而不用水洗,因为酯在 食盐水中的溶解度比水中小
八、思考题
1. 酯化反应有什么特点?本实验如何使反应向 生成酯的方向进行?
2. 浓H2SO4有什么作用?在反应过程中浓H2SO4 是否有消耗?
粗产品中主要有哪些杂质?如何除去?
三、主要试剂与相关物性参数
四、实验装置
刺形分馏柱 滴液漏斗
三颈烧瓶
电热套
直形冷凝管
升降台
四、实验装置
五、实验流程
滴加回流 约90min
蒸馏 10min
乙 蒸馏
酸
乙 酯
74-80 ℃
干燥 无水硫酸镁
1 ~2g
洗涤、 分液
①饱和碳酸钠水溶液②饱 和食盐水
测折光率
《乙酸乙酯制备》课件

反应物:乙醇、乙酸、浓硫酸
反应条件:加热、催化剂
反应方程式:CH3CH2OH+H2H2+CH3COOH=CH3COOC2H5+H2O
注意事项:控制温度、避免副反应发生
反应机理及影响因素
反应机理:乙酸与乙醇在酸性催化剂作用下发生酯化反应生成乙酸乙酯和水
影响因素:温度、压力、催化剂种类和浓度、原料配比等
拓展:其他酯类的制备方法与比较
其他酯类的制备方法介绍
实际应用中如何选择合适的酯类制备方法
酯类制备方法的优缺点分析
不同酯类制备方法的比较
实际应用:乙酸乙酯在化工、医药等领域的应用前景
化工领域:乙酸乙酯在化工领域中具有广泛的应用,如作为溶剂、涂料、油漆等。随着环保要求的提高,乙酸乙酯作为环保型溶剂的应用前景更加广阔。
实验材料与设备
实验材料:乙醇、乙酸、浓硫酸、饱和碳酸钠溶液
浓硫酸:作为催化剂,促进酯化反应的进行
饱和碳酸钠溶液:用于中和反应剩余的酸和硫酸,同时除去反应生成的乙酸乙酯中的酸性物质
乙醇:作为反应物,提供醇基
乙酸:作为反应物,提供羧基
实验设备:用于混合和加热反应物
乙酸乙酯制备实验原理和流程
单击此处输入你的正文,请阐述观点
实验操作注意事项和安全措施
单击此处输入你的正文,请阐述观点
实验结果分析和讨论
单击此处输入你的正文,请阐述观点
实验误差分析和改进措施 PPT致谢:感谢参与和支持
PPT致谢:感谢参与和支持
感谢老师和同学们的参与和支持
单击此处输入你的正文,请阐述观点
单击此处添加文本具体内容,简明扼要地阐述您的观点。根据需要可酌情增减文字,以便观者准确地理解您传达的思想
医药领域:乙酸乙酯在医药领域中可用于合成多种药物,如抗生素、镇痛药等。随着医药行业的不断发展,乙酸乙酯在医药领域的应用前景也将更加广阔。
反应条件:加热、催化剂
反应方程式:CH3CH2OH+H2H2+CH3COOH=CH3COOC2H5+H2O
注意事项:控制温度、避免副反应发生
反应机理及影响因素
反应机理:乙酸与乙醇在酸性催化剂作用下发生酯化反应生成乙酸乙酯和水
影响因素:温度、压力、催化剂种类和浓度、原料配比等
拓展:其他酯类的制备方法与比较
其他酯类的制备方法介绍
实际应用中如何选择合适的酯类制备方法
酯类制备方法的优缺点分析
不同酯类制备方法的比较
实际应用:乙酸乙酯在化工、医药等领域的应用前景
化工领域:乙酸乙酯在化工领域中具有广泛的应用,如作为溶剂、涂料、油漆等。随着环保要求的提高,乙酸乙酯作为环保型溶剂的应用前景更加广阔。
实验材料与设备
实验材料:乙醇、乙酸、浓硫酸、饱和碳酸钠溶液
浓硫酸:作为催化剂,促进酯化反应的进行
饱和碳酸钠溶液:用于中和反应剩余的酸和硫酸,同时除去反应生成的乙酸乙酯中的酸性物质
乙醇:作为反应物,提供醇基
乙酸:作为反应物,提供羧基
实验设备:用于混合和加热反应物
乙酸乙酯制备实验原理和流程
单击此处输入你的正文,请阐述观点
实验操作注意事项和安全措施
单击此处输入你的正文,请阐述观点
实验结果分析和讨论
单击此处输入你的正文,请阐述观点
实验误差分析和改进措施 PPT致谢:感谢参与和支持
PPT致谢:感谢参与和支持
感谢老师和同学们的参与和支持
单击此处输入你的正文,请阐述观点
单击此处添加文本具体内容,简明扼要地阐述您的观点。根据需要可酌情增减文字,以便观者准确地理解您传达的思想
医药领域:乙酸乙酯在医药领域中可用于合成多种药物,如抗生素、镇痛药等。随着医药行业的不断发展,乙酸乙酯在医药领域的应用前景也将更加广阔。
乙酸乙酯的制备PPT课件

体溢出为止
倒入等体积饱和NaCl溶液
振摇萃取 静置
弃去下层液
倒入5ml饱和CaCl2溶液
振摇萃取 静置
弃去下层液
除去乙醇
上层液转移到具塞试管
放入无水MgSO4具
塞试管约1厘米厚
精选ppt课件最新
除去水
6
步骤四:蒸馏
将干燥好的粗乙酸乙 酯转移置单口烧瓶中
沸石
常压蒸馏称重并计算产率来自为乙酸乙 酯的实际 产量
收集76-80℃馏分
注意:不是76-80℃馏分用小烧杯作为精废选液ppt杯课件收最集新,注意不要漏气,否则收率低。 7
计算
• 乙酸乙酯的理论产量以乙酸为准计算(因为 乙醇过量),加入15ml冰醋酸摩尔数的计 算:
• 摩尔数=质量/摩尔质量=体积*密度/摩尔质 量
• 冰乙酸【相对分子量或原子量】60.05 【密 度】1.049g/ml
4
步骤二:蒸馏
把反应液倒入一圆底烧瓶 1-2粒新 蒸馏
沸石
收集60-90℃馏分
注意:不是60-90℃馏分用小烧杯精作选为pp废t课液件杯最新收集,注意不要漏气,否则收率低5。
步骤三:纯化
注意是一滴一滴加
把收集的馏分转移到小烧杯,小
转移入梨形分
烧杯中滴加入饱和NaCO3溶液中
液漏斗
和馏出液中的酸,直到无CO2气
精选ppt课件最新
3
三、实验步骤
步骤一:回流
圆底烧瓶
+23ml 95%乙醇 振摇
滴入7.5ml浓硫酸,稍冷 充分摇匀
却后再加15ml 冰醋酸
2~3粒沸石
(乙酸)
装上冷凝管
回流30min
注意:1浓硫酸需一滴一滴加,边加边
《乙酸乙酯的制备》PPT课件

在50mL园底烧瓶中加入9.5mL(0.2mol)无水乙醇和6mL(0.1mol)冰醋酸,再小心加 入2.5mL浓硫酸,加上沸石,然后装上冷凝管。
• 2、制备 小火加热反应瓶,保持加热回流0.5h,待瓶内反应物冷却后,将回流装置改成蒸馏装置, 接受瓶用冷水冷却。加热蒸出生成的乙酸乙酯,直至馏出液体积约为反应物体积总体 积的1/2为止。
Company Logo
• 思考题: • 1、酯化反应有什么特点?在实验中如何创
造条件促使酯化反应尽量向生成物方向进 行? • 2、本实验若采用醋酸过量的做法是否合适 ?为什么? • 3、蒸出的粗乙酸乙酯中主要有哪些杂质? 如何除去?
Company Logo
乙酸乙酯的制备
• 实验目的: 了解从有机酸合成酯的一般原理及方法;掌 握蒸馏、分液漏斗的使用等操作。
实验原理: 醇和有机酸在酸性条件下发生酯化反应生成 酯。CH3COOH+CH3CH2OH===CH3CO OC2H5+H2O (可逆反应、加热、浓硫酸 催化剂)
Company Logo
• 实验步骤: • 反应装置
Company Logo
• 3、馏出液洗涤 在馏出液中慢慢加入饱和碳酸钠溶液,并不断搅拌,直至不再有二氧化碳气体产生,然 后将混合液转入分液漏斗,分去下层溶液,有机层用5mL饱和食盐水洗涤,再用5mL 饱和氯化钙洗涤,最后用水洗一次,分去下层液体。 4、干燥 有机层倒入一干燥的三角烧瓶中,用无水硫酸镁干燥,称重。
• 2、制备 小火加热反应瓶,保持加热回流0.5h,待瓶内反应物冷却后,将回流装置改成蒸馏装置, 接受瓶用冷水冷却。加热蒸出生成的乙酸乙酯,直至馏出液体积约为反应物体积总体 积的1/2为止。
Company Logo
• 思考题: • 1、酯化反应有什么特点?在实验中如何创
造条件促使酯化反应尽量向生成物方向进 行? • 2、本实验若采用醋酸过量的做法是否合适 ?为什么? • 3、蒸出的粗乙酸乙酯中主要有哪些杂质? 如何除去?
Company Logo
乙酸乙酯的制备
• 实验目的: 了解从有机酸合成酯的一般原理及方法;掌 握蒸馏、分液漏斗的使用等操作。
实验原理: 醇和有机酸在酸性条件下发生酯化反应生成 酯。CH3COOH+CH3CH2OH===CH3CO OC2H5+H2O (可逆反应、加热、浓硫酸 催化剂)
Company Logo
• 实验步骤: • 反应装置
Company Logo
• 3、馏出液洗涤 在馏出液中慢慢加入饱和碳酸钠溶液,并不断搅拌,直至不再有二氧化碳气体产生,然 后将混合液转入分液漏斗,分去下层溶液,有机层用5mL饱和食盐水洗涤,再用5mL 饱和氯化钙洗涤,最后用水洗一次,分去下层液体。 4、干燥 有机层倒入一干燥的三角烧瓶中,用无水硫酸镁干燥,称重。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4
实验2-5 乙酸乙酯的制备和反应条件的 探究
乙 酸 乙 酯 的 结 构
5
主要试剂及产品的物理常数(文献值)
6
实验原理
酸和醇起作用,生成酯和水的反应叫做酯化反应。 在浓硫酸催化下,乙酸和乙醇生成乙酸乙酯:
+ + C H 3 C O O HH O C H 2 C H 3 浓 △ 硫 酸 C H 3 C O O C H 2 C H 3H 2 O
封面
1
实验2-5 乙酸乙酯的制备和反应条件的 探究
(第三课时)
2
千年陈酿 酒越变越香
3
思考与交流
酒精的主要成分是什么?其物理性 质是?空气中能发生什么反应?
酒精的主要成分是乙醇 乙醇是透明、无色、有刺激性气味、易挥发 的液体。在空气中被氧化成乙酸(有强烈刺 激性)。
乙醇和乙酸反应生成乙酸乙酯有香味, 而这个过程很缓慢所以酒越变越香
2.自制肥皂 油脂在加热和碱性条件下可完全水解,生成的不 溶性高级脂肪酸盐,再经饱和食盐水中浸泡、静 置,沥出、压缩并干燥可得肥皂。
14
练习
请分析下列装置能防倒吸的原理?
15
作业
课本 问题与讨论1-31617 Nhomakorabea7
思考与交流
根据反应特点,在实验过程中应 怎样提高转化量?
8
小结
酯化反应是可逆反应,为了提高酯的产量, 为使平衡向生成酯的方向移动,常常使反应 物之一过量,或将生成物从反应体系中及时 分离出去(将乙酸乙酯及时蒸出或将水吸 收)。
9
实验2-5
10
11
12
13
科学探究
1.厨房中制胶水 将20mL的脱脂牛奶倒入杯中,加入5mL食醋,充分搅 拌,过滤,取滤渣。在滤渣中加入绿豆大小的小苏 打,充分搅拌后即得胶水。用该胶水粘接纸质,看 看效果如何
实验2-5 乙酸乙酯的制备和反应条件的 探究
乙 酸 乙 酯 的 结 构
5
主要试剂及产品的物理常数(文献值)
6
实验原理
酸和醇起作用,生成酯和水的反应叫做酯化反应。 在浓硫酸催化下,乙酸和乙醇生成乙酸乙酯:
+ + C H 3 C O O HH O C H 2 C H 3 浓 △ 硫 酸 C H 3 C O O C H 2 C H 3H 2 O
封面
1
实验2-5 乙酸乙酯的制备和反应条件的 探究
(第三课时)
2
千年陈酿 酒越变越香
3
思考与交流
酒精的主要成分是什么?其物理性 质是?空气中能发生什么反应?
酒精的主要成分是乙醇 乙醇是透明、无色、有刺激性气味、易挥发 的液体。在空气中被氧化成乙酸(有强烈刺 激性)。
乙醇和乙酸反应生成乙酸乙酯有香味, 而这个过程很缓慢所以酒越变越香
2.自制肥皂 油脂在加热和碱性条件下可完全水解,生成的不 溶性高级脂肪酸盐,再经饱和食盐水中浸泡、静 置,沥出、压缩并干燥可得肥皂。
14
练习
请分析下列装置能防倒吸的原理?
15
作业
课本 问题与讨论1-31617 Nhomakorabea7
思考与交流
根据反应特点,在实验过程中应 怎样提高转化量?
8
小结
酯化反应是可逆反应,为了提高酯的产量, 为使平衡向生成酯的方向移动,常常使反应 物之一过量,或将生成物从反应体系中及时 分离出去(将乙酸乙酯及时蒸出或将水吸 收)。
9
实验2-5
10
11
12
13
科学探究
1.厨房中制胶水 将20mL的脱脂牛奶倒入杯中,加入5mL食醋,充分搅 拌,过滤,取滤渣。在滤渣中加入绿豆大小的小苏 打,充分搅拌后即得胶水。用该胶水粘接纸质,看 看效果如何
