(新课标)2015届高考化学大一轮复习讲义 第四章 专题讲座五 无机框图题的解题策略导学案
高考化学一轮复习方案 第4单元非金属及其化合物课件 新人教版

第四单元 │ 知识系统总览
(2)氯元素及其化合物之间的转化关系
第四单元 │ 知识系统总览
(3)硫元素及其化合物之间的转化关系
第四单元 │ 知识系统总览
(4)氮元素及其化合物之间的转化关系
第四单元 │ 高考纵览
高考纵览
碳、 硅 及 其 化 合 物
2009年
浙江28(解 答)
全国Ⅰ29( 解答)
第10讲 无机非金属材料的 主角——硅
第10讲 │ 课标考纲展示
课标考纲展示
考纲要求
了解C、Si元素单质及 其重要化合物的主要性 质及应用。
考向追踪
1.C、Si元素单质及其化 合物知识主要是以实验 探究、框图推断考查的 综合运用为主要命题形 式,难度中等。
2.硅及其化合物在生产、 生活中的应用通常是以 新材料、新技术为背景 考查常识性知识,难度
第10讲 │ 考向互动探究
变式题 我国科学家在纳米材料研究领域位于世界前列。我国科 学家成功研制出的 3 mm 长的管状定向碳纳米管,长度居世界之首。 这种碳纤维具有强度高、刚度大、密度小、熔点高、化学稳定性好等 特点,因而被称为“超级纤维”。下列对此碳纳米管的说法中不正确的 是( )
A.它是制造飞机的理想材料 B.它与石墨互为同素异形体 C.这种碳纳米管中含有非极性共价键 D.碳纤维复合材料为一种高分子化合物
第10讲 │ 考向互动探究
②不稳定性
硅酸受热分解的化学方程式: _____H_2_S_iO__3=_=_△_=_=_=_S_iO__2+__H__2_O_________________。
(3)用途:硅胶可用作干燥剂,也可以用作催化剂的载体等。
2.硅酸盐
(1)硅酸盐 由 硅、氧和金属
高考化学第一轮复习全套资料-策略27无机框图题的解法与技巧

策略27无机框图题的解法与技巧金点子:无机框图主要包括元素的框图分析与推断、无机物的框图分析与推断、无机物的合成、混合物的分离与除杂等题型。
由于此类试题可全面考查无机化学知识的内在联系,及其分析问题的方法和解决问题的能力,因而成为高考化学优秀的传统题型。
此类试题的解法与技巧主要有:1.循序渐进法当框图中给出了起始物质时,可利用框图采取循序渐进的方法分析递变过程而获解。
2.题眼扩展法当框图中未给出起始物质时,可通过题中的文字说明和框图中的实验现象等,找出解题的突破囗,也即“题眼”,题眼可以是一种物质,也可以是一类物质,再从题眼中的物质向前或后扩展,找出其它物质。
3.试探法当通过题中文字说明和框图中的变化无法找到相应物质时,此时,可通过题中规律,将中学化学中的常见物质代入试探,如发现试探的物质不符合时,再代入其它物质,直至获得结果。
4.迁移类比法当框图中的物质不是中学化学中的常见物质时,可依据元素周期表中元素的递变规律,将学过的物质的性质迁移到新物质中,而进行类比分析。
经典题:例题1 :(2001年上海高考)利用天然气合成氨的工艺流程示意如下:依据上述流程,完成下列填空:(1)天然气脱硫时的化学方程式是。
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2mol(用含n的代数式表示)(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是(多选扣分)a.相似相溶原理b.勒夏特列原理c.酸碱中和原理(4)由KHCO3分解得到的CO2可以用于(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
方法:从起始物质循序渐进分析。
捷径:(1)根据框图中的物质变化,可得脱硫方程式3H2S+2Fe(OH)3→Fe2S3+6H2O。
(2)一次转化所发生的反应是CH4+H2O=CO+3H2,根据产生CO 0.9n mol知,参加反应的CH4为0.9n mol,生成的H2为3×0.9n=2.7nmol 。
2016届高考化学一轮复习专题讲座4无机框图题的解题技巧

必考部分 第四章 专题讲座四1.有一化合物X ,其水溶液为浅绿色,可发生如下图的转化关系(部分反应物、生成物已略)。
其中,B 、D 、E 、F 均为无色气体,M 、L 为常见的金属单质,C 为难溶于水的红褐色固体。
在混合液中加入BaCl 2溶液可生成不溶于稀盐酸的白色沉淀,H 和M 反应可放出大量的热。
请回答下列问题:(1)B 的电子式为____________。
(2)画出元素M 的原子结构示意图___________________________________。
(3)物质X 的化学式为______________。
(4)电解混合液时阳极反应式为_____________________________________。
(5)按要求写出上述转化关系中有关反应的化学方程式:①含有L 元素的化合反应_________________________________。
②含有L 元素的置换反应_______________________________________。
(6)已知a g E 气体在D 中完全燃烧生成稳定的化合物时,放出b kJ 的热量,写出E 气体燃烧热的热化学方程式: _____________________________________。
【答案】(1)H ··N ··H,····H (2)(3)(NH 4)2Fe(SO 4)2(4)4OH --4e -===O 2↑+2H 2O(5)①4Fe(OH)2+O 2+2H 2O===4Fe(OH)3②Fe 2O 3+2Al=====高温2Fe +Al 2O 3(6)H 2(g)+12O 2(g)===H 2O(l) ΔH =-2b akJ·mol -1 【解析】由颜色可知C 为Fe(OH)3,则A 为Fe(OH)2、H 为Fe 2O 3,由M 、L 为常见的金属单质,可知M 、L 分别为Al 、Fe ;X 与NaOH 反应生成气体B ,B 一定是NH 3;在混合液中加入BaCl 2溶液可生成不溶于稀盐酸的白色沉淀,故X 中含有SO 2-4,所以X 为(NH 4)2Fe(SO 4)2,混合液为NaOH 和Na 2SO 4溶液,电解生成H 2、O 2,D 、E 分别为O 2、H 2,F 为NO 、G 为HNO 3。
高三化学高考备考一轮复习化工流程与无机框图题解题策略课件

Cl2
AgCl、BaSO4
消毒剂 潜艇氧来源 烘焙剂 补铁剂 制作印刷电路板
光照
加碱产生白色沉淀,迅速变成灰绿色,最终变成红褐色 加KSCN显血红色或加碱产生红褐色沉淀
与水反应产生气体的物质 与碱反应产生气体的物质
A O2 B H2O C A+Na2O2=B+C A D B D C A
B+C↑+D↑
分享答题规范注意点
一个苹果和一个苹果交换,每人仍然一个苹果 一种思想和一种思想交换,每人会有两种思想……
1 无机框图题
1.2 规范作答
1
化学用语
名称、符号、化学式、电子式、结构式
三注意
3
2
方程式
化学/离子方程式
单线桥/双线桥
答现象,还是结论
送你一个成功的故事
这是一个真实的故事。
一个中学的的篮球队,他们做了一个实验,把水平相似的队 员分为三个小组,告诉第一个小组停止练习自由投篮一个月;第 二组在一个月中每天下午在体育馆练习一小时;第三组在一个月 中每天在自己的想象中练习一个小时投篮。
Cl2 NaOH
Al 金单
Fe FeCl2 Fe Fe3+
Al Na+
问题探究
H2
HCl 金单
Cl2
Na 金单
Cl2 NaOH
Al 金单
Al
Fe FeCl2 Fe Fe3+
请回答下列问题:
Na+
(1)F的化学式为__A__lC__l3___。 (2)E的电子式为__H___C_l____。
(3)写出Y和D溶液反应的离子方程式: _____2_A_l_+__2_O_H__-_+__2_H__2O__=__2_A_l_O_2_-_+__3_H__2↑____。
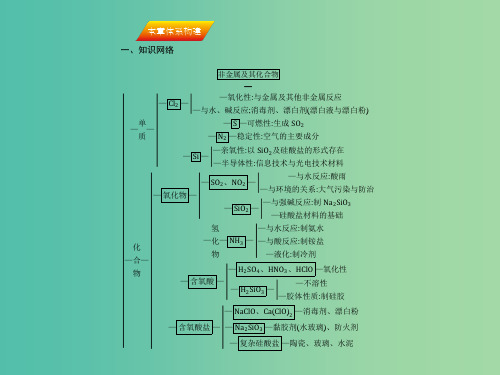
高考化学一轮复习 第四章 非金属及其化合物本章体系构建课件 新人教版
(2)导管口处产生白烟 (3)先打开 a、c 活塞,再挤压胶头滴管(或先打开 a 活塞,挤压胶头滴管, 再打开 c 活塞)。片刻后,关闭 a,然后打开 b 活塞
基础专题整合
3.氯及其化合物关系图
本章体系构建4Biblioteka 硫及其化合物关系图本章体系构建
5.氮及其化合物关系图
基础专题整合
基础专题整合
有关“喷泉实验”思想的综合应用
1.喷泉形成的原理 容器内外存在较大的压强差,在这种压强差的作用下,液体迅速流动,通 过带有尖嘴的导管喷出来,即形成喷泉。 2.使容器内外产生较大的压强差的两类情况 (1)容器内气体极易溶于水或容器内气体易与溶液中的溶质发生化学 反应,因此当外部的水或溶液接触容器内气体时由于气体大量溶解或溶液 中的溶质发生化学反应,从而使容器内气压迅速降低,在外界大气压作用下, 外部液体迅速进入容器,通过尖嘴导管喷出,形成喷泉。下表列出的气体作 用于吸收剂,就能形成喷泉:
装置Ⅳ:在锥形瓶中加入能产生气体的物质,使锥形瓶内气体的压强明 显增大,将液体压入烧瓶而产生喷泉。 装置Ⅴ:在水槽中加入使水温度升高的物质,致使锥形瓶内酒精因升温而挥 发,锥形瓶内气体压强增大而产生喷泉。
基础专题整合
装置Ⅵ:烧瓶中通入 H2S(或 SO2),然后通入 SO2(或 H2S),现象为有淡黄 色粉末状物质生成,瓶内壁附有水珠,NaOH 溶液喷到烧瓶内。
(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶
Ⅰ中不产生“喷泉”现象,其操作方法
是
。
(2)若先打开 a、c 活塞,再挤压胶头滴管,在烧瓶中可观察到的现象
是
。
(3)通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,
(新课标)2015届高考化学大一轮复习讲义 第四章 排查落实练七 碳、硅、氯课件

盐酸、次氯酸,呈酸性使石蕊试液变红,而次氯酸又具有强 氧化性,使红色褪去
。 7.漂白粉、漂粉精为什么要密封包装,避光、隔潮存放?
答案 因为漂白粉、 漂粉精在空气中久置因发生下述反应而 失效:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO, 光照 2HClO=====2HCl+O2↑。
2.氯气及其化合物 (1)知识网络构建
(2)重要反应必练 写出下列反应的方程式,是离子反应的写离子方程式。 ① Cl2 和 H2O 的反应 + - Cl2+H2O H +Cl +HClO ; ② Cl2 和 NaOH 的反应 Cl2+2OH-===Cl-+ClO-+H2O ; ③ Cl2 和石灰乳的反应 2Cl2+2Ca(OH)2===2Ca2++2Cl-+2ClO-+2H2O ; ④把 Cl2 通入到 Na2SO3 溶液中 2- 2- Cl2+SO3 +H2O===SO4 +2H++2Cl-; ⑤将 Cl2 和 SO2 混合通入 H2O - SO2+Cl2+2H2O===4H++2Cl-+SO2 4 ;
的火焰,在瓶口有白雾形成 。
5.强光照射 H2 和 Cl2 的混合气体, 现象是 迅速反应,发生爆炸 。
产生棕黄色 6.Cu 在 Cl2 中燃烧现象 Cu 在 Cl2 中剧烈燃烧, 的烟
,加水后, 生成蓝色溶液
。
溶液
7.将 Cl2 通入 KI 溶液中,再加入 CCl4,其现象为 分层,上层无色,下层呈紫红色 。
高温 SiO2+2C=====Si+2CO↑
; ; ; ;
④ SiO2 和氢氟酸的反应 SiO2+4HF===SiF4↑+2H2O
⑤向 Na2SiO3 溶液中通入过量 CO2 气体 - - SiO2 + 2CO + 2H O===H SiO ↓+ 2HCO 3 2 2 2 3 3
高考化学第一轮复习考点突破:《无机框图题推断》(课件)

(4) 反应⑥的离子方程式是
________________________________
(3) 反应①的化学方程式是 _3_F_e_+_4_H_2_O__高=_=_温=__F_e_3O__4_+_4_H_2____,在实验室中 引发反应④的操作是_加__少__量__K__C_l_O_3_,__插__上__镁_ _条__并__将__其__点__燃___
(4) 反应⑥的离子方程式是 _2_A__l+_2_O__H__-_+_2_H__2O__=_2_A__lO__2_-_+_3_H__2↑___
(1) 写出B的电子式:
________________________________ (2) 写出生成E的电极反应式:
________________________,反应⑤的现象 是_____________________________________
(3) 反应①的化学方程式是 __________________________,在实验室中 引发反应④的操作是____________________
(3) 反应①的化学方程式是 __________________________,在实验室中 引发反应④的操作是____________________
______________ (4) 反应⑥的离子方程式是
________________________________
高三化学大一轮复习专题讲座七无机框图题的解答策略(讲义)(人教)

专题讲座七无机框图题的解答策略1.题型特点无机框图推断题集基本概念、基本理论及元素化合物知识于一体,具有考查知识面广、条件隐蔽性强、思维容量大、试题区分度高等特点,是高考命题专家的“宠儿”。
该题型能较好地考查学生对所学知识进行重组、转换、迁移、解决实际问题的能力、逻辑推理能力和分析综合能力等。
从历年高考考生答卷情况来看,无机框图推断题仍为考生的“软肋”。
在高三复习中抓住无机推断题,不仅能进一步加深元素及其化合物的有关知识,还能培养分析推理、观察思维、获取信息及综合应用的能力。
2.解题策略无论推断题属于哪种形式,均遵循这样的推断思路:迅速浏览、整体扫描、产生印象、寻找“突破口”,突破点由点到面、随时检验,注意联系、大胆假设、全面分析(正推或逆推),验证确认。
解题的关键是仔细审题,依物质的特性或特征转化来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。
我们可以将推断题的解题方法及推理过程表示如下:推断题――→审题⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫明显条件隐含条件――→抓关键(突破口)⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫结构特征反应特征现象特征其他特征――→推断结论―→验证 3.解题“突破口”(1)物质的特殊颜色相关知识:①有色固体a .红色:Cu 、Cu 2O 、Fe 2O 3;b .红褐色:Fe(OH)3;c .黄色:AgI 、Ag 3PO 4;d .淡黄色:S 、Na 2O 2或AgBr ;e .蓝色:Cu(OH)2;f .黑色:炭粉、CuO 、FeO 、FeS 、CuS 、Ag 2S 、PbS ;g .紫黑色:KMnO 4、I 2;h .白色:Fe(OH)2、CaCO 3、BaSO 4、AgCl 、BaSO 3。
②有色溶液:Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO -4(紫红色)、Fe 3+与苯酚(紫色)、Fe 3+与SCN -(血红色)、I 2与淀粉(蓝色)等。
③有色气体:Cl 2(黄绿色)、Br 2(g)(红棕色)、NO 2(红棕色)、I 2(g)(紫色)、O 3(淡蓝色)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题讲座五 无机框图题的解题策略1.解题策略无论推断题属于哪种形式,均遵循这样的推断思路:迅速浏览、整体扫描、产生印象、寻找“突破口”,突破点由点到面、随时检验,注意联系、大胆假设、全面分析(正推或逆推),验证确认。
解题的关键是仔细审题,依物质的特性或特征转化来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。
我们可以将推断题的解题方法及推理过程表示如下:推断题――→审题⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫明显条件隐含条件――→抓关键(突破口)⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫结构特征反应特征现象特征其他特征――→推断结论―→验证 2.解题“突破口” (1)物质的特殊颜色 相关知识: ①有色固体:a.红色:Cu 、Cu 2O 、Fe 2O 3;b.红褐色:Fe(OH)3;c.黄色:AgI ;d.淡黄色:S 、Na 2O 2、AgBr ;e.蓝色:Cu(OH)2;f.黑色:炭粉、CuO 、MnO 2、FeS 、CuS ;g.紫黑色:KMnO 4、I 2;h.白色:Fe(OH)2、CaCO 3、BaSO 4、AgCl 、BaSO 3。
②有色溶液:Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO -4(紫红色)、Fe 3+与SCN -(血红色)、I 2与淀粉(蓝色)等。
③有色气体:Cl 2(黄绿色)、Br 2(g)(红棕色)、NO 2(红棕色)、I 2(g)(紫色)、O 3(淡蓝色)等。
④火焰颜色:a.焰色反应:Na +(黄色)、K +(紫色)、Ca 2+(砖红色)等;b.蓝色:CO 在空气中燃烧;c.淡蓝色:S 、H 2、CH 4等在空气中燃烧;d.苍白色:H 2在Cl 2中燃烧。
【例1】 (2012·四川理综,26)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。
已知A 、B 为气态单质,F 是地壳中含量最多的金属元素的单质;E 、H 、I 为氧化物,E 为黑色固体,I 为红棕色气体;M 为红褐色沉淀。
请回答下列问题:(1)B 中所含元素位于周期表中第________周期________族。
(2)A 在B 中燃烧的现象是__________________________________。
(3)D +E ―→B 的反应中,被氧化与被还原的物质的物质的量之比是__________。
(4)G +J ―→M 的离子方程式是__________________________________。
(5)Y 受热分解的化学方程式是____________________________。
解析 解题的关键是利用物质的颜色进行突破。
Ⅰ为红棕色气体氧化物,一定是NO 2;M 为红褐色沉淀,一定是Fe(OH)3;F 是地壳中含量最多的金属元素的单质,一定是Al ;X 电解生成三种物质,其中A 、B 是气态单质且能反应生成D ,猜测是电解NaCl 溶液,生成的H 2和Cl 2反应生成HCl ,盐酸能与黑色固体E(氧化物)反应生成气体B ,则E 应是MnO 2,B 是Cl 2,则A 是H 2。
NO 2和H 2O 反应生成HNO 3(N),HNO 3和Fe(OH)3反应生成Fe(NO 3)3(Y),Fe(NO 3)3可分解生成Fe 2O 3(H),Fe 2O 3与HCl 反应生成FeCl 3(J),NaOH(C)与Al 反应生成NaAlO 2(G),Fe 3+和AlO -2可以发生双水解反应生成Fe(OH)3(M)。
答案 (1)三 ⅦA (2)产生苍白色火焰 (3)2∶1 (4)3AlO -2+Fe 3++6H 2O===3Al(OH)3↓+Fe(OH)3↓(5)4Fe(NO 3)3=====△2Fe 2O 3+12NO 2↑+3O 2↑ (2)物质的特征性质 相关知识:①能使品红溶液褪色的气体:SO 2(加热后又恢复红色)、Cl 2(加热后不恢复红色)。
②沉淀特殊的颜色变化:白色沉淀先变灰绿色,再变红褐色: Fe(OH)2――————→放置于空气中Fe(OH)3。
③在空气中变为红棕色: NO(无色)——————→被氧气氧化NO 2(红棕色)。
④能使澄清石灰水变浑浊的气体:CO 2、SO 2。
⑤通入CO 2气体变浑浊的溶液:石灰水(过量则变澄清)、Na 2SiO 3溶液、饱和Na 2CO 3溶液。
⑥使湿润的红色石蕊试纸变蓝的气体:NH 3。
⑦使湿润的淀粉-KI 试纸变蓝:NO 2、Cl 2、Br 2、FeCl 3等。
⑧常温下能溶解SiO 2固体的物质:氢氟酸和NaOH 溶液。
⑨滴入沸水中可得到红褐色胶体的溶液:含Fe 3+的盐溶液。
⑩烟雾现象:a.棕(黄)色的烟:Cu 或Fe 在Cl 2中燃烧;b.白烟:Na 在Cl 2中燃烧;NH 3遇到浓盐酸或浓硝酸;c.白雾:由HX 等极易溶于水的气体产生。
【例2】 已知有以下物质相互转化。
试回答下列问题:(1)B 的化学式为______________________,D 的化学式为______________________。
(2)由E 转变成F 的化学方程式为________________________。
(3)用KSCN 鉴别G 溶液的离子方程式为__________________; 向G 溶液加入A 的有关离子反应方程式为_______________________。
解析 由白色沉淀E 置于空气中转化为红褐色沉淀F ,可见E 为Fe(OH)2,F 为Fe(OH)3;G 为FeCl 3,从而推断出A 为Fe ,B 为FeCl 2;焰色反应呈紫色,说明溶液中含有K +,从而确定C 为KOH 。
(1)B 的化学式为FeCl 2,D 的化学式为KCl 。
(2)由E 转变成F 的化学方程式为4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
(3)用KSCN 鉴别FeCl 3溶液的离子方程式为Fe 3++3SCN -===Fe(SCN)3,向FeCl 3溶液中加入铁,离子反应方程式为2Fe 3++Fe===3Fe 2+。
答案 (1)FeCl 2 KCl (2)4Fe(OH)2+O 2+2H 2O===4Fe(OH)3 (3)Fe 3++3SCN-===Fe(SCN)3 2Fe 3++Fe===3Fe 2+(3)物质之间的特征转化关系 相关知识:①连续氧化反应:A ――→O 2B ――→O 2C ――→H 2O D(酸或碱)。
a.NH 3(g)――→O 2N 2――→O 2NO ――→O 2NO 2――→H 2O HNO 3;b.H 2S(g)――→O 2S ――→O 2SO 2――→O 2SO 3――→H 2OH 2SO 4; c.CH 4(g)――→O 2C ――→O 2CO ――→O 2CO 2――→H 2O H 2CO 3; d.Na(s)――→O 2Na 2O ――→O 2Na 2O 2――→H 2O NaOH 。
X 可能为弱酸的铵盐:(NH 4)2CO 3或NH 4HCO 3;(NH 4)2S 或NH 4HS ;(NH 4)2SO 3或NH 4HSO 3等 ③三角转化关系:④化合物+化合物→单质+化合物这类反应主要有:CO +H 2O(g)=====高温CO 2+H 2、Fe 2O 3+3CO=====高温2Fe +3CO 2等。
⑤化合物A +单质B →化合物C +单质D 。
这类反应主要有: CO 2+2Mg=====点燃2MgO +C ; Fe 2O 3+3H 2=====高温2Fe +3H 2O ; Fe +2HCl===FeCl 2+H 2↑; C +H 2O(g)=====高温CO +H 2; 3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2等。
【例3】 已知A 、B 、C 、D 为气体,E 、F 为固体,G 是氯化钙,它们之间的转换关系如下图所示:(1)D 的化学式是____________,E 的化学式是________。
(2)A 和B 反应生成C 的化学方程式是______________________________________。
(3)E 和F 反应生成D 、H 和G 的化学方程式是____________________________。
解析 本题的突破口为“D(气体)→E(固体)→D(气体)”这一系列转化过程,可联想到中学化学中“氨气→铵盐→氨气”这一转化过程,据此可推测D 为NH 3,结合G 为CaCl 2,可知E 为NH 4Cl ,F 为Ca(OH)2。
其余物质可以逐一确定:A 为H 2(或Cl 2),B 为Cl 2(或H 2),C 为HCl ,H 为H 2O 。
答案 (1)NH 3 NH 4Cl (2)H 2+Cl 2=====点燃2HCl (3)2NH 4Cl +Ca(OH)2=====△CaCl 2+2NH 3↑+2H 2O (4)特殊反应条件 相关知识:具有特殊反应条件的反应,大多数是重要的工业生产反应。
①高温条件:CaCO 3=====高温CaO +CO 2↑;SiO 2+CaCO 3=====高温CaSiO 3+CO 2↑; SiO 2+Na 2CO 3=====高温Na 2SiO 3+CO 2↑; SiO 2+CaO=====高温CaSiO 3; SiO 2+2C=====高温Si +2CO ↑; C +H 2O(g)=====高温CO +H 2; CO +H 2O(g)=====高温CO 2+H 2; 3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2; 2Al +Fe 2O 3=====高温2Fe +Al 2O 3; 4FeS 2+11O 2=====高温2Fe 2O 3+8SO 2等。
②高温、高压和催化剂条件: N 2+3H 2高温、高压催化剂2NH 3等。
③加热、催化剂条件:4NH 3+5O 2=====催化剂△4NO +6H 2O ; 2SO 2+O 2催化剂△2SO 3等。
④通电条件:2NaCl +2H 2O=====电解2NaOH +H 2↑+Cl 2↑;2H 2O=====电解2H 2↑+O 2↑等。
【例4】 A ~F 均为中学化学中常见的物质,它们之间相互转化的关系如下图所示(产物水等略去)(1)写出下列物质的化学式:A__________,D__________,F________。
(2)C 和D 的稀溶液不反应,但若B 与C 反应后再与D 反应可生成A ,试写出有关反应方程式:_________________________。
(3)写出A 的溶液电解时阳极的电极反应方程式:__________________________________。
