工程热力学第1章-基本概念
工程热力学-01 基本概念及定义

平衡状态1
p1 v1
p
p2
2
压容图 p-v图
平衡状态2
p1
1
p2 v2
O
v2
v1
v
12
1-4 状态方程式
在平衡状态下,由气态物质组成的系统,只要知道两个独立的 状态参数,系统的状态就完全确定,即所有的状态参数的数值随之 确定。这说明状态参数间存在某种确定的函数关系,状态参数之间 存在着确定的函数关系,这种函数关系就称为热力学函数。
(2)当系统处于热力学平衡状态时,只要没有外界的影响, 系统的状态就不会发生变化。
(3)整个系统可用一组具有确定数值的温度、压力及其他参
? 数来描述其状态。
10
经验表明,确定热力学系统所处平衡状态所需的独立状 态参数的数目,就等于系统和外界间进行能量传递方式的数 目。对于工程上常见的气态物质组成的系统,系统和外界间传递 的能量只限于热量和系统容积变化所作的功两种形式,因此只需 要两个独立的状态参数即可描述一个平衡状态。
3、平衡状态、稳定状态、均匀状态
(1)关于稳定状态与平衡状态
稳定状态时,状态参数虽不随时间改 变,但它是依靠外界影响来维持的。而平 衡状态是不受外界影响时,参数不随时间 变化的状态。
85℃ 20℃
90℃
15℃
铜棒
平衡必稳定,稳定未必平衡。
(2)关于均匀状态与平衡 水
质统称为外界。 通常选取工质作为热力学系统,把高温热源、低温热源
等其他物体取作外界。
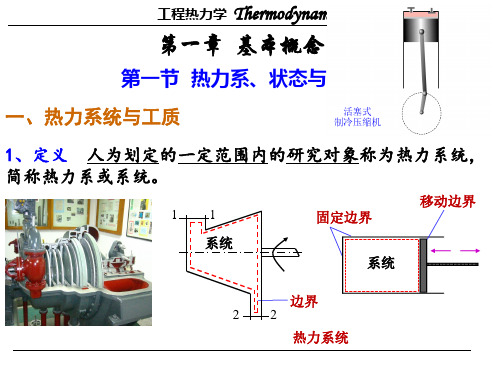
3、边界 ——热力学系统和外界之间的分界面称为边界。
边界可以是固定的,也可以是移动的; 边界可以是实际的,也可以是假想的。
3
二、热力学系统的分类 依据——有无物质或能量的交换
工程热力学第一章

(3)好处:用系统的参数来计算;可以作 好处:用系统的参数来计算; 为实际过程中能量转换效果比较的标准和极 限;可把实际过程当作可逆过程进行分析计 然后再用经验系数加以修正。 算,然后再用经验系数加以修正。 (4)热量和功量 热量和功量都是过程量, 热量和功量都是过程量,它们的大小不仅与 过程的初终状态有关, 过程的初终状态有关,而且与过程的性质有 关。 可逆过程的功量: 可逆过程的功量: w = ∫ pdv 可逆过程的热量: 可逆过程的热量: q = ∫ Tds
C B A
课后题1 课后题1-5;1-6;1-9
(c)系统内部状态参数不随时间而变化 (d)系统内部状态不发生改变 2.均质等截面杆的两端的温度由分别维持 2.均质等截面杆的两端的温度由分别维持 t1 t2的两热源保持 t1 t2 不变,取此杆为系统, 不变,取此杆为系统, 则系统处于( 则系统处于(B)。 平衡状态, (a)平衡状态,因其各截面温度不随时间改 变 非平衡状态, (b)非平衡状态,因其各截面温度不等 平衡状态, (c)平衡状态,因其各截面温度不随时间改 变,且流入系统的热量等于流出系统的热量 非平衡状态, (d)非平衡状态,因其处于重力场
4.基本状态参数:温度、压力、 4.基本状态参数:温度、压力、比体积 基本状态参数 温度: (1)温度:是热平衡的惟一判据
t = T − 273.15
(2)压力Βιβλιοθήκη p = B + pg
p = B−H
(3)比体积 二、平衡状态、状态公理及状态方程 平衡状态、 1.定义 是指在没有外界作用的情况下, 定义: 1.定义:是指在没有外界作用的情况下, 系统的宏观性质不随时间变化的状态。 系统的宏观性质不随时间变化的状态。 2.实现平衡的条件: 2.实现平衡的条件:系统内部及系统与外界 实现平衡的条件 之间各种不平衡势差消失
工程热力学概念整理

⼯程热⼒学概念整理⼯程热⼒学与传热学概念整理⼯程热⼒学第⼀章、基本概念1.热⼒系:根据研究问题的需要,⼈为地选取⼀定范围内的物质作为研究对象,称为热⼒系(统),建成系统。
热⼒系以外的物质称为外界;热⼒系与外界的交界⾯称为边界。
2.闭⼝系:热⼒系与外界⽆物质交换的系统。
开⼝系:热⼒系与外界有物质交换的系统。
绝热系:热⼒系与外界⽆热量交换的系统。
孤⽴系:热⼒系与外界⽆任何物质和能量交换的系统3.⼯质:⽤来实现能量像话转换的媒介称为⼯质。
4.状态:热⼒系在某⼀瞬间所呈现的物理状况成为系统的状态,状态可以分为平衡态和⾮平衡态两种。
5.平衡状态:在没有外界作⽤的情况下,系统的宏观性质不随时间变化的状态。
实现平衡态的充要条件:系统内部与外界之间的各种不平衡势差(⼒差、温差、化学势差)的消失。
6.强度参数:与系统所含⼯质的数量⽆关的状态参数。
⼴延参数:与系统所含⼯质的数量有关的状态参数。
⽐参数:单位质量的⼴延参数具有的强度参数的性质。
基本状态参数:可以⽤仪器直接测量的参数。
7.压⼒:单位⾯积上所承受的垂直作⽤⼒。
对于⽓体,实际上是⽓体分⼦运动撞击壁⾯,在单位⾯积上所呈现的平均作⽤⼒。
8.温度T:温度T是确定⼀个系统是否与其它系统处于热平衡的参数。
换⾔之,温度是热⼒平衡的唯⼀判据。
9.热⼒学温标:是建⽴在热⼒学第⼆定律的基础上⽽不完全依赖测温物质性质的温标。
它采⽤开尔⽂作为度量温度的单位,规定⽔的汽、液、固三相平衡共存的状态点(三相点)为基准点,并规定此点的温度为273.16K。
10状态参数坐标图:对于只有两个独⽴参数的坐标系,可以任选两个参数组成⼆维平⾯坐标图来描述被确定的平衡状态,这种坐标图称为状态参数坐标图。
11.热⼒过程:热⼒系从⼀个状态参数向另⼀个状态参数变化时所经历的全部状态的总和。
12.热⼒循环:⼯质由某⼀初态出发,经历⼀系列状态变化后,⼜回到原来初始的封闭热⼒循环过程称为热⼒循环,简称循环。
13.准平衡过程:由⼀系列连续的平衡状态组成的过程称为准平衡过程,也成准静态过程。
工程热力学第一章

单位 : Pa (帕),1 Pa =1 N/ m2 ,
常用压力单位: 1 MPa = 103 kPa =106 Pa 1 atm(标准大气压) = 1.013105 Pa 1 mmHg (毫米汞柱) = 133.3 Pa 1 at (工程大气压) = 0.981105 Pa 1 mmH2O(毫米水柱) = 9.81 Pa
摄氏温标:
瑞典天文学家摄尔修斯( Celsius )于 1742 年 建立。用摄氏温标确定的温度称为摄氏温度,用 符号t 表示,单位为℃。 在标准大气压下,纯水的冰点温度为 0 ℃ ,纯 水的沸点温度为100 ℃,纯水的三相点(固、液、汽 三相平衡共存的状态点)温度为0.01℃ 。 选择水银的体积作为温度测量的物性,认为其 随温度线性变化,并将0 ℃ 和100 ℃温度下的体积 差均分100份,每份对应1 ℃。
A C
B
热力学第零定律是温度测量的理论依据 。
温度:可以确定一个系统是否与其他系统处于 热平衡的物理量。是一个强度量。
50
(c)温标:
温度的数值表示法。
建立温标的三个要素:
a . 选择温度的固定点,规定其数值; b. 确定温度标尺的分度方法和单位;
c. 选择某随温度变化的物性作为温度测量的依据。
51
四个主要装置: 锅炉 汽轮机 凝汽器 给水泵
燃气轮机
燃气轮机结构图
活塞
热动力装置的本质
利用某一种媒介物从某个能源获取热能,具 备作功能力并对机器作功,最后把余下的 热能排向环境介质(大气或冷却水) 本质特性:吸热 → 膨胀做功→ 排热
1.热力系统、状态 及状态参数
1.1 热力系统与 工质
1、定义: 在不受外界影响的条件下(重力场除外),如果系统的状 态参数不随时间变化,则该系统处于平衡状态。
工程热力学(基本概念)
国际实用温标的固定点
平衡状态
平衡氢三相点 平衡氢沸点 氖沸点 氧三相点 氧冷凝点
国际实用温标指定
值
T,K
t,℃
13.81 -259.34
20.28 -252.87
20.102 -246.048
54.361 -218.789
90.183 -182.962
平衡状态
水三相点 水沸点
锌凝固点 银凝固点 金凝固点
一、热力过程
定义:热力系从一个状态向另一个状态变化时所经 历的全部状态的总和。
二、准平衡(准静态)过程
准平衡过程的实现
工程热力学 Thermodynamics
二、准平衡(准静态)过程
定义:由一系列平衡态组成的热力过程 实现条件:破坏平衡态存在的不平衡势差(温差、
力差、化学势差)应为无限小。 即Δp→0 ΔT→0 (Δμ→0)
工程热力学 Thermodynamics
三、可逆过程
力学例子:
定义: 当系统完成某一热力过程后,如果有可能使系统再
沿相同的路径逆行而恢复到原来状态,并使相互中所涉 及到的外界亦恢复到原来状态,而不留下任何变化,则 这一过程称为可逆过程。
实现条件:准平衡过程加无耗散效应的热力过程 才是可逆过程。
工程热力学 Thermodynamics
用来实现能量相互转换的媒介物质称为工质。
理想气体
工 质
实际气体
蒸气
工程热力学 Thermodynamics
二、平衡状态
(一)热力状态:热力系在某一瞬间所呈现的宏观
物理状况。(简称状态)
(二)平衡状态 1、定义:一个热力系统,如果在不受外界影响的条件下,
系统的状态能够始终保持不变,则系统的这种状态称为平衡 状态。
工程热力学

3.某远洋货轮的真空造水设备的真空度为0.0917MPa,而当地大气压力为0.1013MPa,当航行至另一海域,其真空度变化为0.0874MPa,而当地大气压力变化为0.097MPa。试问该真空造水设备的绝对压力有无变化?
4.如图1-1所示,一刚性绝热容器内盛有水,电流通过容器底部的电阻丝加热水。试述按下列三种方式取系统时,系统与外界交换的能量形式是什么。
7.气体在气缸中被压缩,压缩功为186kJ/kg,气体的热力学能变化为56kJ/kg,熵变化为-0.293kJ/(kg·K)。温度为20C的环境可与气体发生热交换,试确定每压缩1kg气体时的熵产。
8.设一可逆卡诺热机工作于1600℃和300℃的两个热源之间,工质从高温热源吸热400kJ,试求:(1)循环热效率;(2)工质对外作的净功;(3)工质向低温热源放出的热量。
图
图2-1
7.某气体从初态p1=0.1MPa,V1=0.3m3可逆压缩到终态p2=0.4MPa,设压缩过程中p=aV-2,式中a为常数。试求压缩过程所必须消耗的功。
8.如图2-2所示,p-v图上表示由三个可逆过程所组成的一个循环。1-2是绝热过程;2-3是定压过程;3-1是定容过程。如绝热过程1-2中工质比热力学能的变化量为-50kJ/kg,p1=1.6MPa,v1=0.025m3/kg,p2=0.1MPa,v2=0.2m3/kg。(1)试问这是一个输出净功的循环还是消耗净功的循环?
工程热力学第1章-基本概念
输出净功; 在p-v图及T-s图上顺时针进行; 膨胀线在压缩线上方;吸热线在放热线上方。
河北理工大学
工程热力学
四、逆向循环(reverse cycle)
▲制冷循环(refrigeration cycle) ▲热泵循环(heat-pump cycle)
一般地讲:输入净功; 在状态参数图逆时针运行; 吸热小于放热。
t C TK 273.15
河北理工大学
工程热力学
河北理工大学
工程热力学
华氏温标和摄氏温标
{t} ℃=5/9[{t} ℉-32]
{t} ℉ =9/5{t} ℃ +32
河北理工大学
工程热力学
五、压力(pressure)
压力计所测得的压力为工质的真实压力(或 称绝对压力)与环境介质压力之差,叫做表 压力或真空度。 绝对压力 p (absolute pressure) 表压力 pe(pg)(gauge pressure) 真空度 pv(vacuum; vacuum pressure) 当地大气压pb(local atmospheric pressure)
孤立系统(isolated system)— 热力系统与外界无任何形式的能量 和物质交换。
注意: 1)闭口系统与系统内质量不变的区别; 2)开口系统与绝热系统的关系; 3)孤立系统与绝热系统的关系。
河北理工大学
工程热力学
四、热力系示例
1.刚性绝热气缸-活塞系统,B侧设有电热丝 红线内 ——闭口绝热系统 黄线内不包含电热丝 ——闭口系统 黄线内包含电热丝 ——闭口绝热系统 兰线内 ——孤立系统
河北理工大学
工程热力学
作功过程
p
pb
F
f
工程热力学基本概念
= 收获/代价
炉
热效率: t
w net q1
顺 时 针
汽轮机
发电机 凝 汽 器
逆向循环 又称制冷循环或热泵循环
高温热源
或 制 Q1
逆 时
热冷 泵机
W
针
Q2
低温热源
制冷循环的经济性用制冷系数衡量:
2
1
1,a,2
1,b,2
b
2
状态参数的变化只与初终态相关,
1 dxx2 x1 与路径无关。
状态参数都有以上特性。
状态参数的循环 dx 0 积分等于零。
反之,有以上特性之一, 即为状态参数。
1-3 平衡状态、状态方程式、坐标图
一、平衡状态
热力系在没有外界作用的情况下〔重力场除 外〕,宏观性质不随时间变化的状态。
热力过程:工质由一个状态变化到另一状态所经历 的全部状态的总和。
实际过程由一系列非 平衡状态组成
例:
非平衡状态
无法简单描述
平衡状态
宏观静止
能量不能转换
“平衡〞意味着宏观静止, 引入 理想模型:
“过程〞意味着变化,意味着
准平衡过程
平衡被破坏。二者如何统一?
一、准平衡过程 热力系从一个平衡态连续经历一系列
系统与外界 通过边界进 展相互作用
热力系的选取主要决定于研究任务 。
选取热力系时注意:
❖热力系可以很大,但不能大到无限。
❖热力系可以很小,但不能小到只包含少量分子, 以致不能遵守统计平均规律。
❖ 边界可以是实际存在的, 也可以是假想的。
❖ 边界可以是固定的, 也可以是变动的。
系统与外界通过边界进展相互作用。
平衡的中间态过渡到另一个平衡态
工程热力学---第1章 基本概念
pv RgT
实际气体(real gas; imperfect gas)的状态方程
范德瓦尔方程
R—K方程
a p 2 v b v
RgT
a p 0.5 v b T v(v b)
RgT
(a,b为物性常数)
27
三、状态参数坐标图
一简单可压缩系只有两个独立参数,所以 可用平面坐标上一点确定其状态,反之任一状 态可在平面坐标上找到对应点,如:p-v、T-s。
a)刚性的或可变形的或有弹性的 b)固定的或可移动的 c)实际的或假想的
边界示意图
10
汽缸-活塞装置(闭口系例)
11
汽车发动机(开口系示例)
12
热力系分类
按照组元和相数分 单元系 多元系 按系统与外界能质交换分 单相系 复相系
闭口系—closed system 控制质量CM) —没有质量越过边界 开口系—open system (控制体积CV) —通过边界与外界有质量交换
所有状参一一对应相等
简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
状态法则:系统独立状态参数的数目N等于系统对外所 作广义功的数目n加1,即N=n+1.
20
基本状态参数
温度
热力学第零定律(R.W. Fowler in 1931) 如果两个系统分别与第三个系统处于 热平衡,则两个系统彼此必然处于热平衡。
dx 0
ห้องสมุดไป่ตู้
2、分类 #可逆循环与不可逆循环,状态参数坐标图上表示。 正向循环:输出功,热能 目的 机械能 Q 高温热源
逆向循环:消耗功,低温热源
二、正向循环(动力循环)
wnet t 1 q1
6 6 6
工程热力学知识点笔记总结
工程热力学知识点笔记总结第一章热力学基本概念1.1 热力学的基本概念热力学是研究能量与物质的转化关系的科学,它关注热与功的转化、能量的传递和系统的状态变化。
热力学中最基本的概念包括系统、热力学量、状态量、过程、功和热等。
1.2 热力学量热力学量是描述系统的性质和状态的物理量,包括内能、焓、熵、自由能等。
内能是系统的总能量,焓是系统在恒压条件下的能量,熵是系统的无序程度,自由能是系统进行非体积恒定的过程中能够做功的能量。
1.3 热力学第一定律热力学第一定律是能量守恒的表达形式,在闭合定容系统中,系统的内能变化等于系统所接受的热量减去系统所做的功。
1.4 热力学第二定律热力学第二定律是描述系统不可逆性的定律,它包括开尔文表述和克劳修斯表述。
开尔文表述指出不可能将热量完全转化为功而不引起其他变化,克劳修斯表述指出热量自然只能从高温物体传递到低温物体。
根据第二定律,引入了熵增大原理和卡诺循环。
1.5 热力学第三定律热力学第三定律是指当温度趋于绝对零度时,系统的熵趋于零。
这一定律揭示了绝对零度对热力学过程的重要意义。
第二章热力学系统2.1 定态与非定态定态系统是指系统的性质在长时间内不发生变化,非定态系统是指系统的性质在长时间内发生变化。
2.2 开放系统与闭合系统开放系统是指与外界交换物质和能量的系统,闭合系统是指与外界不交换物质但可以交换能量的系统。
2.3 热力学平衡热力学平衡是指系统内各部分之间的温度、压力、化学势等性质达到一致的状态。
系统处于热力学平衡时,不会产生宏观的变化。
第三章热力学过程3.1 等温过程在等温过程中,系统的温度保持不变,内能的变化全部转化为热量输给外界。
3.2 绝热过程在绝热过程中,系统不与外界交换热量,内能的变化全部转化为对外界所做的功。
3.3 等容过程在等容过程中,系统的体积保持不变,内能的变化全部转化为热量。
3.4 等压过程在等压过程中,系统的压强保持不变,内能的变化转化为对外界所做的功和系统所吸收的热量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
两者关系:
v
1
河北理工大学
1-4 平衡状态
工程热力学
一、平衡状态(thermodynamic equilibrium state)
1.定义:无外界影响系统保持状态参数不随时间而改变的状态
热平衡(thermal equilibrium) : 在无外界作用的条件下,系统内部、系统与外界 处处温
度相等。
河北理工大学
四、逆向循环(reverse cycle)
▲制冷循环(refrigeration cycle) ▲热泵循环(heat-pump cycle)
工程热力学
一般地讲:输入净功; 在状态参数图逆时针运行; 吸热小于放热。
河北理工大学
五、循环经济性指标:
收益 代价
动力循环: 热效率(thermal efficiency)
河北理工大学
三、热量(heat)
1.定义:仅仅由于温差而 通过边界传递的能量。
2.符号约定:系统吸热“+”; 放热“-”
3.单位: J kJ
4.计算式及状态参数图
(T-s图上)表示
2
Q TdS
(可逆过程)
1
δQ TdS
热量是过程量
河北理工大学
工程热力学
四、热量与功的异同:
1.均为通过边界传递的能量;
热力学温标单位:开尔文,K。水的三相 点的温度,即固相、液相和气相平衡共 存状态的温度作为基准点,并规定为 273.16K。
t T 273.15
C
K
河北理工大学
河北理工大学
工程热力学
工程热力学
华氏温标和摄氏温标
{t} ℃=5/9[{t} ℉-32] {t} ℉ =9/5{t} ℃ +32
pA F cos pb A ( f 0)
河北理工大学
准静态过程,可逆
讨论:
工程热力学
1.可逆=准静态+没有耗散效应 2.准静态着眼于系统内部平衡,可逆着眼于
系统内部及系统与外界作用的总效果 3.一切实际过程不可逆 4.可逆过程可用状态参数图上实线表示
河北理工大学
1-6 功和热量
工程热力学
wnet ' q1 1
wnet
河北理工大学
二、系统及边界示例
• 汽车发动机— 开口系统
工程热力学
河北理工大学
• 汽缸-活塞装置(闭口系例)
工程热力学
河北理工大学
气缸进、排气阀都关闭时,取 气缸内工质为系统—闭口系统
进排气及燃烧膨胀过程一起研 究,取气缸为系统—开口系统
• 移动边界
河北理工大学
工程热力学
1kPa 1103 Pa
河北理工大学
环境压力与大气压力 环境压力是压力表所处环境 注:环境压力一般为大气压力,但不一定都是。
工程热力学
河北理工大学
河北理工大学
工程热力学
六、比体积和密度
比体积(specific volume)
工程热力学
vV m
密度(density)
m
V
单位质量工质的体积 m3/kg 单位体积工质的质量 kg/m3
四、热力系示例
1.刚性绝热气缸-活塞系统,B侧设有电热丝
红线内 ——闭口绝热系统 黄线内不包含电热丝 ——闭口系统
黄线内包含电热丝 ——闭口绝热系统
兰线内 ——孤立系统
河北理工大学
工程热力学
工程热力学
1-3 工质的热力学状态和基本状态参数
一、热力学状态和状态参数
热力学状态(state of thermodynamic system) —热力变化过程中某一瞬间所呈现的宏观物理状况
5.功和功率的单位:
J 或 kJ J/s W kJ/s kW
附: 1kW h 3600kJ
河北理工大学
工程热力学
6.讨论 有用功(useful work)概念
工程热力学
Wu W Wl Wp
pb
f
其中:
W—膨胀功(compression/expansion work); Wl—摩擦耗功; Wp_排斥大气功。
力平衡(mechanical equilibrium): 在无外界作用的条件下,系统内部、系统与外界处处压力
相等。
热力平衡的充要条件 —系统同时达到热平衡和力平衡。
河北理工大学
三、纯物质的状态方程 (pure substance state equation)
工程热力学
状态方程 f p, v,T 0
2.均为过程量; 3.功传递由压力差推动,比体积变化是作功标志; 热量传递由温差推动,比熵变化是传热的标志;
工程热力学
4.功是物系间通过宏观运动发生相互作用传递的能量; 热是物系间通过紊乱的微粒运动发生相互作用而传递的
能量。
功
热是无条件的;
热
功是有条件、限度的。
河北理工大学
1-7 热力循环
工程热力学
1+2+3 绝热闭 口系统
1+2+3+4 孤立
3
系统
河北理工大学
三、系统状态相同的充分必要条件
系统两个状态相同的充要条件: 所有状态参数一一对应相等
简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
工程热力学Βιβλιοθήκη 河北理工大学工程热力学
四、温度和温标(temperature and temperature scale)
类
喷气发动机(jet power plant)
……
蒸气动力装置 (steam power plant)
共同本质:由媒介物通过吸热—膨胀作功—排热
河北理工大学
二、工质(working substance; working medium)
定义:实现热能和机械能相互转化的媒介物质。 对工质的要求:
工程热力学
可逆过程与准平衡过程的关系:可逆过 程必然是准平衡过程;准平衡过程只是
可逆过程的必要条件。
工程热力学
河北理工大学
作功过程
工程热力学
F
p
pb
f
pA F cos f pb A pA F cos f pb A
非准静态过程 (non-equilibrium process)
准静态过程,不可逆
温度的定义: 测温的基础—热力学第零定律
(zeroth law of thermodynamics) 热力学温标和国际摄氏温标 (thermodynamics scale; Kelvin
scale;absolute temperature scale and internal Celsius temperature scale)
p
p1 1
O
v1
河北理工大学
T
T2
2
p
p3 3
vO
s2
sO
T3
T
1-5 工质的状态变化过程
工程热力学
一、准平衡过程(准静态过程)(quasi-static process;
quasi-equilibrium process)
定义:若过程进行相对缓慢,工质在平衡
被破坏后自动回复平衡所需的时间(驰 豫时间)很短,工质有足够时间恢复平
一、定义:
封闭的热力过程
特性:一切状态参数恢复原值,即 dx 0
二、可逆循环与不可逆循环(reversible cycle and irreversible cycle )
河北理工大学
1-2 热力系统
一、定义
• 热力系统(thermodynamic system, system) 人为分割出来,作为热力学 研究对象的有限物质系统。
一、功(work)的定义和可逆过程的功
1.功的力学定义 2.功的热力学定义:通过边界传递的能量其全部
效果可表现为举起重物。 3.可逆过程功的计算
2
W 1 δW
2
2
1 pAdx 1 pdV
m
n
▲功是过程量
▲功可以用p-v图上过程线
与v轴包围的面积表示1-2-n-m-1
河北理工大学
4.功的符号约定: 系统对外作功为“+” 外界对系统作功为“-”
状态参数(state properties) —描述物系所处状态的宏观物理量
二、状态参数的特性和分类
1.状态参数是宏观量,是大量粒子的统计平均效 应,只有平
衡态才有状参,系统有多个状态参数,如 p,V ,T ,U , H , S
河北理工大学
热力系统
工程热力学
m 1 W 4
2
1 开口系统
1+2 闭口系统
逆向循环: 制冷系数(coefficient of performance for the refrigeration cycle)
供暖系数(coefficient of performance for the heat-pump cycle)
工程热力学
t
wnet q1
1
q2 or 1
p pb pv ( p pb ) p pb pe ( p pb )
河北理工大学
工程热力学
常用压力单位:
1Pa
1
N m2
1MPa 1106 Pa
1bar 1105 Pa
1atm 101325Pa 760mmHg
1mmHg 133.32Pa
1mmH2O 9.80665Pa
• 外界(surrounding ): 与体系发生质、能交换的物系。
• 边界(boundary): 系统与外界的分界面(线)。
