《化工原理》第13章 热质同时传递的过程
化工原理重要概念和公式

《化工原理》重要概念第八章气体吸收吸收的目的和基本依据吸收的目的是分离气体混合物,吸收的基本依据是混合物中各组份在溶剂中的溶解度不同。
主要操作费溶剂再生费用,溶剂损失费用。
解吸方法升温、减压、吹气。
选择吸收溶剂的主要依据溶解度大,选择性高,再生方便,蒸汽压低损失小。
相平衡常数及影响因素m 、 E 、 H 均随温度上升而增大, E 、 H 与总压无关, m 反比于总压。
漂流因子P/P Bm 表示了主体流动对传质的贡献。
( 气、液 ) 扩散系数的影响因素气体扩散系数与温度、压力有关;液体扩散系数与温度、粘度有关。
传质机理分子扩散、对流传质。
气液相际物质传递步骤气相对流,相界面溶解,液相对流。
有效膜理论与溶质渗透理论的结果差别有效膜理论获得的结果为k ∝ D ,溶质渗透理论考虑到微元传质的非定态性,获得的结果为k ∝ D 0.5 。
传质速率方程式传质速率为浓度差推动力与传质系数的乘积。
因工程上浓度有多种表达,推动力也就有多种形式,传质系数也有多种形式,使用时注意一一对应。
传质阻力控制传质总阻力可分为两部分,气相阻力和液相阻力。
当 mky<<kx 时,为气相阻力控制;当 mky>>kx 时,为液相阻力控制。
低浓度气体吸收特点① G 、 L 为常量,② 等温过程,③ 传质系数沿塔高不变。
建立操作线方程的依据塔段的物料衡算。
返混少量流体自身由下游返回至上游的现象。
最小液气比完成指定分离任务所需塔高为无穷大时的液气比。
NOG 的计算方法对数平均推动力法,吸收因数法,数值积分法。
第九章液体精馏蒸馏的目的及基本依据蒸馏的目的是分离液体混合物,它的基本依据 ( 原理 ) 是液体中各组分挥发度的不同。
主要操作费用塔釜的加热和塔顶的冷却。
双组份汽液平衡自由度自由度为 2(P 一定, t ~ x 或 y ; t 一定, P ~ x 或 y) ; P 一定后,自由度为 1 。
泡点泡点指液相混合物加热至出现第一个汽泡时的温度。
第13章热,质同时传递的过程
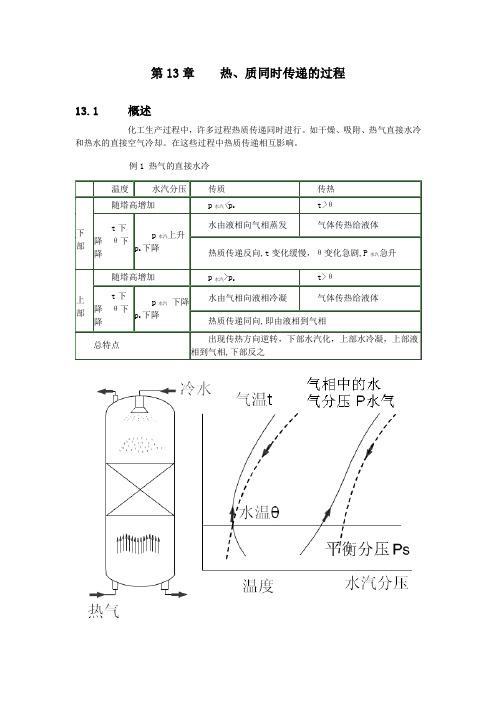
第13章热、质同时传递的过程13.1 概述化工生产过程中,许多过程热质传递同时进行。
如干燥、吸附、热气直接水冷和热水的直接空气冷却。
在这些过程中热质传递相互影响。
例1 热气的直接水冷例2 热水的直接空气冷却13.2 气液直接接触时的传质和传热1 过程的分析⑴过程方向的判据从上一节例子讨论可看到:温差决定传热方向,即热量总从高温传向低温;压差决定传质,即物质总从高分压相传向低分压相,且气体中的水气分压最大值为同温下水的饱和蒸汽压p s。
当p水汽=p s时,传质达到极限,此时的空气称为饱和湿空气.⑵传递方向逆转的原因在上节图中可看到,当t=θ时;即传热达到瞬时平衡时,未饱和气体中p水汽<p s,此时必发生传质,水由液相到气相传质,即水汽化,这使θ下降,t>θ,传热由气相到液相,传递方向就发生逆转。
同理,p水汽=p s即传质瞬时达到平衡时,不饱和气体t>θ,传热由气相到液相,θ上升,p s也增大,p水汽<p s,这时传质由液相到气相,即汽化,也发生传递方向逆转.由此可见,一过程的继续进行必打破另一过程的瞬时平衡,从而使传递方向逆转。
2过程的速率⑴传热速率假设:①气液相界面温度θi高于气相温度t②由于水气直接接触时液相侧给热系数α远大于气相,所以气液相界面温度与液相主体温度相等,即θ=θi。
传热速率: q=α(θ-t) kw/m2 13-1⑵传质速率以水汽分压差为推动力表示当液相平衡分压p s高于气相中水汽分压p水汽时 ,传质速率:N A=k g(p s-p水汽) kmol/(s·m2) 13-2k g气相传质系数 kmol/(m2·s·kPa)②以气体湿度差为推动力表示a:湿度H的定义:单位质量干气中带有的水汽量 kg水汽/kg干气b:H与p水汽的关系为: H= 13-3p为气相总压kPaM水,M气为水与气体的摩尔质量对水与空气系统 H=0.622 13-4饱和湿度 H s=0.622 13-5c:传质速率:N A=k H(H s-H) 13-6k H以湿度表示的气相传质系数 kg/(s·m2)3 、过程的极限热质同时传递时,过程的极限与单一传递过程不同,可区分为两种情况:⑴大量气体与少量液体接触过程的极限液相状态固定不变,气相状态变化。
传热操作技术—认识传热过程(化工原理课件)

2.1 认识传热过程
系统内温度的差异使热量从高温向低温转移的过程称之为热 量传递过程,简称传热过程。传热的推动力是温度差;传热的方 向是高温向低温;
化工生产中对传热过程的要求一是强化传热过程,如各种换 热设备中的传热。二是削弱传热过程,如对设备或管道的保温, 以减少热损失。
一、传热过程在化工生产中的应用
间壁式换热器
适用于冷热 流体不允许 混合的情况
三. 常用的加热剂与冷却剂 化工生产中的换热目的主要有两种:一是将工艺流体加热
(汽化),二是将工艺流体冷却(冷凝)。为了将冷流体加热或热 流体冷却,必须用另一种流体供给或取走热量,此流体称为热 载体。起加热作用的热载体称为加热剂;而起冷却作用的热载 体称为冷却剂。
,应用最为普遍。在水资源较缺乏的地区,宜采用空气 冷却,但空气传热速度慢。
此外,为了得到更低的冷却温度或更好的冷却效果 ,还可借助于制冷技术,使用沸点更低的制冷剂,如液 氨等。
3. 选择原则 加热剂或冷却剂的选择应以本着能量综合利用的原
则来进行,即应尽可能选用工艺上要求冷却降温的高温 流体作加热剂,选用工艺上要求加热升温的低温流体作 冷却剂。以达到降低生产成本、提高经济效益的目的。 当生产系统中无可利用为加热剂或冷却剂的流体时,一 般以水蒸气为加热剂,以空气、水为冷却剂。
对原料和产品进行加热及冷却: 3
回收余热、废热,充分利用能量: 4
对设备及管线进行保温(保冷),减少热量损失:
5
综上所述,传热,即热量传递,它在化工生产过程中的应 用主要有以下几个方面。
1. 为化学反应创造必要的条件。 2. 为单元操作创造必要的条件。 3. 热能的合理利用和余热的回收。 4. 隔热与节能
根据生产任务的需要,结合生产实际,采用的加热剂与冷 却剂种类较多。
化工原理第十三章干燥

第十三章 干燥 Drying
13.2.1 湿空气的性质
13.2.2 湿度图及其应用
第二节 湿空气的性质和湿度图
2024/2/8
13.2.1 湿空气的性质
1、湿含量H( humidity)
单位质量干空气中所含水汽的质量 ,又称湿含量。
湿空气中水汽的质量 H 湿空气中绝干空气的质量
气中汽化
温增湿
焓 不 变
tas
饱和
一般情况下,绝热增湿过程可看视为等焓过程,即 空气释放的显热与水分汽化带回的潜热相等:
cH (t tas ) (Has H )ras
Has H cH 1.011.88H
tas t
ras
ras
Has、ras是tas的函数,cH是H的函数
2024/2/8
不饱和空气:t tas(t ) td
饱和空气: t tas (t ) td
2024/2/8
13.2.2 湿度图及其应用
1、H-t图
•F=2-1+2=3,总压P一定,则F=2.
•6条线
-等t线 –等H线 –等相对湿度线 –等CH线 –VH线 – tas线
2024/2/8
2、湿度图的应用
1)由测出的参数确定湿空气的状态 a)水与空气系统,已知空气的干球温度t和湿球温度tw,确 定该空气的状态点A(t,H)。 b)水与空气系统中,已知t和td,求原始状态点A(t,H)。 c)水与空气系统中,已知t和φ,求原始状态点A的位置 2)已知湿空气某两个可确定状态的独立变量,求该湿空气 的其他参数和性质
tM1)
qL
cwtM1
物料升温所需热量
2024/2/8
l
(I2
陈敏恒《化工原理》(第3版)课后习题(含考研真题)(热、质同时传递的过程 课后习题详解)

13.2 课后习题详解(一)习题过程的方向和极限13-1 温度为30℃、水汽分压为2kPa的湿空气吹过如表13-1所示三种状态的水的表面时,试用箭头表示传热和传质的方向。
表13-1解:已知:t=30℃,P=2kPa,与三种状态水接触。
求:传热、传质方向(用箭头表示)查水的饱和蒸汽压以Δt为传热条件,为传质条件,得:表13-213-2 在常压下一无限高的填料塔中,空气与水逆流接触。
入塔空气的温度为25℃、湿球温度为20℃。
水的入塔温度为40℃。
试求:气、液相下列情况时被加工的极限。
(1)大量空气,少量水在塔底被加工的极限温度;(2)大量水,少量空气在塔顶被加工的极限温度和湿度。
解:已知:P=101.3kPa,,逆流接触。
求:(1)大量空气,少量水,(2)大量水,少量空气,(1)大量空气处理少量水的极限温度为空气的湿球温度(2)大量水处理少量空气的极限温度为水的温度且湿度为查40℃下,过程的计算13-3 总压力为320kPa的含水湿氢气干球温度t=30℃,湿球温度为t w=24℃。
求湿氢气的湿度H(kg水/kg干氢气)。
已知氢-水系统的α/k H≈17.4kJ/(kg·℃)。
解:已知:P=320kPa,t=30℃,氢水-水系统,求:H(kg水/kg干氢气)查得24℃下,13-4 常压下气温30℃、湿球温度28℃的湿空气在淋水室中与大量冷水充分接触后,被冷却成10℃的饱和空气,试求:(1)每千克干气中的水分减少了多少?(2)若将离开淋水室的气体再加热至30℃,此时空气的湿球温度是多少?图13-1解:已知:P=101.3 kPa,求:(1)析出的水分W(kg水/kg干气)(1)查水的饱和蒸汽压(2)设查得与所设基本相符,13-5 在t1=60℃,H1=0.02kg/kg的常压空气中喷水增湿,每千克的干空气的喷水量为0.006kg,这些水在气流中全部汽化。
若不计喷入的水本身所具有的热焓,求增湿后的气体状态(温度t2和湿度H2)。
《化工原理传热》课件

导热问题的数学描述
导热问题的数学描述通常使 用偏微分方程,如热传导方 程。
解这些方程可以得到导热过 程中的温度分布、热流量等 参数。
通过建立数学模型,可以描 述导热过程中温度随时间和 空间的变化规律。
在实际应用中,还需要考虑 其他因素如边界条件、初始 条件等。
03
对流换热
对流换热基本概念
01
02
04
辐射换热
辐射换热基本概念
定义
01
物体通过电磁波传递能量的过程称为辐射换热。
辐射换热与物质属性
02
物体的辐射换热能力与其发射率、吸收率、反射率和透射率有
关。
辐射换热与温度
03
物体的辐射换热能力随温度升高而增强。
辐射换热计算方法
斯蒂芬-玻尔兹曼定律
描述了物体在绝对黑体条件下辐射换热的规律。
发射率修正
02
它主要通过物质分子、原子或分子的振动和相互碰 撞进行热量传递。
03
热传导是三种基本传热方式之一,另外两种是热对 流和热辐射。
傅里叶定律
傅里叶定律是热传导的基本定 律,它描述了热传导速率与温
度梯度之间的线性关系。
公式为:q = -k * grad(T), 其中q为热流密度,k为导热 系数,grad(T)为温度梯度。
传热方式
01
02
总结词:传热主要有三 种方式:热传导、热对 流和热辐射。
详细描述
03
04
05
1. 热传导是指热量在物 质内部通过分子、原子 等微观粒子的运动传递 热量。不同物质导热能 力不同,金属是良好的 导热体。
2. 热对流是指由于物质 宏观运动引起的热量传 递过程,如气体、液体 等流动过程中热量的传 递。对流换热在化工、 能源、动力等领域有广 泛应用。
热质同时传递的过程

水汽
p p水汽
7
2019/3/2
气膜 气体 t, H
对流传热 q
h
液滴 kH 对流传质 N
液滴 表面 tw , Hw
2019/3/2
8
气相向液相的传热速率与液相向气相传质 时带走潜热的速率相等:
(t tw ) kH (H w H ) w
tw决定于三方面: 1.物系性质 2.气相状态 3.流动条件
第13章 热、质同时传递的过程
主讲:李梅
2019/3/2
1
13.1 概述
热质同时传递的分类: 1.以传热为目的,伴有传质的过程:如热气 体的直接水冷,热水的直接空气冷却等; 2.以传质为目的,伴有传热的过程:如空气 调节中的增湿和减湿等。
2019/3/2
2
一、热气体的直接水冷
1、塔下部:气温高于液温,气 体传热给液体。同时,气相中 的水汽分压低于液相的水汽分 压,水由液相向气相蒸发。特 点:热、质反向传递,液相温 度变化和缓;气相温度变化急 剧,水汽分压自下而上急剧上 升,但气体的热焓变化较小; 2、塔上部:气温高于液温,气 体传热给液体。特点:热、质 同时进行,水温急剧变化。
四、设计型计算的命题 设计任务:将一定流量的热水从入口温度冷 却至指定温度; 设计条件:可供使用的空气状态,即进口空 气的温度与湿度; 计算目的:选择适当的空气流量,确定经济 上合理的塔高及其它有关尺寸。 五、计算方法 逐段计算法和以焓差为推动力的近似计算法。
2019/3/2 19
2019/3/2 16
三、热量衡算微分方程 对微元塔段作热量衡算: VdI=c pl(Ldθ+θdL) 其中I为湿空气的焓:1千克干气体的焓及其 所带H千克水汽的焓之和。 通常,干气体的焓以0℃的气体为计算基准, 水汽的焓以0℃的水为基准。所以,温度t、 湿度H的湿气体的焓: I=c pgt+c pvHt+r 0H
化工原理实验思考题答案[1]
![化工原理实验思考题答案[1]](https://img.taocdn.com/s3/m/7543d4bd51e79b896802265c.png)
实验5 精馏塔的操作和塔效率的测定⑴ 在求理论板数时,本实验为何用图解法,而不用逐板计算法?答:相对挥发度未知,而两相的平衡组成已知。
⑵ 求解q 线方程时,C p ,m ,γm 需用何温度? 答:需用定性温度求解,即:2)(b F t t t +=⑶ 在实验过程中,发生瀑沸的原因是什么?如何防止溶液瀑沸?如何处理?答;① 初始加热速度过快,出现过冷液体和过热液体交汇,釜内料液受热不均匀② 在开始阶段要缓慢加热,直到料液沸腾,再缓慢加大加热电压。
③ 出现瀑沸后,先关闭加热电压,让料液回到釜内,续满所需料液,在重新开始加热。
⑷ 取样分析时,应注意什么?答:取样时,塔顶、塔底同步进行。
分析时,要先分析塔顶,后分析塔底,避免塔顶乙醇大量挥发,带来偶然误差。
⑸ 写出本实验开始时的操作步骤。
答:①预热开始后,要及时开启塔顶冷凝器的冷却水,冷却水量要足够大。
②记下室温值,接上电源,按下装置上总电压开关,开始加热。
③缓慢加热,开始升温电压约为40~50伏,加热至釜内料液沸腾,此后每隔5~10min 升电压5V 左右,待每块塔板上均建立液层后,转入正常操作。
当塔身出现壁流或塔顶冷凝器出现第一滴液滴时,开启塔身保温电压,开至150 V ,整个实验过程保持保温电压不变。
④等各块塔板上鼓泡均匀,保持加热电压不变,在全回流情况下稳定操作20min 左右,用注射器在塔顶,塔底同时取样,分别取两到三次样,分析结果。
⑹ 实验过程中,如何判断操作已经稳定,可以取样分析?答:判断操作稳定的条件是:塔顶温度恒定。
温度恒定,则塔顶组成恒定。
⑺ 分析样品时,进料、塔顶、塔底的折光率由高到底如何排列?答:折光率由高到底的顺序是:塔底,进料,塔顶。
⑻ 在操作过程中,如果塔釜分析时取不到样品,是何原因?答:可能的原因是:釜内料液高度不够,没有对取样口形成液封。
⑼ 若分析塔顶馏出液时,折光率持续下降,试分析原因?答:可能的原因是:塔顶没有产品馏出,造成全回流操作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
⑴传热,伴有传质 如热水直接空气冷却
⑵传质,伴有传热 如气体增减湿
②原理:温度差、分压差(判据没变) ③实施方法:气液直接接触 ④操作费用:热量(汽化、冷凝)
输送机械能
工业实例: 热气体直接水冷
工业实例: 凉水塔
冷却塔外观
冷却塔 下部
凉水塔外观
0.622
0.5 2.27 101.3 0.5 2.27
=0.007水/kg干气
② p水=0.5×2.27=1.14 kPa
由φ1=100 %,查表得t1=9℃
③查tW=25℃, rW=2441kJ/kg, pW=3.186 kPa
(t0 tW ) kH rW ( HW H0 )
H0
HW
,
tas≈tW
湿球温度的物理含义是什么? 绝热饱和温度的物理含义是什么? 两者有什么异同点? 焓-湿图(238页,总压一定,两个独立变量) 注意:td, p水汽, H 相互不独立
例:已知:100kPa, t=50℃, p水汽=4kPa
求: , H , I , td (查表50℃,pS=12.4kPa)
c.流动条件:α, kH 空气-水系统,流动时
1.09 kJ/kgK
kH
⑵绝热饱和温度
气体在绝热条件下,
增湿至饱和(等焓过程)
Vc pH (t tas ) V ( Has H )ras
气温下降放热 气体增湿带热
路易ta斯s 规t 则 cr:paHs 空(H气as -水H系) 统:
kH
c pH
凉水塔风机
凉水塔外观
凉水塔图纸
凉水塔风机
凉水塔图纸
⑤过程新特点: ⑴传热方向或传质方向可能发生逆转 ⑵极限不一定是θ=t, p水汽=pe
传递方向会逆转的原因: 气相双组分,有两个独立变量 t, p水汽 液相单组分,只有一个独立变量 pe=f(θ)
传热传质相互牵制, 一个过程的继续可打破另一过程的平衡 条件:大量气体,少量液体
⑶两股气流的混合
本次讲课习题: 第十三章 1,2,3,4
露点温度: 返回
例2 常压下,现需调节气温及湿度,新鲜空气经 喷水室与水充分接触,被冷却后排去冷凝水,再 经加热器升温至所需温度。试求:
⑴ H1 ⑵ t1 ⑶ 整个过程前后湿度变化 设离开喷水室的气、液温度相同
解:①H1=H2,出喷水室φ1=100%
先算H2,查20℃,pS=2.27kPa
H1
H2
0.622
pS p pS
则t1, H1与t, H之间视为等焓, I=I1
(1.01+1.88H)t+2500H=(1.01+1.88H1)t1+2500H1
H1
(1.01
1.88H )t 2500H 1.88t1 2500
1.01t1
或
t1
(1.01
1.88H 1.01
)t 2500(H 1.88H1
H1
)
达到气相中水分饱和时,则
计算: p水汽 4 32.3%
pS 12.4
H
0.622
p
p水汽 p水汽
0.622
4 100
4
=0.026kg水/kg干气
I (1.01 1.88H )t 2500H =118kJ/kg干气
查表p水汽=4kPa的饱和温度29℃
td=29℃
查图
查图 例:已知: td=20℃, φ=30% 查:H, t, p, I
kH rW
(t0
tW
)
0.622
pW p pW
1.09 rW
(t
0
tW ) 0.0178kg水/kg干气
H H2 H0 0.007 0.0178 0.0108kg水 / kg干气
3 焓湿图中表示过程变化 ⑴加热与冷却的过程
⑵绝热增湿过程(等焓过程)
∵Cpθ<<r
∴ΔI<<I, 可忽略ΔI
Vc pH (t tas ) V ( Has H )ras
tas
t
ras c pH
( H as
H)
查等焓线至φ=100%
查:t=80℃, H=0.03 kg水/kg干气 等焓增湿至55℃, H1=? 此空气的tas=?
路易斯规则:空气-水系统 tW≈tas 查:tW=30℃, t=45℃, H=?
I (1.01 1.88H )t 2500H
⑤湿空气的比容 vH m3/kg干气
常压下,
vH
(22.4 22.4 H ) t 273
M气 M水
273
⑥极限温度
⑴湿球温度tW
A (t tW ) AkH ( HW tW
t
kH
(HW
H )rW
tW的影响因素: a.物性,b.气体状态: t, p水汽(或H), 总压p
2 湿空气状态的描述 ①水汽分压p水汽或露点温度td (录像)
②湿度 H kg水汽/kg干气
H M水 p水汽 0.622 p水汽
M气 p p水汽
p p水汽
③相对湿度φ p水汽
pS
p水汽
p
(当pS≤p) pS为t温度下的饱和蒸汽压 (当pS≥p)
④湿空气的焓 I kJ/kg干气
I (c pg c pV H )t r0 H
