2013-第三章--配合物的化学键理论解析
合集下载
第三章配合物的化学键理论

• 计算分裂能的经验公式
Jø rgensen公式: = f· g
f:配体因子 g:中心金属离子因子
2-4 电子成对能(P)与配合物自旋状态
问题:正八面体场Fe3+ (d5)中的电子如何排布呢?
Paulli原理 需要满足三个条件: 能量最低原理
Hund规则
eg
o
eg
o
t2g
低自旋 高自旋
低自旋配合物的晶体场稳定化能
•配合物的热力学性质 离子的水合热(-H):
Mn+(g) + xH2O = [M(H2O)6]n+ (aq) + (-H)
水 合 能
Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
100
离子半径
由于随核电荷增 加,d电子也增加, 但d电子不能将增加 的核电荷完全屏蔽, 单从这个因素考虑应 单调下降。
dyz , dxz dxy, dyz , dxz
dxy
2
dxy dyz , dxz
Z轴缩短的 正八面体场 Oh 八面体(D4h)
Z轴拉长的 八面体(D4h)
dx2-y2 dz2, dx2-y2
d
dz2 dxy dxy , dyz , dxz
dyz , dxz 拉长八面体场中Cu2+ (d9)的电子排布
如[Fe(H2O)6]2+/3+,[FeX6]3-等
③ P: 自旋交叉
㈡ 晶体场理论对配合物高低自旋状态的预测
•[Fe(CN)6]4-: = 33000 cm-1, P = 17600 cm-1
>P,t2g6,低自旋 ( = 0)
•[Fe(H2O)6]2+: = 10400 cm-1, P = 17600 cm-1 <P,t2g4eg2,高自旋 ( = 4.9 B.M.)
配合物的化学键理论

杂化
轨道 sp3d2 d2sp3
sp3
dsp2
配键 类型 外轨型 内轨型
外轨型
内轨型
Kf 1014
稳定性
<
1042
107. 96
1031. 3
<
磁性
Ni2+的d电子构型 杂化轨道 配键类型
未成对电子数 磁性
[Ni(NH3)4]2+ [Ni(CN)4]2 d8
sp3 外轨型
dsp2 内轨型
2 顺磁性
弱场配体
强场配体
——以上称为光谱化学序列
4. 电子成对能和配合物高、低自旋
电子在分裂后轨道上的分布遵循: 能量最低原理和洪特规则
如 Cr3+ d3
eg
E t2g
八面体场
d4d7构型的离子, d电子分布有高、低自旋两种方式。
如 Cr2+ d4
[Cr(H2O)6]2+
eg
△o t2g
[Cr(CN)6]4-
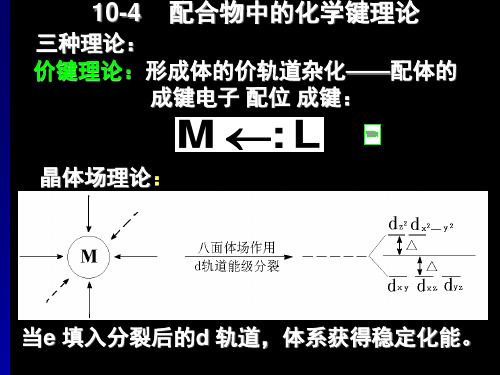
中心离子和配体之间以静电引力相互作用而形 成化学键。
中心离子的5个能量相同的d轨道受配体负电场 的排斥作用,发生能级分裂(有的轨道能量升 高,有的能量降低)。
2. 正八面体场中d轨道的能级分裂
无外电场作用下的d轨道 Edxy= Edxz= Edyz= Edx2-y2= Edz2
在带负电荷均匀球形场的作用下,d轨道能量 均升高相同值,能级不发生分裂。
请问: [Zn(NH3)4]2+、 [Ag(NH3)2]+呈现什么颜色?
中心离子d 轨道全空(d0)或全满(d10), 不能发生 d-d跃迁,其水合离子为无色。
解释配合物的稳定性
Eeg=+0.
配合物化学键理论

强场:o > P 弱场:o < P
d5 型
强场o > P
弱场o < P
(4) 影响CFSE的因素 ① d电子数目; ② 配位体的强弱; ③ 晶体场的类型
表1 过渡金属络离子的稳定化能(CFSE)
弱场CFSE/Dq
dn d0 离子 Ca2+,Sc3+ 正方型 0 正八面体 0 正四面 体 0 正方型 0
中心离子用外层(n-1)d,ns,np杂化轨道与电负性 较小的配位原子,如CN-、NO2-等形成内轨型配合 物。例如[Fe(CN)6]3-配离子,Fe采用d2sp3内轨型 杂化轨道,配合物的键能大,稳定,在水中不易 离解。
(3)内、外轨型配合物的测定---磁矩
由磁矩可判断内轨或外轨型配合物
s n—分子中未成对电子数
z
y
x
x
dz2
y z
dx2-y2
z
x
x
y
dxy
dxz
dyz
1.分裂能 (1)分裂能与配合物几何构型的关系
八面体型的配合物
在八面体型的配合物中,6个配位体分别占据八 面体的6个顶点,由此产生的静电场叫做八面体场。
(1)八面体场
八面体场中d轨道能级分裂
dz2 dx2-y2 eg 3 5 Δo =6Dq Δ o =10Dq 2 5 Δ o = 4Dq t2g dxy dxz dyz
[CrCl6]313600
[MoCl6]319200
分裂能与配位体的关系:光谱化学序列
[CoF6]3- [Co(H2O)6]3+ [Co(NH3)6]3+ o/cm-1 13000 18600 22900 [Co(CN)6]334000
配合物中的化学键理论
7
3-
3-
3、 外轨型配合物和内轨型配合物 外轨型配合物: ①、外轨型配合物:
A、定义:指形成配合物时,中心离子全部采用 定义:指形成配合物时, 外层空轨道( nd)进行杂化, 外层空轨道(ns, np, nd)进行杂化,并与配体结 合而形成的配合物。 合而形成的配合物。
B、特点: 特点:
a 、 中心离子仅采用外层空轨道 ( ns, np, nd) 中心离子仅采用外层空轨道( nd) 进行杂化成键。 进行杂化成键。 b、杂化类型为:sp3和sp3d2杂化。 杂化类型为: 杂化。 c、配合物有较多的未成对电子。 配合物有较多的未成对电子。
4d
d2sp3
返回6 返回6
26
16
④、成键过程: 成键过程:
17
[Ag(NH3)2]+的形成过程 Ag+的价电子构型为 解:Ag+的价电子构型为 4d10 5s0
5p 5s 4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
SP杂化 杂化 5p
4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
sp
:NH3 :NH3
↑↓ ↑↓ ↑↓
5p
2NH3
↑↓ ↑↓
4d
↑↓ ↑↓
3
2、 配离子的空间构型 ①、配位数为2的配离子 配位数为2 中心离子sp杂化 空间构型为直线型。 杂化, 中心离子sp杂化,空间构型为直线型。 [Ag(CN)2]-等。 如 例: 配位数为4 ②、配位数为4的配离子 有两种成键方式 A、以sp3杂化轨道成键 : 中心离子sp 杂化, 中心离子sp3杂化,配离子的空间构型为 四面体。 正 四面体。 如: [Zn(NH3)4]2+、[HgI4]2-等。 例:
见例5 例:(见例5、例7、)
3-
3-
3、 外轨型配合物和内轨型配合物 外轨型配合物: ①、外轨型配合物:
A、定义:指形成配合物时,中心离子全部采用 定义:指形成配合物时, 外层空轨道( nd)进行杂化, 外层空轨道(ns, np, nd)进行杂化,并与配体结 合而形成的配合物。 合而形成的配合物。
B、特点: 特点:
a 、 中心离子仅采用外层空轨道 ( ns, np, nd) 中心离子仅采用外层空轨道( nd) 进行杂化成键。 进行杂化成键。 b、杂化类型为:sp3和sp3d2杂化。 杂化类型为: 杂化。 c、配合物有较多的未成对电子。 配合物有较多的未成对电子。
4d
d2sp3
返回6 返回6
26
16
④、成键过程: 成键过程:
17
[Ag(NH3)2]+的形成过程 Ag+的价电子构型为 解:Ag+的价电子构型为 4d10 5s0
5p 5s 4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
SP杂化 杂化 5p
4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
sp
:NH3 :NH3
↑↓ ↑↓ ↑↓
5p
2NH3
↑↓ ↑↓
4d
↑↓ ↑↓
3
2、 配离子的空间构型 ①、配位数为2的配离子 配位数为2 中心离子sp杂化 空间构型为直线型。 杂化, 中心离子sp杂化,空间构型为直线型。 [Ag(CN)2]-等。 如 例: 配位数为4 ②、配位数为4的配离子 有两种成键方式 A、以sp3杂化轨道成键 : 中心离子sp 杂化, 中心离子sp3杂化,配离子的空间构型为 四面体。 正 四面体。 如: [Zn(NH3)4]2+、[HgI4]2-等。 例:
见例5 例:(见例5、例7、)
配合物的化学键理论

配体场理论
配位场理论是晶体场理论的发展,分别 取其晶体场理论和分子轨道理论的优点 结合而成。对中心离子与配体静电作用 部分用晶体场理论来处理,而共价作用 部分用分子轨道理论来处理。
遵循成键三原则:能量近似、最大重叠 和对称性匹配原则。
在理论上比晶体场理论等方法更为严谨, 所得的结果常用来补充晶体场理论的不 足。
一.判断配合物的空间构型 二.判断配合物的成键类型 三.判断配合物的磁性 四.价键理论的特殊应用
(一) 判断配合物的空间构型
杂化类型决定配离子的空间构型;杂化轨道数 等于中心原子的配位数。
价键理论顺利地解释了配合物的分子构型:
配位数
2
3
4
杂化轨道
sp
sp2
sp3
4 dsp2
分子构型 直线 三角形 正四面体 正方形
配位数
5
杂化轨道 sp3d d2sp2,
分子构型 三角双锥
5 d4s 四方锥
6 sp3d2, d2 正八面体
➢ 2配位的配合物 [Ag(NH3)2]+
Ag+(d10)的电子结构:
4d
5s
5p
[Ag(NH3)2]+的结构 4d :
sp杂化 5p
H3N NH3
结果: [Ag(NH3)2]+形成前后, 中心原子的d电子
单击此处添加标题
第4讲 配合物的化学键理论
单击此处添加标题
配合物的化学键理论,主要研究中心原子和 配体之间结合力的本性;
并用来说明配合物的物理和化学性质:如配 位数、几何构型、磁学性质、光学性质、热 力学稳定性、动力学反应性等。
单击此处添加标题
静电理论 体场理论
分子轨道理论
第三章配合物的化学键理论

2
思考题2
利用光谱化学序列和磁矩数据确定下列配合 物的配体哪些是强场配体,哪些是弱场配体? 并确定d电子的排布及未成对电子数。
[Co(NO2)6]3- = 0 B.M. [Fe(NH3)6]2+ = 5.2 B.M.
[Fe(CN)6]3[FeF6]3-
2019/11/1
3
思考题3
已知Co3+的p=17800cm-1,Co3+与下列配体
L
t*2g
eg* 10Dq
t2g
t2g
t2g 由p轨道构成
F-
Mn+
M t2*g
eg*由*轨t2道g 构成
t2g CO
2019/11/1
40
形成p-d键,使得分裂能减小 形成d - *反馈键,使得分裂能增大
2019/11/1
41
三种理论比较
价键理论:中心原子采取杂化轨道与配体形成配位 键。对于说明比较简单的分子的结构和反应性是有 用的,但是往往不适用于说明非经典配合物
9
思考题1
已知: [Co(H2O)6]2+ = 4.3 B.M. [Co(EDTA)]- = 0 B.M.
指出分子构型、中心离子的价层电子排布和杂化方式
2019/11/1
10
价键理论的优缺点
很好地解释了配合物的空间构型、磁性,直 观明了
无法解释配合物的颜色(吸收光谱) 无法解释配合物的稳定性随Mn+的d电子数目
( 1
4)
1 2
( 2
5)
1 2
( 3
6)
eg,e*g t1u,t*1u
配合物的化学键理论(讲义)
在不同场中的分裂情况:正方形>八面体>四面体
四面体场
八面体场
四方形场
分裂能与中心离子的关系电荷Z增大,增大;主量子数n 增大, o增大,3d < 4d < 5d。 例如:
[Cr(H2O)6]3+ o /cm-1 o /cm-1 o /cm-1 17600 [Fe(H2O)6]3+ 13700 [Cr(H2O)6]2+ 14000 [Fe(H2O)6]2+ 10400
[CrCl6]313600
[MoCl6]319200
分裂能与配位体的关系:光谱化学序列
[CoF6]3- [Co(H2O)6]3+ [Co(NH3)6]3+ o/cm-1 13000 18600 22900 [Co(CN)6]334000
各种配体对同一中心离子的晶体场分裂能的值由小到大的 顺序:
4.价键理论的局限性 配离子的杂化轨道类型,说明了配离子的空间构型和 配位数,以及配合物之间稳定性的差异。 (1)可以解释[Co(CN)6]4- 易被氧化[Co(CN)6]3- 但无法 解释[Cu(NH3)4]2+结构稳定的事实。 (2)对配合物产生高低自旋的解释过于牵强。 (3)无法解释配离子的稳定性与中心离子电子构型之 间的关系,未考虑配体对中心离子的影响。
二、 晶体场理论
晶体场理论要点: 在配合物中,中心离子M处于带电的配位体L形 成的静电场中,二者完全靠静电作用结合在一起。 配位体对中心离子的影响 (a)中心离子M与配位体L成键时,配体的静电 场对中心离子的d 轨道电子的不同排 斥作用力, 使d 轨道能级发生了分裂。
(b)过渡金属的中心离子的5个d轨道在假想的球形 场(均匀电场) 中能量是简并的, 受到配位体负电 场作用时,会发生d 轨道的能级分裂。 晶体场理论的核心是配位体的静电场与中心离子 的作用引起的d轨道的分裂和d电子进入低能轨 道时所产生的稳定化能。 分裂类型与空间构型有关。
配合物中的化学键理论
16
④、成键过程:
17
[Ag(NH3)2]+的形成过程 解:Ag+的价电子构型为 4d10 5s0
5p 5s 4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
SP杂化 5p
4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
sp
:NH3 :NH3
↑↓ ↑↓ ↑↓
5p
2NH3
4d
↑↓ ↑↓ ↑↓ ↑↓
重叠
返回3
18
例:
[Ni(NH3)4]2+的形成 。
↑ ↑
3d
↑ ↑ ↑
4d
SP 3d2 杂化
3d
↑ ↑ ↑ ↑ ↑
sp3d2
23
6F重叠
4d
:F- :F- :F- :F- :F- ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑ ↑
3d
↑ ↑ ↑
:F- ↑↓
sp3d2
返回5
24
例: [Fe(CN)6]3-的形成。 解:Fe3+ 的价电子构型为
4S 3d
↑ ↑ ↑ ↑ ↑
③规律:中心离子 SP3d2 与d2SP 3 杂化, 配离子的空间构型均为正八面体形。
7
3-
3-
3、 外轨型配合物和内轨型配合物 ①、外轨型配合物:
A、定义:指形成配合物时,中心离子全部采用 外层空轨道(ns, np, nd)进行杂化,并与配体结 合而形成的配合物。
B、特点:
a、中心离子仅采用外层空轨道(ns, np, nd) 进行杂化成键。 b、杂化类型为:sp3和sp3d2杂化。 c、配合物有较多的未成对电子。
4
B、以dsp2杂化轨道成键:
例:
成键结果分析比较: 2+ 2①Ni(NH3)4 ②Ni(CN)4 M 用以杂 4s 4p (4-1)d 4s 4s 化的轨道: ns np (n-1)d ns np 杂化特点:全部用外层轨道 使用内层轨道和 外层轨道 成键类型: 外轨配键 内轨配键 配合物的类型: 外轨型 内轨型 成单电子状态: 高自旋 低自旋 空间构型 正四面体 平面正方形
④、成键过程:
17
[Ag(NH3)2]+的形成过程 解:Ag+的价电子构型为 4d10 5s0
5p 5s 4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
SP杂化 5p
4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
sp
:NH3 :NH3
↑↓ ↑↓ ↑↓
5p
2NH3
4d
↑↓ ↑↓ ↑↓ ↑↓
重叠
返回3
18
例:
[Ni(NH3)4]2+的形成 。
↑ ↑
3d
↑ ↑ ↑
4d
SP 3d2 杂化
3d
↑ ↑ ↑ ↑ ↑
sp3d2
23
6F重叠
4d
:F- :F- :F- :F- :F- ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑ ↑
3d
↑ ↑ ↑
:F- ↑↓
sp3d2
返回5
24
例: [Fe(CN)6]3-的形成。 解:Fe3+ 的价电子构型为
4S 3d
↑ ↑ ↑ ↑ ↑
③规律:中心离子 SP3d2 与d2SP 3 杂化, 配离子的空间构型均为正八面体形。
7
3-
3-
3、 外轨型配合物和内轨型配合物 ①、外轨型配合物:
A、定义:指形成配合物时,中心离子全部采用 外层空轨道(ns, np, nd)进行杂化,并与配体结 合而形成的配合物。
B、特点:
a、中心离子仅采用外层空轨道(ns, np, nd) 进行杂化成键。 b、杂化类型为:sp3和sp3d2杂化。 c、配合物有较多的未成对电子。
4
B、以dsp2杂化轨道成键:
例:
成键结果分析比较: 2+ 2①Ni(NH3)4 ②Ni(CN)4 M 用以杂 4s 4p (4-1)d 4s 4s 化的轨道: ns np (n-1)d ns np 杂化特点:全部用外层轨道 使用内层轨道和 外层轨道 成键类型: 外轨配键 内轨配键 配合物的类型: 外轨型 内轨型 成单电子状态: 高自旋 低自旋 空间构型 正四面体 平面正方形
无机化学-配位化学基础-配合物的化学键理论
解得: Et2 = + 1.78 Dq Ee = - 2.67 Dq
dxy ,dxz 和 dyz 轨道(即t 轨道) d x2-y2和 d z2轨道(即e 轨道)
( 3 ) 正方形场
sq = 17.42 Dq
四面体、八面体或正方形场中,中心金属离子5个d 轨道的能级分裂
t = 4.45 Dq
sq = 17.42 Dq
中心离子
电荷↑,半径↑, △ ↑
同一几何构型配合物的 △ : 八面体场△o
第二过渡系列中心离子 > 第一过渡系列(40 - 50%)
第三过渡系列中心离子 > 第二过渡系列(20 - 25%)
正八面体配合物ML6的△o (cm-1)
1 cm-1 = 1.23977 10-4 eV = 1.19 10-2 kJ.mol-1
电荷迁移跃迁: KMnO4 , K2CrO4 , HgO 等
(中心离子为d 0 或d 10的化合物)
互相极化 e(荷移跃迁) Mn+ ——— O2- ———→ Mn+
h
→ 显示互补色
E
hν e
O2-
1951年,几位化学家用CFT解释了 [Ti(H2O)6]3+的吸收光谱,应用于配合物,迅 速发展。
9.3.2.1 要点
1. 静电模型:配合物中Mn+ - L纯粹是静电作用,均
为点电荷,L是阴离子成偶极分子.
2. d 轨道能量分裂:
中心离子的d 轨道的能量在非球形对称的配位体形成
的晶体场中都升高,且发生分裂,分离能为 △ :
d4 – d7 构型中心离子在 八面体强场和弱场中d电子的排布
弱 场 ( △o < P )
d4
第3章 配合物的化学键理论
Mn2+ < Co2+ Ni2+ < V2+ < Fe3+ < Cr3+ < Co3+ < Mo3+ < Rh3+ < Ir3+ < Pt4+
3. 晶体场理论
3. 晶体场理论
(3)配体的性质和光谱化学序
(A)同一金属、不同配位原子对的影响 I < Br < Cl < S < F < O < N < C
MXL5:拉长 / 缩短八面体
3. 晶体场理论
3. 晶体场理论
3.2 晶体场分裂能( )及其影响因素
晶体场分裂能( ):d轨道能量分裂后,最高能量d轨道与最低能量 d轨道之间的能量差。相当于1个电子从能量最低d轨道跃迁至能量最高d 轨道所需吸收的能量。
影响因素:
(1)晶体场类型
八面体场、四面体场、平面正方形场· · · · · ·
[Co(NH3)6]3+
o = 23000 cm-1
(C)中心金属离子半径:半径越大, 越大。 中心离子半径越大,d轨道离核越远,易在配体场作用下改变能量, 增加。 同族元素, 随中心离子轨道主量子数的增加而增加: 3d4d, 增加约40%50%; [Co(NH3)6]3+ [Rh(NH3)6]3+ 4d5d, 增加约20%25%
原子半径减小 电负性减小
(B)光谱化学序列 (spectrochemical series) 弱场 I-<Br-<S2-<SCN-<Cl-<NO3-<F-<(NH2)2CO<OH- ~
CH3COO- ~ HCOO-<C2O42-<H2O<NCS-<gly-<CH3CN<edta4<py < NH3<en<NH2OH<bpy<Phen<NO2-<PPh3<CN-<CO 强场
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有4个不成对电子
sp3d2杂化
[ [Fe(CN3)-6]4- InneIrnonrebritoarlbciotmalplceoxmesplexes
内轨配合物:6 配位原子的电负性较小,如氰基(CN-, 以C配位),氮 (-NO2,以N配位),较易给出孤电子对, 对中心离子的影响较大,使电子层结构发生变化, (n-1)d 轨道上的成单电子被强行配位(需要的能量叫 “成对能”,P) 腾出内层能量较低的 d 轨道接受配位 体的孤电子对, 形成内轨型配合物。
过渡金属与羰基、氰、链烯烃、环烯烃等含有π电 子配体形成的配合物都含有d-p π配键(反馈键)。
(1) 羰基配合物 单核配合物:Ni(CO)4、Fe(CO)5 等 双核配合物:Fe2(CO)9、Co2(CO)8 等
例 讨论Ni (CO)4的成键情况 解:Ni采取sp3杂化,CO中C上的孤电子对向Ni的
sp
直线形
3
sp2
三角形
4
sp3
四面体
4
dsp2
正方形
5
sp3d
三角双锥
5
dsp3
三角双锥
6
sp3d2
正八面体
6
d2sp3
正八面体
实例 Ag(NH3)2+ Cu(CN)32- Zn(NH3)42+ Ni(CN)42- Fe(SCN)52-
Fe(CO)5 Co(NH3)62+ Co(NH3)63+
四配位的配合物: 以[Ni (NH3)4]2+的结构为例
中心离子Ni2+的结构 3d
4s
4p
[Ni(NH3)4]2+的结构 3d
sp3杂化
NH3 NH3 NH3
NH3
结果: [Ni(NH3)4]2+形成前后, 中心原子的d电子排布 没有变化,配位原子的孤对电子填在由外层轨道杂
化而得的杂化轨道上。这样一类配合物叫外轨型配
合物(Outer orbital complexes)。
缺陷:难定量计算、无法说明激发态的问题,例如: 配合物的颜色、吸收光谱 六配位 M(II) 的相对稳定性
1. 理论要点和配合物的本质 形成体(M)有空轨道,配位体(L)有孤对电子或π电
子,形成配位键 ML; 形成体(中心离子)采用杂化轨道成键; 配位单元的构型与中心空轨道的杂化类型有关; 可以形成反馈π键──由金属原子提供电子对与配
sp3 杂化空轨道配位,形成σ配键。实验结果表明, Ni(CO)4 较稳定,这和配体与中心之间只有σ配键不符,
进一步实验和理论计算都证明,中心原子与配体之间 肯定还有其它成键作用。
Ni (CO)4 中d-pπ配键示意图
(2) 氰配合物
氰(CN-)配位能力很强,与过渡金属形成的配 合物都很稳定,除了C原子给电子能力较强外,氰能 与过渡金属形成d-pπ配键也是一个重要因素。
§3-1 配合物的价键理论 (Valence bond theory) 把杂化轨道理论应用于配合物的结构与成键研究,
就形成配合物的价键理论。其实质是配体中配位原子的 孤电子对向中心的空杂化轨道配位形成配位键。
要点:中心原子杂化,配体提供孤对电子 解释: 配位数,立体构型,磁性,
定性讨论部分配合物的稳定性
CN-与CO相似,既有可配位的孤电子对,又有 与d轨道对称性一致的π* 轨道可接受d电子的配位。
与羰基配合物成键过程相似,CN-配体中C上的 孤电子对向金属的杂化空轨道配位,形成σ配键,金 属的d电子向CN- π* 轨道配位,形成d-pπ配键。
没有不成对电子
稳定性:内轨型配合物 > 外轨型配合物
根据实验测得的有效磁矩,判断下列各种离子分
别有多少个未成对电子?哪个是外轨?哪个是内轨?
① Fe(en22)
5.5 B.M.
② Co(SCN42) 4.3 B.M.
③ Pt(CN42) 0 B.M.
Mn(SCN46)
根据计算磁矩的近似公式 µ= [n ( n + 2 ) ] 1/2
同样是四配位,但对配合物 [Ni(CN)4]2– 则不相同
[Ni(CN)4]2–的结构 3d
dsp2杂化
CN CN CN CN
结果:[Ni(CN)4]2-形成前后, 中心原子的d电子排布发 生了变化,原来由单电子占据、后来腾空了的(n-1)d 轨道参与了杂化,这样一类配合物叫内轨型配合物
(Inner orbital complexes),它们是指配位体孤对电子 填充在(n-1)d轨道和一部分n层轨道上的一类配合物。
体空的反键π轨道形成的配位键。
① 配体的孤对电子可以进入中心原子的空轨道。 ② 中心原子用于成键的轨道是杂化轨道
(用于说明构型)。
价键理论顺利地解ห้องสมุดไป่ตู้了配合物的分子构型。
显然, 分子构型决定于杂化轨道的类型:
配位数 2
杂化轨道 sp
分子构型 直线
3
4
4
sp2
sp3 dsp2
三角形 正四面体 正方形
配位数
第三章 配合物的化学键理论
内容:研究中心原子和配体之间结合力的本性。
目标:解释性质,如配位数、几何结构、磁学性
质、光谱、热力学稳定性、动力学反应性等。
理论:① 价键理论
② 晶体场理论
③ 分子轨道理论 ④ 角重叠模型
§3-1 配合物的价键理论 (VBT) §3-2 配合物的晶体场理论 (CFT) §3-3 配合物的分子轨道理论 (MOT)
① 5.5 = [n(n+2)]1/2 ② 4.3 = [n(n+2)]1/2 ③ 0 = [n(n+2)]1/2
n 4 n 3 n 0
是外轨型配合物 是外轨型配合物 是内轨型配合物
形成内轨型配合物还是外轨型配合物与配位原子 的电负性大小、中心离子的电子构型有关。
配合物中的 d-pπ配键(反馈π键)
5
5
6
杂化轨道 sp3d d2sp2, d4s sp3d2, d2sp3
分子构型 三角双锥 四方锥 正八面体
根据配合物的磁矩可以计算配合物中成单的电子数 并由此确定杂化轨道的类型:
= n(n2) (B.M) 玻尔磁子 其中n为配合物中的成单电子数, 为配合物的磁矩。
配位数 中心杂化类型 空间构型
2
六配位的配合物 Outer orbital complexes [FeF6]3- 或 [Fe(H2O)6]3+ 外轨型配合物:
配位原子的电负性很大,如卤素、氧等, 不易给 出孤电子对,使中心离子的结构不发生变化,仅用外 层的空轨道ns、np和nd进行杂化生成能量相同,数目 相等的杂化轨道与配体结合。
sp3d2杂化
[ [Fe(CN3)-6]4- InneIrnonrebritoarlbciotmalplceoxmesplexes
内轨配合物:6 配位原子的电负性较小,如氰基(CN-, 以C配位),氮 (-NO2,以N配位),较易给出孤电子对, 对中心离子的影响较大,使电子层结构发生变化, (n-1)d 轨道上的成单电子被强行配位(需要的能量叫 “成对能”,P) 腾出内层能量较低的 d 轨道接受配位 体的孤电子对, 形成内轨型配合物。
过渡金属与羰基、氰、链烯烃、环烯烃等含有π电 子配体形成的配合物都含有d-p π配键(反馈键)。
(1) 羰基配合物 单核配合物:Ni(CO)4、Fe(CO)5 等 双核配合物:Fe2(CO)9、Co2(CO)8 等
例 讨论Ni (CO)4的成键情况 解:Ni采取sp3杂化,CO中C上的孤电子对向Ni的
sp
直线形
3
sp2
三角形
4
sp3
四面体
4
dsp2
正方形
5
sp3d
三角双锥
5
dsp3
三角双锥
6
sp3d2
正八面体
6
d2sp3
正八面体
实例 Ag(NH3)2+ Cu(CN)32- Zn(NH3)42+ Ni(CN)42- Fe(SCN)52-
Fe(CO)5 Co(NH3)62+ Co(NH3)63+
四配位的配合物: 以[Ni (NH3)4]2+的结构为例
中心离子Ni2+的结构 3d
4s
4p
[Ni(NH3)4]2+的结构 3d
sp3杂化
NH3 NH3 NH3
NH3
结果: [Ni(NH3)4]2+形成前后, 中心原子的d电子排布 没有变化,配位原子的孤对电子填在由外层轨道杂
化而得的杂化轨道上。这样一类配合物叫外轨型配
合物(Outer orbital complexes)。
缺陷:难定量计算、无法说明激发态的问题,例如: 配合物的颜色、吸收光谱 六配位 M(II) 的相对稳定性
1. 理论要点和配合物的本质 形成体(M)有空轨道,配位体(L)有孤对电子或π电
子,形成配位键 ML; 形成体(中心离子)采用杂化轨道成键; 配位单元的构型与中心空轨道的杂化类型有关; 可以形成反馈π键──由金属原子提供电子对与配
sp3 杂化空轨道配位,形成σ配键。实验结果表明, Ni(CO)4 较稳定,这和配体与中心之间只有σ配键不符,
进一步实验和理论计算都证明,中心原子与配体之间 肯定还有其它成键作用。
Ni (CO)4 中d-pπ配键示意图
(2) 氰配合物
氰(CN-)配位能力很强,与过渡金属形成的配 合物都很稳定,除了C原子给电子能力较强外,氰能 与过渡金属形成d-pπ配键也是一个重要因素。
§3-1 配合物的价键理论 (Valence bond theory) 把杂化轨道理论应用于配合物的结构与成键研究,
就形成配合物的价键理论。其实质是配体中配位原子的 孤电子对向中心的空杂化轨道配位形成配位键。
要点:中心原子杂化,配体提供孤对电子 解释: 配位数,立体构型,磁性,
定性讨论部分配合物的稳定性
CN-与CO相似,既有可配位的孤电子对,又有 与d轨道对称性一致的π* 轨道可接受d电子的配位。
与羰基配合物成键过程相似,CN-配体中C上的 孤电子对向金属的杂化空轨道配位,形成σ配键,金 属的d电子向CN- π* 轨道配位,形成d-pπ配键。
没有不成对电子
稳定性:内轨型配合物 > 外轨型配合物
根据实验测得的有效磁矩,判断下列各种离子分
别有多少个未成对电子?哪个是外轨?哪个是内轨?
① Fe(en22)
5.5 B.M.
② Co(SCN42) 4.3 B.M.
③ Pt(CN42) 0 B.M.
Mn(SCN46)
根据计算磁矩的近似公式 µ= [n ( n + 2 ) ] 1/2
同样是四配位,但对配合物 [Ni(CN)4]2– 则不相同
[Ni(CN)4]2–的结构 3d
dsp2杂化
CN CN CN CN
结果:[Ni(CN)4]2-形成前后, 中心原子的d电子排布发 生了变化,原来由单电子占据、后来腾空了的(n-1)d 轨道参与了杂化,这样一类配合物叫内轨型配合物
(Inner orbital complexes),它们是指配位体孤对电子 填充在(n-1)d轨道和一部分n层轨道上的一类配合物。
体空的反键π轨道形成的配位键。
① 配体的孤对电子可以进入中心原子的空轨道。 ② 中心原子用于成键的轨道是杂化轨道
(用于说明构型)。
价键理论顺利地解ห้องสมุดไป่ตู้了配合物的分子构型。
显然, 分子构型决定于杂化轨道的类型:
配位数 2
杂化轨道 sp
分子构型 直线
3
4
4
sp2
sp3 dsp2
三角形 正四面体 正方形
配位数
第三章 配合物的化学键理论
内容:研究中心原子和配体之间结合力的本性。
目标:解释性质,如配位数、几何结构、磁学性
质、光谱、热力学稳定性、动力学反应性等。
理论:① 价键理论
② 晶体场理论
③ 分子轨道理论 ④ 角重叠模型
§3-1 配合物的价键理论 (VBT) §3-2 配合物的晶体场理论 (CFT) §3-3 配合物的分子轨道理论 (MOT)
① 5.5 = [n(n+2)]1/2 ② 4.3 = [n(n+2)]1/2 ③ 0 = [n(n+2)]1/2
n 4 n 3 n 0
是外轨型配合物 是外轨型配合物 是内轨型配合物
形成内轨型配合物还是外轨型配合物与配位原子 的电负性大小、中心离子的电子构型有关。
配合物中的 d-pπ配键(反馈π键)
5
5
6
杂化轨道 sp3d d2sp2, d4s sp3d2, d2sp3
分子构型 三角双锥 四方锥 正八面体
根据配合物的磁矩可以计算配合物中成单的电子数 并由此确定杂化轨道的类型:
= n(n2) (B.M) 玻尔磁子 其中n为配合物中的成单电子数, 为配合物的磁矩。
配位数 中心杂化类型 空间构型
2
六配位的配合物 Outer orbital complexes [FeF6]3- 或 [Fe(H2O)6]3+ 外轨型配合物:
配位原子的电负性很大,如卤素、氧等, 不易给 出孤电子对,使中心离子的结构不发生变化,仅用外 层的空轨道ns、np和nd进行杂化生成能量相同,数目 相等的杂化轨道与配体结合。
