中和试验
红细胞中和试验操作规程

红细胞中和试验操作规程红细胞中和试验是一种常用的实验方法,用来检测抗体与红细胞之间的相互作用。
正常情况下,抗体与相应的抗原结合后可以发生红细胞凝集反应。
红细胞中和试验可以用于诊断某些自身免疫性疾病、血型鉴定以及药物安全性评价等。
下面给出红细胞中和试验的操作规程。
1. 实验前准备:a. 配制所需的缓冲液(一般为生理盐水或PBS缓冲液),并将其调整到所需的PH值;b. 收集需使用的红细胞样本,保证其新鲜性;2. 样品处理:a. 均匀混合已配制好的抗原液和红细胞样本(一般为已标注抗原的红细胞悬液),并置于37°C恒温水浴中孵育15-30分钟;b. 同时准备空白对照组,将PBS缓冲液替代抗原液用于孵育;3. 观察结果:a. 检查红细胞悬液是否发生凝集或沉淀现象;b. 评估凝集程度,可以分为阳性、弱阳性、阴性三种结果;c. 使用雷诺显微镜观察凝集形态和密度,根据标准图谱判断结果;4. 结果分析:a. 阳性反应:红细胞发生凝集或沉淀,表明抗体与抗原发生特异性结合;b. 弱阳性反应:红细胞中有少量凝集或沉淀现象,表明抗体与抗原结合能力较弱;c. 阴性反应:红细胞悬液中无凝集或沉淀现象,表明抗体与抗原未发生结合;5. 结果解释:a. 若阳性结果出现在抗原处理组而非空白对照组中,表示样品中存在特异性抗体;b. 若凝集程度呈阳性到弱阳性,可以进一步进行稀释试验以确定抗体的效价;c. 结果解释时需结合临床情况、病史等综合考虑,确保准确性和可靠性;6. 清洗步骤:a. 实验结束后,将用过的试管和显微镜玻片进行清洗,避免污染下次实验;b. 将使用过的试剂和废弃物安全处理,遵守实验室规范;7. 实验记录:a. 实验过程中需详细记录实验条件、处理方法和结果;b. 记录凝集程度、沉淀形态等信息,方便后续数据分析和讨论;红细胞中和试验是一项较为常见的实验方法,操作规程对保证实验可靠性和准确性至关重要。
在实验过程中,需要注意严格掌握实验步骤和要求,遵守实验室安全操作规范,确保实验结果的有效解释和分析。
微量细胞病变中和试验名词解释

微量细胞病变中和试验名词解释
微量细胞病变(微小的细胞病变)是指在组织、器官或细胞水平上出现的单个或少量细胞的异常变化。
这些异常细胞变化通常是由外界因素(如化学物质、病毒、细菌等)或内部因素(如代谢紊乱、遗传因素等)引起的。
微量细胞病变可以导致组织受损、器官功能异常和疾病发生。
中和试验是一种检测微量细胞病变的常用方法。
中和试验是通过向样本中引入特定的化学物质,观察这些物质对细胞的影响来确定细胞病变的存在。
这种试验通常需要使用一定浓度的化学物质,并且需要严格控制实验条件,以确保实验
结果的准确性和可靠性。
微量细胞病变和中和试验之间的联系在于,它们都与细胞和分子水平上的异常变化有关。
微量细胞病变可以通过多种方式引起,包括病毒感染、化学物质中毒、遗传因素等。
而中和试验则是通过对样本中化学物质的影响来检测微量细胞病变的存在。
因此,中和试验可以用于诊断和监测微量细胞病变,并为疾病诊断和治疗提供支持。
除了用于检测微量细胞病变,中和试验还可以应用于其他领域。
例如,在生物医学研究、药物开发、环境保护等方面,中和试验都具有重要的应用价值。
此外,中和试验还可以用于检测某些遗传性疾病、代谢性疾病等,为这些疾病的诊断和治疗提供依据。
微量细胞病变和中和试验是两种不同的细胞和分子检测方法,但它们之间的联系和应用领域非常广泛。
随着技术的发展和应用场景的不断扩大,微量细胞病变和中和试验将在生物医学研究、疾病诊断和治疗等领域发挥越来越重要的作用。
病毒中和试验测定法
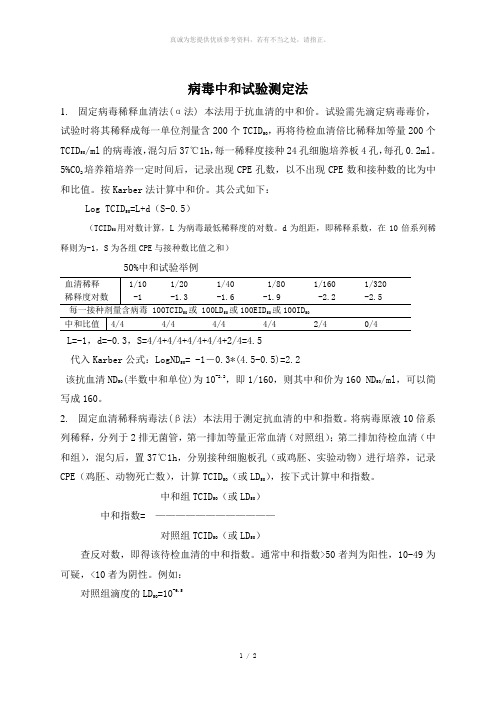
1 / 2病毒中和试验测定法1. 固定病毒稀释血清法(α法) 本法用于抗血清的中和价。
试验需先滴定病毒毒价,试验时将其稀释成每一单位剂量含200个TCID 50,再将待检血清倍比稀释加等量200个TCID 50/ml 的病毒液,混匀后37℃1h ,每一稀释度接种24孔细胞培养板4孔,每孔0.2ml 。
5%C02培养箱培养一定时间后,记录出现CPE 孔数,以不出现CPE 数和接种数的比为中和比值。
按Karber 法计算中和价。
其公式如下:Log TCID 50=L+d (S-0.5)(TCID 50用对数计算,L 为病毒最低稀释度的对数。
d 为组距,即稀释系数,在10倍系列稀释则为-1,S 为各组CPE 与接种数比值之和)50%中和试验举例50505050L=-1,d=-0.3,S=4/4+4/4+4/4+4/4+2/4=4.5代入Karber 公式:LogND 50= -1-0.3*(4.5-0.5)=2.2该抗血清ND 50(半数中和单位)为10-2.2,即1/160,则其中和价为160 ND 50/ml ,可以简写成160。
2. 固定血清稀释病毒法(β法) 本法用于测定抗血清的中和指数。
将病毒原液10倍系列稀释,分列于2排无菌管,第一排加等量正常血清(对照组);第二排加待检血清(中和组),混匀后,置37℃1h ,分别接种细胞板孔(或鸡胚、实验动物)进行培养,记录CPE (鸡胚、动物死亡数),计算TCID 50(或LD 50),按下式计算中和指数。
中和组TCID 50(或LD 50) 中和指数= ———————————— 对照组TCID 50(或LD 50)查反对数,即得该待检血清的中和指数。
通常中和指数>50者判为阳性,10-49为可疑,<10者为阴性。
例如:对照组滴度的LD 50=10-6.5中和组滴度的LD=10-4.550中和指数=10(6.5-4.5)=102.0=100中和指数的对数Log=Log100=2.0一般来说,以10倍稀释进行滴度测定,Log10=1。
中和试验计算xls

中和试验计算xls中和反应是化学反应中常见的一种,通常用于中和酸碱溶液。
中和反应会产生盐和水,并且能够控制溶液的pH值。
这篇文章将介绍中和反应的计算方法,帮助读者了解如何进行中和反应试验计算。
首先,我们需要了解什么是中和反应。
酸和碱是两种常见的化学物质。
当酸和碱被混合时,它们会发生反应并产生一个盐和水。
这就是中和反应。
例如,在中和反应中,氢离子(H+)来自酸,而羟基离子(OH-)来自碱。
它们结合在一起形成水,并且盐会在溶液中产生。
中和反应可以用于控制溶液的pH值,也就是浓度为1mol/L的氢离子的浓度。
在实验室中,我们可以通过溶液的体积和浓度计算中和反应的结果。
相关计算公式如下:酸的摩尔数× 酸的浓度 = 碱的摩尔数× 碱的浓度通过这个公式,我们可以计算出溶液中物质的浓度。
例如,如果我们要求以0.1mol/L NaOH溶液中加入0.1mol/L的盐酸,需要多少体积才能中和?首先,我们需要找到酸和碱的摩尔数。
假设以30mL盐酸为例,摩尔数为0.1 x 0.03 = 0.003。
因为是1:1的酸碱中和反应,所以碱的摩尔数也是0.003。
然后,我们就可以通过上面的公式计算出,碱的浓度应为0.003/0.1 =0.03mol/L。
最后,我们可以通过摩尔浓度计算出所需的NaOH溶液体积为0.003/0.03 = 0.1=L。
这就是中和反应的计算方法。
当我们知道溶液的浓度和体积时,我们可以使用这个公式计算出中和反应的结果。
这个过程既简单又有用,可以帮助我们控制溶液的pH值,并进行常见的化学反应。
中和试验

中和试验中和试验是病毒或毒素与相应的抗体结合后,失去对易感动物的致病力的试验方法。
所属分类:免疫学概述动物受到病毒感染后,体内产生特异性中和抗体,并与相应的病毒粒子呈现特异性结合,因而阻止病毒对敏感细胞的吸附,或抑制其侵入,使病毒失去感染能力。
中和试验(Neutralization Test)是以测定病毒的感染力为基础,以比较病毒受免疫血清中和后的残存感染力为依据,来判定免疫血清中和病毒的能力。
两种试验方法介绍中和试验常用的有两种方法:一种是固定病毒量与等量系列倍比稀释的血清混合,另一种是固定血清用量与等量系列对数稀释(即十倍递次稀释)的病毒混合。
(一) 定血清-稀释病毒法(病毒中和试验)1.病毒毒价的测定毒价单位:衡量病毒毒价(毒力)的单位过去多用最小致死量(MLD),即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致全组试验动物死亡的最小剂量。
但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。
而一般在死亡率越接近50%时,对剂量的变化越敏感,故现多改用半数致死量(LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的剂量。
用鸡胚测定时,毒价单位为鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50)。
用细胞培养测定时,用组织细胞半数感染量(TCID50)。
在测定疫苗的免疫性能时,则用半数免疫量(IMD50)或半数保护量(PD50)。
(1) LD50的测定(以流行性乙型脑炎病毒为例)。
测定方法:将接种病毒,并已发病濒死的小鼠,无菌法取脑组织,称重、加稀释液充分研磨,配制成10-1悬液,3 000r/min离心20分钟,取上清液,以10倍递次稀释成10、10、10……10,每个稀释度分别接种5只小鼠,每只脑内注射0.03ml,逐日观察记录各组的死亡数。
本例高于50%病毒稀释度的对数-6,距离比例为0.5,称释系数的对数为-1。
中和试验原理

中和试验原理中和试验是一种常见的化学实验,用于研究酸和碱之间的中和反应。
中和反应是指酸和碱溶液混合后,产生盐和水的化学反应。
在中和试验中,我们可以通过观察颜色变化、PH值变化等现象,来了解酸碱溶液的中和过程。
下面我们来详细了解一下中和试验的原理。
首先,我们需要了解酸和碱的性质。
酸是一类能够释放氢离子(H+)的化合物,而碱是一类能够释放氢氧根离子(OH-)的化合物。
当酸和碱混合时,氢离子和氢氧根离子会结合生成水,同时盐的阳离子和阴离子会结合在一起。
这就是中和反应的基本原理。
在中和试验中,我们通常会使用酚酞指示剂来帮助观察中和反应的进行。
酚酞是一种能够根据溶液的PH值发生颜色变化的指示剂。
在酸性溶液中,酚酞呈现无色状态;而在碱性溶液中,酚酞会呈现粉红色。
因此,当酸性溶液和碱性溶液混合时,我们可以通过观察酚酞的颜色变化来确定中和反应是否发生。
除了酚酞指示剂外,我们还可以通过PH试纸或PH计来监测溶液的PH值变化。
PH值是用来表示溶液酸碱性强弱的指标,通常在0-14的范围内。
PH值小于7的溶液为酸性溶液,PH值大于7的溶液为碱性溶液,PH值等于7的溶液为中性溶液。
在中和反应中,溶液的PH值会逐渐趋于7,从而达到中和的状态。
中和试验不仅可以帮助我们了解酸碱中和的原理,还可以在生活和工业中得到广泛应用。
例如,在制备肥皂的过程中,中和反应是至关重要的;在水处理和污水处理过程中,也需要进行中和反应来调节水的酸碱性。
因此,深入了解中和试验的原理对于我们的生活和工作都具有重要意义。
总之,中和试验是一种重要的化学实验,通过观察酸碱溶液的中和反应,我们可以更好地了解酸碱中和的原理。
通过使用指示剂、PH试纸等工具,我们可以清晰地观察到中和反应的进行,从而加深对化学反应的理解。
希望通过本文的介绍,能够帮助大家更好地理解中和试验的原理和应用。
中和试验

4.病毒的中和抗体(neutralization antibody )指:针对病毒某些表面抗原的抗体,此类 抗体能与细胞外游离的病毒结合从而消除病 毒的感染能力。 5.中和抗体的作用机制:
①直接封闭病毒表面抗原,如与病 毒表面吸附蛋白(VAP)结合,从 而阻断病毒的吸附
②改变病毒表面结构
6.病毒中和试验:Neutralization of a virus is defined as the loss of infectivity through reaction of the virus with specific antibody.
• 以测定病毒感染力为基础,以病毒受免疫 血清中和后残存的感染力为依据,来判定 免疫血清中和病毒的能力。
步 骤 三
加至已长成单层 的MRC-5细胞
16h,18h,20h 所铺细胞数目要求较高,防止细胞叠层
梯度乙醇固定细胞, 封闭30min
相继用IE1单抗, 生物素标记羊抗鼠IgG,
链霉亲和素-HRP, 以及底物显色
图像采集与数据处理
步骤一 步骤二 步骤三
实验组
病毒对照
细胞对照
25μ l血清 25μ l维持液 25μ l维持液
以hcmv中和抗体效价测定为例2倍稀释血清样02ml2倍稀释血清样品终体积02ml200pfu02ml200pfuhcmv每孔02ml加到成单层mrc5细胞37孵育1h弃去液体弃去液体pbs洗三含03琼脂的维持液覆盖35天再次覆盖14天甲醛固定孵育1h甲基蓝染色中和抗体效价的测定同时设病毒对照和细胞对照病毒对照组只加病毒不加血清细胞对照组用维持液代替血清和病毒
体内中和试验也称保护试验,试验时先对实验动物接 种疫苗或抗血清,间隔一定时间后,再用一定量病毒攻 击,最后根据动物是否得到保护来判定结果。常用于疫 苗免疫原性的评价和抗血清的质量评价。
红细胞中和试验操作规程

红细胞中和试验操作规程
《红细胞中和试验操作规程》
一、实验目的
红细胞中和试验是一种用于检测体液中抗体和抗原反应的实验方法。
本实验的目的是通过红细胞中和试验来判断患者的血清中是否存在特定的抗体,并对其抗原进行鉴定。
二、实验仪器与试剂
1. 离心机
2. 玻璃试管和试管架
3. 1% 的红细胞悬液
4. 不同血型抗体
三、实验步骤
1. 取一根试管,在底部标记所需进行的血型和试验样本编号。
2. 取充分标记的血样和同等数量的1%红细胞悬液,混合均匀。
3. 在37℃孵育20分钟。
4. 用离心机离心5分钟。
5. 观察红细胞悬液下清液的混浊度,判断是否发生了红细胞中和反应。
四、实验结果判定
1. 若上清液清澈,表示未发生红细胞中和反应。
2. 若上清液混浊,表示发生了红细胞中和反应,即患者血清中含有特定抗体。
五、实验注意事项
1. 实验过程中要严格遵守无菌操作,以免污染。
2. 实验操作时要注意用手套和口罩,避免细菌感染和呼吸道排放。
3. 实验结束后,要将试管和实验仪器及时清洗消毒,以保持实验室卫生。
六、实验结果记录
实验结束后,要将实验结果准确记录在实验记录表中,并及时归档保存。
以上就是关于红细胞中和试验操作规程的详细介绍,希望能对您有所帮助。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
测定方法:将接种病毒,并已发病濒死的小鼠,无菌法取脑组织,称重、加稀释液充分研磨,配制成10-1悬液,3 000r/min离心20分钟,取上清液,以10倍递次稀释成10、10、10……10,每个稀释度分别接种5只小鼠,每只脑内注射0.03ml,逐日观察记录各组的死亡数。
IgLD50(或TCID50)=L+d(S-0.5)
L为病毒最低稀释度的对数,d为组距,即稀释系数,S为死亡比值的和。本例L=-4,d=-1,S=1+1+5/6+1/6=3
IgLD50=-4+(-1)×(3-0.5)
=-6.5
则LD50=10,0.03ml
注意:用本法计算稀释血清中和试验中和效价时,S应为保护比值之和。
(3)病毒的稀释按选定的病毒稀释度范围,将病毒液作10倍递次稀释,使之成为所需要的稀释度。
(4)感作将不同稀释度病毒分别定量加入两排无菌试管内,第一排每管加入与病毒等量的免疫(或被检)血清作为试验组;第二排每管加入与免疫(或被检)血清同种的正常阴性血清作为对照组;充分摇匀后放37℃感作12h。
(5)接种按“病毒价测定”中所述接种方法接种试验动物(或鸡胚、组织细胞)。观察持续时间,根据病毒和接种途径而定。
(2)EID50的测定(以新城疫病毒为例)将新鲜病毒液体10倍递次稀释法释成10-1、10-2、10-3……10-9不同稀释度,分别接种9-10日龄鸡胚尿囊腔,鸡胚必须来自健康母鸡,并且没有新城疫抗体。每只鸡胚接种0.2ml,每个稀释度接种6只鸡胚为一组,以石蜡封口,置37-38℃培养,每天照蛋,24h之内死亡的鸡胚弃掉,24h之后死亡的鸡胚置4℃保存。连续培养5天,取尿囊液作血球凝集试验,出现血凝者判阳性,记录结果,按上述方法计算EID50。
2.中和试验
(1)病毒稀释度的选择选择病毒稀释度范围,要根据毒价测定的结果而定,如病毒的毒价为10,则试验组选用10-10对照组选用10-10其原则是:最高稀释度要求动物全存活(或无细胞病变),最低稀释度动物全死亡(或均出现细胞病变)。
(2)血清处理用于试验的所有血清在用前须作56℃30min加温灭活。但来自不同动物的血清,灭活的温度和时间也是不同的。
(6)中和指数据计算物按Reed和Muench两氏法(或Karber)法分别计算试验组和对照组的LD50(或EID50、TCID50)
试验级LD50(EID50、TCID50)
中和指数=──────────────────
对照组LD50(EID50、TCID50)
假如试验组LD50为10,对照组LD50为10。则中和指数为10,10=1995,也就是说该待检血清中和病毒的能力比正常血清大1995倍。
中和试验(NeutralizationTest)是以测定病毒的感染力为基础,以比较病毒受免疫血清中和后的残存感染力为依据,来判定免疫血清中和病毒的能力。
两种试验方法介绍
中和试验常用的有两种方法:一种是固定病毒量与等量系列倍比稀释的血清混合,另一种是固定血清用量与等量系列对数稀释(即十倍递次稀释)的病毒混合。
(3)TCID50的测定(以致细胞病变病毒为例)取新鲜病毒悬液,以10倍递次稀释成不同稀释度,每个稀释度分别接种经Hank’s液洗3次的组织细胞管,每管细胞接种0.2ml,每个稀释度接种4只细胞管,接种病毒后的细胞管放在细胞盘内,细胞层一侧在下,使病毒与细胞充分接触,放置37℃吸附1h,加入维持液,置37℃培养,逐日观察并记录细胞病毒管数,按上述方法计算TCID50。
(一)定血清-稀释病毒法(病毒中和试验)
1.病毒毒价的测定毒价单位:衡量病毒毒价(毒力)的单位过去多用最小致死量(MLD),即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致全组试验动物死亡的最小剂量。但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。而一般在死亡率越接近50%时,对剂量的变化越敏感,故现多改用半数致死量(LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的剂量。用鸡胚测定时,毒价单位为鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50)。用细胞培养测定时,用组织细胞半数感染量(TCID50)。在测定疫苗的免疫性能时,则用半数免疫量(IMD50)或半数保护量(PD50)。
表2Байду номын сангаас24LD50的计算(接种剂量为0.03ml)
病毒稀释度
接种鼠数
活鼠数
死鼠数
积累总计
死亡比
死亡率(%)
活鼠
死亡
10
5
0
5
0
15
15/15
100
10
5
0
5
0
10
10/10
100
10
5
1
4
1
5
5/6
83
10
5
4
1
5
1
1/6
17
10
5
5
0
10
0
0/10
0
10
5
5
0
15
0
0/15
0
LD50的计算:按Reed和Muench氏法计算。
中和试验
———————————————————————————————— 作者:
———————————————————————————————— 日期:
中和试验
中和试验是病毒或毒素与相应的抗体结合后,失去对易感动物的致病力的试验方法。
所属分类:免疫学
概述
动物受到病毒感染后,体内产生特异性中和抗体,并与相应的病毒粒子呈现特异性结合,因而阻止病毒对敏感细胞的吸附,或抑制其侵入,使病毒失去感染能力。
LgLD=-6+0.5×(-1)=-6.5
则LD50=10,0.03ml,即该病毒作10稀释,接种0.03ml能使半数小鼠发生死亡。
注意:稀释血清法中和试验,计算TCID50或LD50,MID50时,计算公式应改为:TCID50的对数=高于50%血清稀释度的对数-距离比例×稀释系数的对数。
如按Karber氏法计算,其公式为:
高于50%的死亡分数-50%83%-50%
距离比例= ──────────────────── = ────── = 0.5
高于50%的死亡百分数-低于50%的死亡百分数83%-17%
LD50的对数=高于50%病毒稀释度的对数+距离比例×稀释系数的对数
本例高于50%病毒稀释度的对数-6,距离比例为0.5,称释系数的对数为-1。代入上式:
