电位分析法2_膜电极
电位分析法

Preferential : privileged ,
流动载体膜电极(液膜电极)的讨论
(1) 流动载体膜电极(液膜电极)的机理与玻璃膜电极相似; (2) 离子载体(有机离子交换剂)被限制在有机相内,但可在相内自由 移动,与试样中待测离子发生交换产生膜电位; (3) 具有 R-S-CH2COO- 结构的液体离子交换剂,由于含有硫和羧基,可与 重金属离子生成五元内环配合物,对Cu2+、Pd2+等具有良好的选择性; (4) 采用带有正电荷的有机液体离子交换剂,如邻菲罗啉与二价铁所生 成的带正电荷的配合物,可与阴离子 ClO4- , NO3- 等生成缔合物,可制备 对阴离子有选择性的电极; (5) 中性载体 ( 有机大分子 ) 液膜电极,中空结构,仅与适当离子配合, 高选择性,如颉氨霉素(36 个环的环状缩酚酞)对钾离子有很高选择性, KK,Na=3.1×10-3; (6) 冠醚化合物也可用作为中性载体。
K+:(冠醚+邻苯二甲二戊酯+PVC-环已酮)
钙电极:内参比溶液为含 Ca 2+
水溶液。内外管之间装的是
0.1mol/L二癸基磷酸钙(液体离子交 换剂)的苯基磷酸二辛酯溶液。其极
易扩散进入微孔膜,但不溶于水,
故 不 能 进 入 试 液 溶 液 。 二癸基磷酸根可以在液膜-试液两相界面间传递钙离子,直至达到平衡。由 于Ca2+在水相(试液和内参比溶液)中的活度与有机相中的活度差异,在两 相之间产生相界电位。液膜两面发生的离子交换反应: [(RO)2PO]2 - Ca2+ (有机相) = 2 [(RO)2PO]2 -(有机相) + Ca2+ (水相) 钙电极适宜的pH范围是5~11,可测出10-5 mol/L的Ca2+ 。
郑大仪器分析第14章电位分析法

ED RT a( 2) E1 E2 ln zF a(1)
负离子扩散时
三、膜电位
膜电位产生的原因:
敏感膜仅对阳离子MZ+有选择 性响应膜内外两侧均产生道南 相间电位
E 道,外
RT a M外 k1 lg zF a M外
1.第一类电极 指金属与该金属离子溶液组成的体系,其电极电位 决定于金属离子的活度.
M n ne M RT E E Mn M lna n M nF
Ag Ag+ 金属银和银离子之间存在如下平衡: Ag++e ⇋ Ag 这类电极主要有Ag,Cu,Zn,Cd,Pb等
2.第二类电极
二donanndonann电位电位若有一种带负电荷载体的膜阳离子交换物质或选择性渗透膜它能交换阳离子或让被选择的离子通过如膜与溶液接触时膜相中可活动的阳离子的活度比溶液中的高膜让阳离子通过不让阴离子通过这是一种强制性和选择性的扩散从而造成两相界面的电荷分布不均匀产生双电层形成电位差这种电位称为donan电位在离子选择电极中膜与溶液两相界上的电位具有donan电位性质
系指金属及其难溶盐(或络离子)所组成的电极
体系.它能间接反映与该金属离子生成难溶盐(或 络离子)的阴离子的活度.
Ag AgClCl-1
E E
AgCl , Ag
AgCl+e-⇌Ag + ClRT ln a Cl F
电极电位随溶液中难溶盐阴离子活度变化而变化。 该电极由于电位较稳定,重现性好,常作参比电极。 干扰:能与金属的阳离子形成难溶盐的其他阴离子的 存在,将产生干扰。
电位分析法是
电化学分析的一 个重要分支,它 是利用电极电位 和溶液中某种离 子的活度或浓度 之间的关系来测 定待测物含量的 方法
电位分析法(离子选择性电极)

参比电极 Ag/AgCl参比电极 电极套管 0.1mol/LNH4Cl溶液 溶液 透气膜
气敏氨电极结构示意图
以Ca 2+离子选择性电极为例
液膜 二癸基磷酸钙的苯基磷
酸二辛酯溶液
内 参 比 溶 液
Ca2+
| | | |
CaR | | | | | | ++++ +
Ca2+ 待 测 溶 液
++++++
X-
X-
带电荷流动载体膜作用示意图 X- 非响应离子 R 载体 CaR 离子型 缔合物
气敏电极
pH玻璃电极 玻璃电极
电位分析法
RT aM,内 RT aM,外 膜电位的产生ln 若敏感膜仅对阳离子 n+有选 若敏感膜仅对阳离子M ln E道 ,内 = k 2 + E道 ,外 = k1 + nF 择性相应 a′ ,内 nF a′ ,外 M M
E道内 E扩内 E扩外 E道外 内参 比溶 液
a内 a内/
待测 溶液 膜
a外/ a外
晶体膜电极 以F-选择性电极为例
内参比电极 Ag-AgCl
塑料管 内参比溶液 NaF-NaCl
RT EF = k − ln a F − 掺EuF 的LaF 单晶片 F F 电极电极结构示意图 = k − 0.059 lg a F −
2 3 −
流动载体电极: 流动载体电极:
• 其关键部分 是液体敏感 膜,它由三 部分组成: 部分组成: 载体 有机溶剂 惰性微孔膜。 惰性微孔膜。
RT aM,外 E膜 = E道 ,外 − E道 ,内 = ln nF aM,内
E膜 = k 3 +
仪器分析学习课件 第3章 电位分析法

+ 0 .2 8 2 8
+ 0 .2 4 3 8
温度校正,对于SCE,t ℃ 时的电极电位为:
Et= 0.2438- 7.6×10-4(t-25) (V)
银-氯化银电极:
银丝镀上一层AgCl沉淀,浸在一定浓度 的KCl溶液中即构成了银-氯化银电极。
电极反应:AgCl + e- == Ag + Cl-
电极内溶液的Cl-活度 一定,甘汞电极电位固定。
参比电极
表 甘汞电极的电极电位( 25℃)
0 .1 m o l/L 甘 汞 电 极标 准 甘 汞 电 极 (N C E ) 饱 和 甘 汞 电 极 (S C E )
K C l浓 度
0 .1m o l/L
1 .0m o l/L
饱 和 溶 液
电 极 电 位 ( V ) + 0 .3 3 6 5
参比电极
甘汞电极 电极反应:Hg2Cl2 + 2e- = 2Hg + 2 Cl半电池符号:Hg,Hg2Cl2(固)KCl 电极电位(25℃):
EH2gCl/H gEH O22gCl/H g0.025l9ga2(aH (H)g2agC 2(2C l)l) EH2gCl/H gEH O22gCl/H 0 g.05lg 9a(Cl)
第二类电分析化学法是以电物理量的突变作为滴定分 析中终点的指示,所以又称为电容量分析法。属于这类分 析方法的有:电位滴定,电导滴定,电流滴定等。
第三类电分析化学法是将试液中某一个待测组分通过 电极反应转化为固相,然后由工作电极上析出物的质量来 确定该组分的量。称为电重量分析法(电子做“沉淀剂” ),即电解分析法。
1、直接电位法: 零电流条件下测量指示电极相 对于参比电极的电位,据电位 与浓度的关系计算被测物含量。
电位分析法2
K+离子选择性电极
4) 敏化电极 (1)气敏电极 (Gas sensing electrodes) 是基于界面化学反应的 敏化电极。是一种化学电池, 由一对电极(指示电极和参 比电极)组成。 试样中待测组分气体扩散通过透气膜, 进入中介液,使液层内离子选择电极敏感的 离子活度变化,则离子选择电极膜电位改变, 故电池电动势也发生变化。
如氨气敏电极: 测定时加入强碱使铵盐转 化为氨,氨扩散由透气膜进 入NH4Cl溶液,影响其pH.
NH3 H 2 O NH OH
4 Kp
NH OH
4
p NH 3
OH
Kw
H
4
Kp
NH K W / H
4
p NH 3
H
NH K W K p p NH 3
例: 用PNa玻璃电极(K Na+,H+=30)测定pH=6 并含Na+(10-3 mol· L-1)溶液时,将引入多大的 误差? 解:
K 误差%
Na ,H
H
Na
100
30 106 100 3% 3 10
3.响应时间 是指从ISE和参比电极一 起接触测量溶液到电极电位 数值达到稳定值的95%所需 的时间。 响应时间用以表达电极到达动态平衡的速度。 在实际应用中,它指示在测量过程中需要经过 多长时间才能记录测量结果。 响应时间越短越好。
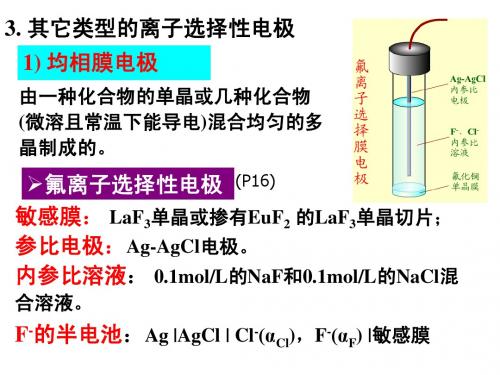
3. 其它类型的离子选择性电极 1) 均相膜电极
由一种化合物的单晶或几种化合物 (微溶且常温下能导电)混合均匀的多 晶制成的。
氟离子选择性电极 (P16) 敏感膜: LaF3单晶或掺有EuF2 的LaF3单晶切片; 参比电极:Ag-AgCl电极。 内参比溶液: 0.1mol/L的NaF和0.1mol/L的NaCl混
电位分析法

电位分析法一、概论:电位分析法是通过化学电池的电流为零的一类方法二、电位分析法指示电极分类1、第一类电极:金属及其离子溶液2、第二类电极:金属及其难溶盐(或络合离子)3、第三类电极:金属与具有两种共同阴离子的难溶盐或难解离的络合离子4、第零类电极:惰性金属Pt 、Au 、C 等三、参比电极与盐桥1、参比电极1标准氢电极:在任何温度下电位值都为零,但一般不使用,因为操作麻烦又贵。
2甘汞电极和银-氯化银电极:电极电位可从P362查表获得甘汞电极:)/(|)(),(22L xmol KCl s Cl Hg l Hg 银-氯化银电极:)/(|)(),(L xmol KCl s AgCl s Ag 2、盐桥1作用:联通电路,消除或减小液接电位2使用条件:不含被测离子、正负电子迁移率基本相等、离子浓度尽可能大,减少液接电位。
四、离子选择电极1、膜电电位E 膜=in Dd out D E E E ++=l in l out a a nF RT k ln '±(d E :扩散电位,D E :界面电位,a :活度)2、离子选择电极电位:l out ISE a nF RT const E ln '±=(负离子➕,正离子➖)l out ISE SCEBattery a nFRT K E E E ln ±=-=(负离子➖,正离子➕)ISE :离子选择电极,SCE :参比电极3、离子选择电极类型及其相应机理1玻璃电极:玻璃在纯水或稀酸中浸泡时,玻璃中的+Na 与溶液里的+H 发生交换,在玻璃表面形成水化胶层。
此时玻璃的结构为:内外水化胶层+中间干玻璃层;干玻璃层靠+Na 导电,而水化胶层靠+H 扩散导电。
2晶体膜电极A 、氟离子单晶电极:敏感膜为3LaF 的单晶薄片,氟离子能扩散进入膜相的缺陷空穴,膜中的氟离子也可以进入溶液,因而在两相界面上产生了膜电位。
B 、硫、卤素离子电极。
第九章--电位分析法(2014)PPT课件
H水 合层 H溶 液
E内K内0.059lgaaHH内 内 参 水比 化溶 层液 E外K外0.059lgaaH H外 外 部 水溶 化液 层
.
13/6193
E内K内0.059lgaaHH内 内 参 水比 化溶 层液 E外K外0.059lgaaH H外 外 部 水溶 化液 层
同一玻璃电极,膜内外表面性质可以看成是相同 的,所以常数K内=K外;
属于非晶体膜电极。 最早使用的离子选择性电极。 核心部分是玻璃膜。
.
6/696
玻璃膜的不同组成可制成对不同 阳离子响应的玻璃电极。
pH玻璃膜电极的敏感膜是在SiO2 基质中加入Na2O、Li2O和CaO烧 结而成的特殊玻璃膜。厚度约为 100 mm左右。
原理:玻璃膜产生的膜电位与待 测溶液的pH值有关。
.
19/6199
3.3 pH值的测定
pHlogH[] pH loagH
饱和甘汞电极为参比电 极 , 玻 璃 电 极 作 为 H+ 活 度 指 示电极,两者插入溶液中组 成电池:
A A g ,0 . g 1 m C L 1 H ol 玻 lC 试 l 璃 K ( 饱 液 C ) 膜 ,H 2 C l 和 2 H g l
.
34/6394
二氧化碳气敏电极
电极浸入待测液,试液中 待测CO2通过透气膜扩散 ,直到透气膜内外CO2的 分压相等。
CO2引起的内电解质溶液 pH变化用pH玻璃电极指 示,由此测定试液中CO2 的浓度。
.
35/6395
气敏电极一览表:
.
36/6396
7. 酶电极
将 生物酶 涂剂:二癸基磷酸钙+苯基磷酸二辛酯溶液。
.
32/6392
第四章电位分析法2
浓度)。若有气体,应注明其分压、温度,若 不注明,则指25℃,101325Pa
原电池的表示方法: (-) Zn(s)|ZnSO4(a1)||CuSO4(a2)|Cu(s) (+)
10
(-) Zn(s)|ZnSO4(a1)||CuSO4(a2)|Cu(s) (+) 电池电动势: E电池= 右- 左 = +- -
在测试过程中,有较大电流通过,溶液的主 体浓度发生显著变化的电极称为工作电极 例:电解分析和库仑分析中所用的Pt电极
30
(b) 参比电极
31
(b) 参比电极的原理 甘汞电极结构图
32
在测量过程中,具有已知、恒 定电位的电极称为参比电极。
甘汞电极是常用的参比电极, 它的电极电位取决于氯离子活度, 使用不同浓度的KCl溶液可以得到不 同电极电位的甘汞电极
电子转移而产生电位 第五类电极是由于离子交换和扩散产生
的电极
22
(a) 第一类电极
由金属浸入含有该金属离子的溶液组成
电极反应 : Mn+ + ne- = M
25℃
M n / M
M n / M
0.059 lg a(M n ) n
M
M n+
23
如 : Ag+/Ag 组 成 的 银 电 极 , 电 极 反 应 是 : Ag+ + e- = Ag
2、电位滴定法 (potentiometric titration): 是借助测
量滴定过程中电池电动势的突变来确定滴定终点,再根
据反应计量关系进行定量的方法。
37
电位分析法的实质是通过在零电流条件下测定 两电极间的电位差(即所构成原电他的电动势) 进 行分析测定。
8第四章电位分析法(二)
电位。
这类扩散是自由扩散,正负离子可自由通
过界面,没有强制性和选择性。
② Donnan电位: 选择性渗透膜或离子交换膜,它至少阻止
一种离子从一个液相扩散至另一液相或与溶液
中的离子发生交换。这样将使两相界面之间电 荷分布不均匀——形成双电层——产生电位差 ——Donnan 电位。 这类扩散具强制性和选择性。
直线AB段对应的检测离子的
活度(或浓度)范围,为离子 选择性电极的线性范围。
直线AB部分的斜率为离子响应电极的响应斜率, 当斜率接近理论值时,称电极在给定的活度范围内 具有能斯特响应。
②检测下限
指可进行有效测量的最低活度。 实际定义为图中AB与CD延长线的交点M所对应的测定 离子的活度(或浓度) 。离子选择性电极一般不用于测定 高浓度试液(1.0mol/L),高浓度溶液对敏感膜腐蚀溶解
离子活度条件下测定的选择性系数值各不相同
,是一个实验数据。
c Ki,j可用来估计干扰离子存在时产生的测定误
差或确定电极的适用范围。
( a j) 相对误差 K i .j a i
n n i/ j
100 %
例:
用pNa玻璃膜电极(KNa+,K+= 0.001)测定pNa=3的试液
时,如试液中含有pK=2的钾离子,则产生的误差是多少?
效率。
四、膜内阻 膜内阻:电极的内阻决定测量仪器的输入
阻抗 ( 即二者要匹配,否则会带来较大测量误
差)。
膜内阻包括敏感膜内阻、内参比液和内参
比电极的内阻;主要由膜电阻决定,电阻很高 。需要用高输入阻抗的毫伏计测量。 通常玻璃膜比晶体膜有更大的内阻。
§4-6 离子选择性电极的种类和性能
3电位分析法
1.导线;
2. KCl 饱和溶液;
3. Hg 2Cl 2;
4.多孔物质;
5.胶帽;
6.导线;
7. Hg ;
8.纤维
化学修饰电极
水浸泡后,表面的Na+与水中的
表面形成水合硅胶层。
玻璃电极使用前,必须在水溶液中
玻璃膜电位的形成
玻璃电极在水中浸泡后,生成三层结构,即中间的干玻璃
层和两边的水化硅胶层:
水化硅胶层厚度:0.01~10 μm。
在水化层,玻璃上的Na+与
溶液中H+发生离子交换而产生相界电位。
溶液中H+经水化层扩散至干玻璃层,干玻璃层的阳离子向外
扩散以补偿溶出的离子,离子的相对移动产生扩散电位。
两个相界电位和两个扩散电位两者之和构成膜电位。
玻璃电极放入待测溶液,平衡后:
/ a2’);ϕ外= k2+0.059 lg(a1 / a1’)。
+ 0.059 pF
之间使用,pH高
交换,pH较低时,
电位分析是通过在零电流条件下测定两电极间的电位差(电池电动势)所进行的分
装置:参比电极、指示电极
(2)标准加入法
,C x)得到:ϕx 测定溶液(V
x
,C s测得:ϕ1
加入V
s
结合能斯特方程得到:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电位分析法(二)三、离子选择电极(Membrane potential and ISE)和膜电位1. 膜电位及其产生膜电极(Membrane potential and ISE),具有敏感膜且能产生膜电位的电极。
膜电位产生于被分隔两边不同成分的溶液,测量体系为:参比电极1|溶液1|膜|溶液2|参比电极2膜电极特点:仅对溶液中特定离子有选择性响应(离子选择性电极)。
膜电极的关键:选择膜的敏感元件。
敏感元件构成:特殊组分的玻璃、单晶、混晶、液膜、高分子功能膜及生物膜等。
膜电极组成的半电池,没有电极反应;相界间没有发生电子交换过程。
表现为离子在相界上的扩散,造成双电层存在,产生界面电位差。
该类主指离子选择性电极。
•膜电位: = 膜内扩散电位和膜与电解质溶液形成的内外界面的Donnan电位的代数和。
膜电位=扩散电位(膜内) + Donnan电位(膜与溶液之间)(1)扩散电位:液液界面或固体膜内,因不同离子之间或离子相同而浓度不同而发生扩散即扩散电位。
其中,液液界面之间产生的扩散电位也叫液接电位。
特点:这类扩散是自由扩散,正负离子可自由通过界面,没有强制性和选择性。
(2)Donnan电位:选择性渗透膜或离子交换膜,它至少阻止一种离子从一个液相扩散至另一液相或与溶液中的离子发生交换。
这样将使两相界面之间电荷分布不均匀——形成双电层——产生电位差——Donnan 电位。
这类扩散具强制性和选择性。
2. 离子选择性电极ISE 原电极晶体膜均相膜如F-,Cl-,Cu2+非均相膜如硅橡胶膜非晶体膜刚性基质如PH,PNa流动载体带正电荷如NO3-,ClO4-,BF4-带负电荷如Ca2+, Mg2+中性如K+敏化电极气敏电极如CO2, NH4+电极生物电极如酶电极,生物组织电极1)玻璃膜电极玻璃电极构成:是一种特定配方的玻璃吹制成球状的膜电极,这种玻璃的结构为三维固体结构,网格由带有负电性的硅酸根骨架构成,Na+可以在网格中移动或者被其他离子所交换,而带有负电性的硅酸根骨架对H+有较强的选择性。
当玻璃膜浸泡在水中时,由于硅氧结构与氢离子的键合强度远大于其与钠离子的强度(约为1014倍),因此发生如下的离子交换反应:G-Na+ + H+↔G+H+ + Na+电极构造球状玻璃膜(Na2SiO3,0.1mm厚)+[内参比电极(Ag/AgCl)+缓冲液]膜电位产生机理当内外玻璃膜与水溶液接触时,Na2SiO3晶体骨架中的Na+与水中的H+发生交换:G-Na+ + H+====G-H+ + Na+因为平衡常数很大,因此,玻璃膜内外表层中的Na+的位置几乎全部被H+所占据,从而形成所谓的“水化层”。
选择膜的一面与被测溶液接触,另一面与电极的内充液相接触,内充液中含有固定浓度的被测离子。
膜内外被测离子活度的不同而产生电势差,将膜电极和参比电极一起插到被测溶液中,则电池结构为:玻璃膜=水化层+干玻璃层+水化层电极的相=内参比液相+内水化层+干玻璃相+外水化层+试液相膜电位ϕm= ϕ外(外部试液与外水化层之间)+ϕ玻(外水化层与干玻璃之间)- ϕ玻’(干玻璃与内水化层之间)- ϕ内(内水化层与内部试液之间)pH测定的电池组成为:Ag,AgCl ⎢pH溶液(已知浓度) ⎢玻璃膜⎢pH试液⎢⎢KCl(饱和) ⎢Hg2Cl2,Hg内外参比电极的电势值固定,且内充溶液中离子的活度也一定,则电池电动势为:ϕ内= k1 + 0.059lg(a2/a2’ )ϕ外= k2 + 0.059lg(a1/a1’)由于玻璃膜内、外表面的性质基本相同,则k1=k2,a1’ = a2’ϕm = ϕ外- ϕ内= 0.059lg(a1 /a2)由于内参比溶液中的H+活度(a2)是固定的,则:ϕm = K´+0.059lg a1 = K´- 0.059pH试液a1、a2分别表示外部试液和电极内参比溶液的H+活度;a1’、a2’分别表示玻璃膜外、内水合硅胶层表面的H+活度;k1、k2则是由玻璃膜外、内表面性质决定的常数。
玻璃电极特点•不对称电位:当玻璃膜内外溶液H+浓度或pH值相等时,ϕm=0,但实际上ϕm不为0,这说明玻膜内外表面性质是有差异的,如表面的几何形状不同、结构上的微小差异、水化作用的不同等。
消除方法:充分浸泡电极和用标准pH缓冲溶液校正。
•酸差:当用pH玻璃电极测定pH<1的强酸性溶液或高盐度溶液时,电极电位与pH之间不呈线性关系,所测定的值比实际的偏高:因为H+浓度或盐份高,即溶液离子强度增加,导致H2O分子活度下降,即H3O+活度下降,从而使pH测定值增加。
•碱差或钠差:当测定较强碱性溶液pH值时,玻璃膜除对H+响应,也同时对其它离子如Na+响应。
因此pH测定结果偏低。
pH电极的最佳适用范围:pH1~9•当用Li玻璃代替Na玻璃吹制玻璃膜时,pH测定范围可在1~14之间。
•通过改变玻璃膜的结构可制成对K+、Na+、Ag+、Li+等响应的电极。
有H+,Na+,K+,Ag+,Li+的玻璃电极。
•对H+有高度选择性的指示电极,使用范围广,不受氧化剂、还原剂、有色、浑浊或胶态溶液的pH测定;响应快(达到平衡快)、不沾污试液。
缺点:膜太薄,易破损,且不能用于含F-的溶液;电极阻抗高,须配用高阻抗的测量仪表。
2).晶体膜电极(典型:氟电极)结构:()敏感膜:(氟化镧单晶):掺有EuF2的LaF3单晶切片;内参比电极:管内的Ag-AgCl电极。
内参比溶液:0.1 mol/L NaCl + 0.10 mol/L NaF原理: LaF3的晶格中有空穴,在晶格上的F-可以移入晶格邻近的空穴而导电,对于一定的晶体膜,离子的大小、形状和电荷决定其是否能够进入晶体膜内,故膜电极一般都具有较高的离子选择性。
当氟电极插入到含有F-的溶液中时,F-在晶体膜表面进行交换,如果溶液中的F-活度较高,则溶液中的F-进入晶体。
反之,晶体表面的F-进入溶液。
由此产生的膜电势与溶液中的F-活度的关系,在一定范围内可以用奈斯特方程来表示。
25℃时:ϕ膜= K-0.059lg a F- = K+0.059pF酸度影响:OH-与LaF3反应释放F-,使测定结果偏高;H+与F-反应生成HF或HF2-降低F-活度,使测定偏低。
减小干扰:控制pH5-7。
阳离子干扰:Be2+,Al3+,Fe3+, Th4+,Zr4+等可与F-络合——使测定结果偏低,可通过加络合掩蔽剂(如柠檬酸钠、EDTA、钛铁试剂、磺基水杨酸等)消除其干扰。
基体干扰(以活度代替浓度)消除:标准和待测样品中同时加入惰性电解质----总离子强度调节剂(Total ion strength adjustment buffer, TISAB),控制pH、消除阳离子干扰、控制离子强度。
TISAB组成:KNO3+NaAc+HAc+柠檬酸钾。
3).流动载体膜电极(液膜电极)流动载体可在膜中流动,但不能离开膜,而离子可以自由穿过膜。
界面双电层Dinann扩散机理。
构成:固定膜[活性物质(载体)+溶剂(增塑剂)+基体(微孔支持体)]+液体离子交换剂+内参比流动载体膜:固化PVC膜电极离子交换剂+有机溶剂+ PVC+四氢呋喃→膜特点:稳定,寿命长机理:膜内活性物质(液体离子交换剂)与待测离子发生离子交换,但其本身不离开膜。
这种离子之间的交换将引起相界面电荷分布不均匀,从而形成膜电位。
几种流动载体电极NO3-:(季铵类硝酸盐+邻硝基苯十二烷醚+5%PVC)Ca2+:(二癸基磷酸钙+苯基磷酸二辛酯+微孔膜)K+:(冠醚+邻苯二甲二戊酯+PVC-环已酮)钙电极:构成:内参比电极:Ag-AgCl电极内参比溶液:0.1mol/L CaCl2水溶液内外管之间:0.1mol/L二癸基磷酸钙的苯基磷酸二辛酯溶液多孔膜:载有离子交换剂(二癸基磷酸钙)原理:二癸基磷酸钙极易扩散进入微孔膜,但不溶于水,故不能进入试液溶液,但二癸基磷酸根可以在液膜-试液两相界面间来回迁移,传递钙离子,直至达到平衡。
由于Ca2+在水相(试液和内参比溶液)中的活度与有机相中的活度差异,在两相之间产生相界电势。
钙电极适宜的pH范围是5~11,可测出10-5 mol/L的Ca2+ 。
4).敏化电极敏化电极是指气敏电极、酶电极、细菌电极及生物电极等。
这类电极的结构特点是在原电极上覆盖一层膜或物质,使得电极的选择性提高。
气敏电极端部装有透气膜,气体可通过它进人管内。
管内插入pH 玻璃复合电极,复合电极是将外参比电极(Ag /AgCI )绕在电极周围。
管中充有电解液(中介液)。
试样中的气体通过透气膜进入中介液,引起电解液中离子活度的变化,这种变化由复合电极进行检测。
如 CO2气敏电极,pH 玻璃电极作为指示电极, 中介液为0.01mol/L 的碳酸氢钠。
二氧化碳与水作用生成碳酸,从而影响碳酸氢钠的电离平衡来指示CO2 。
5). 生物膜电极生物膜电极是将生物化学和电分析化学相结合而研制成的电极。
特点:将电位法电极作为基础电极,生物酶膜或生物大分子膜作为敏感膜而实现对底物或生物大分子的分析。
1、酶电极:覆盖于电极表面酶活性物质(起催化作用)与待测物反应生成可被电极反应的物质, 原理:基于用电位法直接测量酶促反应中反应物的消耗或反应物的产生而实现对底物分析的一种分析方法。
它将酶活性物质覆盖在电极表面,这层酶活性物质与被测的有机物或无机物(底物)反应,形成一种能被电极响应的物质。
例,尿素在尿素酶催化下发生下面反应:反应生成的NH 4+可用铵离子电极来测定。
若将尿素酶涂在铵离子电极上则成为尿素电极,此电极插入含有尿液的试液中,可由于尿素分解出来的NH4+的响应而间接测出尿素的含量。
氨基酸测定:上述反应产生的NH 4+可由铵离子电极测定。
四、离子选择性电极的性能参数 1.Nernst 响应、线性范围、检测下限校正曲线:以离子选择电极的电位对响应离子活度的负对数作图。
若这种响应变化服从于Nernst 方程,则称它为 Nernst 响应。
线性范围:CD 段对应的检测离子的活度(或浓度)范围。
级差:CD 段的斜率:即活度相差一数量级时,电势改变的数值,用S 表示。
检测下限:当活度较低时,曲线就逐渐弯曲,GF 与CD 延长线的交点A 所对应的测定离子的活度(或浓度)。
2. 选择性系数(selectivity coefficient)离子选择电极除对某特定离子有响应外,溶液中共存离子对电极电位也有贡献。
电极电位i 为待测离子,j 为共存离子。
Kij 为离子选择性系数,其值越大,表示ISE 测定i 离子抗j 离子的干扰能力越强。
第二项正离子取+,负离子取-。
)lg(303.2/j i zz j jpot ij i i K F z RT k ααϕ∑++'=K ij pot(K ij)称为选择性系数,该值越小,表示i离子抗j离子的干扰能力越大。
