无机化学元素化学部分练习
无机化学题库15-d区元素.

十五、d 区元素(319题)一、选择题 ( 共69题 )1. 2 分 (1607)将K 2MnO 4溶液调节到酸性时,可以观察到的现象是………………………………( )(A)紫红色褪去 (B)绿色加深(C)有棕色沉淀生成 (D)溶液变成紫红色且有棕色沉淀生成2. 2 分 (1622)用Cr 2O 3为原料制备铬酸盐应选用的试剂是…………………………………………( )(A) 浓硝酸 (B) KOH(s)+KClO 3(s) (C) Cl 2 (D) H 2O 23. 2 分 (1627)用作治疗癌症的含铂药物是……………………………………………………………( )(A) H 3NPt Cl H 3N Cl (B) H 3N Pt ClCl NH 3(橙黄) (鲜黄)(C) H 2PtCl 6 (D) PtCl 44. 1 分 (1637)在Fe 3+溶液中加入NH 3·H 2O 生成的物质是…………………………………………( ) (A) Fe (OH)3 (B) Fe (OH)6]3- (C) [Fe (NH 3)6]3+ (D) [Fe (NH 3)3(H 2O)3]3+5. 2 分 (1638)[Ni(CN)4]2-和[Ni(CO)4]中未成对电子数分别是………………………………………( )(A) 0和2 (B) 2和2 (C) 2和0 (D) 0和06. 1 分 (1644)在Cr 2(SO 4)3溶液中,加入Na 2S 溶液,其主要产物是…………………………………( )(A) Cr + S (B) Cr 2S 3 + Na 2SO 4(C) Cr(OH)3 + H 2S (D)+ S−2CrO 2−7. 1 分 (1654)在下列氢氧化物中,既能溶于过量NaOH ,又能溶于氨水的是………………………( )(A) Ni(OH)2 (B) Zn(OH)2 (C) Fe(OH)3 (D) Al(OH)38. 2 分 (1655)某金属离子在八面体弱场中的磁矩是4.90 B.M.,而在八面体强场中的磁矩为0,该中心金属离子可能是……………………………………………………………………………( )(A) Cr(III) (B) Mn(II) (C) Mn(III) (D) Fe(II)9. 2 分 (1657)含有下列离子的溶液,与Na 2S 溶液反应不生成黑色沉淀的一组是…………………( ) (A) Fe 2+,Bi 3+ (B) Cd 2+,Zn 2+ (C)Fe 3+,Cu 2+ (D) Mn 2+,Pb 2+10. 2 分 (1659)下列各组元素中,性质最相似的两种元素是……………………………………………( )(A) Mg 和Al (B) Zr 和Hf (C) Ag 和Au (D) Fe 和Co11. 2 分 (1660)下列氧化物与浓H 2SO 4共热,没有O 2生成的是………………………………………( )(A) CrO 3(B) MnO 2 (C) PbO 2 (D) V 2O 5 12. 2 分 (1661)下列各组自由离子的顺磁磁矩从小到大变化顺序,正确的是………………………( ) (A) Cu 2+ < Ni 2+ < Co 2+ (B) Cr 2+ < Fe 2+ <Fe 3+ (C) Cr 2+ < Mn 2+ < V 2+ (D) Ti 2+ < V 3+ < Cr 2+13. 2 分 (1664)在酸性介质中加入过氧化氢(H 2O 2)时不生成过氧化物的化合物是…………………( )(A) 钛酸盐 (B) 重铬酸盐 (C) 钒酸盐 (D) 高锰酸盐14. 2 分 (1674)在碱性溶液中氧化能力最强的是………………………………………………………( )(A) (B) NaBiO −4MnO 3 (C) Co 2O 3 (D)-272O Cr 15. 1 分 (1694)下列元素中,可形成多酸的是…………………………………………………………( )(A) Na (B) W (C) Fe (D) Ag16. 2 分 (1695)在强碱性介质中,钒(Ⅴ)存在的形式是……………………………………………… ( )(A) VO 2+(B) VO 3+ (C) V 2O 5·n H 2O (D) -34VO 17. 2 分 (1699)CrO 5中Cr 的氧化数为 ………………………………………………………………( )(A) 4 (B) 6 (C) 8 (D) 1018. 1 分 (4601)在硝酸介质中,欲使 Mn 2+ 氧化为可加的氧化剂是…………………………( ) −4MnO (A) KClO 3 (B) (NH 4)2S 2O 8(Ag +催化) (C) K 2Cr 2O 7 (D) 王水19. 2 分 (4603)下列物质不能大量在溶液中共存的是…………………………………………………( )(A)和OH -36Fe(CN)−(B)和I -36Fe(CN)− (C)和I -46Fe(CN)2 (D) Fe 3+ 和Br −20. 2 分 (4604)根据价层电子的排布,下列化合物中为无色的是……………………………………( )(A) CuCl (B) CuCl 2(C) FeCl 3 (D) FeCl 221. 2 分 (4605)根据价层电子的排布,预料下列化合物中为无色的是………………………………( )(A) TiCl 3(B) ScF 3 (C) MnF 3 (D) CrF 322. 2 分 (4606)下列离子中磁性最大的是………………………………………………………………( ) (A) V 2+ (B) Cr 3+ (C) Mn 2+ (D) Fe2+23. 2 分 (4607)最适于对 Fe(H 2O) 描述的是………………………………………………………( ) (A) sp 3d 2杂化,顺磁性(B) sp 3d 2杂化,反磁性 (C) d 2sp 3杂化,顺磁性 (D) d 2sp 3杂化,反磁性24. 2 分 (4608)过渡金属和许多非金属的共同点是……………………………………………………( )(A) 有高的电负性 (B) 许多化合物有颜色(C) 多种氧化态 (D) 许多顺磁性化合物25. 2 分 (4609)对第四周期的过渡元素,不具备的性质是……………………………………………( )(A) 形成多种氧化态(B) 形成配位化合物(C) 配位数为4或6(D) 形成的离子必具有4s 23d n 的电子排布26. 2 分 (4610)下列化合物中显反磁性的是……………………………………………………………( )(A) NiCl 2 (B) CoSO 4 (C) VOCl 3 (D) TiF 327. 2 分 (4616)在某种酸化的黄色溶液中,加入锌粒,溶液颜色从黄经过蓝、绿直到变为紫色,该溶液中含有…………………………………………………………………………………………( )(A) Fe 3+ (B) (C) (D) Fe (CN) +2VO -24CrO −4628. 2 分 (4617)下列离子中氧化性最强的是……………………………………………………………( )(A) CoF (B) Co(NH −363) (C) Co(CN) (D) Co +33−363+29. 2 分 (4636)根据晶体场理论,FeF 高自旋配合物的理论判据是………………………………( ) −36 (A) 分裂能 > 成对能 (B) 电离能 > 成对能(C) 分裂能 > 成键能 (D) 分裂能 < 成对能30. 2 分 (4643)下列气体中能用氯化钯(PdCl 2)稀溶液检验的是………………………………………() (A) O 3 (B) CO 2 (C) CO (D) Cl 231. 2 分 (4645)下列物质的氧化性与惰性电子对效应无关的是………………………………………() (A) Pb(IV) (B) Bi(V) (C) Cr(VI) (D) Tl(III)32. 2 分 (4646)欲将K 2MnO 4转变为KMnO 4,下列方法中可得到产率高、质量好的是………………() (A) CO 2通入碱性K 2MnO 4溶液 (B) 用Cl 2氧化K 2MnO 4溶液(C) 电解氧化K 2MnO 4溶液 (D) 用HAc 酸化K 2MnO 433. 1 分 (4648)Al(Ⅲ)和Cr(Ⅲ)化学性质的不同点表现在…………………………………………… () (A) 形成配合物的能力 (B) 形成复盐的能力(C) 盐类的水解性 (D) 氢氧化物的两性34. 1 分 (4653)下列四种绿色溶液,加酸后,溶液变为紫红色并有棕色沉淀产生的是( )(A) NiSO 4 (B) CuCl 2(浓) (C) NaCrO 2 (D) K 2MnO 435. 1 分 (4654)在下列化合物中,属杂多酸盐的是……………………………………………………() (A) Na 3[P(W 12O 40)] (B) KCr(SO 4)2·12H 2O(C) Na 4Mo 7O 23 (D) Fe 2(CO)936. 2 分 (4659)下列提炼金属的方法,不可行的是……………………………………………………() (A) Mg 还原TiCl 4制备Ti (B) 热分解Cr 2O 3制备Cr(C) H 2还原WO 3制备W (D) 羰化法提纯Ni37. 1 分 (4663)欲使软锰矿(MnO 2)转变为 MnO 4应选择的试剂是…………………………………() (A) KClO 3(s) + KOH(s) (B) 浓HNO 3(C) Cl 2 (D) O 238. 1 分 (4670)下列新制备出的氢氧化物沉淀在空气中放置,颜色不发生变化的是………………() (A) Fe(OH)2 (B) Mn(OH)2 (C) Co(OH)2 (D) Ni(OH)239. 1 分 (4671)下列锰的氧化物中酸性最强的是………………………………………………………() (A) MnO (B) Mn 2O 3 (C) MnO 2 (D) Mn 20740. 2 分 (4672)在FeCl 3与KSCN 的混合液中加入过量NaF ,其现象是………………………………() (A) 产生沉淀 (B) 变为无色 (C) 颜色加深 (D) 无变化41. 1 分 (4673)同一族过渡元素,从上到下,氧化态的变化是………………………………………() (A) 趋向形成稳定的高氧化态 (B) 先升高后降低(C) 趋向形成稳定的低氧化态 (D) 没有一定规律42. 2 分 (4677)在水溶液中不能存在的离子是………………………………………………………… ( ) (A) [Ti(H 2O)6]3+ (B) [Ti(H 2O)6]4+ (C) [Ti(OH)2(H 2O)4]2+ (D) [Ti(O 2)OH(H 2O)4] 43. 1 分 (4678)当和I −4MnO −在浓强碱性溶液中反应,产物最可能是………………………………( )(A) Mn(s)和I 2 (B)和-24MnO −3IO (C) MnO 2、O 2和IO − (D) Mn 2+ 和I 244. 1 分 (4679)性质最相似的两种元素是………………………………………………………………( )(A) Zr 和Hf (B) Ru 和Rh (C) Mn 和Mg (D) Cu 和Cr45. 1 分 (4680)由于La 系收缩,导致下列元素中性质相似的一组是…………………………………( )(A) Ti 和V (B) Hg 和Pb (C) Nb 和Ta (D) Mn 和Re46. 2 分 (4681)用Cr 2O 3为原料制备铬酸盐应选用的试剂是…………………………………………( )(A) 浓硝酸 (B) KOH(s) + KClO 3(s)(C) KMnO 4 (D) H 2O 247. 2 分 (4682)弱场中,八面体和四面体配合物的 CFSE 相等的是…………………………………( ) (A) Fe 2+(B) Ni 2+ (C) Mn 2+ (D) Cu 2+48. 2 分 (7612)PR 3在配合物M(PR 3)6中可能形成键,这种π 键属于…………………………………( )(A) M(d π ) → L(p π )(B) M(d π ) → L(d π ) (C) L(p π ) → M(d π ) (D) L(p π ) → M(p π )49. 2 分 (7618)在向紫色V 2+ 溶液中滴加KMnO 4溶液时,观察到溶液中钒离子价态和颜色的变化的过程为_________________→_________________→_________________→ ________________。
高中化学竞赛辅导无机元素练习题

(1)确定A的结构简式。写出生成A的化学反应方程式。
(2)在室温或高于室温的条件下,A能定量地分解,产生B和C。已知B的阳离子的价电子总数比C的价电子总数少4。试确定B的结构简式,写出B中阴、阳离子各中心原子的杂化形态。
3为什么NF3常温不水解,而NCl3常温可以水解?写出水解产物。
九、回答下列关于磷的问题:
高中化学竞赛练习(无机化学主族元素)
第一章卤素
一、于酸性溶液中混合等物质的量的KBrO3和KI,生成哪些氧化还原产物,它们的物质量的比是多少?
(2)用漂白粉漂白物料时,常采用以下步骤:将物料浸入漂白粉溶液,然后暴露在空气中;将物料浸在稀盐酸中;将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每一步处理的作用,并写出有关的反应方程式。
(2)石硫合剂在空气中与H2O及CO2作用又生成具有杀虫作用的S,写出分步的反应方程式。
四.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。
1.氯化亚砜分子的几何构型是;中心原子采取杂方式,
是(等性、不等性)杂化。
2.写出亚硫酸钙和五氯化磷共热,制备氯化亚砜反应的化学方程式
3.氯化亚砜在有机化学中用作氯化剂,写出乙醇和氯化亚砜反应的化学方程式
1.写出N2O4在登月飞船的液体推进系统中所发生主要反应的方程式;
2.说明N2O4分子中N原子的杂化方式和成键情况;
3.画出偏二甲肼的构型。
4.写出我国长征系列火箭二元推进剂反应的化学方程式。
5.偏二甲肼可用二甲胺被亚硝酸氧化、再用锌还原来制备,写出各步反应方程式。
无机化学第五章习题参考答案
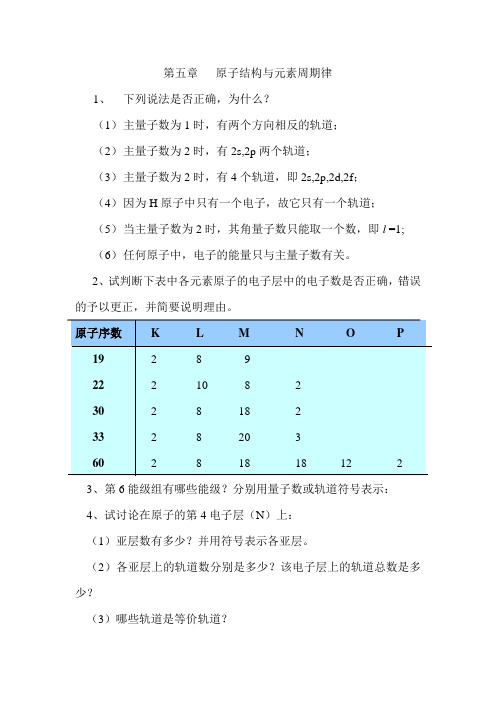
第五章原子结构与元素周期律1、下列说法是否正确,为什么?(1)主量子数为1时,有两个方向相反的轨道;(2)主量子数为2时,有2s,2p两个轨道;(3)主量子数为2时,有4个轨道,即2s,2p,2d,2f;(4)因为H原子中只有一个电子,故它只有一个轨道;(5)当主量子数为2时,其角量子数只能取一个数,即l =1;(6)任何原子中,电子的能量只与主量子数有关。
2、试判断下表中各元素原子的电子层中的电子数是否正确,错误的予以更正,并简要说明理由。
3、第6能级组有哪些能级?分别用量子数或轨道符号表示:4、试讨论在原子的第4电子层(N)上:(1)亚层数有多少?并用符号表示各亚层。
(2)各亚层上的轨道数分别是多少?该电子层上的轨道总数是多少?(3)哪些轨道是等价轨道?5、写出与下列量子数相应的各类轨道符号,并写出其在近似能级图中的前后能级所对应的符号:(1)n=2, l=1(2) n=3, l =2(3) n=4, l =0(4) n=4, l =36、在下列各项中,填入合适的量子数:(1)n=?, l=2, m=0, m s=±1/2(2)n=2, l=?, m=-1, m s=±1/2(3)n=4, l=?, m=+2, m s=±1/2(4)n=3, l=0, m=?, m s=±1/27、指出下列假设的电子运动状态(依次为n,l,m, m s),哪几种不可能存在?为什么?(1)3,2,+2,+1/2 (2)2, 2, -2, +1/2(3)2, 0, +1, -1/2 (4) 2, -1, 0, +1/2(5) 4, 3, -1, 18、原子吸收能量由基态变成激发态时,通常是最外层电子向更高的能级跃迁。
试指出下列原子的电子排布中,哪些属于基态或激发态,哪些是错误的。
(1)1s2 2s2 2p1(2)1s2 2s2 2p62d1(3) 1s22s22p43s1(4) 1s2 2s4 2p29、写出原子序数为45,52,79各元素的原子核外电子排布式及其价层电子构型。
无机化学s区元素测试题及答案

无机化学s区元素测试题及答案一、选择题(每题2分,共10分)1. 以下哪种元素属于s区元素?A. 锂(Li)B. 钠(Na)C. 氧(O)D. 氯(Cl)答案:B2. s区元素的价电子排布是什么?A. ns^2B. ns^2np^xC. nd^xns^2D. (n-1)d^xns^2答案:A3. s区元素中,哪个元素的原子半径最大?A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)答案:D4. s区元素中,哪个元素的电负性最高?A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)答案:A5. 下列化合物中,哪一个是s区元素形成的?A. NaClB. MgOC. SO2D. CO2答案:A二、填空题(每题2分,共10分)1. s区元素包括碱金属元素和______元素。
答案:碱土金属2. 碱金属元素的原子序数从______到______。
答案:3 到 113. 碱土金属元素的原子序数从______到______。
答案:12 到 184. s区元素的电子亲和能通常______。
答案:较低5. s区元素的电负性通常______。
答案:较低三、简答题(每题5分,共20分)1. 描述s区元素的一般化学性质。
答案:s区元素通常具有较低的电负性,容易失去最外层的电子形成阳离子,表现出强碱性,与水反应生成氢气和相应的碱。
2. 解释为什么碱金属元素的原子半径随着原子序数的增加而增大。
答案:碱金属元素的原子半径随着原子序数的增加而增大,是因为随着核电荷的增加,电子云的屏蔽效应增强,使得外层电子受到的吸引力减弱,从而导致原子半径增加。
3. 碱土金属元素与碱金属元素相比,其化学性质有何不同?答案:碱土金属元素的电负性比碱金属元素高,因此它们更容易形成化合物,并且它们的金属性比碱金属元素弱。
4. 举例说明s区元素在日常生活和工业中的应用。
答案:s区元素在日常生活和工业中有广泛的应用,例如钠(Na)用于制造食盐,钾(K)用于农业肥料,钙(Ca)用于建筑材料和骨骼强化,铯(Cs)用于原子钟等。
高三化学无机化学练习题及答案

高三化学无机化学练习题及答案1. 题目:元素周期表和原子结构答案:在元素周期表中,元素按照原子序数的大小排列,原子序数表示了一个原子核中的质子数。
原子由质子、中子和电子组成。
原子核中质子和中子质量远大于电子的质量,电子在原子的外层环绕核运动。
2. 题目:元素周期表的分类答案:元素周期表根据元素的性质和化学特性进行了分类。
通常分为金属、非金属和半金属三大类。
金属具有良好的导电性和导热性,大多数元素属于金属。
非金属大多数为气体或者是脆性固体,导热和导电性较差。
半金属则介于金属和非金属之间,具有一部分金属和非金属的性质。
3. 题目:键合与离子半径答案:原子通过化学键进行结合形成分子或晶格。
共价键是由两个非金属原子之间通过电子共享而形成的。
离子键是由一个金属和非金属原子之间通过电子转移而形成的。
键长与原子半径有关,原子半径较小的元素常常形成较短的键。
4. 题目:化合价与元素周期表答案:化合价是一个元素在化合物中与其他元素结合的电荷数目。
化合价与元素在元素周期表中的位置有关。
在周期表中,化合价一般等于主族元素的主量子数。
5. 题目:氧化还原反应答案:氧化还原反应是指元素的氧化态和还原态发生变化的化学反应。
在氧化还原反应中,氧化剂接受电子,还原剂损失电子。
电子的转移导致物质的氧化和还原。
6. 题目:氧化物和酸碱性答案:氧化物是由氧元素和其他元素形成的化合物。
氧化物的碱性和酸性取决于其中金属元素和氧化物之间的化学键。
金属氧化物通常具有碱性性质,而非金属氧化物通常具有酸性性质。
7. 题目:化学计量与物质的组成答案:化学计量是指在化学反应中物质的质量关系。
化学计量可以用化学方程式表示。
化学方程式中的系数表示了物质的摩尔比例关系,从而确定了物质的组成。
8. 题目:尿素的合成和应用答案:尿素是一种有机化合物,通常用于肥料和农业上,也被应用于许多其他领域,如塑料、医药和化妆品工业。
尿素的合成可以通过氨和二氧化碳的反应产生。
第四版无机化学习题及答案

第四版无机化学习题及答案第一章原子结构和原子周期系1-1根据原子序数给出下列元素的基态原子的核外电子组态:(a)K (b)Al (c)Cl (d)Ti(Z=22)(e)Zn(Z=30)(f)As(Z=33)答:(a)[Ar]4s1(b)[Ne]3s23p1(c)[Ne]3s23p5(d)[Ar]3d54s2(e)[Ar] 3d104s1(f)[Ar]4s24p31-2给出下列原子或离子的价电子层电子组态,并用方框图表示轨道,填入轨道的电子用箭头表示。
(a)Be (b)N (c)F (d)Cl-(e)Ne+(f)Fe3+(g)As3+1-3 Li+、Na+、K+、Rb+、Cs+的基态的最外层电子组态与次外层电子组态分别如何?1-4以下+3价离子那些具有8电子外壳?Al3+、Ga3+、Bi3+、Mn3+、Sc3+答:Al3+和Sc3+具有8电子外壳。
1-5已知电中性的基态原子的价电子层电子组态分别为:(a)3s23p5(b)3d64s2(c)5s2(d)4f96s2(e)5d106s1 试根据这个信息确定它们在周期表中属于那个区、哪个族、哪个周期。
答:(a)p区,ⅦA族,第三周期(b)d区,Ⅷ族,第四周期(c)s区,ⅡA族,第五周期(d)f区,ⅢB族,第六周期(e)ds 区,ⅠB族,第六周期1-6根据Ti、Ge、Ag、Rb、Ne在周期表中的位置,推出它们的基态原子的电子组态。
答:Ti位于第四周期ⅣB族,它的基态原子的电子组态为[Ar]3d24s2;Ge位于第四周期ⅣA族,它的基态原子的电子组态为[Ar]3d104s24p2;Ag位于第五周期ⅠB族,它的基态原子的电子组态为[Kr] 4d105s1;Rb位于第五周期ⅠA族,它的基态原子的电子组态为[Kr] 5s1;Ne位于第二周期0族,它的基态原子的电子组态为[He] 2s22p6。
1-7某元素的基态价层电子构型为5d36s2,给出比该元素的原子序数小4的元素的基态原子电子组态。
无机化学p区元素习题

P区元素习题目录一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题 (返回目录)1 硼在自然界主要以含氧化合物的形式存在。
()2 在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。
()3 硼酸是三元酸。
()4 硼是非金属元素,但它的电负性比氢小。
()5 由于B-O键键能大,所以硼的含氧化合物很稳定。
()6 硼砂的化学式为Na2B2O7。
()7 B2H6为平面形分子。
()8 硼是缺电子原子,在乙硼烷中含有配位键。
()9 三卤化硼熔点的高低次序为BF3<BCl3<BBr3<BI3。
()10 三卤化硼沸点的高低次序为BF3>BCl3>BBr3>BI3。
()11 地壳中丰度最大的金属元素是铝。
()12 Al2O3是两性氧化物,因而各种晶型的Al2O3既可溶于酸,又可溶于碱。
()13 只有在强酸性溶液中才有Al(H2O)63+存在。
()14 在气相中三氯化铝以双聚分子Al2Cl6的形式存在。
()15 AlX3都是共价型化合物。
()16 KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17 在氯化氢气流中加热金属铝可制得无水AlCl3。
()19 因AlCl3分子中Al为缺电子原子,所以AlCl3中有多中心键。
()20 碳酸盐的溶解度均比酸式碳酸盐的溶解度小。
()21 Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。
()22 硅在地壳中的含量仅次于氧。
()23 分子筛是人工合成的硅铝酸盐,具有吸附和催化作用。
()24 活性炭具有吸附作用,它是颗粒状的石墨。
()25 金刚石比石墨更稳定,即使在纯氧气中,金刚石也不能燃烧。
()26 一般情况下,CO2不能助燃,但是镁在二氧化碳气体中能燃烧。
()27 高纯度的硅和锗是良好的半导体。
()28 金刚石与石墨是同素异形体,由金刚石转变为石墨的△r H>0。
无机化学练习题(含答案)

无机化学练习题(含答案)第1章原子结构与元素周期系1-1试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-2Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
1-3氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?1-4周期系中哪一个元素的电负性最大?哪一个元素的电负性最小?周期系从左到右和从上到下元素的电负性变化呈现什么规律?为什么?1-5什么叫惰性电子对效应?它对元素的性质有何影响?1-6当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是121.6nm;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是656.3nm。
问哪一个光子的能量大?1-7有A,B,C,D四种元素。
其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数。
D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1-8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型。
(1)A,B,C为同一周期活泼金属元素,原子半径满足A>B>C,已知C有3个电子层。
(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
第2章分子结构2-1键可由-、-p和p-p原子轨道“头碰头”重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的键分别属于哪一种?2-2NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
2-3一氧化碳分子与酮的羰基(>C=O)相比,键能较小,键长较小,偶极矩则小得多,且方向相反,试从结构角度作出解释。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢、稀有气体1.氙的氟化物是很好的氧化剂,其原因是(D )(A) 氧化性强 (B) 还原到氙 (C) 不污染反应体系 (D) A 、B 、C 都是 2.下列分子或离子中,几何构型不是正四面体的一组是( D )(A) SO 42-,ClO 4-,PO 43- (B) SiCl 4,SnCl 4,CCl 4 (C) BF 4-,B(OH)4-,BH 4-(D) SF 4,XeF 4,SeF 43.用化学方程式表示H 2 的三种主要工业制法和两种较为方便的实验室制法。
工业上高温:CH 4 + H 2O −→−CO + 3H 2 CO + H 2O −→−CO 2 + H 2 C + 2H 2O −→−CO 2 + 2H 2 实验室常温: 2HCl + Zn −→−ZnCl 2 + H 2 NaH + CH 3OH −→−NaOCH 3 +H 2 4.举出第2/IIA 、第11/IB 和第16/VIA 族元素氢化合物的实例并进行归类,他们当中有无能参与形成氢键的物种?第2族:MgH 2,盐型;第11族:CuH ,过渡型;第16族:H 2O ,分子型。
三例当中只有H 2O 形成氢键硼族元素1.铝在空气中燃烧时,生成(D )(A) 单一化合物Al 2O 3 (B) Al 2O 3和Al 2N 3 (C) 单一化合物Al 2N 3 (D) Al 2O 3和AlN 2. BF 3通入过量的Na 2CO 3溶液,得到的产物是( C )(A) HF 和H 3BO 3 (B) HBF 4和B(OH)3 (C) NaBF 4和NaB(OH)4 (D) HF 和B 4O 3 3.从分子轨道理论出发,可以认为在B 2分子中存在的化学键是(C )(A) 三中心二电子键 (B) 一个σ 键 (C) 二个单电子π 键 (D) 一个σ 键和一个π 键 4. BX 3分子若再接受一对电子,分子重排需要能量最大的是( A )(A) BF 3 (B) BCl 3 (C) BBr 3 (D) 不能比较5. H 3BO 3是极弱的一元酸,在定量分析中不能直接用强碱滴定,如果加一定量的甘油或甘露醇(己六醇),生成配合物 HOCHCH 2OCH 2BOCH 2OCH 2CHOHH 后,因酸性大为增强,则就可滴定了。
6. BF 3的几何构型为平面三角形,而BF 4-的几何构型为正四面体。
BF 3中的B —F 键长比BF 4-中的键要短。
7. BF 3与BCl 3的水解方程式分别为 4BF 3 +3H 2O = H 3BO 3 + 3H[BF 4]和BCl 3 + 3H 2O =H 3BO 3 + 3HCl 。
8. 为什么BH 3不存在,而BF 3却能稳定存在,其原因是什么? BH 3系缺电子分子,不稳定,极易形成B 2H 6。
BF 3也属缺电子分子,但BF 3中的F 原子有未成键的p 孤电子对,它可以提供出来,与B 的空轨道形成大π 键,补偿了缺电子的性质,因此BF 3就很稳定,能单独存在。
9. 为什么BCl 3能强烈地水解?写出水解反应式。
因为BCl 3的配位数为3,还有一空轨道可给H 2O 分子的未配电子对进攻:HH +B ClClCl=O H HB Cl Cl Cl=HO B ClCl+ H + + Cl -第一步的水解产物二氯氢氧化硼继续与水反应,重复配位和取代作用,最后得H 3BO 3和 HCl 。
BCl 3 + 3H 2O =H 3BO 3 + 3HCl10. 苯和无机苯(B 3N 3H 6)为等电子体,都具有环状结构,但无机苯与HCl 能发生加成反应,而苯却不能,试简要说明原因。
苯和无机苯都为共轭体系,但由于B 和N 的电负性差异使得离域π 键的电荷分布不均匀,即电荷分布主要是定域在N 原子,导致离域π 键不稳定,与极性分子易发生加成反应,加成时,N 为Lewis 碱中心,B 为Lewis 酸中心。
11. 写出下列各物种的结构式,并指出中心原子B 的杂化轨道类型:(1) BF 3·NH 3 BF F FN HH ,B 以sp 3杂化 (2)(BO )233-B OBOB OO--O O-3-,B 以sp 2杂化(3) [B 4O 5(OH)4]]2-OOB B O B OHOO OOB OHHH2-,B 有sp 2和sp 3两种杂化方式碳族元素1. IV A 族元素从Ge 到Pb ;下列性质随原子序数的增大而增加的是( A )(A) +2氧化态的稳定性 (B) 二氧化物的酸性 (C) 单质的熔点 (D) 氢化物的稳定性 2. 试判断 Ge 、Sn 、Pb 分别与浓HNO 3作用时,正确的说法是( C ) (A) 三元素都被氧化成 +2价 (B) 三元素都被氧化成 +4价 (C) Ge 和Sn 被氧化成 +4价,但Pb 却被氧化成 +2价 (D) Ge 被氧化成 +4价,但Sn 和Pb 只却被氧化成 +2价 3. 下列硫化物,能溶于Na 2S 溶液生成硫代酸盐的是( B ) (A) SnS (B) SnS 2 (C) PbS (D) Bi 2S 3 4. 下列说法不正确的是(D )(A)HCO 3-可通过氢键形成双聚离子 (B) NaHCO 3的热稳定性不如NaCO 3高 (C) BeCO 3在热水中就可发生分解 (D) 所有碱金属碳酸盐都是易溶于水的 5. 将过量SiF 4通入NaOH 溶液中,主要产物是( C )(A) H 4SiO 4,NaF (B) Na 2SiO 3,NaF (C) Na 2SiO 3,Na 2SiF 6 (D) SiO 2,HF 6. 下列分子中,C 与O 之间键长最短的是(A )(A) CO (B) Ni(CO)4 (C) CO 2 (D) CH 3COOH 7. 鉴别Sn 4+和Sn 2+离子,应加的试剂为( D )(A) 盐酸 (B) 硝酸 (C) 硫酸钠 (D) 硫化钠(过量) 8. 分离SnS 和PbS ,应加的试剂为( D )(A) 氨水 (B) 硫化钠 (C) 硫酸钠 (D) 多硫化铵 9 在气态C 2中,最高能量的电子所处的分子轨道是( C )(A) σ 2p (B) σ *2p (C) π 2p (D) π *2p 10.由于SnCl 2极易__水解__和__被氧化__,所以在配制SnCl 2水溶液时,必须先将SnCl 2溶于较浓的盐酸溶液中,而后还要加入少量_锡粒。
11.由碳或硅形成的化合物中,碳原子间能以单键、双键、叁键结合,而硅原子间很难以双键结合,其原因是C 原子半径较小而电负性较大易形成稳定的σ 单键及π 键;Si 原子半径较大而电负性较小难形成π 键进而构成复键。
12.用> 或 < 号表示下列各对碳酸盐热稳定性的大小。
(A) Na 2CO 3 > BeCO 3 (B) NaHCO 3 < Na 2CO 3 (C) PbCO 3 < CaCO 313. C 和O 的电负性相差较大,但CO 分子的偶极矩却很小。
其原因是由于CO 的结构可表示为C O 在CO分子内有一个由O 单方面提供一对电子而形成的配位键。
从而使分子中电子云重心不再明显偏向电负性较大的O的一方,而移向C 的一端,使C 端反而略带负电即配位键的形成削弱了由于C 与O 电负性差别,使偶极矩变小。
14. 两种区别开NaHCO 3和Na 2CO 3的方法是:(1) NaHCO 3固体加热有CO 2气体产生,而Na 2CO 3加热到熔融也不分解; (2) NaHCO 3溶液的pH 值(~8)小于Na 2CO 3液的pH 值(~ 11)。
15.将Cl 2通入Pb(II)的碱性溶液中,这时发生的反应是 Pb(OH)4-+ Cl 2 =PbO 2 + 2Cl - + 2H 2O 。
16. K 2CO 3与HCl(aq),Na 2SiO 3与酸反应的化学方程式分别是K 2CO 3 + 2HCl −→−2KCl + H 2O +CO 2 和Na 2SiO 3 + 2H +−→−2Na + + SiO 2·H 2O(硅胶) 17.在Sn(II)的强碱溶液中加入硝酸铋溶液,发生变化的化学方程式为:3Sn(OH)3-+ 2Bi 3+ + 9OH - =3Sn(OH)62-+ 2Bi ↓(黑)18.HF 腐蚀SiO 2玻璃的反应方程式为SiO 2 + 4HF −→−2H 2O +SiF 4 SiF 4 + 2HF −→−H 2SiF 6 19. 一般教科书中把CO 32-离子的结构写为:C O OO2-(1) 试说明上述结构中的键合情况;(2) 但实验数据表明,其中C —O 键是等价的,而不是上述的非等价形式,仿照苯中的大π键(非定域键)更确切的表示CO 32-的结构。
(1) C 原子通过sp 2杂化,形成三个σ 键,键角120°。
C 的第四个价电子和三个氧原子上的价电子及二个负电荷的电子组成离域π 键∏46键。
(2) COO O2-20. 绘出分离和鉴定Pb 2+、Bi 3+ 和Sn 4+ 三种离子的示意图。
21. 回答关于CO 分子的下列问题:(1) 用分子轨道理论说明CO 分子中的键级;分子轨道表示(σ 1s )2 (σ 1s *)2 (σ 2s )2 (σ 2s *)2 (σ 2px )2 (π 2py )2 (π 2pz )2 键级=(10 - 4) / 2=3 (2) CO 分子为什么能作配合物的配位体?举二例此类配合物;CO 作为配位体是因为它的孤电子对和金属原子的空轨道形成σ 键;此外CO 分子中的反键轨道(π 2p *)和金属原子的d 电子形成反馈键如羰基化合物Fe(CO)5、Ni(CO)4等 (3) 举例说CO 的还原性。
如在反应 CuO + CO== Cu + CO 2 FeO + CO ==Fe + CO 2 中CO 起还原剂作用 22.有一种白色固体,可能是SnCl 2、SnO 2、PbCl 2、PbSO 4中的一种,由下列实验判断,该白色固体是什么化合物?写出有关方程式。
(1) 加水生成悬浊液;(2) 将该白色固体加入盐酸中溶解后,滴加碘淀粉溶液可以褪色;(3) 通H 2S 于白色固体的盐酸溶液中,得到棕色沉淀,沉淀与H 2O 2反应又析出白色沉淀。
根据实验现象可判断此化合物为SnCl 2,发生的各步反应如下:(1) SnCl 2 + H 2O = Sn(OH)Cl ↓ + HCl (2) SnCl 2 + I 2 + 4HCl =H 2SnCl 6 + 2HI(3) SnCl 2 + H 2S =SnS ↓(棕色) + 2HCl (4) SnS + 2H 2O 2 =Sn(OH)4↓(白色) + S ↓23.碳与硅为同族元素,SiCl 4和CCl 4结构相似,且根据:CCl 4(l) + 2H 2O(l) =CO 2(g) + 4HCl(g)m r G ∆= -377 kJ ·mol -1SiCl 4(l) + 2H 2O(l) =SiO 2(s) + 4HCl(g)m r G ∆= -282 kJ ·mol -1CCl 4(l)的水解比SiCl 4(l) 的水解在热力学上趋势更大。
