九年级化学《碳的化学性质》
人教版九年级上册化学6.1.2碳的化学性质教学设计及说课

一、教学目标
(一)知识与技能
1.理解碳的化学性质,掌握碳的化学符号、原子结构、电子排布等基本知识。
2.学习碳的化学反应,如燃烧、还原、氧化等,了解其在生产、生活中的应用。
3.学会使用碳的性质进行实验操作,如制备二氧化碳、检测碳的存在等。
4.掌握碳的同素异形体(如金刚石、石墨、富勒烯等)的性质及用途。
-设想一:通过比较金刚石、石墨、富勒烯等碳的同素异形体的结构模型,引导学生理解其性质差异。
-设想二:设计问题情境,让学生运用所学知识解释日常生活中的碳相关现象,巩固对难点知识的掌握。
3.创设互动式教学环境,鼓励学生提问、讨论,激发学生的思维活力。
-设想一:开展小组讨论,让学生针对碳的化学性质和应用互相提问、解答。
-设想二:组织课堂问答,检验学生对碳的性质知识的掌握程度,并及时给予反馈。
4.注重课后巩固和拓展,通过布置适量的作业和实践活动,提高学生对知识的运用能力。
-设想一:设计具有挑战性的课后实验题目,鼓励学生自主探究碳的化学性质。
-设想二:布置研究性学习任务,让学生调查碳在生活中的应用,撰写研究报告。
5.关注学生的情感态度,激发学习兴趣,提高学生的学习积极性。
提示:可以从碳的燃烧、还原、氧化反应以及二氧化碳的制备和检测等方面展开论述。
2.设计一组实验,验证碳的化学性质,并记录实验过程和结果。实验题目如下:
-实验一:碳的燃烧反应
-实验二:碳的还原反应
-实验三:二氧化碳的制备和检测
要求:实验操作规范,数据记录准确,实验报告不少于500字。
3.深入了解碳的同素异形体,如金刚石、石墨、富勒烯等,并分析它们在结构和性质上的差异。请同学们绘制一份关于碳同素异形体的思维导图,要求涵盖以下内容:
《碳的化学性质》教案及说课稿
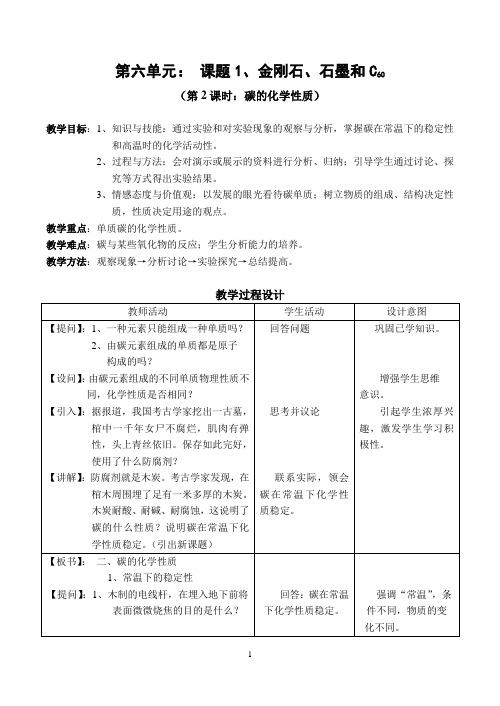
第六单元:课题1、金刚石、石墨和C60(第2课时:碳的化学性质)教学目标:1、知识与技能:通过实验和对实验现象的观察与分析,掌握碳在常温下的稳定性和高温时的化学活动性。
2、过程与方法:会对演示或展示的资料进行分析、归纳;引导学生通过讨论、探究等方式得出实验结果。
3、情感态度与价值观:以发展的眼光看待碳单质;树立物质的组成、结构决定性质,性质决定用途的观点。
教学重点:单质碳的化学性质。
教学难点:碳与某些氧化物的反应;学生分析能力的培养。
教学方法:观察现象→分析讨论→实验探究→总结提高。
明光市教学开放日公开教学教案——《碳的化学性质》明光市教学开放日公开教学教案——《碳的化学性质》附:板书计划✍二、碳的化学性质 1、常温下的稳定性2、碳与氧气的反应(可燃性) C+O 2点燃CO 22C+O 2点燃2CO3、碳与某些氧化物的反应(还原性) C+2CuO高温CO 2↑+2Cu (与金属氧化物反应)(黑色粉末) (红色粉末)澄清的石灰水变浑浊反应后的粉末中有红色物质3C+2Fe 2O 3高温3CO 2↑+4Fe(红色粉末) (黑色粉末)澄清的石灰水变浑浊反应后的粉末中有黑色物质 C+CO 2高温2CO (与非金属氧化物反应)均放出热量现象现象第六单元:“碳的化学性质”——九年级化学一、教材分析本单元(或课题)的特点是实验较多,联系生产和生活实际的内容也较多。
无论是讲物理性质,还是化学性质,都应尽可能地从演示实验引出;对一些不能在课堂演示的实验,可密切联系生产、生活实际,使学生听起来倍感亲切,接受起来比较自然,这样便于学生从它们的性质了解它们的用途。
教学目标:1、知识与技能:通过实验和对实验现象的观察与分析,掌握碳在常温下的稳定性和高温时的化学活动性。
2、过程与方法:会对演示或展示的资料进行分析、归纳;引导学生通过讨论、探究等方式得出实验结果。
3、情感态度与价值观:以发展的眼光看待碳单质;树立物质的组成、结构决定性质,性质决定用途的观点。
教案《碳的化学性质》

全国中小学“教学中的互联网搜索”优秀教学案例评选教案设计初中化学(二碳的化学性质)一.教案背景1.面向学生:中学2.学科:化学3.课时:1课时二.教学课题第六单元碳和碳的氧化物课题 1 金刚石、石墨和C60第 2 课时二碳的化学性质能力目标:发展和培养学生的实验观察能力和从现象到本质的思维能力。
教学目标:1.了解单质碳在常温下稳定,在高温下化学活动性强。
2.掌握单质碳的可燃性和还原性。
教学重点:单质碳的化学性质。
教学难点:碳单质跟氧化铜、二氧化碳的化学反应。
三.教材分析人教版初中化学九年级上册第六单元《碳和碳的氧化物》课题1《金刚石、石墨和C60》共分2个课时,第1课时上第一部分一.碳的单质,本教案是第2课时,教材内容是二. 碳的化学性质。
本课题是初中学生学习氧气、氢气之后首次全面学习的固态非金属单质。
此节内容起着承上启下的作用,它是氧气、氢气学习的继续,同时为后面学习金属单质打下基础。
本节课要充分运用学生已学知识进行新知识的学习,已增长学生的知识链、能力链,并联系实际生活、联系科学研究进行教学提高学生学习兴趣。
在探究式教学过程中,引导学生自主探究,创新思维。
碳与氧化铜反应是学生学习的难点,通过实验,掌握单质碳的可燃性、还原性、稳定性。
实验时要引导学生着重观察两个问题,澄清石灰水发生了什么变化,试管里的粉末发生了什么变化,根据实验现象,由学生自己分析碳与氧化铜反应生成了什么物质,教师加以指导,写出反应的化学方程式,然后分析这个反应中,反应物和生成物的关系,引出还原反应,说明碳有还原性。
四. 教学方法及教学思路主要教学法①谈话法;②总结归纳法;③阅读法;④实验观察法。
教学思路由碳原子排列方式不同,决定了碳的几种单质的物理性质不一样,但碳原子的核外电子排列方式相同,决定它们的化学性质相似,引入碳的化学性质。
由于碳原子最外层有四个电子,在化学反应中不易得失电子,决定了碳的化学性质不活泼,即具有稳定性,可用于绘制字画。
九年级化学单质碳的化学性质

单质碳的化学性质1、常温下碳单质的化学性质。
2、碳具有可燃性:在氧气充足的条件下燃烧的化学方程式:在氧气不充足的条件下燃烧的化学方程式:3、碳在高温下可以夺取含氧物质中的氧元素,表现出性,可以用来。
(1)碳还原氧化铜的化学方程式:;实验的现象:。
实验注意事项:酒精灯加网罩的作用:;实验结束后,等到冷却后再将试管中的固体倒出,可以防止。
(2)碳还原氧化铁的化学方程式:(3)碳还原四氧化三铁的化学方程式:(4)碳还原二氧化碳的化学方程式:(5)碳和水在高温下制取水煤气:注:碳参加还原反应都要条件。
二氧化碳制取的研究1、工业上制取CO2的原理:2、实验室制取CO2:(1)药品:固态的:与液态的(2)原理:(3)实验装置:发生装置:根据和来确定,选择型发生装置制取。
收集装置:根据气体的和气体的溶解性确定,选择法收集,选择方法收集,因为。
空气的平均相对分子质量。
CO2的检验方法:;反应的化学方程式:。
CO2的验满方法:。
二氧化碳1、CO2的物理性质:(1)常温下CO2是颜色、气味的气体,于水,密度比空气。
(2)CO2在低温下可形成冰块状固体,俗称________。
该物质在升华时能___________,因此可以做制冷剂,用于________,还可以用作干冰灭火器。
2、二氧化碳的化学性质:(1)CO2________________________,可以用来灭火。
(2)二氧化碳可以与水反应,生成的________能使紫色石蕊溶液变______。
但是反应生成的物质不稳定,在加热时分解,已经变成红色的石蕊变为_______。
CO2与水反应的化学方程式________________________。
(3)二氧化碳可以使澄清的石灰水________。
次反应可以用于________________。
该反应的化学方程为________________________________________________3、CO2的用途:CO2是植物__________的原料,可以作_________。
初中九年级上册化学(人教版):碳单质的化学性质

合作讨论
结合本节课所学知识,你认为这个装置还需 要改进吗?如何改进?
单质碳的化学性质
潜伏训练
一、化学性质不活泼
1、古代的字画为何可以长久保持而不变色? 2、埋木桩之前,常要把埋入地里的那段用火微微 烧焦,这是为什么?
东 晋 王 羲 之 《 长 风 帖 》
二、可燃性
潜伏训练
精讲释疑 为何这位男士会晕倒在房间呢?
①
②
碳与某些氧化物的反应
①气密性检验 ②装药 ③固定装置 ④点燃酒精灯。 ⑤移出导管,停止加热。
1、固定装置过程中应该注意那些问题?
2、实验结束时,为何要先移出导管,再熄灭酒精 灯?
3、已知铜在受热的情况下, 容易被氧化。那这装置需要 改进吗?
Байду номын сангаас 三、还原性
失氧,被还原
2CuO + C =高=温= 2Cu + CO2
还原性
合作讨论
3、还原性——冶炼金属
(1)利用焦炭从铁矿中炼铁的化学方程式
(2)小组内还能想出利用碳冶炼出其他金属吗, 请写出化学方程式?
人教版初中九年级化学《第六单元课题1第二课时 碳的性质》评课稿(方案1)

初中化学《第六单元课题1第二课时碳的化学性质》评课稿(方案1)第二课时碳的化学性质本节课是初中化学第六章课题一的第二课时《碳的化学性质》,本节课注重从学生熟悉的日常事物着手来创设学习情景,教师积极引导学生去发现问题,充分发挥以学生为主体,以教师为主导的教学思路,通过“提出问题(发现问题)→实验探究→得出结论”这一系列活动来认识物质的性质,分析现象后得出结论,然后由物质的性质推导出物质的用途,激发学生积极主动地去探究、去学习,培养了学生科学的学习态度,使其真切地体验到探究学习的乐趣,从而收到了良好的教学效果。
教师结合科学发展的现实向学生说明随着科学研究的不断深入,对物质的了解也会更加细致,从而激发学生对科学的向往,激发学生自觉学习的动力。
亮点一:教师能够对演示实验——碳还原氧化铜,进行改进,使实验现象更明显,更直观的展示在学生面前这说明了教师的创新精神,这给学生一个感性的教材。
亮点二:在碳和氧气的反应不充分反应中,生成一氧化碳的讲解中注重引入生活中的例子,煤气中毒事件,并用图片展示出严重的后果,从而使安全教育达到更好的效果。
不足之处:有点紧张,教态不太自然;讲得不够流畅,与学生的互动较少,课堂气氛不够活跃。
本次化学教学活动对我的启发:教师无论在课堂还是课后都要善于思考,理论与实践相结合,多点对自己的教学进行反思和总结,不断修正自己的教学方法,树立正确的教学观念,与时俱进。
增加对学生的了解,多和学生沟通和交流,接收学生在学习化学上存在的疑问等有效信息,有针对性地进行教学。
同时也能增加师生的感情,令课堂气氛愉快,促进师生互动,增大教学效果。
提高化学用语的表述能力,提高化学教师的专业素养。
多留意教学上的细节方面,给学生打下扎实的化学基础。
多媒体的使用要恰当:注意课件,板书,视频,实验之间的平衡。
不要过渡依赖多媒体,忽视实验的重要性;也不要太过注重传统教学模式,忽视多媒体的作用。
初中化学《碳的化学性质》教学PPT课件

知1-练
2 用墨书写字,虽年久仍不变色,这是因为墨中主要成
分碳在常温下具有( ) B
A.可燃性
B.稳定性
C.还原性
D.氧化性
知1-练
3 用木制电线杆时,常把埋入地下部分表面烧焦,其主 要目是( ) D A.烧死蛀虫 B.使木杆变硬 C.烘干木材 D.使表面形成化学性质稳定炭层
知识点 2 碳可燃性
知2-导
知2-讲
【例2】下列有关碳化学性质描述中正确是( ) D A.碳具有可燃性,燃烧时一定生成二氧化碳 B.碳充分燃烧时放热,不充分燃烧时吸收热量 C.木炭可以燃烧,金刚石不能燃烧 D. C60 在氧气中充分燃烧化学方程式为: 点燃 C60+60O2 ==== 60CO2
知2-讲
导引:碳单质都具有可燃性,燃烧产物与氧气量有关. 金刚石、石墨、木炭、C60 等碳单质具有相似化学 性质.如木炭具有可燃性,石墨、金刚石在一定条件 下也能燃烧.碳单质燃烧产物与氧气量有关,氧气充 足时会生成二氧化碳,氧气不充足时生成一氧化碳, 不过都会放出热量.
知2-讲
问题
回顾木炭在氧气中燃烧实验,燃烧现象是什么?
发出白光,放出热量, 生成一种能使澄清 石灰水变浑浊气体.
知2-导
归纳
知2-导
化学方程式:C+O2==点=燃==CO2 木炭在氧气中不充分燃烧时,生成一氧化碳. 化学方程式:2C+O2=点==燃==2CO
【视频播放】金刚石在液态氧气中燃烧.
(来自《点拨》)
总结
知2-讲
物质燃烧时,反应物浓度会影响反应现象,如: 1.氧气浓度不同,燃烧剧烈程度不同
如木炭在氧气中剧烈燃烧,发出白光,在空气 中燃烧时不剧烈,发出红光;硫在氧气中燃烧发出 明亮蓝紫色火焰,在空气中燃烧发出微弱
《碳的化学性质》教案及说课稿

《碳的化学性质》教案及说课稿教学目标:1. 让学生了解碳的基本化学性质,如可燃性、还原性和稳定性。
2. 使学生掌握碳单质和碳的化合物之间的转化关系。
3. 培养学生的实验操作能力和观察能力,提高学生的科学思维能力。
教学内容:第一章:碳的基本化学性质1.1 碳的可燃性1.2 碳的还原性1.3 碳的稳定性第二章:碳单质之间的转化2.1 碳的氧化反应2.2 碳的还原反应2.3 碳的置换反应第三章:碳的化合物之间的转化3.1 碳酸盐的与分解3.2 碳酸的与分解3.3 碳氢化合物的转化第四章:碳的氧化物4.1 一氧化碳的与性质4.2 二氧化碳的与性质4.3 一氧化碳和二氧化碳的鉴别方法第五章:碳的卤化物5.1 碳卤化物的制备与性质5.2 碳卤化物的结构与命名5.3 碳卤化物的反应特点教学方法:1. 采用问题驱动的教学方法,引导学生思考和探索碳的化学性质。
2. 通过实验和观察,培养学生的实践操作能力和观察能力。
3. 利用多媒体教学,生动展示碳的化学反应过程,提高学生的学习兴趣。
教学评估:1. 课堂问答:检查学生对碳的化学性质的理解和掌握程度。
2. 实验报告:评估学生在实验中的操作能力和观察能力。
3. 课后作业:巩固学生对碳的化学性质的知识点。
教学资源:1. 实验仪器和试剂:进行碳的化学性质实验。
2. 多媒体教学设备:展示碳的化学反应过程。
3. 教材和参考书:提供碳的化学性质的相关知识。
教学步骤:第一章:碳的基本化学性质1.1 碳的可燃性1. 介绍碳的可燃性概念。
2. 进行碳的可燃性实验,观察实验现象。
3. 分析碳的可燃性原因。
1.2 碳的还原性1. 介绍碳的还原性概念。
2. 进行碳的还原性实验,观察实验现象。
3. 分析碳的还原性原因。
1.3 碳的稳定性1. 介绍碳的稳定性概念。
2. 进行碳的稳定性实验,观察实验现象。
3. 分析碳的稳定性原因。
第二章:碳单质之间的转化2.1 碳的氧化反应1. 介绍碳的氧化反应概念。
