分析化学 T
分析化学中t检验的名词解释

分析化学中t检验的名词解释在分析化学中,t检验(t-test)是一种常用的统计方法,用于比较两组数据之间的差异性是否显著。
它是由英国统计学家William Sealy Gosset(更为人所熟知的是他的笔名Student)于1908年提出的。
1. t检验的基本原理t检验基于t分布,是统计学中一类常见的概率分布。
当数据符合特定条件(包括总体近似正态分布、总体方差未知等)时,t检验可以使用t分布进行推断。
t分布相对于正态分布拥有更宽的尾部,这意味着它可以更好地处理样本量较小的情况。
2. t检验的类型根据研究设计和实验目的的不同,t检验可以分为两种类型:独立样本t检验和配对样本t检验。
2.1 独立样本t检验独立样本t检验用于比较两组独立的样本之间的差异。
例如,我们可以通过独立样本t检验来确定两种不同施肥方式对作物生长的影响是否显著。
2.2 配对样本t检验配对样本t检验适用于对同一组样本进行两次测量,比较两次测量结果之间的差异是否显著。
例如,我们可以通过配对样本t检验来验证某种新药物在治疗前后的疗效是否有统计学上的显著差异。
3. t检验的计算步骤进行t检验时,我们需要按照以下步骤进行计算:3.1 收集数据首先,我们需要收集所需的数据样本。
对于独立样本t检验,我们需要分别获得两个独立群体的数据;对于配对样本t检验,我们需要获取同一群体的两个相关变量的数据。
3.2 计算均值和标准差接下来,我们计算每个样本的均值和标准差。
均值表示数据的中心趋势,标准差表示数据的离散程度。
3.3 计算t值根据独立样本t检验和配对样本t检验的具体公式,我们可以计算得出t值。
t 值表示样本之间的差异程度,t值越大说明差异越显著。
3.4 判断差异的显著性最后,我们使用t分布表来查找对应t值的显著性。
通常,在设定的显著性水平(如α=0.05)下,查找t分布表中的临界值。
如果计算得到的t值大于临界值,则可认为差异是显著的。
4. t检验的应用场景t检验在分析化学中广泛应用于各种实验设计和数据分析中。
分析化学2.1.2.2-有限次测量数据的误差分布-t分布
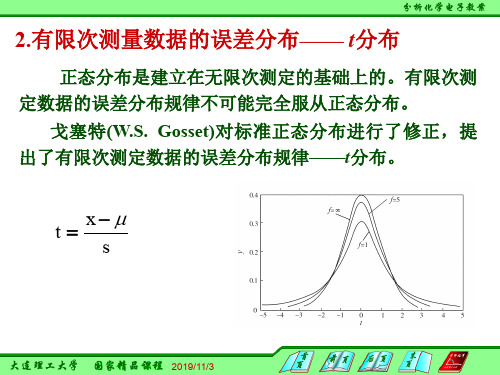
正态分布是建立在无限次测定的基础上的。有限次测 定数据的误差分布规律不可能完全服从正态分布。
戈塞特(W.S. Gosset)对标准正态分布进行了修正,提 出了有限次测定数据的误差分布规律——t分布。
t x
s
2019/11/3
t分布
t 分布曲线形状与自由度 f 有关。自由度 f 与测定次 数 n 有关(f = n – 1),所以 f 对 t 分布的影响实质上也 就是测定次数对 t 分布的影响。
当 f = ∞时,t 分布 曲线与标准正态分布 曲线完全重合。
标准正态分布看做 t分布的极限状态 。
2019/11/3
t 值表
t值表是将积分值(即概率)固定,而列出了相应的 t 值。其目的是应用更为方便。表中每一个 t 值所对应的概 率都是双侧值,即±t 之间所夹曲线下的面积。
2019/11/3
分析化学需记忆的公式

标准溶液1.00 mL,搅拌平衡后,测得钙离子电极电位为-
0.0483 V (对SCE)。试计算原水样中Ca2+的浓度。 解: Cx C 10E / S 1
C CS VS VX
1
E 0.0619 0.0483
1
S
K
a1
K
a2
共轭酸碱体系(HA-A-)
H
ca cb
K
a
pH pK
a
lg
cb ca
酸(碱)滴定可行性条件
Et:终点误差
pH
Et
10
10
pH 1 2
pH=pHsp-pHep Kt:滴定反应常数
c sp K t
csp:终点时反应物浓度
E t 0 .1 % pH 0 . 3
MY MY MY K MY M Y M Y M Y
lg K ' MY lg KMY lg MY lg M lg Y
EDTA的副反应系数Y
H
YH
Y N i
Y
N
Y ' Y
Ox cOx / Ox
Ox cOx Ox / Ox Re d cRe d Re d / Re d
Re d cRe d / Red
0 . 059 n lg Ox
Ox
/ Re d
Ox
'
lg x 'x c x '
'
x x
'
cx
c
Z E 0.059
定量分析化学知识点

定量分析化学知识点一、第二章1.真值:是指在某一时刻、某一位置、某一情况下,等量的效应体现的客观值或实际值。
2.准确度:测定值(x)与真值(T)之间的符合程度,它说明了测定值的可靠性。
(准确定的高低用误差表示,误差的大小事衡量一个测定值的不确定性的尺度,反应测量准确度的高低,误差越小,测量的准确性越高。
)3.△绝对误差(Ea)测定值的平均值与真值之差,正负皆可。
Ea=x(平均值)-T4.△相对误差(Er)为绝对误差与真值的比值,没有单位。
Er=Ea/T*100%5.绝对偏差(di)和相对偏差。
用来衡量每一个测定值的可靠程度。
di=xi-x(平均值)dr=di/x(平均值)*100%6.平均偏差(d(平均数))与相对平均偏差(dr(平均数))d(平均数)={|d1|+|d2|+…+|dn|}/ndr(平均数)={d(平均数)/x(平均数)}*100%7.标准偏差(S)越小,精密度越高。
f(自由度)=n-1相对标准偏差(Sr)(p12页)标准偏差在平均值中所占的百分率Sr=S/x(平均值)*100%8.极差R=xmax-xmin9.类似正态分布,t=x-μ/S10.可疑值11.置信区间,在某一t值时,测定值x落在(μ±tS)内的概率。
测定值x落在此范围外的概率为(1-P),用α表示(1-P),称为显著水平或置信系数、显著性水准等。
μ(置信区间)=x(平均值)±t(S/根号n)12.有效数字分析工作中是技能测得到的数字。
包括从仪器上准确读出的数字和最后一位估计数字。
第三章1.滴定度:滴定度以每毫升标准溶液含有标准物质的质量(g)来表示,符号为Ts(s表示标准物质的化学式),或表示每毫升标准溶液相当于被测物质的质量(g),符号位Ts/x(x是被测物质的化学式)第四章酸碱滴定法1.能给出质子(H+)的物质是酸,能够接受质子的物质是碱。
分析化学公式和计算

分析化学公式和计算文件编码(TTU-UITID-GGBKT-POIU-WUUI-0089)1、准确度:指测量值与真值之间相互接近的程度,用“误差”来表示。
(1)、绝对误差:测量值x 与真值μ的差值,δ=x -μ(2)、相对误差:指绝对误差在真值中所占的比值,以百分率表示:%100%⨯=μδ%2、精密度:指对同一样品多次平行测量所得结果相互吻合的程度,用“偏差”来表示。
(1)、绝对偏差:d=x i -x(x i 表示单次测量值,x 表示多次测量结果的算术平均值)平均偏差:d =nd d d d n++++......321=nxxni i∑=-1(2)、相对偏差:xd ×100%相对平均偏差:xd×100%3、标准偏差:样本标准偏差S=1)(21--∑=n x xni i相对标准偏差(RSD)%=xs ×100%例:测定铁矿石中铁的质量分数(以%表示),5次结果分别为:%,%,%,%和%。
计算:⑴平均偏差⑵相对平均偏差⑶标准偏差⑷相对标准偏差⑸极差解:套以上公式4、平均值的精密度:用平均值的标准偏差来表示ns s x x=平均值的置信区间:nts x ±=μ 5、异常值的取舍:Q 检验:Q=最小最大紧邻可疑x x x x--G 检验:sx x G q -=6、t 检验和F 检验⑴题目提供的数据与具体数值μ(权威数据)比较,t 检验: t=n sx μ-,如计算出来的值小于查表值,说明无显着性差异。
⑵题目提供两组数据比较,问两组数据是否有显着性差异时,F 检验+t 检验: F 检验:判断精密度是否存在显着性差异。
F=2221ss (1s 是大方差,2s 是小方差,即1s 〉2s ),计算值小于,说明两组数据的精密度不存在显着性差异,反之就有。
两组数据F 检验无显着性差异后,进行两个样本平均值的比较:212121n n n n s x x t R+•-=,)1()1()1()1(21222121-+--+-=n n n s n s s R ,如果计算出来值小于查表值,表示两测量平均值之间无显着性差异。
分析化学完整版课件

误差的表示方法
1.绝对误差:(absolute error) =x-
x> 为正误差,x< 为负误差 2.相对误差:(relative error)
(/)100%
例题:某人称量真实值为0.0020g 和0.5000g 的 两个样品,称量结 果分别为0.0021g和0.5001g。计算 绝对和相对误差。
•对化学物质的测定 化学和生物活 性物质瞬时跟踪监测和过程控制
•解析型分析策略 整体型综合分 析策略(分析完整的生物体内的基因、 蛋白质、代谢物、通道等各类生物元 素随时间、空间的变化和相互关联, 获取复杂体系的多维综合信息)
•提高选择性、灵敏度和智能化水平
第三节 分析化学的方法分类
1. 按照分析任务分类
4.10(-0.02) 0.0050(+0.0001)/1.97(-0.04)
解:R=4.10×0.0050/1.97=0.0104 SR/R=[(-
0.02/4.10)2+(0.0001/0.00500)2 + (-0.04/1.97)
五、提高分析结果准确度的方法
方法选择 减小测量误差 增加平行测定次数,减小偶然误差 消除测量中的系统误差
小结绝对误差和相对误差系统误差和偶然误差定义特点来源等精密度的表示方式以及相互间的运算准确度与精密度的关系误差的传递提高分析结果准确度的方法有效数字及其运算法则有效数字的判断有效数字的修约有效数字的运算规则有限量测量数据的统计处理统计概念回顾正态分布t分布总体均数的区间估计数据统计检验的基本步骤相关与回归第三章滴定分析法概论anintroductiontotitrimetricanalysis滴定分析将一种已知准确浓度的试剂溶液标准溶液滴加到被测物质的溶液中根据所加试剂溶液的浓度和体积计算出被测物质的量
分析化学
titrimetric analysis
1
基本内容和重点要求
掌握滴定分析法的特点、分类、对化学反应的要 求; 掌握基准物质的概念和要求,常用的基准物质及 其应用; 掌握标准溶液的配制方法、浓度的表示方法、滴 定度的概念和计算; 熟练掌握滴定分析中的各种计算。
2
第一节 滴定分析法和滴定方式
7
滴定分析法的特点: 滴定分析法的特点: 1)用于常量组分的测定 2)仪器简单、操作简便 仪器简单、 3)快速准确 4)应用广泛
8
滴定分析对化学反应的要求及滴定的方式与 分类
1、要求 、 确定的化学计量关系 反应能定量完成( 反应能定量完成(> 99.9%) ) 反应迅速 有合适的指示终点的 指示剂 2、方式 、 直接滴定 返滴定 间接滴定 置换滴定 3、分类 、 反应类型 酸碱滴定 络合滴定 氧化还原滴定 沉淀滴定 终点确定方法 目测滴定法 电位滴定法 光度滴定法
也叫摩尔比。
34
18
滴定分析常用基准物质
标定对象 名称 碳酸氢钠 十水合碳酸钠 无水碳酸钠 碳酸氢钾 硼砂 二水合草酸 邻苯二甲酸氢钾 重铬酸钾 溴酸钾 碘酸钾 铜 三氧化二砷 草酸钠 碳酸钙 锌 氧化锌 氯化钠 氯化钾 硝酸银 基准物质 化学式 NaHCO3 Na2CO3.10H2O Na2CO3 KHCO3 Na2B4O7 .10H2O H2C2O4.2H2O KHC8H4O4 K2Cr2O7 KBrO3 KIO3 Cu As2O3 Na2C2O4 CaCO3 Zn ZnO NaCl KCl AgNO3 NaHCO3 Na2CO3 Na2CO3 KHCO3 Na2B4O7 .10H2O H2C2O4.2H2O KHC8H4O4 K2Cr2O7 KBrO3 KIO3 Cu As2O3 Na2C2O4 CaCO3 Zn ZnO NaCl KCl AgNO3 270~300 270~300 270~300 270~300 放在装有NaCl和蔗糖饱 放在装有 和蔗糖饱 和溶液的干燥器中 室温空气干燥 105~110 120 180 180 室温干燥器中保存 硫酸干燥器中保存 105 110 室温干燥器中保存 800 500~550 500~550 硫酸干燥器中保存 干燥后组成 干燥条件/° 干燥条件 °C
分析化学实验报告
10、当水的硬度较大时,在pH≈10会析出CaCO3沉淀,使溶液浑浊:
HCO3—+ Ca2++ OH—== CaCO3↓+ H2O
这种情况下,滴定至“终点”时出现返回现象,使终点难以确定,测定结果重现性差。为了防止Ca2+、Mg2+的沉淀,可量取水样100.0mL,放入一小块刚果红试纸,用1:1盐酸酸化至试纸变蓝色,振摇两分钟后,再如前述进行测定。
铬黑t指示剂51称取05铬黑t加20ml三乙醇胺用水稀释至100ml氨氯化铵缓冲溶液ph10溶解20gnhcl于少量水中加入100ml浓氨水用水稀释至1四实验步骤1005moll1edta溶液的配制取edta2na2h57g加100ml蒸馏水专业资料温热使固体快速溶解用蒸馏水稀释至300ml摇匀贮存于聚乙烯瓶中备用
2、滴加氨试液至溶液呈微黄色,应边加边振摇,如果出现Zn(OH)2沉淀,可用稀HCl调回,使沉淀溶解。
3、配位反应为分子反应,反应速度不如离子反应速度快,因此近终点时,滴定速度不宜太快。
4、铬黑T与Mg2+显色的灵敏度高,与Ca2+显色的灵敏度低,当水样中钙含量很高而镁含量很低时,往往得不到敏锐的终点。可在水样中加入少许Mg-EDTA,利用置换滴定法的原理来提高终点变色的敏锐性,或者改用K-B指示剂。
(mg·
三、【实验试剂和仪器】
仪器:分析天平,台秤,酸式滴定管,烧杯,锥形瓶,量筒,聚乙烯瓶,酒精灯,pH试纸,洗瓶,碱式滴定管,吸移管,吸耳球,试剂瓶,称量瓶。
试剂与材料:EDTA-2Na·2H2O(A.R),ZnO(基准试剂),盐酸,铬黑T指示剂:铬黑T 0.1g与NaCl 10g研细混匀;
分析化学T——精选推荐
分析化学T分析化学模拟试卷班级姓名教师分数⼀( )、选择题,请将正确的答案编号填⼊下表题序号后的空格中(每空2分,10⼩题共20分)1、⽤NaOH标准溶液测定FeCl3溶液中的游离HCl时,Fe3+将产⽣沉淀⽽引起⼲扰,可消除其⼲扰的物质是:(A) Na2H2Y (B) CaY2-(C) 柠檬酸三钠(D) 三⼄醇胺2、对正态分布特性描述错误的是:(A) 在x=x处有最⼤值(B) µ值的任何变化都会使正态曲线沿着x轴平移,但曲线的形状不变(C) 改变σ会使峰加宽或变窄,但µ仍然不变(D) 在x=±σ处有两个拐点3、总体平均值的95%置信区间的含义是:(A) 有95%的测量值包含在此区间内(B) 平均值落在此区间的概率为95%(C) 有95%的把握该区间把总体平均值µ包含在内(D) 测量值x落在对µ左右对称的区间4、以下关于随机误差的叙述正确的是:(A) ⼤⼩误差出现的概率相等(B) 正负误差出现的概率相等(C) 正误差出现的概率⼤于负误差(D) 负误差出现的概率⼤于正误差5、下列⼏种误差属于系统误差的是:(1) ⽅法误差(2) 操作误差(3) 仪器和试剂误差(4) 环境的温度、湿度、灰尘等造成的误差(A)1,3,4 (B)1,2,4 (C)1,2,3 (D)2,3,46、强酸滴定弱碱,以下指⽰剂中不适⽤的是:(A) 甲基橙(B) 甲基红(C) 酚酞(D) 溴酚蓝(p T = 4.0)7、在下列四个数据中,两位有效数字的是:(1)1.80 (2)0.180(3)K a=1.8×10-5(4)pH=1.80(A) 1,2 (B) 3,4 (C) 1,4 (D) 2,38、对阿波罗11号从⽉球上取回的⼟样中碳的质量分数w(C) 作了四次平⾏测定,得到的数据(%)为1.30×10-4,1.62×10-4,1.60×10-4和1.22×10-4。
分析化学范文
分析化学范文分析化学是化学的一个重要分支,主要研究物质的成分、结构和性质的分析方法和技术。
它在生产、科研和生活中都有着重要的应用价值。
本文将从分析化学的基本概念、主要内容和应用领域等方面进行介绍和分析。
分析化学是研究物质成分和结构的一门学科,它的基本任务是确定物质的成分和性质。
分析化学的主要内容包括定性分析和定量分析两个方面。
定性分析是指确定物质中所含化学成分的种类和性质,主要包括离子的分析和有机物的分析。
定量分析是指确定物质中各种成分的含量,主要包括重量分析和容量分析。
分析化学的方法主要包括化学分析法、物理分析法和仪器分析法三种。
化学分析法是利用化学反应来确定物质的成分和性质,物理分析法是利用物理性质来确定物质的成分和性质,仪器分析法是利用各种仪器设备来进行分析。
分析化学在生产、科研和生活中都有着广泛的应用。
在生产中,分析化学可以用于原料的分析、产品的质量控制和环境的监测等方面。
在科研中,分析化学可以用于新物质的发现、物质结构的确定和反应机理的研究等方面。
在生活中,分析化学可以用于食品的安全检测、药品的质量控制和环境污染的治理等方面。
总之,分析化学在各个领域都发挥着重要的作用。
分析化学是化学的一个重要分支,它的研究对象是物质的成分、结构和性质。
分析化学的主要内容包括定性分析和定量分析两个方面,方法主要包括化学分析法、物理分析法和仪器分析法三种。
分析化学在生产、科研和生活中都有着广泛的应用,对于推动社会发展和改善人们生活质量起着重要的作用。
希望通过本文的介绍和分析,能够增加人们对分析化学的了解,进一步推动分析化学的发展和应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析化学模拟试卷
班级姓名教师分数
一( )、选择题,请将正确的答案编号填入下表题序号后的空格中(每空2分,10小题共20分)
1、用NaOH标准溶液测定FeCl3溶液中的游离HCl时,Fe3+将产生沉淀而引起干扰,可消
除其干扰的物质是:
(A) Na2H2Y (B) CaY2-(C) 柠檬酸三钠(D) 三乙醇胺
2、对正态分布特性描述错误的是:
(A) 在x=x处有最大值
(B) μ值的任何变化都会使正态曲线沿着x轴平移,但曲线的形状不变
(C) 改变σ会使峰加宽或变窄,但μ仍然不变
(D) 在x=±σ处有两个拐点
3、总体平均值的95%置信区间的含义是:
(A) 有95%的测量值包含在此区间内
(B) 平均值落在此区间的概率为95%
(C) 有95%的把握该区间把总体平均值μ包含在内
(D) 测量值x落在对μ左右对称的区间
4、以下关于随机误差的叙述正确的是:
(A) 大小误差出现的概率相等(B) 正负误差出现的概率相等
(C) 正误差出现的概率大于负误差(D) 负误差出现的概率大于正误差
5、下列几种误差属于系统误差的是:
(1) 方法误差
(2) 操作误差
(3) 仪器和试剂误差
(4) 环境的温度、湿度、灰尘等造成的误差
(A)1,3,4 (B)1,2,4 (C)1,2,3 (D)2,3,4
6、强酸滴定弱碱,以下指示剂中不适用的是:
(A) 甲基橙(B) 甲基红
(C) 酚酞(D) 溴酚蓝(p T = 4.0)
7、在下列四个数据中,两位有效数字的是:
(1)1.80 (2)0.180
(3)K a=1.8×10-5(4)pH=1.80
(A) 1,2 (B) 3,4 (C) 1,4 (D) 2,3
8、对阿波罗11号从月球上取回的土样中碳的质量分数w(C) 作了四次平行测定,得到的数
据(%)为1.30×10-4,1.62×10-4,1.60×10-4和1.22×10-4。
则w(C) 的平均值为:
(A)1.435×10-4(B)1.44×10-4(C)1.40×10-4(D)1.4×10-4
9、在含有Fe3+和Fe2+的溶液中,加入下述何种溶液,Fe3+/Fe2+电对的电位将升高(不考虑离
子强度的影响):
(A) 稀H2SO4(B) HCl
(C) NH4F (D) 邻二氮菲
10、分光光度计检测器直接测定的是:
(A) 入射光的强度(B) 吸收光的强度
(C) 透过光的强度(D) 散射光的强度
二( )、填空题,请将合适的内容填入题中下划线的空格内(每空格2分,20空格共40分)
1、在以K2Cr2O7法测定Fe2O3的含量时,0.0100 mol/L K2Cr2O710.0 mL 相当于Fe2O3
______________________ mg 。
[M r(Fe2O3)= 159.7]
2、含磷0.35 μg/mL的标准液显色后,测得吸光度为0.450,同条件下测含磷未知液吸光度
为0.540,则未知液中磷的浓度为_______________mg/L。
3、在pH=5.5的HAc缓冲溶液中,以0.010 mol/L EDTA滴定同浓度的Zn2+,化学计量点后
0.1% 的pZn为__________。
若浓度均增大10倍,化学计量点后0.1%的pZn为_______。
[lg K(ZnY)=16.5,lgαY(H)=5.5]
4、用NaOH溶液滴定某一元弱酸HA,滴定至化学计量点时,需37.20 mLNaOH。
在该点
时,加入18.60 mL与NaOH同浓度的HCl溶液,测得其pH为4.30,试计算HA的K a _________。
5、以下测定和标定各应采用的滴定方式分别是:(填A,B,C,D)
(1) 用酸碱滴定法测定CaCO3试剂的纯度____
(2) 以K2NaCo(NO2)6形式沉淀,再用KMnO4滴定以测定K+ ____
(3) 用K2Cr2O7标定Na2S2O3____
(4) 用H2C2O4标定KMnO4____
(A)直接法(B)回滴法(C)置换法(D)间接法
6、一含Pb2+的试液,使Pb2+生成PbCrO4↓,沉淀经过滤洗涤后用酸溶解,加入过量KI,
以淀粉作指示剂,用Na2S2O3标准溶液滴定,则n(Pb2+):n(S2O32-)为__________________。
7、某溶液含有M和N两种金属离子,已知K(MY) > K(NY)。
lg K'(MY)先随溶液的pH增
加而增大,这是由于__________________________________________;而后当pH增加时,lg K'(MY)保持在某一定值(N在此条件下不水解),这是因为___________________________________________________________________________ ___________________________。
8、克氏法测定氮时,称取0.2800 g有机物,经消化处理后蒸出的NH3正好中和20.00 mL
0.2500 mol/L 的H2SO4,则该有机物中氮的质量分数w(N)[A r(N)=14.00]为
____________。
9、分析天平的绝对误差为±0.1mg,若要求由称样引起的相对误差不大于0.1%,最少应称
取试样______ g。
10、在pH = 5.0的HAc-Ac-缓冲介质中,以EDTA滴定Pb2+至化学计量点时,当溶液中游离
Ac-浓度增大时,pPb'sp _____________;pPb sp ___________。
(答:增大、减小或不变)
11、根据随机误差的标准正态分布曲线,某测定值出现在u = ±1.0之间的概率为68.3%,
则此测定值出现在u>1.0之外的概率为________________________。
12、在用配位滴定法进行实际试样分析时,为消除干扰组分的影响,常用的掩蔽方法有:
⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽、⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽、⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
三( )、计算题,计算下列各题(每小题5分,4小题共20分)
1( )、丁酸在苯-水体系中的分配系数K D=3(有机相中浓度与水相中的浓度之比),当100 mL 0.10 mol/L丁酸溶液用25 mL苯萃取时,计算在(a) pH=4.00;(b) pH=10.00时
丁酸在苯中的浓度?
(丁酸根离子不被萃取、丁酸的p K a=4.8)
2( )、将15 mmol氯化银沉淀置于500 mL氨水中,已知氨水平衡时的浓度为0.50 mol/L,计算溶液中游离的Ag+离子浓度。
[已知Ag+与NH3络合物的β1=103.24、β2=107.05,K sp(AgCl)=1.8×10-10]
3( )、称取0.7000 g硫脲试样,溶解后在容量瓶中稀释至250 mL。
移取25.00 mL 试液,需要0.008333 mol/L KBrO3 15.00 mL与其定量反应,反应式如下。
计算试样中硫
脲的质量分数。
{M r[CS(NH2)2]=76.10}
3CS(NH2)2+4BrO3-+3H2O=3CO(NH2)2+3SO42-+4Br-+6H+
4( )、计算CdCO3在纯水中的溶解度。
[p K sp(CdCO3)=11.28,Cd2+基本不形成羟基络合物,H2CO3的p K a1= 6.38,p K a2=
10.25]
四( )、问答题,请回答下列问题(3小题,共20分)
1( )、钛-H2O2和钒-H2O2配合物的最大吸收波长分别在415 nm和455 nm处,取50.00 mL
1.06⨯10-3 mol/L钛-H2O2溶液,定容100 mL,以1 cm比色皿在415 nm和455 nm
处测得吸光度分别为0.435和0.246; 取25.00 mL6.28⨯10-3 mol/L钒-H2O2溶液,定
容100 mL,以1 cm比色皿在415 nm和455 nm处测得吸光度分别为0.251和0.377。
取20.00 mL钛钒混合液,加入H2O2显色后定容为100 mL,以上述相同的条件测
得A415=0.645,A455=0.553,求原混合液中钛和钒的浓度。
(10 分)
2( )、在强酸性或在Zn2+存在下,Fe(CN)63-能氧化I-,借此用间接碘量法测定Fe(CN)63-。
从以上事实判断H3Fe(CN)6和H4Fe(CN)6何者是弱酸?两者的锌盐溶解度哪个更小?
已知
ϕ(I2/I-)=0.54 V。
(5 分)
ϕ[Fe(CN)3-/Fe(CN)4-]=0.36 V,
3( )、利用共沉淀法分离,对于微量组分的测定有何意义?与无机共沉淀剂相比较,有机共沉淀剂有何优点?(5 分)。
