2020版药典新增及变化全汇总
《中国药典》2020年版(三部)生物技术产品增修订概况

中国药品标准DrugStandardsofChina2021,22(1) ·5 · 第一作者简介:赵雄,副研究员,研究方向:生物制品研发及质量控制。
Tel:010 67079598;E mail:zhaoxiong@chp org cn 通讯作者简介:郭中平,研究员,研究方向:生物制品。
Tel:010 67079561;E mail:guozhongping@chp org cn《中国药典》2020年版(三部)生物技术产品增修订概况赵雄,王晓娟,曹琰,郭中平(国家药典委员会,北京100061)摘要:生物技术产业的快速发展推动了生物技术产品国家标准的不断提升。
本文介绍了《中国药典》2020年版(三部)生物技术产品及相关通用技术要求的增修订概况,阐释了增修订的考量和特点,旨在为正确理解和执行生物技术产品国家标准提供参考。
关键词:生物技术产品;国家标准;增修订中图分类号:R921 2 文献标识码:A 文章编号:1009-3656(2021)01-0005-05doi:10 19778/j chp 2021 01 001UpdatesandAmendmentsofBiotechnologyProductsintheChinesePharmacopoeia2020(VolumeⅢ)ZHAOXiong,WANGXiaojuan,CAOYan,GUOZhongping(ChinesePharmacopoeiaCommission,Beijing100061,China)Abstract:Therapiddevelopmentofthebiotechnologyindustryhaspromotedthecontinuousimprovementofnation alstandardsforbiotechnologyproducts TheupdatesandamendmentsofbiotechnologyproductsandgeneralrequirementsintheChinesePharmacopoeia2020(VolumeⅢ)areintroduced,andtheconsiderationsandcharac teristicsoftherevisionsareexplained Thataimstoprovideareferencefortheaccurateunderstandingandimple mentationofnationalstandardsforbiotechnologyproducts.Keywords:biotechnologyproducts;nationalstandards;updatesandamendments 生物技术产品是指采用生物技术制备的、临床上用于疾病治疗的大分子生物制品[1]。
《中国药典》2020版修订内容.docx

三十一、生物制品的标签及说明书应符合“生物制品包装规程”的规定。疫苗制品的说明书应符合本版药典“人用疫苗总论”的相关原则性要求。疫苗制品的说明书应符合《中国药典》相关品种“使用说明”项下通用模板的原则要求,生产企业应依据注册申报的临床试验结果和同品种上市后监测情况等资料确定和及时更新“【不良反应】” “【禁忌】” “【注意
外源因子污染情况。
近交系(Inbred Strain)
新增
在一个动物群体中,任何个体基因组中 99%以上的等位
位点为纯合时定义为近交系。
并后再分装至一定数量细胞培养容器的一批细胞。
对 照 细 胞 (Vaccine Production Control Cell)
新增
取用于疫苗生产的同一细胞批的细胞,按一定比例留取样品,不接种目标病毒,与接种目标病毒的其他细胞采用相同的培养基成分,并在同一培养温度பைடு நூலகம்培养场地下,平行培养至规定的时间。采用规定的方法,通过对对照细胞系外源因子检测情况的判定,评估该细胞批的
《中国药典》2020版凡例增修订内容
序号
2020 版拟修订
1
十六、生产过程中抗生素和防腐剂使用的相关要求
2. 防腐剂的使用
(2)单剂量注射用冻干制剂中不得添加任何防腐剂;除另有规定外,单剂量注射液不得添加防腐剂;供静脉用的注射液不得添加任何防腐剂。
2
十七、生产及检定用动物
1、用于制备注射用活疫苗的原代动物细胞应来源于无特定病原体(SPF 级)动物;用于制备口服疫苗和灭活疫苗的原代动物细胞应来自清洁级或清洁级以上动物。其他动物组织来源的制品应符合各论的要求。所用动物应符合“生物制品实验动物质量控制”实验动物微生物学和寄生虫学检测要求(通则36013602与通则3603)的相关规定。
2020年版药典中药材、中药饮片都有哪些新变化

2020年版药典中药材、中药饮片都有哪些新变化{{中国药典}}2020年版收载品种总数计划达到6400个左右,其中:中药增加品种约220个,化学药增加品种约420个,生物制品增加品种收载30个,药用辅料增加品种约100个,药包材品种收载30个,共约800个。
药典已收载品种计划修订1400个,其中:中药500个,化药600个,生物制品150个。
中药材标准的增修订中药材是中医临床和中药产业的根本,是基础中的基础,必须建立严格、科学的标准。
(一)品种的增加与退出(1)增加收载有临床用药需求、基础研究扎实、资源(野生和栽培)丰富的品种。
(2)增加收载现版药典收载或拟收载中成药处方药味中未收入药典的中药材标准。
(3)对于野生资源枯竭、商品匮乏、存在明显安全性、伦理等问题(如化石类、人类胎盘类、动物粪便类等),以及基础研究薄弱的品种从药典中退出或不再增加收入本版药典。
(4)已有中药材品种新增基原,原则上按照“新发现中药材”进行申报注册,获得批准后,可考虑作为新的基原收入药典,但经本草考证证明属于历史误用需要正本清源的品种不在此列。
(二)中药材名称、来源和药用部位的修订与规范根据本草考证,结合中药材生产实际,对部分中药材名称、来源和药用部位进行修订;对原植、动物的科、属、种和拉丁学名、原矿物的类、族和矿石进行进一步的考证,进一步修订和规范中药材的来源。
(三)中药材采收和加工方法及药材性状的修订当前,随着中药农业的快速发展,许多常用中药材已不再依赖野生资源,实现了大规模种植养殖,且采收和加工已相对集中,并逐步实现机械化。
中国药典要顺应中药产业的变革和进步,把好质量关,本版药典须对中药材采收和加工方法及药材性状进行修订。
(1)制定中药材采收加工技术评价方法和指导原则,把中药材采收和产地加工纳入科学化、法制化轨道。
(2)收载和规范中药材趁鲜切片直接干燥的产地加工方式。
其收载品种必须符合上述指导原则的要求,仅限于部分传统采收加工方法落后,药材难以干燥且长时间干燥过程中易霉变或导致成分明显下降的中药材以及对传统采用硫磺熏蒸改用产地无硫加工方法的中药材。
中国药典2020版212个中药材及饮片品种变化数据汇总
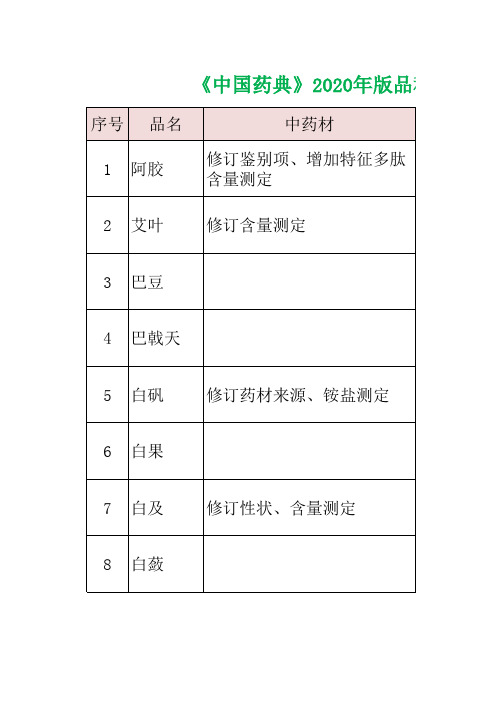
修订性状、鉴别、检查、浸出 直径由1~1.5cm改为
物,删除含量测定
0.7-1.6cm
增加显微鉴别、薄层鉴别、水 分、总灰分、酸不溶性灰分、 浸出物
修订鉴别3、增加薄荷脑含量
删除炒苍耳子苍术苷含量测 定,苍耳子、炒苍耳子含量同 药材
增加饮片性状
修订饮片性状
增加蟾酥粉性状、水分、鉴别 234、特征图谱、含量测定
200 芫花 修订鉴别2
201 远志 修订来源、性状、鉴别12
202 皂矾 修订药材来源
203 泽泻
修订来源、鉴别2、含量测 定
204 浙贝母 修订性状
205 栀子 增加重金属项
206 枳实
207 炙黄芪
208 重楼 修订薄层鉴别、含量测定
209 朱砂 增加二价汞检查
210 竹节参
修订鉴别2、增加酸不溶性 灰分、含量测定
128 青蒿
129 青礞石
130 青葙子
增加薄层鉴别、水分、总灰 分、酸不溶性灰分,删去杂 质
131 青叶胆 修订薄层鉴别
132 清半夏
133 全蝎
增加水分、总灰分、酸不溶 性灰分,修订浸出物
134 人参 增加重金属项
135 肉桂
136 三颗针
137 三七 增加重金属
138 桑白皮 139 桑螵蛸 140 桑叶 141 山豆根 修订薄层鉴别2 142 山柰 修订水分、增加含量测定 143 山香圆叶 144 山药 修订鉴别2 145 山楂 修订重金属项 146 山茱萸 增加重金属项 147 蛇蜕
增加饮片性状 增加青礞石和煅青礞石性状 修订饮片性状、检查、鉴别 修订工艺
修订性状、鉴别12、总灰分 修订工艺 增加水分、总灰分、酸不溶性 灰分,修订浸出物
2020药典三部,收载品种变化情况

本版药典(三部)新增品种名单预防类•23价肺炎球菌多糖疫苗•无细胞百白破b型流感嗜血杆菌联合疫苗•黄热减毒活疫苗•冻干人用狂犬病疫苗(人二倍体细胞)•S a b i n株脊髓灰质炎灭活疫苗(V e r o细胞)•口服I型I I I型脊髓灰质炎减毒活疫苗(人二倍体细胞)治疗类•马破伤风免疫球蛋白F(a b')2•人凝血酶•人干扰素α2b阴道泡腾片•外用人粒细胞巨噬细胞刺激因子凝胶•康柏西普眼用注射液•精蛋白人胰岛素混合注射液(30R)•精蛋白人胰岛素混合注射液(50R)•甘精胰岛素•甘精胰岛素注射液•赖脯胰岛素•赖脯胰岛素注射液•治疗用卡介苗体外诊断类•人类免疫缺陷病毒抗原抗体诊断试剂盒(酶联免疫法)•乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒1型核酸检测试剂盒二部转三部品种•人胰岛素•人胰岛素注射液•精蛋白人胰岛素注射液•注射用人生长激素本版药典(三部)采用生物制品通用名称与原通用名称对照本版药典(三部)新增的生物制品通则/总论/通则和指导原则名单一、新增的生物制品通则•生物制品通用名称命名原则二、新增的总论•人用聚乙二醇化重组蛋白及多肽制品总论•人用基因治疗制品总论•生物制品病毒安全性控制•螨变应原制品总论人用马免疫血清制品总论三、新增的通则和指导原则•3128抗毒素/抗血清制品分子大小分布测定法•3129单抗电荷变异体测定法•3130单抗N糖谱测定法•3208人血白蛋白铝残留量测定法(第二法)•3303鼠源性病毒检査法(第二法)•3307黄热减毒活疫苗猴体试验•3308禽源性病毒荧光定量P C R(Q-P C R)检查法•3407外源性D N A残留量测定法(第三法)•3428人免疫球蛋白类制品I g A残留量测定法•3429免疫化学法•3503人用狂犬病疫苗效价测定法(第二法)•3534S a b i n株脊髓灰质炎灭活疫苗效力试验•3535康柏西普生物学活性测定法•3601生物制品生产及检定用实验动物质量控制•3603重组胰蛋白酶•3650氢氧化铝佐剂•9401生物制品生物活性/效价测定方法验证指导原则•9402生物制品稳定性试验指导原则生物制品术语本版药典(三部)未收载2015年版药典(三部)及增补本中的品种名单治疗类•注射用重组链激酶体外诊断类•梅毒快速血桨反应素诊断试剂•梅毒甲苯胺红不加热血清试验诊断试剂。
《中国药典》2020年版第四部通用技术要求主要特点和增修订内容

主要特点和增修订内容2.1制剂通则论述框架和技术要求进一步完善2.1.1系统修订制剂通则整体框架0100制剂通则旨在通过对药物制剂的总体论述来指导医药工作者对不同剂型、亚剂型进行合理的应用。
《中国药典》2015年版制剂通则是《中国药典》2010年版中药、化学药和生物制品制剂通则的简单整合,缺少关键考察项的汇总和归纳。
为进一步引导生产企业全面关注制剂生产质量控制和整体要求,对0100制剂通则进行修订,主要修改包括两个方面:首先完善了叙述结构。
从药物制剂制备的原则“安全、有效、可控、依从性”的角度出发,增加对剂量单位均匀性、稳定性、安全性与有效性、剂型与给药途径、包装与贮藏和标签与说明书等部分的分论述;强调中药制剂在整个生产过程中的关键质量属性,关注每个关键环节的量值传递规律。
其次,完善了具体内容。
提出剂量单位均匀性的要求,保障制剂生产质量的批间和批内药物含量等的一致性,体现制剂全过程控制的理念;在稳定性中提出复检期概念,促进生产企业根据产品自身的稳定性特性进行前瞻性的质量考察;在安全性与有效性中提出“通过人体临床试验证明药物的安全有效性后,药物才能最终获得上市与临床应用”,提示上市制剂的处方和工艺不得随意变更。
2.1.2系统修订各制剂通则的框架和表述《中国药典》2020年版制剂通则统一了各剂型论述框架及主要制备技术的简单论述。
除0110糊剂及0186膏剂外,其他36个剂型均不同程度修订了体例格式。
为进一步统一目前各剂型的表述问题,规范统一“生产与贮藏期间应符合下列规定”项下内容,按照原辅料→工艺与技术→质量与控制→包装与使用→贮存与运输等五方面的技术要点,着重补充大多数剂型缺少的工艺与技术方面的阐述。
增加特殊亚剂型临床使用关注点,如泡腾片不得直接吞服等,指导临床合理用药。
2.1.3收载和整合临床成熟剂型和亚剂型收载和整合临床成熟剂型和亚剂型,体现《中国药典》的先进性和对我国临床成熟新制剂技术的支持。
2020中国药典三部全文内容

2020年我国药典三部(简称2020年版药典)是我国医药行业的重要文献,对于保障人民群众用药安全、推动中医药现代化、促进行业发展具有重要意义。
本篇文章将通过对2020年版药典的全文内容进行介绍,分析其对医药行业的影响以及对公众健康的意义。
一、2020年版药典的编纂背景2020年版药典是我国药典的第三次修订,是在充分吸取前两次版本的经验基础上,结合我国医药行业发展的新需求和新情况而编写的。
本次修订共分为三部,分别是《中华人民共和国药典》、《我国药典附录》和《中华人民共和国药典补编》。
编纂工作由我国药典委员会牵头,全面深化对药品的审评审核工作,力求使药品质量更加稳定可靠。
二、2020年版药典的主要内容1. 《中华人民共和国药典》《中华人民共和国药典》是我国药典的主体部分,详细收录了临床常用的中成药和西药的药材、制药工艺、理化性质、炮制鉴别、贮藏和药用等内容。
在本次修订中,《中华人民共和国药典》在原有基础上新增了多种药材,并对中药鉴别、品质评价等内容进行了全面修订,以确保药品质量的稳定和可靠。
2. 《我国药典附录》《我国药典附录》是对《中华人民共和国药典》的补充和扩展,主要包括了罕用药材和一些外国传入的新药材等内容。
在本次修订中,《我国药典附录》增加了对罕用药材的详细描述和鉴别方法,以帮助临床上遇到少见药材时的鉴别和使用。
3. 《中华人民共和国药典补编》《中华人民共和国药典补编》是对已实施的《中华人民共和国药典》进行现代化补充的部分,主要内容包括对国际通用的一些新增药材和用药技术的收录。
在本次修订中,《中华人民共和国药典补编》新增了多种国际通用的药材和药物制剂制备技术,以满足医药行业对国际化交流合作的需求。
三、2020年版药典对医药行业的影响2020年版药典的发布对医药行业有一系列的积极影响。
它为医药企业提供了权威的药品质量标准,有助于规范药品生产和监管,提高药品的质量和安全性。
它促进了中医药传统药材的保护和利用,加强了对中药材的产地保护和质量控制,推动了中医药的国际化发展。
2020药典(一 ~ 四部),新增、变化全汇总!

020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
一部中药收载2711种,其中新增117种、修订452种。
在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
新增了药材:裸花紫珠。
新增制剂:116个,具体清单如下:二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
2020年版药典二部新增品种(117个),与一部新增品种居然一样!未收载品种(8个),名称变化的品种(5个)。
具体清单如下:未收载品种(8个)本版药典(二部)未收载2015年版药典(二部)中的品种名单:•鱼肝油•重组人生长激素•注射用重组人生长激素•重组人胰岛素•重组人胰岛素注射液•精蛋白重组人胰岛素注射液•盐酸吡硫醇注射液•注射用盐酸吡硫醇新增品种(117个)本版药典(二部)新增品种名单:1.注射用门冬氨酸鸟氨酸2.马来酸氟伏沙明3.马来酸氟伏沙明片4.扎来普隆5.乌苯美司片6.丙戊酸钠缓释片(I)7.丙泊酚乳状注射液(曾用名:丙泊酚注射液)8.丙酸氟替卡松9.左卡尼汀10.左甲状腺素钠11.左甲状腺素钠片12.右佐匹克隆13.右佐匹克隆片14.卡培他滨15.卡培他滨片16.甲钴胺片17.甲钴胺注射液18.甲磺酸多沙唑嗪19.甲磺酸多沙唑嗪片20.甲磺酸多沙唑嗪胶囊21.甲磺酸瑞波西汀22.甲磺酸瑞波西汀片23.甲磺酸瑞波西汀胶囊24.兰索拉唑肠溶胶囊25.矛头蝮蛇血凝酶(曾用名:蛇毒血凝酶、血凝酶)26.注射用矛头蝮蛇血凝酶(曾用名:注射用蛇毒血凝酶、注射用血凝酶)27.地红霉素肠溶片28.地红霉素肠溶胶囊29.西尼地平胶囊30.西吡氯铵31.西吡氯铵含漱液32.西咪替丁注射液33.西洛他唑片34.托拉塞米35.托拉塞米片36.托拉塞米胶囊37.注射用托拉塞米38.吗替麦考酚酯分散片39.伏格列波糖40.伏格列波糖片41.伏格列波糖胶囊42.米氮平43.米氮平片44.那他霉素45.那他霉素滴眼液46.坎地沙坦酯片47.克霉唑阴道膨胀栓[曾用名:克霉唑栓(指含膨胀棉条的克霉唑栓)]48.更昔洛韦胶囊49.来曲唑50.来曲唑片51.吲哚美辛片52.佐米曲普坦分散片53.阿托伐他汀钙54.阿利沙坦酯55.阿利沙坦酯片56.阿那曲唑片57.苯磺酸左氨氯地平58.苯磺酸左氨氯地平片59.拉西地平60.拉西地平片61.依巴斯汀62.依巴斯汀片63.草酸艾司西酞普兰64.草酸艾司西酞普兰片65.枸橼酸坦度螺酮66.枸橼酸坦度螺酮胶囊67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]68.枸橡酸钾颗粒69.氟尿苷(曾用名:氟脲苷)70.复方氨基酸(15)双肽(2)注射液71.美司钠72.美司钠注射液73.盐酸乙哌立松74.盐酸乙哌立松片75.盐酸左布比卡因76.盐酸左布比卡因注射液77.盐酸托烷司琼片78.盐酸托烷司琼胶囊79.盐酸曲普利啶80.盐酸伊达比星81.注射用盐酸伊达比星82.盐酸奈福泮胶囊83.盐酸度洛西汀84.盐酸度洛西汀肠溶片85.盐酸度洛西汀肠溶胶囊86.盐酸羟甲唑啉87.盐酸羟甲唑啉喷雾剂88.盐酸羟甲唑啉喷鼻液89.盐酸羟苄唑90.盐酸羟苄唑滴眼液(曾用名:羟苄唑滴眼液)91.盐酸奥布卡因92.盐酸奥布卡因滴眼液93.氨糖美辛肠溶片94.氨糖美辛肠溶胶囊95.脂肪乳注射液(C14~24)(曾用名:脂肪乳注射液)96.酒石酸溴莫尼定97.酒石酸溴莫尼定滴眼液98.酚磺乙胺99.注射用酚磺乙胺100.铝碳酸镁101.铝碳酸镁咀嚼片102.葡萄糖酸钙氯化钠注射液103.硝酸益康唑阴道膨胀栓[曾用名:硝酸益康唑栓(指含膨胀棉条的硝酸益康唑栓)] 104.氯沙坦钾105.氯沙坦钾片106.氯沙坦钾胶囊107.酮咯酸氨丁三醇108.酮咯酸氨丁三醇注射液109.腺苷110.腺苷注射液[曾用名:腺苷注射液(供诊断用)]111.去氨加压素片(曾用名:醋酸去氨加压素片)112.注射用去氨加压素(曾用名:注射用醋酸去氨加压素)113.磷酸氟达拉滨114.注射用磷酸氟达拉滨115.磷酸腺嘌呤(曾用名:维生素b4)116.磷酸腺嘌呤片(曾用名:维生B4片)117.碘帕醇注射液三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新增制剂:116个,具体清单如下:
二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
2020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
一部中药收载2711种,其中新增117种、修订452种。
在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
65.枸橼酸坦度螺酮
66.枸橼酸坦度螺酮胶囊
67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]
68.枸橡酸钾颗粒
69.氟尿苷(曾用名:氟脲苷)
70.复方氨基酸(15)双肽(2)注射液
71.美司钠
72.美司钠注射液
73.盐酸乙哌立松
48.更昔洛韦胶囊
49.来曲唑
50.来曲唑片
51.吲哚美辛片
52.佐米曲普坦分散片
53.阿托伐他汀钙
54.阿利沙坦酯
55.阿利沙坦酯片
56.阿那曲唑片
57.苯磺酸左氨氯地平
58.苯磺酸左氨氯地平片
59.拉西地平
60.拉西地平片
61.依巴斯汀
62.依巴斯汀片
63.草酸艾司西酞普兰
64.草酸艾司西酞普兰片
32.西咪替丁注射液
33.西洛他唑片
34.托拉塞米
35.托拉塞米片
36.托拉塞米胶囊
37.注射用托拉塞米
38.吗替麦考酚酯分散片
39.伏格列波糖
40.伏格列波糖片
41.伏格列波糖胶囊
42.米氮平
43.米氮平片
44.那他霉素
45.那他霉素滴眼液
46.坎地沙坦酯片
47.克霉唑阴道膨胀栓[曾用名:克霉唑栓(指含膨胀棉条的克霉唑栓)]
在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
2020年版药典二部新增品种(117个),与一部新增品种居然一样!未收载品种(8个),名称变化的品种(5个)。具体清单如下:
74.盐酸乙哌立松片
75.盐酸左布比卡因
76.盐酸左布比卡因注射液
77.盐酸托烷司琼片
78.盐酸托烷司琼胶囊
79.盐酸曲普利啶
80.盐酸伊达比星
81.注射用盐酸伊达比星
82.盐酸奈福泮胶囊
83.盐酸度洛西汀
84.盐酸度洛西汀肠溶片
85.盐酸度洛西汀肠溶胶囊
86.盐酸羟甲唑啉
87.盐酸羟甲唑啉喷雾剂
88.盐酸羟甲唑啉喷鼻液
体外诊断类
人类免疫缺陷病毒抗原抗体诊断试剂盒(酶联免疫法)
乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒1型核酸检测试剂盒
二部转三部品种
人胰岛素
人胰岛素注射液
精蛋白人胰岛素注射液
注射用人生长激素
本版药典(三部)采用生物制品通用名称
口服I型III型脊髓灰质炎减毒活疫苗(人二倍体细胞)
治疗类
马破伤风免疫球蛋白F(ab')2
人凝血酶
人干扰素α2b阴道泡腾片
外用人粒细胞巨噬细胞刺激因子凝胶
康柏西普眼用注射液
精蛋白人胰岛素混合注射液(30R)
精蛋白人胰岛素混合注射液(50R)
甘精胰岛素
甘精胰岛素注射液
赖脯胰岛素
赖脯胰岛素注射液
治疗用卡介苗
未收载品种(8个)
本版药典(二部)未收载2015年版药典(二部)中的品种名单:
鱼肝油
重组人生长激素
注射用重组人生长激素
重组人胰岛素
重组人胰岛素注射液
精蛋白重组人胰岛素注射液
盐酸吡硫醇注射液
注射用盐酸吡硫醇
新增品种(117个)
本版药典(二部)新增品种名单:
1.注射用门冬氨酸鸟氨酸
2.马来酸氟伏沙明
3.马来酸氟伏沙明片
4.扎来普隆
5.乌苯美司片
6.丙戊酸钠缓释片(I)
7.丙泊酚乳状注射液(曾用名:丙泊酚注射液)
8.丙酸氟替卡松
9.左卡尼汀
10.左甲状腺素钠
11.左甲状腺素钠片
12.右佐匹克隆
13.右佐匹克隆片
14.卡培他滨
15.卡培他滨片
16.甲钴胺片
17.甲钴胺注射液
18.甲磺酸多沙唑嗪
19.甲磺酸多沙唑嗪片
20.甲磺酸多沙唑嗪胶囊
此外还将进一步完善生物制品全过程质量控制的要求,补充完善生物检测技术、方法以及相关技术指南,完善品种收载类别,加快我国近年来批准上市的、成熟的疫苗及治疗性生物药的收载。
新增品种名单
预防类
23价肺炎球菌多糖疫苗
无细胞百白破b型流感嗜血杆菌联合疫苗
黄热减毒活疫苗
冻干人用狂犬病疫苗(人二倍体细胞)
Sabin株脊髓灰质炎灭活疫苗(Vero细胞)
21.甲磺酸瑞波西汀
22.甲磺酸瑞波西汀片
23.甲磺酸瑞波西汀胶囊
24.兰索拉唑肠溶胶囊
25.矛头蝮蛇血凝酶(曾用名:蛇毒血凝酶、血凝酶)
26.注射用矛头蝮蛇血凝酶(曾用名:注射用蛇毒血凝酶、注射用血凝酶)
27.地红霉素肠溶片
28.地红霉素肠溶胶囊
29.西尼地平胶囊
30.西吡氯铵
31.西吡氯铵含漱液
89.盐酸羟苄唑
90.盐酸羟苄唑滴眼液(曾用名:羟苄唑滴眼液)
91.盐酸奥布卡因
92.盐酸奥布卡因滴眼液
93.氨糖美辛肠溶片
94.氨Байду номын сангаас美辛肠溶胶囊
95.脂肪乳注射液(C14~24)(曾用名:脂肪乳注射液)
96.酒石酸溴莫尼定
97.酒石酸溴莫尼定滴眼液
98.酚磺乙胺
99.注射用酚磺乙胺
100.铝碳酸镁
111.去氨加压素片(曾用名:醋酸去氨加压素片)
112.注射用去氨加压素(曾用名:注射用醋酸去氨加压素)
113.磷酸氟达拉滨
114.注射用磷酸氟达拉滨
115.磷酸腺嘌呤(曾用名:维生素b4)
116.磷酸腺嘌呤片(曾用名:维生B4片)
117.碘帕醇注射液
三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。
101.铝碳酸镁咀嚼片
102.葡萄糖酸钙氯化钠注射液
103.硝酸益康唑阴道膨胀栓[曾用名:硝酸益康唑栓(指含膨胀棉条的硝酸益康唑栓)]
104.氯沙坦钾
105.氯沙坦钾片
106.氯沙坦钾胶囊
107.酮咯酸氨丁三醇
108.酮咯酸氨丁三醇注射液
109.腺苷
110.腺苷注射液[曾用名:腺苷注射液(供诊断用)]
