2020版中国药典变化情况
2020年药典特点

2020版中国药典修订工作展示6大特点,预示药品质控新趋势对于中国制药行业的小伙伴们,2020年注定是充实和知识体系重新构建的一年。
2019年底修订发布的《药品管理法》为引领开启了系列法规、工作文件和指南的修订和实施工作,必将引发行业巨变和持续学习压力。
而《中国药典》2020版的修订和颁布,也必将对于药品研发、注册、生产和质控产生巨大影响。
笔者长期跟踪《中国药典》2020版的增修订工作,根据笔者的持续搜集信息和分析,为各位展示即将到来的2020版《中国药典》的崭新特点。
特点一:强化调动社会资源,对方协力推动标准提高在2010版《中国药典》实施之前,中国药典委员会的委员多来自官方机构,例如医药大学、药品检验机构。
自2015《中国药典》修订工作开启,就开始积极吸纳民间科技专家参加中国药典的各类增订和修订工作。
而在2020版《中国药典》大纲上面则强调:完善国家药品标准形成和淘汰机制,着力突出政府在国家标准制定中的主导作用和企业在产品标准制定中的主体地位,采取积极的鼓励政策和措施引导社会和行业将更多的人力、物力和财力投入到标准的研究制定,构建药品标准工作的新格局。
例如,中国药典委曾经委托中国医药设备协会承担了《中国药典》通则"制药用水"修订科研课题调研工作。
根据笔者统计,截止到2019年底,中国药典委共召开各类技术会议34次。
具体情况参见下表。
可以说,通过上面这些技术会议的召开和各类密集沟通,这版药典极大的调动了社会各界积极参与药典增订和修订和修订的工作,促进了行业交流。
特点二:大幅度增修订辅料标准,为制剂创新和质量提高夯实基础辅料在制剂开发和生产中发挥着重要作用;如果没有辅料行业的持续发展,制药行业的发展必定受到掣肘。
曾经有中国制剂人员这样感叹,即使原料药(API)的品质再好,把很好的原料药和脏的辅料混合,然后投入药品内包装中,这就是中国制剂的现状和水平。
应该说,这段感叹既表达了制剂人员的无奈和期盼,也说明持续加强辅料发展和管理的必要性。
2020年版药典中药材、中药饮片都有哪些新变化

2020年版药典中药材、中药饮片都有哪些新变化{{中国药典}}2020年版收载品种总数计划达到6400个左右,其中:中药增加品种约220个,化学药增加品种约420个,生物制品增加品种收载30个,药用辅料增加品种约100个,药包材品种收载30个,共约800个。
药典已收载品种计划修订1400个,其中:中药500个,化药600个,生物制品150个。
中药材标准的增修订中药材是中医临床和中药产业的根本,是基础中的基础,必须建立严格、科学的标准。
(一)品种的增加与退出(1)增加收载有临床用药需求、基础研究扎实、资源(野生和栽培)丰富的品种。
(2)增加收载现版药典收载或拟收载中成药处方药味中未收入药典的中药材标准。
(3)对于野生资源枯竭、商品匮乏、存在明显安全性、伦理等问题(如化石类、人类胎盘类、动物粪便类等),以及基础研究薄弱的品种从药典中退出或不再增加收入本版药典。
(4)已有中药材品种新增基原,原则上按照“新发现中药材”进行申报注册,获得批准后,可考虑作为新的基原收入药典,但经本草考证证明属于历史误用需要正本清源的品种不在此列。
(二)中药材名称、来源和药用部位的修订与规范根据本草考证,结合中药材生产实际,对部分中药材名称、来源和药用部位进行修订;对原植、动物的科、属、种和拉丁学名、原矿物的类、族和矿石进行进一步的考证,进一步修订和规范中药材的来源。
(三)中药材采收和加工方法及药材性状的修订当前,随着中药农业的快速发展,许多常用中药材已不再依赖野生资源,实现了大规模种植养殖,且采收和加工已相对集中,并逐步实现机械化。
中国药典要顺应中药产业的变革和进步,把好质量关,本版药典须对中药材采收和加工方法及药材性状进行修订。
(1)制定中药材采收加工技术评价方法和指导原则,把中药材采收和产地加工纳入科学化、法制化轨道。
(2)收载和规范中药材趁鲜切片直接干燥的产地加工方式。
其收载品种必须符合上述指导原则的要求,仅限于部分传统采收加工方法落后,药材难以干燥且长时间干燥过程中易霉变或导致成分明显下降的中药材以及对传统采用硫磺熏蒸改用产地无硫加工方法的中药材。
中国药典2020版212个中药材及饮片品种变化数据汇总
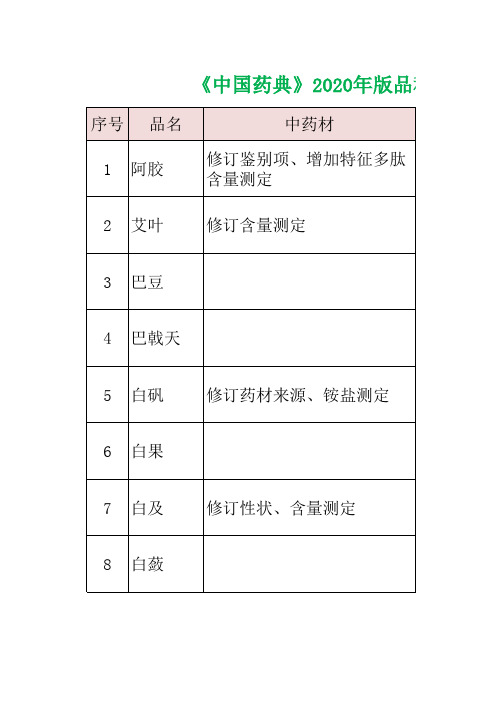
修订性状、鉴别、检查、浸出 直径由1~1.5cm改为
物,删除含量测定
0.7-1.6cm
增加显微鉴别、薄层鉴别、水 分、总灰分、酸不溶性灰分、 浸出物
修订鉴别3、增加薄荷脑含量
删除炒苍耳子苍术苷含量测 定,苍耳子、炒苍耳子含量同 药材
增加饮片性状
修订饮片性状
增加蟾酥粉性状、水分、鉴别 234、特征图谱、含量测定
200 芫花 修订鉴别2
201 远志 修订来源、性状、鉴别12
202 皂矾 修订药材来源
203 泽泻
修订来源、鉴别2、含量测 定
204 浙贝母 修订性状
205 栀子 增加重金属项
206 枳实
207 炙黄芪
208 重楼 修订薄层鉴别、含量测定
209 朱砂 增加二价汞检查
210 竹节参
修订鉴别2、增加酸不溶性 灰分、含量测定
128 青蒿
129 青礞石
130 青葙子
增加薄层鉴别、水分、总灰 分、酸不溶性灰分,删去杂 质
131 青叶胆 修订薄层鉴别
132 清半夏
133 全蝎
增加水分、总灰分、酸不溶 性灰分,修订浸出物
134 人参 增加重金属项
135 肉桂
136 三颗针
137 三七 增加重金属
138 桑白皮 139 桑螵蛸 140 桑叶 141 山豆根 修订薄层鉴别2 142 山柰 修订水分、增加含量测定 143 山香圆叶 144 山药 修订鉴别2 145 山楂 修订重金属项 146 山茱萸 增加重金属项 147 蛇蜕
增加饮片性状 增加青礞石和煅青礞石性状 修订饮片性状、检查、鉴别 修订工艺
修订性状、鉴别12、总灰分 修订工艺 增加水分、总灰分、酸不溶性 灰分,修订浸出物
中国药典2020年版四部增补本

我国药典2020年版四部增补本:全面评估与深度探讨近年来,随着中医药产业的快速发展和国际化进程的加快,我国药典也在不断更新和完善。
作为规范中药材、中药饮片、中成药等中药制剂的质量标准和国家药典,我国药典2020年版四部增补本的出台必将对中医药产业的发展起到积极推动作用。
本文将对我国药典2020年版四部增补本的内容进行全面评估,并围绕其重要意义、具体内容、以及对中医药产业的影响进行深度探讨。
一、我国药典2020年版四部增补本的重要意义我国药典是我国国家药典的简称,也是我国制订和发布的唯一具有法定地位的集中体现中药材、中药饮片、中成药等中药制剂质量标准的大部头书。
而2020年版四部增补本作为我国药典的更新内容,对于进一步规范和提高中药质量,推动中药产业升级,提升中医药产业国际竞争力具有非常重要的意义。
二、我国药典2020年版四部增补本的具体内容我国药典2020年版四部增补本主要是在原有的基础上进行修订和完善,增补了一些新的内容或者修正了一些不合理的地方。
其中包括《中华人民共和国药典》、《中华人民共和国药材》、《中华人民共和国中药饮片》、《中华人民共和国中成药》四个部分。
在这些部分中,涵盖了大量的中药材、中药饮片和中成药的制备、炮制、品质、质量标准、检验方法等内容,以及一些新的药材和新的中药制剂。
三、我国药典2020年版四部增补本对中医药产业的影响我国药典2020年版四部增补本的出台,将对中医药产业产生深远的影响。
它将提高中药质量标准,加强对中药材、中药饮片、中成药等中药制剂的质量监管,保障中药的安全有效性。
增加了一些新的药材和新的中药制剂,有利于促进中药资源的合理开发和利用。
再次,修订了一些不合理的地方,对于中药产业的规范化发展具有积极的意义。
我国药典2020年版四部增补本的出台将进一步提高中医药产业的整体水平,为中医药产业的健康发展提供坚实的保障。
四、个人观点和理解我国药典2020年版四部增补本的出台,对中医药产业的发展无疑是一件好事。
中国药典将再编,中药扩军220个,标准制订引争议!

中国药典将再编,中药扩军220个,标准制订引争议!问题:怎么才能每天收到这种文章呢?答案:只需点击上方蓝字药信达即可!日前,国家药典委员会与北京医药行业协会联合在京召开《中国药典》中药饮片标准执行与修订工作研讨会。
国家药典委员会秘书长张伟指出,2020版中国药典将更加关注中药饮片标准的完善,特别是安全标准的提升。
通过药典标准形成机制的改革完善,使标准的制订更加开放、科学、严谨。
结合前期国家药典委员会透露信息,我们发现,新版2020版药典在中药领域,新增和修订品种预计超过1600个。
其中新增中药材品种220个,修订当前中药标准500个。
2020版药典,中药方面的“扩军”原则按照“临床常用、疗效确切、使用安全、工艺成熟、质量可控”的品种遴选原则,新进入药典品种需符合以下条件:1.基础研究扎实,来源单一,有安全型和有效性研究资料,资源(野生和栽培)有保障的;2. 药典收载过,且现版药典收载的多个中成药处方中含有的;3. 药典未曾收载过,但在现版药典收载的多个中成药处方含有的,且在临床配方上有应用的;4. 单个中成药处方中含有,如果该制剂的产量和经济效益很大,原则上可考虑收录;5. 对于新收录品种,本着高标准的原则,严格要求;6. 对于已有药材品种新增基源的,原则上不考虑,应按照新药品种报批。
按照以上原则,哪些药材可能进入新版药典呢?如果有220个药材品种进入药典,则意味着在2015版药典的618种药材和饮片品种基础上,将再次大幅度扩编至838个,增幅达到35.6%,是近几版药典扩充力度最大的一次。
那么,我中心预计将有以下药材可能进入新版药典:一是进入基药目录中成药的部分原料,如桉叶、蟾皮、金樱根、獐牙菜、芒果核等;二是单个中成药配方使用,且经济效益较大的品种,如田基黄、莽草、金莲花、天青兰、桃儿七、隔山消等;三是近些年新开发且用量较大的药材或药食两用品种,如桑黄、金蝉花、溪黄草、金线莲、黄花倒水莲等;四是临床用量较为普遍,但尚未进入药典的习用品种,例如毛冬青、夜交藤、透骨草、隔山消、葫芦茶、扁豆花、白花蛇舌草、薜苈、地胆草、叶下珠、海浮石等;五是同名但功效差异较大,甚至同名异物,必须进行药典明确的品种,如黄芥子与白芥子、菥蓂与败酱草、杭菊花和菊花、芦根与苇茎等。
2020药典凡例变化解读(一)
2020药典凡例变化解读(一)写在前面:原则上,无变化内容不做解读,除非在实践中存在某些认知误区或者教训,需要进行必要的提醒。
请正确对待凡例中的一类排版错误,举一反三,以便即将到来的文件修订中避免类似错误。
凡例总则一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。
《中国药典》一经颁布实施,其所载同品种或相关内容的上版药典标准或原国家药品标准即停止使用。
解读:这里的“相关内容”主要指通用技术要求部分,以及新版药典未收载品种的检验通则等内容。
《中国药典》……现行版。
本部为《中国药典》四部。
二、《中国药典》主要由凡例、通用技术要求和品种正文构成。
凡例是为正确使用《中国药典》,对品种正文、通用技术要求以及药品质量检验和检定中有关共性问题的统一规定和基本要求。
通用技术要求包括《中国药典》收载的通则、指导原则以及生物制品通则和相关总论等。
解读:明确指出生物制品分册保留自己特有的部分通则。
注意“总论”。
《中国药典》各品种项下收载的内容为品种正文。
解读:对于标准体系的描述具备了高度的概括性,将“通则、指导原则以及生物制品通则和相关总论等”内容统一收入“通用技术要求”。
和其它国家家药典的表述趋向一致了。
三、药品标准由品种正文及其引用的凡例、通用技术要求共同构成。
本版药典收载的凡例、通则/生物制品通则、总论的要求对未载入本版药典的其他药品标准具同等效力。
解读:由上一版的“国家药品标准由凡例与正文及其引用的通则共同构成。
”的描述修订为上述描述。
突出了药品标准的“正文”的重要性。
当然,正文也有配合相应的凡例、通用技术要求产能完整使用。
四、凡例和通用技术要求中采用“除另有规定外”这一用语,……并据此执行。
无变化。
五、品种正文所设各项规定是针对符合《药品生产质最管理规范》……亦不能认为其符合规定。
无变化。
六、《中国药典》……英文缩写为ChP 。
无变化。
通用技术要求解读:调整了行文顺序,将“通用技术要求”放在了“品种正文”的章节前面,突出药典作为技术标准、技术法规的特殊性。
《中国药典》2020年版附录

《我国药典》2020年版附录一、前言我国药典作为我国药品监管的重要法定依据,一直以来承担着严格标准、严肃认真的责任,旨在保障药品的质量和安全。
2020年版的《我国药典》在原有的基础上进行了全面修订和更新,特别是增加了附录部分,以适应当今新药品种的发展和需求。
二、附录的意义附录是《我国药典》的重要组成部分,它是对《我国药典》主体内容的补充和扩展,可以更好地满足新药品种的登记注册和质量控制需求。
通过增加附录,可以及时更新和完善对于新药品种的规范要求,促进我国药品市场的健康发展,保障人民裙众的用药安全,促进医疗卫生事业的发展。
三、附录的内容2020年版的《我国药典》附录主要包括以下内容:1. 新药品种的品种名称、通用名称、化学名称和结构式等基本信息。
2. 新药品种的质量标准,包括理化性质、含量测定、杂质和微生物等方面的要求。
3. 新药品种的生产工艺、质量控制点和方法、包装储存及贮存期的规定。
4. 新药品种的临床试验方法、药代动力学、药效学等相关要求。
5. 其他对于新药品种具有重要指导意义的内容。
四、附录的作用附录是《我国药典》的重要组成部分,具有以下重要作用:1. 对新药品种进行统一规范,建立起完善的质量标准体系,提高新药品种的质量水平。
2. 为新药品种的注册审评提供参考依据,加快新药品种的上市进程,满足人民裙众对于药品的需求。
3. 引导药品生产企业和科研单位遵循规范要求,促进新药研发和生产的规范化和标准化。
4. 为监管部门提供依据,加强对新药品种的质量监督和管理,保障药品的安全有效使用。
五、展望随着我国医药产业的飞速发展,新药品种不断涌现,附录的完善将成为《我国药典》的一项重要任务。
我们也期待未来《我国药典》附录能够更加科学、系统地对新药品种进行规范,为我国药品监管事业做出更大的贡献。
在这个飞速发展的时代,我们期待《我国药典》在药品监管中发挥更为重要的作用,而《我国药典》2020年版的附录,必将成为我国药品监管工作的重要依据,为我国的药品质量和安全保驾护航。
2020版药典变化全汇总

2020版药典变化全汇总一部中药收载2711种,其中新增117种、修订452种。
新增了药材:裸花紫珠。
新增制剂:116个,具体清单如下:二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
2020年版药典二部新增品种(117个),与一部新增品种居然一样!未收载品种(8个),名称变化的品种(5个)。
具体清单如下:未收载品种(8个)本版药典(二部)未收载2015年版药典(二部)中的品种名单:•鱼肝油••重组人生长激素••注射用重组人生长激素••重组人胰岛素••重组人胰岛素注射液••精蛋白重组人胰岛素注射液••盐酸吡硫醇注射液••注射用盐酸吡硫醇•新增品种(117个)本版药典(二部)新增品种名单:1.注射用门冬氨酸鸟氨酸2.马来酸氟伏沙明3.马来酸氟伏沙明片4.扎来普隆5.乌苯美司片6.丙戊酸钠缓释片(I)7.丙泊酚乳状注射液(曾用名:丙泊酚注射液)8.丙酸氟替卡松9.左卡尼汀10.左甲状腺素钠11.左甲状腺素钠片12.右佐匹克隆13.右佐匹克隆片14.卡培他滨15.卡培他滨片16.甲钴胺片17.甲钴胺注射液18.甲磺酸多沙唑嗪19.甲磺酸多沙唑嗪片20.甲磺酸多沙唑嗪胶囊21.甲磺酸瑞波西汀22.甲磺酸瑞波西汀片23.甲磺酸瑞波西汀胶囊24.兰索拉唑肠溶胶囊25.矛头蝮蛇血凝酶(曾用名:蛇毒血凝酶、血凝酶)26.注射用矛头蝮蛇血凝酶(曾用名:注射用蛇毒血凝酶、注射用血凝酶)27.地红霉素肠溶片28.地红霉素肠溶胶囊29.西尼地平胶囊30.西吡氯铵31.西吡氯铵含漱液32.西咪替丁注射液33.西洛他唑片34.托拉塞米35.托拉塞米片36.托拉塞米胶囊37.注射用托拉塞米38.吗替麦考酚酯分散片39.伏格列波糖40.伏格列波糖片41.伏格列波糖胶囊42.米氮平43.米氮平片44.那他霉素45.那他霉素滴眼液46.坎地沙坦酯片47.克霉唑阴道膨胀栓[曾用名:克霉唑栓(指含膨胀棉条的克霉唑栓)]48.更昔洛韦胶囊49.来曲唑50.来曲唑片51.吲哚美辛片52.佐米曲普坦分散片53.阿托伐他汀钙54.阿利沙坦酯55.阿利沙坦酯片56.阿那曲唑片57.苯磺酸左氨氯地平58.苯磺酸左氨氯地平片59.拉西地平60.拉西地平片61.依巴斯汀62.依巴斯汀片63.草酸艾司西酞普兰64.草酸艾司西酞普兰片65.枸橼酸坦度螺酮66.枸橼酸坦度螺酮胶囊67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]68.枸橡酸钾颗粒69.氟尿苷(曾用名:氟脲苷)70.复方氨基酸(15)双肽(2)注射液71.美司钠72.美司钠注射液73.盐酸乙哌立松74.盐酸乙哌立松片75.盐酸左布比卡因76.盐酸左布比卡因注射液77.盐酸托烷司琼片78.盐酸托烷司琼胶囊79.盐酸曲普利啶80.盐酸伊达比星81.注射用盐酸伊达比星82.盐酸奈福泮胶囊83.盐酸度洛西汀84.盐酸度洛西汀肠溶片85.盐酸度洛西汀肠溶胶囊86.盐酸羟甲唑啉87.盐酸羟甲唑啉喷雾剂88.盐酸羟甲唑啉喷鼻液89.盐酸羟苄唑90.盐酸羟苄唑滴眼液(曾用名:羟苄唑滴眼液)91.盐酸奥布卡因92.盐酸奥布卡因滴眼液93.氨糖美辛肠溶片94.氨糖美辛肠溶胶囊95.脂肪乳注射液(C14~24)(曾用名:脂肪乳注射液)96.酒石酸溴莫尼定97.酒石酸溴莫尼定滴眼液98.酚磺乙胺99.注射用酚磺乙胺100.铝碳酸镁101.铝碳酸镁咀嚼片102.葡萄糖酸钙氯化钠注射液103.硝酸益康唑阴道膨胀栓[曾用名:硝酸益康唑栓(指含膨胀棉条的硝酸益康唑栓)]104.氯沙坦钾105.氯沙坦钾片106.氯沙坦钾胶囊107.酮咯酸氨丁三醇108.酮咯酸氨丁三醇注射液109.腺苷110.腺苷注射液[曾用名:腺苷注射液(供诊断用)]111.去氨加压素片(曾用名:醋酸去氨加压素片)112.注射用去氨加压素(曾用名:注射用醋酸去氨加压素)113.磷酸氟达拉滨114.注射用磷酸氟达拉滨115.磷酸腺嘌呤(曾用名:维生素b4)116.磷酸腺嘌呤片(曾用名:维生B4片)117.碘帕醇注射液三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020版中国药典变化情况
根据《中国药典》(2020版)公开信息,整理了2020版药典的变化内容,主要如下:
2020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
1、一部中药收载2711种,其中新增117种、修订452种。
2、在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
3、在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
4、二部化学药收载2712种,其中新增117种、修订2387种。
5、在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
6、在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
7、三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。
此外还将进一步完善生物制品全过程质量控制的要求,补充完善生物检测技术、方法以及相关技术指南,完善品种收载类别,加快我国近年来批准上市的、成熟的疫苗及治疗性生物药的收载。
8、四部收载通用技术要求361个,其中制剂通则38个(修订35个)、检测方法及其他通则281个(新增35个、修订51个)、指导原则42个(新增12个、修订12个);药用辅料收载335种,其中新增65种、修订212种。
