2-1 中国药典2015版及使用
2015版 中国药典目录介绍

558 椿皮 559 槐花 560 槐角 561 滇鸡血藤 562 满山红 563 煅石膏 564 矮地茶 565 蒲公英 566 蒲黄 567 蒺藜 568 蓍草 569 蓖麻子 570 蓝布正 571 蜂房 572 蜂胶 573 蜂蜜 574 蜂蜡 575 蜈蚣 576 路路通 577 锦灯笼 578 雷丸 579 榧子 580 榼藤子 581 槟榔 582 漏芦 583 磁石 584 罂粟壳 585 蓼大青叶 586 蔓荆子 587 蜘蛛香 588 蝉蜕 589 豨莶草 590 辣椒 591 酸枣仁 592 僵蚕 593 墨旱莲 594 暴马子皮 595 槲寄生 596 熟地黄 597 稻芽 598 蕤仁 599 蕲蛇 600 赭石 601 鹤虱
426 凌霄花 427 夏天无 428 夏枯草 429 娑罗子 430 射干 431 徐长卿 432 拳参 433 柴胡 434 核桃仁 435 桂枝 436 桃仁 437 桃枝 438 桑叶 439 桑白皮 440 桑枝 441 桑寄生 442 桑椹 443 桑螵蛸 444 桔梗 445 浙贝母 446 浮萍 447 海马 448 海风藤 449 海龙 450 海金沙 451 海螵蛸 452 海藻 453 狼毒 454 珠子参 455 益母草 456 益智 457 秦皮 458 秦艽 459 积雪草 460 粉萆薢 461 粉葛 462 臭灵丹草 463 荷叶 464 莪术 465 莱菔子 466 莲子 467 莲子心 468 莲房 469 莲须 8
338 金果榄 339 金沸草 340 金荞麦 341 金钱白花蛇 342 金钱草 343 金铁锁 344 金银花 345 金樱子 346 金礞石 347 闹羊花 348 降香 349 青风藤 350 青叶胆 351 青皮 352 青果 353 青葙子 354 青蒿 355 青黛 356 青礞石 357 鱼腥草 358 前胡 359 南五味子 360 南沙参 361 南板蓝根 362 南鹤虱 363 厚朴 364 厚朴花 365 哈蟆油 366 姜半夏 367 姜黄 368 威灵仙 369 急性子 370 枳壳 371 枳实 372 枸杞子 373 枸骨叶 374 柏子仁 375 柿蒂 376 栀子 377 洋金花 378 洪连 379 炮姜 380 牵牛子 381 独一味 7
2015年版《中国药典》

- 强化检测手段
•基因芯片技术在药物评价的应用扩大先进的、成熟的现代
分析技术的应用
•核酸分子生物学检测技术在中药材鉴别中的应用
•中药材DNA条形码分子鉴定
•二氧化硫测定(GC法)
•农药残留测定(GC-MS法)
•制定相关指导原则(药品晶型研究和晶型质量控制、中药
有害残留物限量)
2021/2/4
15
15
2021/2/4
3
3
常用的国外药典 分类:
《美国药典》 (USP)
—— 2015版药典解析
《英国药典》 (BP) 《日本药局方》 (JP) 《欧洲药典》 (Ph.Eur.)
我国药典
《中华人民共和国药典》 (Ch.P.)
《国际药典》 (Ph.Int)
《北欧药典》
《亚洲药典》等
2021/2/4
4
4
—— 2015版药典解析
2021/2/4
-新药典变化最多的一部
11
11
2015版药典 特点五:
—— 2015版药典解析 -药用辅料标准水平明显提高
2010版药典收载辅料 132种
占常用辅料比例 24%
2015版药典收载辅料 137种
占常用辅料比例49%
辅料增加率 —— 105%
注射剂使用辅料:
2010版
2015版
2
23
2021/2/4
作用:
中华人民共和国药典(CH.P.)
Pharmacopoeia of the People,s Republic of China
国务院药品监督管 理部门颁布的《中华 人民共和国药典》和 药品标准为国家药品 标准” 《中华人民 共和国药品管理法》 明确规定,“药品必 须符合国家药品标准。
《中国药典》2015版二部凡例

(3)物理常数包括相对密度、馏程、熔点、凝点、比旋度、折光率、黏度、吸收系数、 碘值、皂化值和酸值等;测定结果不仅对药品具有鉴别意义,也可反映药品的纯度,是 评价药品质量的主要指标之一。
9
凡例
十六、鉴别项下规定的试验方法,系根据反映该药品的某些物理、化学或生物学等特性所 进行的药物鉴别试验,不完全代表对该药品化学结构的确证。
二十、制剂的规格,系指每一支、片或其他每一个单位制剂中含有主药的重 量(或效价)或含量的(%)或装量;注射液项下,如为“1ml:10mg”,系 指1ml中含有主药10mg;对于列有处方或标有浓度的制剂,也可同时规定装 量规格。
11
凡例
二十一、贮藏项下的规定,系为避免污染和降解而对药品贮存与保管 的基本要求,以下列名词术语表示:
十七、检查项下包括反映药品的安全性与有效性的试验方法和限度、均一性与纯度等制备 工艺要求等内容;对于规定中的各种杂质检查项目,系指该药品在按既定工艺进行生产和 正常贮藏过程中可能含有或产生并需要控制的杂质(如残留溶剂、有关物质等);改变生 产工艺时需另考虑增修订有关项目。
对于生产过程中引入的有机溶剂,应在后续的生产环节予以有效去除。除正文已明确 列有“残留溶剂”检查的品种必须对生产过程中引入的有机溶剂依法进行该项检查外,其 他未在“残留溶剂”项下明确列出的有机溶剂或未在正文中列有此项检查的各品种,如生 产过程中引入或产品中残留有机溶剂,均应按通则“残留溶剂测定法”检查并应符合相应 溶剂的限度规定。
2
凡例
二、国家药品标准由凡例与正文及其引用的通则共同构成。本 部药典收载的凡例与四部收载的通则对未载入本部药典但经国 务院药品监督管理部门颁布的其他化学药品标准具同等效力。 三、凡例是为正确使用《中国药典》进行药品质量检定的基本 原则,是对《中国药典》正文、通则及与质量检定有关的共性 问题的统一规定。 四、凡例和通则中采用的“除另有规定外”这一用语,表示存 在与凡例或通则有关规定不一致的情况时,则在正文中另作规 定,并按此规定执行。 五、正文中引用的药品系指本版药典收载的品种,其质量应符 合相应的规定。
2015年版药典查阅与使用

或II晶型)图谱一致(通则0402)
15
水痘减毒活疫苗的无菌检查
三
预防类
178
依法检査(通则1101),应符合规定。
16
板蓝根颗粒的水分测定
一
成方制剂和单味制剂八画
1033
取本品2g,研细,加乙醇10ml,超声处理30分钟,滤过,滤液浓缩至2ml,作为供试品溶液。另取板蓝根对照药材0.5g,加乙醇20ml,同法制成对照药材溶液。再取亮氨酸对照品、精氨酸对照品,加乙醇制成每lm l各含0.lmg的混合溶液,作为对照品溶液。照薄层色谱法(通则0502)试验,吸取供试品溶液及对照品溶液各5〜10μ1、对照药材溶液2μ1,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,晾干,喷以茚三酮试液,在105°C加热至斑点显色清晰。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色
正文品种第一部分
七画
496
1.照紫外-可见分光光度法(通则0401)测定,在237nm、254nm.334nm和473nm的波长处有最大吸收,在296nm、394nm的波长处有最小吸收。
2.色谱鉴别:HPLC法,供试品主峰应与对照品主峰保留时间一致。TLC法,供试品溶液所显主斑点的位置和颜色应与对照品溶液主斑点的位置和颜色一致。
4.分散均匀性:照崩解时限检查法(通则0921)检查,不锈钢丝网的筛孔内径为水温为15〜2 5 °C ;取供试品6片,应在3分钟内全部崩解并通过筛网。
5.以动物、植物、矿物来源的非单体成分制成的片剂,生物制品片剂,以及黏膜或皮肤炎症或腔道等局部用片剂(如口腔贴片、外用可溶片、阴道片、阴道泡腾片等),照非无菌产品微生物限度检查:微生物计数
《中国药典》2015年版中药材增修订内容
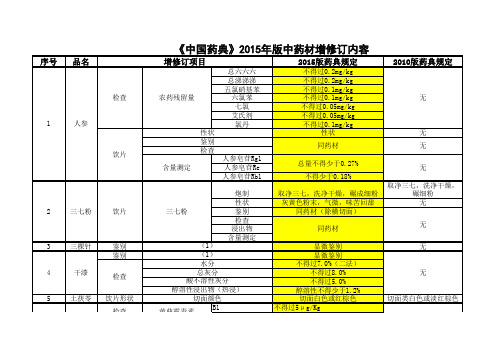
取净大黄片,照炒炭法 炒至表面焦黑色,内部 焦褐色
10 11 12
山银花 山楂 千金子
13
川木香 饮片
煨川木香
无
14 15 16 17 18 19 20 21
川贝母 川芎 广金钱草 女贞子 马兜铃 天仙子 天冬 天花粉
鉴别 性状 饮片 鉴别 鉴别 鉴别 鉴别 检查 饮片 检查 饮片
(2) (3) 表面颜色 表面颜色 (1) (1) (1) (1) 二氧化硫残留量 二氧化硫残留量 二氧化硫残留量 二氧化硫残留量 (1)
鉴别 22 天竺黄
(2) (3)
检查 性状 鉴别 检查 23 天麻 浸出物 含量测定 饮片
体积比 表面颜色 (3) 二氧化硫残留量 醇溶性浸出物 天麻素 对羟基苯甲醇 性状
贝母素乙及贝母辛 无 表面黄褐色 外表皮黄褐色 无 无 无 无 无 无 无 无 (1)溶媒为盐酸与硝酸 (1)溶媒为醋酸2滴,显色剂一滴 的等混合液,显色剂无 变化 (2)显色反应 (2)显示反应 增加天竺黄为对照药材的薄层色谱 无 鉴别 体积比:中粉10g。轻轻 中粉10g,轻轻装入量筒,体积比 装入量筒,体积比不得 不得少于24ml 少于35ml 黄白色至黄棕色 黄白色至淡黄棕色 增加对羟基苯甲醇为对照品的薄层 无 色谱鉴别 不得过400mg/Kg 无 不得少于10%,溶媒为乙 不得少于15.0%,溶媒为稀乙醇 醇 不得少于0.20% 总量不得少于0.25% 无 淡黄色至黄棕色 淡黄色至淡黄棕色
《中国药典》2015年版中药材增修订内容
序号 品名 增修订项目
总六六六 总涕涕涕 五氯硝基苯 六氯苯 七氯 艾氏剂 氯丹 性状 鉴别 检查 含量测定 人参皂苷Rg1 人参皂苷Re 人参皂苷Rb1 炮制 性状 鉴别 检查 浸出物 含量测定
2015版《中国药典》四部介绍及其在中药分析鉴定中的应用

2015 年版《中国药典》四部介绍及其在中药分析鉴定中得应用李峰2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。
2015年版《中国药典》最大得变动之一就是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规范,给药品检验实际操作带来不便得问题。
2015年版《中国药典》四部就是保证《中国药典》执行得重要基础,就是2015年版《中国药典》水平与特色得重要体现,也就是系统阐述药品检测技术、传播药典知识得良好教科书,对于强化药品监管手段,保障药品质量不断提高,促进先进检测技术应用与行业健康必将发挥积极得作用。
一、2015年版《中国药典》四部介绍2015年版《中国药典》四部内容包括凡例、通则与药用辅料。
药典通则涵盖了通用性要求、检验方法、指导原则以及试剂与标准物质等药品标准得共性要求,就是药典标准得基础,不但反映了我国药品质量控制整体状况与药品检验技术水平;同时也对规范药品研究、生产、检验、加强药品监管发挥重要作用。
现就2015年版《中国药典》四部整体情况简要介绍如下。
1、2015年版《中国药典》四部增修订整体情况2015年版《中国药典》四部收载通则总数317个,将药典一部、二部、三部制剂整合后共计38个,检测方法附录287个,其中新增通则28个 (检定方法通则27个、制剂通则1个),整合通则63个,修订通则 67 个;新增生物制品总论3个;指导原则共计30个,其中新增15个,修订10个。
辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。
2、2015年版《中国药典》四部主要特点2、1 整体提升质控水平《中国药典》凡例、通则、总论就是药典得重要组成部分,对药品标准得检测方法与限度进行总体规定,对药典以外得其她药品国家标准具同等效力。
通过对2010年版《中国药典》相关内容得全面增修订,全面完善了药典标准基本共性规定,从整体上提升对药品质量控制得要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求得药典标准体例。
《中国药典》2015一部中药材部分Word版91-258页
中国药典2015年版石榴皮• 91 •【检查】水分不得过13.0%(通则0832第二法)。
总灰分不得过6.0%。
(通则2302)。
【漫出物】照醇溶性浸出物测定法(通则2201)项下的 热浸法测定,用稀乙醇作溶剂,不得少于17.0%。
【含置测定】照髙效液相色谱法(通则0512)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶 为填充剂;以甲醇-水(68 : 32)为流动相;检测波长为334nm 。
理论板数按石吊兰素峰计算应不低于3000。
对照品溶液的制备取石吊兰素对照品适量,精密称定, 加甲醇制成每lml 含25网的溶液,即得。
供试品溶液的制备取本品中粉约〇.5g ,精密称定,置 具塞锥形瓶中,精密加人75%甲醇25ml ,密塞,称定重量,超 声处理(功率240W ,频率45kHz )20分钟,放冷,再称定重量, 用75%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法 '分别精密吸取对照品溶液与供试品溶液各 1(^1,注人液相色谱仪,测定,即得。
本品按干燥品计算,含石吊兰素(C 18 H 16 〇 )不得少于0.10%。
饮片【炮制】除去杂质,洗净,切段,干燥。
【性味与归经】苦,温。
归肺经。
【功能与主治】化痰止咳,软坚散结。
用于咳嗽痰多,瘰 疬痰核。
【用法与用置】9〜15g 。
外用适量,捣敷或煎水外洗。
【贮藏】置干燥处。
石决明ShijuemingHALIOTIDIS CONCHA本品为鲍科动物杂色鲍Haliotis diversicolor Reeve 、皱 纹盘鲍 Haliotis discus hannai Ino 、羊鲍 Haliotis ovina Gmelin 、澳洲鲍 Haliotis (Leach)、耳鲍 Haliotis asinina Linnaeus 或白鲍 Haliotis Zaen*贫 (Donovan)的贝壳。
夏、 秋二季捕捞,去肉,洗净,干燥。
2015版药典
三、《中国药典》2015年版制剂通则检查方法增修订概况
v 单剂量包装 系指按规定一次服用的包装剂量。凡例中还规定:“各品种[用法与用量] 项下规定服用范围者,不超过一次服用量最高剂量包装者也按单剂量包装 检查”
例如:一次服用量为:6-9g 规格1:每袋装9g——为单剂量包装,检查装量差异 规格2:每袋装12g——为多剂量包装,检查装量 v 重量差异检查边缘数据判断:遇有超出允许粒重范围并处于边缘者,应现
4
一、《中国药典》2015年版附录(总论)制修订概况
有关附录的规划指标
v 调整为风凡例、通则与方法、指导原则、药用辅料等单独成卷 v 开展附录整合工作
附录部分立足规范统、着重完善提高 重点:将原各部附录相同方法之间的规范统一,以解决长期以来各部之间相同方 法要求不统一的问题 v 重点抓好药典附录科研起草工作 扩大收载与修订完善制剂通则及与质量相关的检测项目 加强对药品标准检测方法、检测环境和检测条件的研究 增加新的成熟可靠的方法和修订落后的通用检测方法 进一步补充和完善主要检测方法应指导原则 增订药品生产、流通、储运等各环节的技术指导原则,全面控制药品质量 重视引导、推广国产检验仪器的发展和应5 用
与平均粒重相比较,计算出该粒得差异的百分率,再根据差异限度作为判 定。
31
1
17
二部药典
149条
2 三部药典
149条
8
一、《中国药典》2015年版附录(总论)制修订概况
序号 类别
0100 制剂通则 0200 药材及饮片相关通则 0300 药用辅料相关通则 0400 一般鉴别试验 0500 光谱法与波谱法 0600 色谱法 0700 理化性质 0800 含量测定
0900 限量检查
2015版_中国药典目录.
558 椿皮 559 槐花 560 槐角 561 滇鸡血藤 562 满山红 563 煅石膏 564 矮地茶 565 蒲公英 566 蒲黄 567 蒺藜 568 蓍草 569 蓖麻子 570 蓝布正 571 蜂房 572 蜂胶 573 蜂蜜 574 蜂蜡 575 蜈蚣 576 路路通 577 锦灯笼 578 雷丸 579 榧子 580 榼藤子 581 槟榔 582 漏芦 583 磁石 584 罂粟壳 585 蓼大青叶 586 蔓荆子 587 蜘蛛香 588 蝉蜕 589 豨莶草 590 辣椒 591 酸枣仁 592 僵蚕 593 墨旱莲 594 暴马子皮 595 槲寄生 596 熟地黄 597 稻芽 598 蕤仁 599 蕲蛇 600 赭石 601 鹤虱
74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 五加皮 五味子 五倍子 化橘红 升麻 天山雪莲 天仙子 天仙藤 天冬 天花粉 天竺黄 天南星 天麻 天然冰片(右旋龙脑) 天葵子 太子参 巴豆 巴豆霜 巴戟天 月季花 木瓜
514 鹿衔草 515 麻黄 516 麻黄根 517 黄山药 518 黄芩 519 黄芪 520 黄连 521 黄柏 522 黄精 523 黄蜀葵花 524 黄藤 525 斑蝥 526 棕榈 527 楮实子 528 款冬花 529 湖北贝母 530 滑石 531 滑石粉 532 焦栀子 533 焦槟榔 534 番泻叶 535 硫黄 536 筋骨草 537 紫石英 538 紫花地丁 539 紫花前胡 540 紫苏子 541 紫苏叶 542 紫苏梗 543 紫草 544 紫珠叶 545 紫菀 546 紫萁贯众 547 萹蓄 548 葛根 549 葶苈子 550 蛤壳 551 蛤蚧 552 锁阳 553 雄黄 554 鹅不食草 555 黑芝麻 556 黑豆 557 黑种草子 9
2015年版版药典二部附录
0541 电泳法
电泳是指溶解或悬浮于电解液中的带电荷的蛋白质、 胶体、大分子或其他粒子,在电流作用下向其自身 所带电荷相反的电极方向迁移。
电泳法是指利用溶液中带有不同量电荷的阳离子或 阴离子,在外加电场中使供试品组分以不同的迁移 速度向对应的电极移动,实现分离并通过适宜的检 测方法记录或计算,达到测定目的的分析方法。电 泳法一般可分为两大类:一类为自由溶液电泳或移 动界面电泳,另一类为高效液相色谱法系采用高压输液泵将规定的
流动相泵入装有填充剂的色谱柱,对供试品
进行分离测定的色谱方法。注入的物质(原为
供试品),由流动相带入色谱柱(原为柱内)中,
组分在柱内分离,并进入检测器检测,由积
分仪或数据处理系统记录和处理色谱信号。
对仪器的一般要求和色谱条件:
采用散射光式浊度仪测定时,入射光和测定
的散射光呈90度夹角,入射光强度和散射光 强度关系式为Ⅰ =K’ T Ⅰ0; 式中Ⅰ为散射光强度,单位为cd; Ⅰ0为入射光强度,单位为cd; K’为散射系数; T为供试品溶液的浊度值,单位为NTU.
系统的适用性试验:仪器应定期(一般每月
一次)对浊度标准液的线性和重复性进行考 察,采用0.5号至4号浊度标准液进行浊度值 测定,浊度标准液的测定结果(单位NTU) 与浓度间应呈线性关系,线性方程的相关系 数应不低于0.999;取0.5号至4号浊度标准液, 重复测定5次,0.5号和1号浊度标准液测量浊 度值的相对标准偏差应不大于5%,2~4号浊 度标准液测量浊度值的相对标准偏差不大于 2%。
各种色调色号标准比色液的制备-新增0.5号色调标 准比色液
色 号 贮 备 液 ml
0.5
0.25
1
2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2015版《中国药典》内容结构——一、二、三部
一、二、三 部
2015版《中国药典》内容结构——四部
凡例
制剂通则
38个,如:片剂、颗粒剂通则检验方法来自240个,如重金属检查四部
指导原则
30个,如稳定性试验指导原则
药用 辅料
通则
标准物质与 试液试药
9类,如滴定液的配制
通则规定的内容
2015版《中国药典》内容结构——凡例
通则目次
1953年版 1963年版 1977年版 1985年版 1990年版 1995年版 2000年版 2005年版 2010年版 2015年版
2015版《中国药典》基本情况
一部:收载药材及饮片、植物油脂 和提取物、成方制剂和单方制剂等 二部:收载化学药品、抗生素、生 化药品、放射性药品等 三部:收载生物制品 四部:收载通则和药用辅料
笔画数:
(十一划…. 羟液维)
维生素C
1237页
正文品种
质量标准
2015版《中国药典》的使用
第二步:查阅凡例,明确标准中的共性问题
标准内容
本品含量范围为99.0%~101.0%。
凡例规定
2015版《中国药典》的使用
第三步:查阅通则,确定标准中的通用方法
2015版《中国药典》的使用
第四步:确定检验所需试液种类及配制方法
标准品与对照品
计量 05
04
检验方法和限度
03
精确度 06
项目与要求
02
试药、试液、指 07
示剂
01
名称与编排
凡例是对药典共性问题的统一规定,共计:十二类三十八条
2015版《中国药典》的使用——查阅维生素C质量标准
第一步:查阅《中国药典》 ,找到VC质量标准
《中国药典》 2015版2部
品名目次:
正文品种第 一部份
2015版《中国药典》的查阅与使用
《中国药典》概述
药典:一个国家记载药品标准的法典,体现了一 个国家的科技水平和综合实力!
药典 品种 收载 原则
使用安全 疗效可靠 临床需要 工艺合理 标准完善
质量可控
世界上第一部药典
新修本草(唐本草)
《中国药典》概述
英文缩写:ChP。现行是《中国药典》 2015年版,是国家药品标准的核心
