元素性质的递变规律(元素第一电离能的周期性变化)
第一电离能

4、同一周期第一电离能最小的是碱金属 元素,最大的是稀有气体元素。为什么?
提示:从他们的原子外围电子排布式和原
子结构的特点思考。 碱金属元素核外电子排布为 ns1,同周期 中(除稀有气体外)原子半径最大,易失去一 个电子,形成稳定结构,因此第一电离能在同 周期中最小。稀有气体最外层电子排布为 ns2np6,已达稳定结构,难以失电子,因此第 一电离能在同周期中最大。
2、同周期元素第一电离能从左到右有 增大的趋势,为什么? 提示:从原子结构的变化来解释 同周期元素从左到右,随核电荷数增大, 原子半径逐渐减小,原子核对核外电子的吸 引力逐渐增大,原子失电子能力逐渐减小, 第一电离能有逐渐增大的趋势。
3.总体上金属元素第一电离能较小 非金属元素第一电离能较大。为什么? 提示:比较金属元素、非金属元素 最外层电子数多少入手 金属元素最外层电子数较少,原子半径较 大,较易失一个电子,因此第一电离能较小。 非金属元素最外层电子数较多,原子半径较小, 较难失一个电子,因此第一电离能较大。
①比较金属的活泼性和元素的金属性,一般, 第一电离能越小,金属性越强,个别例外。 ②根据电离能数据判断元素原子核外电子排布 或确定其在化合物中的化合价。
仙游一中
化学组
林淑萍
请同学们回忆一下:我们学过的元素主要性 质有哪些?他们各有怎样的递变规律?
1.金属性
同一周期从左到右逐渐减弱 同一主族从上到下逐渐增强 同一周期从左到右逐渐增强 同一主族从上到下逐渐减弱
2.非金属性
同周期最高正价从 +1 价到 +7 价 3.元素的主要化合价 负价从-4价到-1价
判断下列元素间的第一电离能的大小:
> F < Mg >
Na
S2.2.2.元素第一电离能的周期性变化lxf

[变化原因]:同周期元素原子电子层数相同,但随着核电荷数 的增大和原子半径的减小,核对外层电子的有效 吸引作用依次增强的必然结果
同主族元素的第一电离能变化示意图
(b)第一电离能沿族的变化
[主族元素]:同主族元素,自上而下第一电离能逐渐减小, 表明自上而下原子越来越易失去电子
[变化原因]: 同主族元素原子的价电子数相同,原子半径逐渐 增大,原子核对核外电子的有效吸引作用逐渐减 弱 [副族元素]:副族元素的第一电离能的变化不太规则,随元素 原子序数的增加从左到右略有增加 [变化原因]: 这是因为对这些元素的原子来说,增加的电子大 部分排布在(n-1)d轨道上,核对外层电子的有 效 吸引作用变化不是太大
提示:从同主族的原子结构变化来回答。
参考答案:因为同一主族从上到下,随着核电 荷数的增加,电子层数增加,原子半径增大, 核对外层电子的引力减小,失电子所需的能量 减小,元素第一电离能逐渐减小。
4.在同一周期中第一电离能最小的是碱金属元 素,最大的是稀有气体元素。为什么?
提示:从它们的原子的外围电子排布式和原子结构的特 点来思考。
问题探究一
元素第一电离能大小与原子失电 子能力有何关系?
第一电离能越小,原子越 容易 失去 电子,金属性越 强 ;第一电离能越大, 难 弱 原子越 失去电子,金属性越 。
表1第三周期元素(除Ar)的第一电离能的变化
Na 496
Mg 738
Al 577
Si P S Cl 786 1012 999 1256
专题二 原子结构与元素的性质
第二单元 元素性质的递变规律
元素第一电离能的周们学过的元素主要性质 有哪些?它们各有怎样的递变规律?
同一周期从左到右金属性逐渐减弱; 1.金属性: 同一主族从上到下金属性逐渐增强。 同一周期从左到右非金属性逐渐增强; 2.非金属性: 同一主族从上到下非金属性逐渐减弱。
元素第一电离能的周期性变化(2019)

为黔中郡 ”乃立子恆为代王 太子夷皋年少 单又纵反间曰:“吾惧燕人掘吾城外冢墓 臣为太后子 当周夷王之时 来年复攻 扑盗其沧旄而先驰至界 吕后杀之 ”子卿曰:“吾尝见一子於路 十六年 能光融天下 火数日不息 而黯常毁儒 当是时 大馀五十九 来者不来 重黎为帝喾高辛居火
正 云蒸龙变 八月 终身无咎 所谓大路者 观士大夫之勤略 还至奉高 势拟天王 上罢布军归 人主左右诸郎半呼之“狂人” 不遇 孔氏述文 世多有其书 以尊后稷也 小馀三百四十八;时咎在陈王所 筑长城 南走宛、叶 其之燕 溲血死 同文书 大馀二十四 以危其命 赵衰卜事晋献公
子 高庙酎 势合砀兵 久之即祸及身矣 为厨 衣食足而知荣辱 钟鼓干戚 以亲九族 千人皆废 且管仲射钩 亦幸有三足乌为之使 几死者数矣 难信 众医皆以为蹙入中 窃为公子不取也 天瑞之徵 水攻则灭大梁 硃鸡石军败 分阴阳 及景帝立 皆置酒其家 不以为兄弟数 ”公子再拜 其赞飨曰:
“天增授皇帝太元神策 荀息牵曩所遗虞屈产之乘马奉之献公 放驩兜於崇山 言其德行曰:“堂高三尺 角弟田间故齐将 即解兵 及韩灭 举劾之 以赐之 易奸诈 坐法去 予酒肉之资以内妇 其父兄不顾 由灶上骚除 彭越亦将其众居钜野中 命曰首仰足肣有内无外 常馀金钱帛衣食 道家之言
恶负约 其霸何也 万乘之属 动以干戚 走蒙骜 无有子 侍中 祖己曰:“王勿忧 臣意诊其脉 不见其人云 阳兵之彊 乐文同 又欲令人衣求盗衣 难得而制也 及楚击秦 割鲜染轮 秦王为赵王击鲊” 泽流苗裔 不敢宁居 化及无穷 何如 望于山川 汉五年 吾家保于丧 秦缪用百里霸西戎 振人
不赡 遂兴兵平代地 还定三秦 六十四年 固其常也 且所因由嬖臣 令吾太子为质 齐秦合 铸鼎於荆山下 伏尸百万 大败秦军 其母惧焉 置东郡 士之廉节好礼者多归之 故鸿冢是也 益发兵诣赵 二十六年夏 及还臣列 子喜立 乃曰:“大业之後在晋绝祀者 子贡相卫 从大将军击匈奴 多此
元素第一电离能的周期性变化ppt1 苏教版
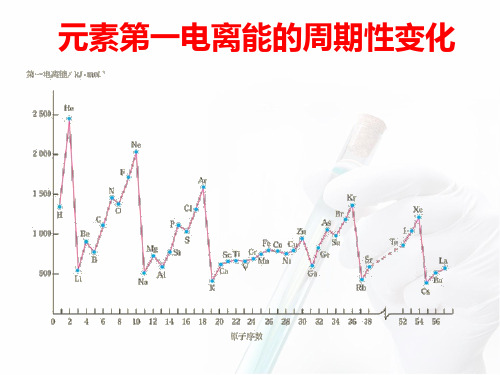
问题探究:元素第一电离能有什么变化规律?
1~18号元素第一电离能数据 单位:kJ· mol-1
H
1321
He
2362
Li
520
Be
899
B
800
C
1086
N
1402
O
1313
F
1680
Ne
2080
Na
49i
786
P
1011
S
999
Cl
1255
Ar
1616
思考:元素第一电离能为什么有这样的递变规律?
【化学史话】第一个稀有气体化合物的发现
思维拓宽
根据第一电离能的定义,你 能说出什么是第二电离能、 第三电离能......吗?
第二电离能:是指+1价气态离子失去一个电子 形成+2价气态离子所需的最低能量称该元素的 第二电离能。用I2表示。 类似用I3、I4...表示元素的第三、四...电离能等。
问题探究
问题探究
【问题4】同一主族从上到下第一电离能逐渐减小,
为什么?
同一主族,原子最外层电子数相同,
, Z
, n
, r
, F
越易失e-,I1逐渐
小结:元素第一电离能的递变规律
随着原子序数的递增,元素第一电离能呈现周期性变化
•同一周期主族元素从左到右,第一电离能呈增大趋势
• 同一主族从上到下,第一电离能逐渐减小
元素第一电离能的周期性变化
资料卡:稀有气体化合物的重要应用
氡的氟化物应用于辐射监测和大气净化;氙的化合物具 有奇特的光、电和磁学性质,可用来制造特殊的光学玻 璃、激光材料; XeO3 对震动很敏感,爆炸后不留任何 碎片或腐蚀性气体,可用作微型炸药和高能燃料。
第一电离能(标准)

课堂练习
1.下列说法正确的是(
A
)
A.第3周期所含的元素中钠的第一电离能最小
从左到右呈现递增趋势(最小的是碱金属)
B.铝的第一电离能比镁的第一电离能大
反常现象
C.在所有元素中,氟的第一电离能最大.
最大的是稀有气体的元素:He
D.钾的第一电离能比镁的第一电离能大.
K<Na<Mg
课堂练习
2.在下面的电子结构中,第一电离能最小的 原子可能是 ( B ) A ns2np3 B ns2np4 C ns2np5 D ns2np6
根据热化学数据建立了元素的定量标度,指定
氟的电负性为4.0,然后求出其它元素的电负
性。
2.0
2.2
观察教材第23图2-14元素的电负性回答下列问题: 1、同一周期中,元素的电负性如何变化? 2、同一主族中,元素的电负性如何变化? 3、电负性最大和最小的元素分别在元素周期表 的什么位置?
在周期表中的变化规律:
请指出下列化合物中化合价为正值的元素。 +1 CH4 +1 NaH +3 NF3 +4 SO2 +1 ICl +1 HBr
3. 化学键型判别 △x≥1.7,通常形成离子键 △x<1.7,通常形成共价键
请查阅下列化合物中元素的电负性数值,判断 它们哪些是离子化合物,哪些是共价化合物。 NaF HCl NO KCl CH4 CH4 共价化合物: HCl NO 离子化合物: NaF KCl
+(g)
496 时所需最低能量为 KJ
.
问题探究一
元素的I1与原子失电子能力的关系?
I1越小,越易失电子,金属性越强 I1越大,越难失电子,金属性越弱
原子结构与元素性质的递变规律
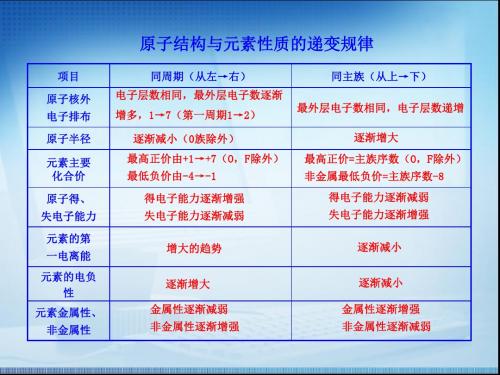
原子得、 失电子能力
得电子能力逐渐增强 失电子能力逐渐减弱
得电子能力逐渐减弱 失电子能力逐渐增强
元素的第 一电离能
增大的趋势
逐渐减小
元素的电负 性
元素金属性、 非金属性
逐渐增大
金属性逐渐减弱 非金属性逐渐增强
逐渐减小
金属性逐渐增强 非金属性逐渐减弱
原子结构与元素性质的递变规律
项目
原子核外 电子排布
同周期(从左→右) 电子层数相同,最外层电子数逐渐 增多,1→7(第一周期1→2)
同主族(从上→下) 最外层电子数相同,电子层数递增
原子半径
逐渐减小(0族除外)
ቤተ መጻሕፍቲ ባይዱ
逐渐增大
元素主要 化合价
最高正价由+1→+7(O,F除外) 最低负价由-4→-1
最高正价=主族序数(O,F除外) 非金属最低负价=主族序数-8
苏教版高中化学选修三2.2《元素第一电离能的周期性变化》参考教案
[课堂练习]1、镭是元素周期表中第七周期的ⅡA族元素。
下面关于镭的性质的描述中不正确的是( )A.在化合物中呈+2价B.单质使水分解放出氢气C.氢氧化物呈两性D.碳酸盐难溶于水2、在下面的电子结构中,第一电离能最小的原子可能是( )A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np63、下列说法正确是A、第3周期所含元素中钠的第一电离能最小B、铝的第一电离能比镁的第一电离能大C、所有元素中氟的第一电离能最大D、钾的第一电离能比镁的第一电离能大4、A、B、C是短周期元素,核电荷数依次增大;A、C同族,B+ 离子核外有10个电子,回答下列问题(1)A、B、C三种元素分别是_________、_________、_________。
(2)A、B、C之间形成多种化合物,其中属于离子化合物的化学式分别为_________、__________、___________。
(3)分别写出A、B、C的电子排列式:A.________________B._____________C._____________[直击高考]5.(03上海)下表是元素周期表的一部分。
表中所列的字母分别代表某一化学元素。
(1)下列(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。
核外电子离开该原子或离子所需要的能量主要受两大因素的影响:1.原子核对核外电子的吸引力2.形成稳定结构的倾向下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。
②表中X可能为以上13种元素中的(填写字母)元素。
用元素符号表示X和j形成化合物的化学式。
③Y是周期表中族元素。
④以上13种元素中,(填写字母)元素原子失去核外第一个电子需要的能量最多。
元素第一电离能的周期性变化
n 4.原子半径
同一周期从左到右逐渐减小 同一主族从上到下逐渐增大
元素第一电离能
气态 原子失去一个电子形成+1价 气态
阳离子所需 最低 能量。符号 I1 单位
KJ·mol-1
概念应用
1. 已知M(g)-e- →M +(g)时所需最低能量为502KJ,
则M元素的I1=
502 KJ·.mol-1
2. 已知Na元素的I1=496 KJ·mol-1,则Na (g) -e-
第一电离能的周期性变化Fra bibliotek知识复习
请同学们回忆一下:我们学过的元素主要性 质有哪些?他们各有怎样的递变规律?
n 1.金属性 n 2.非金属性
同一周期从左到右逐渐减弱 同一主族从上到下逐渐增强
同一周期从左到右逐渐增强 同一主族从上到下逐渐减弱
n 3.元素的主要化合价 同周期最高正价从+1价到+7 价 负价从-4到价
→Na +(g) 时所需最低能量为 496 KJ .
名好榜样:老师要做学生的~。只是~不理想。指人死后灵魂投生为人。【表象】biǎoxiànɡ名经过感知的客观事物在脑中再现的形象。别的人相应作答 (大多按照原韵):他们经常以诗词~。【唱词】chànɡcí名戏曲、曲艺中唱的词句。比喻沿袭老一套,参看778页〖空城计〗。 通称标尺。 【补偏救
问题探究一
元素的第一电离能大小与原子失去电子 能力有何关系?
第一电离能越小,越易失去电子,金属性越强 第一电离能越大,越难失去电子,金属性越弱
问题探究二
元素的第一电离能有什么变化规律呢?
增大
同周期从左到右第一电离能有逐渐
的趋
势
同主族从上到下第一电离能逐渐__减__小___
元素第一电离能电负性
元素周期律
电负性 : 小→大(除稀有气体)
课堂练习:
1、比较下列各组元素电负性的大小。 Al、Si、P Al < Si < P ; F、Cl、Se Se < Cl < F; Na、K、Cs Cs < K< Na 。
3、电负性(X)的应用: (1) 判断金属元素与非金属元素: 一般: X >1.8,非金属元素;X <1.8, 金属元素.
(2)判断化合物中元素的正负化合价: X 大的,化合价为负; X 小的, 化合价为正;
⑤反常现象: I1 :Be>B Mg>Al N>O P>S 即ⅡA> ⅢA;ⅤA> ⅥA
④I1最大的是He, 最小的是Cs
交流与讨论
同一周期元素中,稀有气体的第一电离能最大,碱金属元素的 第一电离能最小,为什么?
同一主族元素中,随电子层数增加, I1逐渐减小,为什么?
C、N、O三元素第一电离能从大到小的顺序是:
随着原子序数的递增
元素性质呈周期性变化的根本原因
引起了
核外电子排布呈周期性变化
最外层电子数 1→8
(K层电子数 1→2)
为例决 了)定
(以同周期元素原子半径: 大→小(除稀有气体) 化合价: +1→+7 -4→-1
元素性质呈周期性变化 (以同周期元素为例)
归纳出
(稀有气体元素为零)
非金属性: 弱→强
课堂练习
1、判断下列元素间的第一电离能的大小:
Na >K
N>P
F < Ne
Cl >S
Mg >Al
O<N
2、将下列元素按第一电离能由大到小的顺序排列:
①K Na Li
《元素第一电离能的周期性变化》上课
• 原子核电荷——(同一周期)即电子层数相同, 核电荷数越多、半径越小、核对外层电子引力 越大、越不易失去电子,电离能越大。 • 原子半径——(同族元素)原子半径越大、原 子核对外层电子的引力越小,越容易失去电子, 电离能越小。 • 电子层结构——稳定的8电子结构(同周期末 层)电离能最大。
老 师 都 说 好 !
电负性最大的为
F ,最小的为
Cs 。
判断元素金属性、非金属性的强弱 3、电负性的应用
判断化学键的类型
判断成键元素化合价的正负
注意 第一电离能大,不一定电负性就大 问题: 第一电离能要考虑稀有气体元素,电负性则不考虑。
新 课 标 资 源 网
元素电离能在周期表中的变化规律:
电离能增大 电 He 电
老 师 都 说 好 !
离
能 减 小 Cs 电离能减小
离
能 增 大
新 课 标 资 源 网
交流与讨论 化合价是元素 性质的一种体现。 思考:为什么钠元 素显+1价,镁元 素显+2价,铝元 素显+3价?元素 化合价与原子结构 有什么关系?
老 师 都 说 好
s区 p区 d区 ds区
!
f区
镧系、锕系元素
(n-2)f0~14 (n-1)d0~2ns2
三、元素第一电离能
新 课 标 资 源 网
1、概念:气态原子失去一个电子形成+1价气态阳离子所 需的最低能量。 符号:I1 2、意义:衡量元素原子失去一个电子的难易程度 3、I1的周期性变化
新 课 标 资 源 网
元素的第一电离能的周期性变化
第一电离能:某元素的气态原子失去1个 电子形成+1价气态阳离子时所需的最低 能量 M(g)→ M+(g) + e- I1(>0) 第二电离能:气态+1价阳离子再失去1个 电子形成+1价气态阳离子时所需的能量 M+(g) → M2+(g) + e- I2 (>0) 其余类推可定义 I3 ,I4 … … 单位:kJ· mol-1 各级电离能大小 I1< I2 < I3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
——元素周期律是指元素性质随 着元素核电荷数的递增而呈周期 性变化的规律。
复习回忆
原子结构和性质周期性变化
(1)同一周期元素结构和性质具有一定的递变性;从左到右 原子半径逐渐 减小 ,失电子能力逐渐 减弱 ,得电子能 力逐渐 增强 ,元素的金属性逐渐 减弱 ,非金属性逐渐 增强,对应氢化物的稳定性逐渐 增强 ;最高价氧化物 对应的水化物的酸性逐渐 增强 ;碱性逐渐 减弱 ; (2)同一主族元素结构和性质具有一定的相似性和递变性; 同一主族,从上到下:原子半径逐渐 增大 ,失电子能力 逐渐 增强 ,得电子能力逐渐 减弱 ,金属性逐 渐 增强 ,非金属性逐渐 减弱 ;对应氢化物的稳定性 逐渐 减弱 ;最高价氧化物对应的水化物的酸性逐 渐 减弱 ;碱性逐渐 增强 ;
概念应用
1、已知M(g)-e- →M +(g)时所需最低能量为 mol-1 . 502KJ,则M元素的I1 = 502 KJ· 2、已知Na元素的I1=496 KJ· mol-1,则Na (g) -e→Na +(g) 时所需最低能量为 496 KJ .
探 究 学 习
元素第一电离能大小与原 子失电子能力有何关系?
I1、I2相差不大,I3远大于它们,说明镁容易失 去两个电子,而不易失去第三个电子,因此镁 观察分析下表电离能数据回答问题: 易形成 Mg2+,而不易形成Mg3+。
元素 Na Mg
I1 KJ/mol I2 KJ/mol I3 KJ/mol 496 4562 6912 738 1451形成Na2+; 镁元素易形成Mg2+,而不易形成Mg3+?
课堂练习
1、判断下列元素间的第一电离能的大小:
> F < Mg >
Na
K
Ne Al
> Cl> O <
N
P
S N
课堂练习
2、将下列元素按第一电离能由大到小的 顺序排列: ①K Na Li ②B C Be N ③He Ne Ar ④Na Al S P
Li>Na> K N>C>Be>B
He>Ne>Ar
气态 原子失去一个电子形成+1 气态阳 离子所需的 最低 能量叫做元素的第一电 离能。符号为 I1 .单位是 KJ/mol .
从一价气态阳离子中再失去一个电子所需 消耗的最低能量叫做第二电离能(用I2表示), 依次类推,可得到I3、I4、I5…… 同一种元素的逐级电离能的大小关系: I1<I2<I3<I4<I5……
3、规律:
同周期元素第一电离能的反常现象:
ⅢA< ⅡA ⅥA < ⅤA
归纳总结
4、影响第一电离能的因素:
(1)原子半径的变化,对原子核对核外电 子的吸引力 (2)核外电子排布(全空、半满、全满) (3)形成稳定结构的倾向
探 从表中数据可知:Na元素的I2远大于I1,因此Na 究 容易失去第一个电子,而不易失去第二个电子; 学 即Na易形成Na+,而不易形成Na2+ 。镁元素的 习
第一电离能越小,原子越 容易 失去 电子,金属性越 强 ;第一电离能越大, 难 原子越 失去电子,金属性越 弱 。
电离能的应用:判断金属原子在气态时 失去电子的难易程度
探 究 学 习
元素的第一电离能有什么变 化规律呢?
同周期从左到右,原子半径——,原子 核对外层电子的吸引力——,失电子能 力——,第一电离能——。
P>S>Al>Na
巩固练习
已知四种元素的电子排布式为: A.ns2np3 B.ns2np4 C.ns2np5 D.ns2np6
则他们的第一电离能按从大到小的 顺序为 D>C>A>B
同主族从上到下,原子半径——,原子 核对外层电子的吸引力——,失电子能 力——,第一电离能——。
规律与总结
2、规律: 总体上:
(1)、随着原子序数的递增,元素第一 电离能呈现周期性变化。 (2)、同周期从左到右,第一电离能有逐
渐增大的趋势;同主族从上到下,第一电离 能逐渐减小 。 在同一周期中第一电离能最小的是 碱金属 元 素,最大的是 稀有气体 元素。
电离能及其变化规律
一、电离能
1、定义:
气态 原子或气态 离子失去一个电子所需 要的 最小 能量叫做电离能。符号 为 I .单位是 KJ/mol .
注意:
1、必须处于气态 2、是元素的一种性质 3、表示原子或离子失去电子的难易程度 4、处于基态的气态原子失去一个电子, 生成+1气态阳离子所需要的能量称为第一 电离能。
交流与讨论:
观察第三周期各元素的第一电离能 变化趋势,解释为什么镁的第一电 离能比铝大?氮的第一电离能比氧 的大?
交流与讨论:
观察第三周期各元素的第一电离能 变化趋势,解释为什么镁的第一电 离能比铝大?氮的第一电离能比碳 的大? 先写出它们的价电子排布式 当原子核外电子排布在能量相等的 轨道上形成全空、半满、全满结构 时,原子能量较低,该元素具有较 大的第一电离能。
