分子原子离子的区别
原子原子核分子离子质子中子电子

原子分子离子质子电子的区别原子由原子核和在原子核和带负电的电子组成。
(原子核一般由带正电荷的质子和不带电的中子构成.)量子是一个比较宽泛的概念~应该是指量子力学中研究的各种粒子,包括质子,中子,电子……粒子也是比较宽泛的概~泛指各种微粒。
离子是带电微粒~因为量子,粒子范围太大,没法比较.能确定大小的最小的是电子吧~1、分子是保持物质化学性质的最小粒子(原子、离子也能保持物质的化学性质)。
原子是化学变化中的最小粒子。
例如:保持氯气化学性质的最小粒子是D(氯分子)(A、Cl B、Cl—C、2Cl D、Cl2)。
保持CO2化学性质的最小粒子是CO2分子;保持水银的化学性质的最小粒子是汞原子。
在电解水这一变化中的最小粒子是氢原子和氧原子.原子中:核电荷数(带正电)=质子数=核外电子数相对原子质量=质子数+中子数原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,构成原子的三种粒子是:质子(正电)、中子(不带电)、电子(带负电)。
一切原子都有质子、中子和电子吗?(错!一般的氢原子无中子)。
某原子的相对原子质量=某原子的质量/C原子质量的1/12。
相对原子质量的单位是“1”,它是一个比值。
相对分子质量的单位是“1”。
由于原子核所带电量和核外电子的电量相等,电性相反,因此整个原子不显电性(即电中性)。
2、①由同种元素组成的纯净物叫单质(由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合物。
)②由一种分子构成的物质一定是纯净物,纯净物不一定是由一种分子构成的。
③由不同种元素组成的纯净物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的.纯净物与混合物的区别是物质的种类不同。
单质和化合物的区别是元素的种类不同。
④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。
氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。
⑤元素符号的意义:表示一种元素,表示这种元素的一个原子。
分子、原子、离子区别

分子、原子、离子区别分子是由原子构成的微观原子是原子核和核外电子构成的. 微观离子是带电的原子,是原子得或者失去核外电子时形成的.离子是带电的原子或原子团。
微观一、、原子指化学反应中的最小微粒;元素指拥有相同核电荷数的一类原子的总称;分子是保持物体化学性质的最小微粒;质子是带电的原子二、原子:1、原子内通常存在质子、中子、电子。
其数量级大约是10^-10m。
因此,与常见物体相比,原子是一个极小的物体,即使把一亿个氧原子排成一排,其长度仍不足1cm,人们只能通过一些特殊的仪器才能间接观测到单个的原子。
2、原子内中子和质子的质量相近且远大于电子,原子核由质子与中子组成,因此原子的质量极小,且99.9%集中在原子核。
3、原子核外分布着电子,电子占据一组稳定的轨道。
当它们吸收和放出光子的时候,电子也可以在不同能级之间跃迁,此时吸收或放出光子的能量与轨道之间的能量差相等。
电子决定了一个元素的化学性质,并且对原子的磁性有着很大的影响。
三、离子:1、离子是指原子由于自身或外界的作用而失去或得到一个或几个电子使其达到最外层电子数为8个或2个(氦原子)或没有电子(四中子)的稳定结构。
这一过程称为电离。
电离过程所需或放出的能量称为电离能。
2、在化学反应中,金属元素原子失去最外层电子,非金属原子得到电子,从而使参加反应的原子或原子团带上电荷。
带电荷的原子叫做离子,带正电荷的原子叫做阳离子,带负电荷的原子叫做阴离子。
阴、阳离子由于静电作用而形成不带电性的化合物。
四、元素:元素(element)又称化学元素,指自然界中一百多种基本的金属和非金属物质,它们只由几种有共同特点的原子组成,其原子中的每一核子具有同样数量的质子,用一般的化学方法不能使之变得更为简单,并且单独地或组合地构成一切物质。
一些常见元素的例子有氢,氮和碳。
到2007年为止,总共有118种元素被发现,其中94种是存在于地球上。
拥有原子序数大于82(即铋Bi及之后的元素)都是不稳定,并会进行放射衰变。
原子原子核分子离子质子中子电子

原子分子离子质子电子的区别原子由原子核和在原子核和带负电的电子组成。
(原子核一般由带正电荷的质子和不带电的中子构成.)量子是一个比较宽泛的概念~应该是指量子力学中研究的各种粒子,包括质子,中子,电子……粒子也是比较宽泛的概~泛指各种微粒。
离子是带电微粒~因为量子,粒子范围太大,没法比较.能确定大小的最小的是电子吧~1、分子是保持物质化学性质的最小粒子(原子、离子也能保持物质的化学性质)。
原子是化学变化中的最小粒子。
例如:保持氯气化学性质的最小粒子是D(氯分子)(A、Cl B、Cl—C、2Cl D、Cl2)。
保持CO2化学性质的最小粒子是CO2分子;保持水银的化学性质的最小粒子是汞原子。
在电解水这一变化中的最小粒子是氢原子和氧原子.原子中:核电荷数(带正电)=质子数=核外电子数相对原子质量=质子数+中子数原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,构成原子的三种粒子是:质子(正电)、中子(不带电)、电子(带负电)。
一切原子都有质子、中子和电子吗?(错!一般的氢原子无中子)。
某原子的相对原子质量=某原子的质量/C原子质量的1/12。
相对原子质量的单位是“1”,它是一个比值。
相对分子质量的单位是“1”。
由于原子核所带电量和核外电子的电量相等,电性相反,因此整个原子不显电性(即电中性)。
2、①由同种元素组成的纯净物叫单质(由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合物。
)②由一种分子构成的物质一定是纯净物,纯净物不一定是由一种分子构成的。
③由不同种元素组成的纯净物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的.纯净物与混合物的区别是物质的种类不同。
单质和化合物的区别是元素的种类不同。
④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。
氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。
⑤元素符号的意义:表示一种元素,表示这种元素的一个原子。
分子、原子、离子、元素

表示方法
实例
元素
元素符号
H、O、Mg
原子
元素符号表示一个原子;元素符 H、O、Mg
号前加数目表示几个原子。
2H、3O、4Mg
分子
化学式表示一个分子;化学 式前加数目表示几个分子。
元素符号右上方标上离子所
离子 带电荷及数目;数目在前,
“+”或“-”在后。
3HH22OO、、4CCOO22
H+、 O22H+、5O2-
A.分子之间有间隔
B.硅原子是由原子核和电子构成的
C.水分子受热运动速率加快 D.构成物质的粒子有分子、原子和离子
类型3 元素和元素周期表
9.(2017·自贡)每 100 g 黑木耳中含铁 0.185 g,是常见天 然食品中铁含量最高的,这里的“铁”应理解为( D )
A.分子 B.原子 C.离子 D.元素
7.(2016•安徽)改编近年,我国科学家首次拍摄到水分子团簇图
像,模型如图 ZT2-2。下列说法正确的是( C )
A.氢、氧两种元素只能组成水
B.团簇中的水分子不再运动 C.水蒸气冷凝成水,分子间隔减小
图 ZT2-2
D.过氧化氢和冰都是由水分子构成的
8.从下列图片中不能获取的信息是( B )
图 ZT2-3
图 ZT2-5 A.在硫原子的核外电子排布中,a=2、b=8 B.硫原子在化学反应中易得到 2 个电子变成 S2- C.硫原子中,质子数=核外电子数=16 D.硫元素在元素周期表中位于第六周期
类型4 原子结构示意图
13.(2016•岳阳)对以下四种粒子的结构示意图,分析错误的是( C )
A.①②属于同一种元素 C.①得到电子可形成③
原子内核电荷数即质子数决定元素的种类
分子、原子、离子及元素的关系
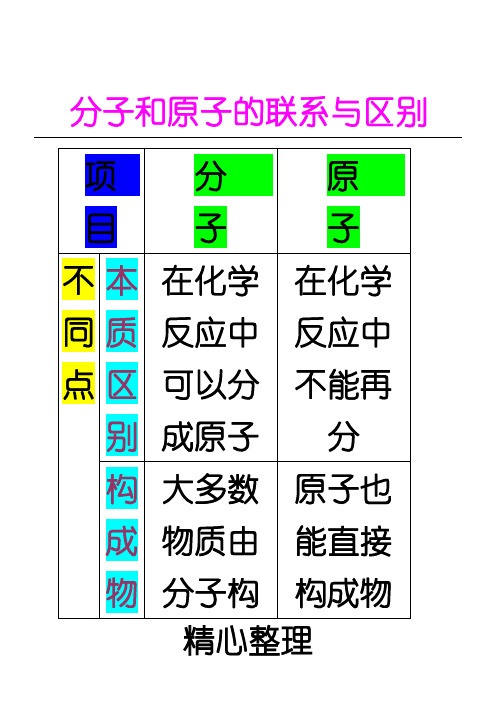
项分 目子 不 本 在化学 同 质 反应中 点 区 可以分
别 成原子 构 大多数 成 物质由
原 子 在化学 反应中 不能再 分 原子也 能直接
精心整理
物 分子构 构成物
质 成 质,但分
情
子是由
况
原子构
成的
相 1、 质量和体积都
同
很小
点 2、 都在不停地运
动
3、 粒子间由间隔
精心整理
稳定
结构
稀 =8 难得 极
有 (氦 失电 难
气为 子 发
体 2) (常 生
元
称为 化
素
稳定 学
结反
构) 应
精心整理
离子与原子的
比较
粒子 原
离
种类 子
子
阳离 阴离
子子
粒 核内 核内 核内
区 子 质子 质子 质子
结 数= 数> 数<
精心整理
构 核外 核外 核外 电子 电子 电子
别 数数 数 粒 不显 带正 带负 子 电性 电 电 电 性 用元 用阳 用阴 符 素符 离子 离子 号 号表 符号 符号
阴离子
失电子
失电子 构分 成裂
系
分
子
元素与原子的比较 精心整理
元
原
素
子
概 具有相同 化学变化
念 核电荷数 中的最小
(即核内 粒子
质子数)
的一类原
子的总称
区 只讲种 既将种
分 类,不讲 类,又讲
精心整理
个数 个数 使 用于描 用于描述 用 述物质 物质的微 范 的宏观 观构成 围 组成 举 水由氢元 每个水分 例 素和氧元 子由两个
原子原子核分子离子质子中子电子

原子分子离子质子电子的区别原子由原子核和在原子核和带负电的电子组成。
(原子核一般由带正电荷的质子和不带电的中子构成.)量子是一个比较宽泛的概念~应该是指量子力学中研究的各种粒子,包括质子,中子,电子……粒子也是比较宽泛的概~泛指各种微粒。
离子是带电微粒~因为量子,粒子范围太大,没法比较.能确定大小的最小的是电子吧~1、分子是保持物质化学性质的最小粒子(原子、离子也能保持物质的化学性质)。
原子是化学变化中的最小粒子。
例如:保持氯气化学性质的最小粒子是D(氯分子)(A、Cl B、Cl—C、2Cl D、Cl2)。
保持CO2化学性质的最小粒子是CO2分子;保持水银的化学性质的最小粒子是汞原子。
在电解水这一变化中的最小粒子是氢原子和氧原子.原子中:核电荷数(带正电)=质子数=核外电子数相对原子质量=质子数+中子数原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,构成原子的三种粒子是:质子(正电)、中子(不带电)、电子(带负电)。
一切原子都有质子、中子和电子吗?(错!一般的氢原子无中子)。
某原子的相对原子质量=某原子的质量/C原子质量的1/12。
相对原子质量的单位是“1”,它是一个比值。
相对分子质量的单位是“1”。
由于原子核所带电量和核外电子的电量相等,电性相反,因此整个原子不显电性(即电中性)。
2、①由同种元素组成的纯净物叫单质(由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合物。
)②由一种分子构成的物质一定是纯净物,纯净物不一定是由一种分子构成的。
③由不同种元素组成的纯净物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的.纯净物与混合物的区别是物质的种类不同。
单质和化合物的区别是元素的种类不同。
④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。
氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。
⑤元素符号的意义:表示一种元素,表示这种元素的一个原子。
分子、原子、离子、元素的区别与联系.pdf

少数非金属单质(例:金刚石、石墨)
离子化合物(由阴、阳离子相互作用组成的化合物)
例:金属氧化物(氧化镁)
8 个质子;氢的原子核内有一个质子)游离态(在单质中例:氢气中的氢元素就是游离态)
例:水中的氢元素就是以化合态存在)
④最外层电子数决定元素的性质。
最外层电子数等于8(氦最外层电子数是 2 )是稀有气
⑤元素组成物质。
例:水是由氢元素和氧元素组成
定义化学变化中的最小微粒具有相同核电荷数(即质子数)的同一类原子的总称
②原子可以组成分子, 也可以直接
组成物质。
(铜由铜原子组成;水
分子由 2 个氢原子和一个氧原子
组成)
区别在化学变化中原子不可分
2。
初中化学必考知识点归纳:分子、原子、离子

初中化学必考知识点归纳:分子、原子、离子一、必考知识点一原子:化学转变中的最小微粒。
(1)原子也是组成物质的一种微粒。
例如少数非金属单质;金属单质;稀有气体等。
(2)原子也不断地运动着;原子虽很小但也有必然质量。
关于原子的熟悉远在公元前世纪提出了有关“原子”的观念。
但没有科学实验作依据,直到19世纪初,化学家境尔顿依如实验事实和严格的逻辑推导,在1803年提出了科学的原子论。
(马上点题目下蓝字"初中化学"关注可获取更多学习方式、干货!)分子:维持物质化学性质的最小粒子。
(1)组成物质的每一个分子与该物质的化学性质是一致的,分子只能维持物质的化学性质,不维持物质的物理性质。
因物质的物理性质,如颜色、状态等,都是宏观现象,是该物质的大量分子聚集后所表现的属性,并非是单个分子所能维持的。
(2)“最小”不是绝对意义上的最小,而是维持物质化学性质的最小。
分子的性质(1)分子质量和体积都很小。
(2)分子老是在不断运动着的。
温度升高,分子运动速度加速,如阳光下湿衣物干得快。
(3)分子之间有距离。
一样说来,气体的分子之间距离距离较大,液体和固体的分子之间的距离较小。
气体比液体和固体容易紧缩,不同液体混合后的整体积小于二者的原体积之和,都说明分子之间有距离。
(4)同种物质的分子性质相同,不同种物质的分子性质不同。
咱们都有如此的生活体验:假设口渴了,能够喝水解渴,同时吃几块冰块也能够解渴,这就说明:水和冰都具有相同的性质,因为水和冰都是由水分子组成的,同种物质的分子,性质是相同的。
二、必考知识点二质子:1个质子带1个单位正电荷原子核。
中子:不带电原子不带电。
电子:1个电子带1个单位负电荷。
(1)组成原子的粒子有三种:质子、中子、电子。
但并非是所有的原子都是由这三种粒子组成的。
如有一种氢原子中只有质子和电子,没有中子。
(2)在原子中,原子核所带的正电荷数确实是质子所带的电荷数,而每一个质子带1个单位正电荷,因此,核电荷数=质子数,由于原子核内质于数与核外电子数相等,因此在原子中核电荷数=质子数=核外电子数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子原子离子的区别
分子、原子、离子是物理化学中三个重要的概念,它们之间存在着重要的区别。
首先,让我们来谈谈分子和原子。
分子是一种物质的最小组成单位,它由至少两个原子组成,它们之间的原子通过化学键连接在一起。
分子是一种能够被观察到的有形物质,它们可以被用来研究物质的性质和特性,例如它们的结构、形状、熔点、沸点等。
原子是物质最小的组成单位,它没有可被看到的形状,但它具有一定的量和质量,就像一颗微小的“弹子”,它由核、中子和电子组成,每一种原子都有其独特的特性,它们能够通过化学反应进行结合形成分子,从而形成不同的物质。
其次,让我们谈一下离子和原子的区别。
离子其实就是原子的一种特殊形式,和原子不同的是,离子已经失去了电子,因此它比原子要小。
离子具有一种充满活力的特性,它们可以通过游离的形式参与化学反应,从而形成不同的化合物。
另外,离子也可以通过介电性现象、营养运输和体外代谢发挥其作用,以及某些细胞电位的调节等。
最后,本文讨论了分子、原子和离子之间的区别。
分子是一种物质的最小组成单位,它们结合在一起形成物质,而原子则是物质中最小的组成单位,而离子则是原子的一种特殊形式,它们可以与其他元素形成化合物,发挥其作用。
总之,分子、原子和离子是物理化学中的三个重要概念,它们的区别对于我们的理解物质有着重要的意义。
- 1 -。
