人教课标版高中化学必修一《镁铝及其化合物》教学PPT
合集下载
镁、铝及其重要化合物ppt 人教课标版

高考总复习.化学
整合拓展
“铝三角”及Al(OH)3沉淀图像
1.“铝三角”
高考总复习.化学
① Al3+ +3NH3· H2O Al(OH)3↓+3NH+4 _________________________________________________ Al3+ +3OHAl(OH)3↓ _________________________________________________ + 3+ +3H O Al ( OH ) +3H Al 3 2 ② ____________________________________
高考总复习.化学
跟踪训练
3.既能与盐酸反应,又能与NaOH溶液反应的化
合物是
(OH)3
( C)
⑤Al
①Al ②NaHCO3 ③Al2O3 ④Mg(OH)2 A.①②③⑤ C.②③⑤ B.①④⑤ D.①③⑤
解析:Al是单质,Mg(OH)2与NaOH溶液不反应。
高考总复习.化学
镁 基础再现 镁的性质 1.Mg与非金属单质反应 (1)Mg与O2的反应:
由2Al+6H+ 和2Al+2OH-+2H2O
2Al3+ +3H2↑ 2AlO-2+3H2↑知:若为
H2SO4或HCl溶液必满足 n(H+)<0.6 mol,若为 Ba(OH)2 ,必满足n(OH-)<0.2 mol,显然只 有D选项符合。
高考总复习.化学
2.甲、乙两烧杯中各盛有200 mL 3 mol/L的盐酸 和NaOH溶液,向两烧杯中分别加入等质量的铝 粉,反应结束后测得生成的气体体积比为甲∶乙 =1∶2,则加入铝粉1)活泼金属通性
镁铝及其化合物1.ppt
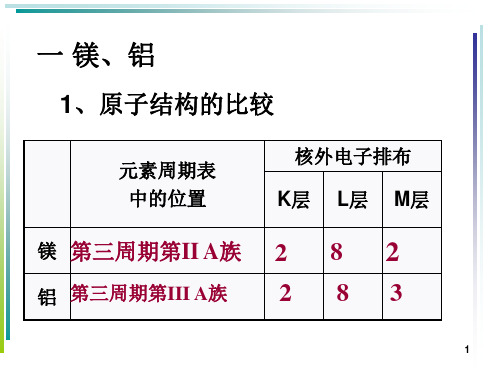
一 镁、铝
1、原子结构的比较
元素周期表 中的位置
核外电子排布 K层 L层 M层
镁 第三周期第II A族 2 8 2
铝 第三周期第III A族
2 83
1
2、物理性质的比较
相似点:均为 银白色 ;均为 轻金属 ; 熔点均 较低 ;硬度均 较小。都具有金属的 通性 不同点:镁在密度、熔点、沸点、硬度上 均 小于(或低于) 铝。
D.反应速率之比为2∶3
【解析】由关系式:Mg~H2,2Al~3H2,可知产生 等量H2时,消耗Mg、Al物质的量之比为3∶2,故A 项 正 确 。 二 者 质 量 之 比 为 4∶3 , 摩 尔 质 量 之 比 为
8∶9,反应速率之比为3∶2。
25
二、“铝三角”及其应用
1.“铝三角”是指Al3+、Al(OH)3和AlO2-相 互转化的三角关系(如下图)
分析依据:
2Al+6HCl === 2AlCl3+3H2↑ 2Al~6HCl~3H2↑
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
2Al~2NaOH~3H2↑
【思考】
1.等质量的铝分别与足量的盐酸、氢氧化钠溶液反应,
所得H2的体积之比是多少? VHCl(H2):VNaOH(H2)=1:1
共存
②AlO2-不能与 H+、HCO3-(直接反应); Al3+、NH4+、 Fe3+(双水解)大量共存 28
即时巩固
4、某无色溶液中加入铝粉只产生氢气,则下列离子
组中可能大量共存的是 ( C D )
A.K+ 、NH4+、Cl- 、NO3- B.K+、Na+、Cl-、HCO3C.K+、NH4+、Cl-、SO42- D.K+、CO32-、Cl-、SO325、某无色透明溶液跟金属Al反应,放出H2。试判断 下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、 OH-、 CO32-、HCO3-、NO3-,下列两种情况能存在此溶液中。 当生成Al3+时,可能存在 __H_+_、__M__g_2_+_、__S_O_4_2- 当生成AlO2-时,可能存在_O__H_-_、__B__a_2_+、__N_ O3_-_ 29
1、原子结构的比较
元素周期表 中的位置
核外电子排布 K层 L层 M层
镁 第三周期第II A族 2 8 2
铝 第三周期第III A族
2 83
1
2、物理性质的比较
相似点:均为 银白色 ;均为 轻金属 ; 熔点均 较低 ;硬度均 较小。都具有金属的 通性 不同点:镁在密度、熔点、沸点、硬度上 均 小于(或低于) 铝。
D.反应速率之比为2∶3
【解析】由关系式:Mg~H2,2Al~3H2,可知产生 等量H2时,消耗Mg、Al物质的量之比为3∶2,故A 项 正 确 。 二 者 质 量 之 比 为 4∶3 , 摩 尔 质 量 之 比 为
8∶9,反应速率之比为3∶2。
25
二、“铝三角”及其应用
1.“铝三角”是指Al3+、Al(OH)3和AlO2-相 互转化的三角关系(如下图)
分析依据:
2Al+6HCl === 2AlCl3+3H2↑ 2Al~6HCl~3H2↑
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
2Al~2NaOH~3H2↑
【思考】
1.等质量的铝分别与足量的盐酸、氢氧化钠溶液反应,
所得H2的体积之比是多少? VHCl(H2):VNaOH(H2)=1:1
共存
②AlO2-不能与 H+、HCO3-(直接反应); Al3+、NH4+、 Fe3+(双水解)大量共存 28
即时巩固
4、某无色溶液中加入铝粉只产生氢气,则下列离子
组中可能大量共存的是 ( C D )
A.K+ 、NH4+、Cl- 、NO3- B.K+、Na+、Cl-、HCO3C.K+、NH4+、Cl-、SO42- D.K+、CO32-、Cl-、SO325、某无色透明溶液跟金属Al反应,放出H2。试判断 下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、 OH-、 CO32-、HCO3-、NO3-,下列两种情况能存在此溶液中。 当生成Al3+时,可能存在 __H_+_、__M__g_2_+_、__S_O_4_2- 当生成AlO2-时,可能存在_O__H_-_、__B__a_2_+、__N_ O3_-_ 29
高中化学第三章第3讲镁铝及其化合物课件新人教.ppt

化的三角关系。根据“铝三角”完成对应的离 子方程式。
(1)Al3+
Al(OH)3
① Al3++3NH3·H2O
Al(OH)3↓+N3H
4
② Al3++A3 lO2 +6H2O
4Al(OH)3↓
③ Al3++3OH-
Al(OH)3↓
(2)Al(OH)3
Al3+
Al(OH)3+3H+
Al3++3H2O
Mg(OH)2↓
Al3++3OH-
Al(OH)3↓
Al(OH)3+OH- A lO2 +2H2O 不能,因为在Al3+与氨水反应生成Al(OH)3后,
Al(OH)3不能与氨水继续反应,从而不能将
Al(OH)3与Mg(OH)2分开
(2)Cl-、K+、A lO2 、H+、OH-、Na+ 因为
氢氧化铝能与强酸反应,所以在加入盐酸使A lO2
C.3∶4
D.4∶3
思路导引
解答本题时需明确以下三点:①Fe、Al均能与
盐酸反应产生H2;②只有Al能与NaOH溶液反 应产生H2;③根据金属与酸、碱反应生成H2的
解析 设每份Fe、Al合金样品中含铁、铝的物质
的量分别为x、y,则由Fe2HCl
H2↑,Al3HCl
3 2
H2↑N, aAOl H23
(3)Al3+
A lO2
Al3++4OH-
A lO2 +2H2O
• A lO2 A lO2 +4H+
Al3+ Al3++2H2O
(1)Al3+
Al(OH)3
① Al3++3NH3·H2O
Al(OH)3↓+N3H
4
② Al3++A3 lO2 +6H2O
4Al(OH)3↓
③ Al3++3OH-
Al(OH)3↓
(2)Al(OH)3
Al3+
Al(OH)3+3H+
Al3++3H2O
Mg(OH)2↓
Al3++3OH-
Al(OH)3↓
Al(OH)3+OH- A lO2 +2H2O 不能,因为在Al3+与氨水反应生成Al(OH)3后,
Al(OH)3不能与氨水继续反应,从而不能将
Al(OH)3与Mg(OH)2分开
(2)Cl-、K+、A lO2 、H+、OH-、Na+ 因为
氢氧化铝能与强酸反应,所以在加入盐酸使A lO2
C.3∶4
D.4∶3
思路导引
解答本题时需明确以下三点:①Fe、Al均能与
盐酸反应产生H2;②只有Al能与NaOH溶液反 应产生H2;③根据金属与酸、碱反应生成H2的
解析 设每份Fe、Al合金样品中含铁、铝的物质
的量分别为x、y,则由Fe2HCl
H2↑,Al3HCl
3 2
H2↑N, aAOl H23
(3)Al3+
A lO2
Al3++4OH-
A lO2 +2H2O
• A lO2 A lO2 +4H+
Al3+ Al3++2H2O
镁、铝及其化合物1 人教课标版精选教学PPT课件

镁、铝及其化合物
一、金属的通性
1.金属的晶体结构 金属具有一些共同性质,是由它们的原子 结构和晶体结构的相似性决定的。金属的价电子 较少,容易失去价电子变成金属离子,这些释放 出的价电子,在整个晶体内自由移动,人称“自 由电子”。金属晶体内的实际情况是“金属离子 沉浸在自由电子的海洋中”。换言之,是金属离 子和自由电子之间存在着较强的电性作用,使许 多金属离子和自由电子相互结合在一起形成晶体。
另外,加热并蒸干AlCl3的水溶液,由于AlCl3
+ 3H2O
Al(OH)3 + 3HCl 为 一 吸 热 反 应 , 且
HCl易挥发,加热会使平衡不断向右移动,AlCl3最
终 变 成 Al(OH)3 , 再 灼 烧 , 2Al(OH)3
Al2O3 +
3H2O , 最 后 留 下 的 物 质 为 Al2O3 。 而 加 热 并 蒸 干
是无色晶体,易溶于水,在水中电离的方程式
为KAl(SO4)2=K++Al3++2SO,同时发生水解
反应:Al3++3H2O
Al(OH)3+3H+,使
其水溶液显酸性。明矾水解所产生的胶状
Al(OH)3吸附能力很强,能吸附水里的杂质,并 形成沉淀,使水澄清,所以明矾常用作净水剂。
向KAl(SO4)2溶液中滴加Ba(OH)2生成的沉淀 的量判断:
铝热反应的应用:焊接钢轨,冶炼熔点 较高的金属,如:钒、铬、锰等。
4.有关Al(OH)3沉淀的图象规律
①向一定量的AlCl3溶液中逐滴加入NaOH溶液至 过量。见图(a)
有关离子方程式为Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=
+2H2O
②向一定量的NaOH溶液中逐滴加入AlCl3溶液至
一、金属的通性
1.金属的晶体结构 金属具有一些共同性质,是由它们的原子 结构和晶体结构的相似性决定的。金属的价电子 较少,容易失去价电子变成金属离子,这些释放 出的价电子,在整个晶体内自由移动,人称“自 由电子”。金属晶体内的实际情况是“金属离子 沉浸在自由电子的海洋中”。换言之,是金属离 子和自由电子之间存在着较强的电性作用,使许 多金属离子和自由电子相互结合在一起形成晶体。
另外,加热并蒸干AlCl3的水溶液,由于AlCl3
+ 3H2O
Al(OH)3 + 3HCl 为 一 吸 热 反 应 , 且
HCl易挥发,加热会使平衡不断向右移动,AlCl3最
终 变 成 Al(OH)3 , 再 灼 烧 , 2Al(OH)3
Al2O3 +
3H2O , 最 后 留 下 的 物 质 为 Al2O3 。 而 加 热 并 蒸 干
是无色晶体,易溶于水,在水中电离的方程式
为KAl(SO4)2=K++Al3++2SO,同时发生水解
反应:Al3++3H2O
Al(OH)3+3H+,使
其水溶液显酸性。明矾水解所产生的胶状
Al(OH)3吸附能力很强,能吸附水里的杂质,并 形成沉淀,使水澄清,所以明矾常用作净水剂。
向KAl(SO4)2溶液中滴加Ba(OH)2生成的沉淀 的量判断:
铝热反应的应用:焊接钢轨,冶炼熔点 较高的金属,如:钒、铬、锰等。
4.有关Al(OH)3沉淀的图象规律
①向一定量的AlCl3溶液中逐滴加入NaOH溶液至 过量。见图(a)
有关离子方程式为Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=
+2H2O
②向一定量的NaOH溶液中逐滴加入AlCl3溶液至
人教课标版 镁铝及其化合物PPT

(4)写出可溶性铝盐与氨水反应的离子方程式
Al3++3NH3· H2O=3NH4++AlOH3
试解释在实验室不适宜用可溶性锌盐与氨水反应制备 可溶性锌盐与氨水反应产生的ZnOH2可溶于 氢氧化锌的原因____________________________________ 过量氨水中,生成,氨水的用量不易控制 。
镁铝的化学性质
Mg Al
常温下、空气中形成氧化物薄膜,具 有抗腐蚀的性能
与 O2 点燃 点燃 非 Mg+ O2 = 2MgO 4Al+ 3O2 = 2Al2O3 金 点燃 属 反 N2 3Mg+ N2 = Mg3N2 应 点燃 加热 S Mg+ S = MgS 2Al+ 3S = Al2S3
Cl2 Mg+Cl2 = MgCl2
Mg2+ + 2OHˉ = Mg (OH)2↓
Al3+ + 3OHˉ(少量) = Al(OH)3↓ Al(OH)3 + OHˉ = AlO2ˉ+2H2O
光卤石
铝土矿
存 在
(KCl· MgCl2· 6H2O)
菱镁矿
(Al2O3· Fe2O3· SiO2等)
(MgCO3)
冶 炼
海水
HCl
Mg(OH)2
铝土矿
MgCl2
电解
Al(OH)3
电解
△
Mg
Al2O3
Al
冰晶石Na3AlF6
用 途
制合金、飞机、汽 车部件、烟火、照 明弹等
制合金、飞机、汽车、 轮船部件、导线、日用 品
0 1 2 3 4 n(NaAlO2 )
③向HCl酸化的AlCl3溶液中滴加NaOH溶液直至过量
人教版高中化学必修一课件第3讲镁、铝及其化合物.pptx

空白演示
在此输入您的封面副标题
第3讲镁、铝及其化合物
基础盘点
一Hale Waihona Puke 金属的通性及合金自我诊断1.下列说法正确的是()
D
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
解析A项不锈钢都含有C等非金属元素;流通硬币
材质是合金,明代还没有铝制品,B、C错;D
A(8+铝l4+热AFel反323OO应34)
9Fe
与非氧化
性酸的反 应
Mg+2H+ Mg2++H2 ↑
与浓硫酸、
浓硝酸 的反应
反应,不放H2
与碱的 反应
用途
制合金、 飞机、照明弹等
A2l+H6+ 2Al3++3H2↑
常温下钝化
A2l+O2H-+H22O 2+A3lOH22↑
制合金、飞机、 导线、日用品等
请回答下列问题: (1)写出混合物中加入足量氢氧化钠溶液时,溶液
中发生反应的离子方程式:,, 。氢氧化钠溶液能否用氨水代替,为什么?。
(2)溶液a中存在的离子有;在溶液a中加入盐酸 时需控制溶液的pH,为什么?; 为此,改进方法是。
(3)为了研究AlCl3晶体的性质,在得到AlCl3溶 液后,如何得到AlCl3晶体?。 解析所给溶液中有Al3+、Mg2+、K+、Cl-,除掉 杂质只得AlCl3,则应先加足量的NaOH溶液使 M g 2 + 沉 淀 完 全 , A l 3 + 全 部 转 化A l成O2后 , 过 滤 将 Mg(OH)2除掉,后往滤液中通入过量的CO2,使 转A 化lO2成 A l ( O H ) 3 沉 淀 析 出 , 过 滤 , 向 所 得 沉 淀 中加足量盐酸,转化为AlCl3即可。
在此输入您的封面副标题
第3讲镁、铝及其化合物
基础盘点
一Hale Waihona Puke 金属的通性及合金自我诊断1.下列说法正确的是()
D
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
解析A项不锈钢都含有C等非金属元素;流通硬币
材质是合金,明代还没有铝制品,B、C错;D
A(8+铝l4+热AFel反323OO应34)
9Fe
与非氧化
性酸的反 应
Mg+2H+ Mg2++H2 ↑
与浓硫酸、
浓硝酸 的反应
反应,不放H2
与碱的 反应
用途
制合金、 飞机、照明弹等
A2l+H6+ 2Al3++3H2↑
常温下钝化
A2l+O2H-+H22O 2+A3lOH22↑
制合金、飞机、 导线、日用品等
请回答下列问题: (1)写出混合物中加入足量氢氧化钠溶液时,溶液
中发生反应的离子方程式:,, 。氢氧化钠溶液能否用氨水代替,为什么?。
(2)溶液a中存在的离子有;在溶液a中加入盐酸 时需控制溶液的pH,为什么?; 为此,改进方法是。
(3)为了研究AlCl3晶体的性质,在得到AlCl3溶 液后,如何得到AlCl3晶体?。 解析所给溶液中有Al3+、Mg2+、K+、Cl-,除掉 杂质只得AlCl3,则应先加足量的NaOH溶液使 M g 2 + 沉 淀 完 全 , A l 3 + 全 部 转 化A l成O2后 , 过 滤 将 Mg(OH)2除掉,后往滤液中通入过量的CO2,使 转A 化lO2成 A l ( O H ) 3 沉 淀 析 出 , 过 滤 , 向 所 得 沉 淀 中加足量盐酸,转化为AlCl3即可。
镁、铝及其化合物课件(78张)
(5)Al(OH)3 既能与稀硫酸反应又能与 NaOH 溶液反应( √ ) (6)明矾的化学式为 Al2(SO4)3·12H2O( × ) (7)下列物质的转化在给定条件下能够实现: Al2O3―NaO―H→aq NaAlO2(aq)―C―O2→Al(OH)3( √ )
题组一 Al2O3 和 Al(OH)3 的性质
应
能在 CO2 中燃烧:2Mg+ CO2=点==燃==2MgO+C
[深化] 1.铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保 护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。 2.铝与酸、碱反应的实质都是:A0l ―失―3e→- Al3+,2H+―得―2e→- H2, 只不过碱中的 H+来源于水的电离。氧化剂分别为酸和水。
[考纲要求] 1.了解镁、铝及其重要化合物的制备方法。 2.掌握镁、铝的主要性质及应用。 3.掌握镁、铝的重要化合物的主要性质及应用。
基础讲练 考点一 镁、铝的性质及应用
1.镁、铝的结构 镁和铝分别位于第三周期的ⅡA 族和ⅢA 族。它们的原子核外
均 有 3 个 电 子 层 , 其 原 子 结 构 示 意 图 分 别 为 Mg
1.下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是
() ①Ca(OH)2 ②Al2O3 ③Ca(HCO3)2 ④Al(OH)3 ⑤NaHSO4 ⑥Al ⑦(NH4)2S A.②④⑥ B.②③⑤⑥ C.①③④⑥ D.②③④⑥⑦
答案:A
3.铝对生物有毒害作用,尤其对人体的毒害更加严重。下列 说法不正确的是( )
A.不吃或少吃使用了含铝食品添加剂的食品 B.不能用铝制器皿长期存放酸性或碱性食品 C.杜绝铝制品在生产、生活中的应用 D.铝不属于重金属,它使人体中毒的原理与铅不同
解析:铝在生物体内长期积累会对神经系统等造成危害,故 A 正确;无论是铝还是其氧化物都能与酸或碱反应,故 B 正确;作为 金属材料,铝的优良性能比较多,比如导电性好、导热率高、轻便 易加工等,不能因其缺点而否定其优点,故 C 不正确;重金属使人 体中毒的原理是使蛋白质变性失活,与铝不同,故 D 正确。
题组一 Al2O3 和 Al(OH)3 的性质
应
能在 CO2 中燃烧:2Mg+ CO2=点==燃==2MgO+C
[深化] 1.铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保 护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。 2.铝与酸、碱反应的实质都是:A0l ―失―3e→- Al3+,2H+―得―2e→- H2, 只不过碱中的 H+来源于水的电离。氧化剂分别为酸和水。
[考纲要求] 1.了解镁、铝及其重要化合物的制备方法。 2.掌握镁、铝的主要性质及应用。 3.掌握镁、铝的重要化合物的主要性质及应用。
基础讲练 考点一 镁、铝的性质及应用
1.镁、铝的结构 镁和铝分别位于第三周期的ⅡA 族和ⅢA 族。它们的原子核外
均 有 3 个 电 子 层 , 其 原 子 结 构 示 意 图 分 别 为 Mg
1.下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是
() ①Ca(OH)2 ②Al2O3 ③Ca(HCO3)2 ④Al(OH)3 ⑤NaHSO4 ⑥Al ⑦(NH4)2S A.②④⑥ B.②③⑤⑥ C.①③④⑥ D.②③④⑥⑦
答案:A
3.铝对生物有毒害作用,尤其对人体的毒害更加严重。下列 说法不正确的是( )
A.不吃或少吃使用了含铝食品添加剂的食品 B.不能用铝制器皿长期存放酸性或碱性食品 C.杜绝铝制品在生产、生活中的应用 D.铝不属于重金属,它使人体中毒的原理与铅不同
解析:铝在生物体内长期积累会对神经系统等造成危害,故 A 正确;无论是铝还是其氧化物都能与酸或碱反应,故 B 正确;作为 金属材料,铝的优良性能比较多,比如导电性好、导热率高、轻便 易加工等,不能因其缺点而否定其优点,故 C 不正确;重金属使人 体中毒的原理是使蛋白质变性失活,与铝不同,故 D 正确。
镁和铝的重要化合物PPT高中化学精选教学课件课件 人教课标版
A.是碱性氧化物
B.与水化合成碱
C.高熔点
D.不易分解
2.用海水加石灰来提取Mg(OH)2是利用了Mg(OH)2的 性质:
A.溶解度比Ca(OH)2的小 B.不稳定受热分解生成MgO
C.碱性比Ca(OH)2的弱 D.白色粉末状固体
二、铝的重要化合物
1、氧化铝(Al2O3) (1)物理性质:
白色固体、熔点高、不溶于水,不与水化合。 (2)化学性质: ①与酸反应:Al2O3+6HCl=AlCl3+3H2O ②与碱反应:Al2O3+2NaOH=2NaAlO2+H2O
酸性: Al(OH)3+NaOH=NaAlO2+H2O
氢氧化铝既能跟酸反应生成盐和水, 又能跟碱反应生成盐和水,所以氢氧
化铝是两性氢氧化物。
氢氧化铝的两性可以下电离方程式来说明:
AlO2-
Al(OH)3
Al3+
当Al(OH)3遇碱时反应向左方向发展,遇酸 时反应向右方向发展。
注意:(1)氢氧化铝作为碱时是三元碱;作 为酸时是一元酸(HAlO3)。
舅舅拿着诊断单去询问另一位医生, 希望有 更好的 治疗方 法。不 久,他 从医生 的办公 室走出 来,只 见他步 履赼趄 ,满脸 哀愁。 姥姥对病情的诊断结果浑然不知。她 心疼我 们昼夜 照顾她 ,嘟囔 说:“ 我已经 活了将 近九十 岁,比 我的父 母、兄 弟和姐 妹活得 都长。 我活得 很知足 ,我活 够了! 我不想 再呆在 医院看 病,我 要回家 ,我要 回家! ”她在 病床上 吵着回 家,不 断用手 捶打着 病床, 她突然 间像是 一个小 孩子。
(2)氢氧化铝与酸碱反应时,弱酸弱 碱是不能把氢氧化铝溶解的。
3、硫酸铝钾( KAl(SO4)2 )
复盐的概念: 由两种不同的金属离子和一种酸根离子组
镁和铝及其化合物 PPT 人教课标版
Mg(OH)2 = MgO+H2O 2Al(OH)3=Al2O3+3H2O
分解
制法
可溶性镁盐加NaOH溶 可溶性铝盐加氨水 液
物质类别
中强碱
两性氢氧化物
总结:
比较铝和钠、镁及它们的氧化物、氢氧化物的性
质,可以看出,铝及铝的氧化物、氢氧化物既可
以与 反应又可以与 反应,而钠镁及它们
的氧化物、氢氧化物只与
4Al+3O2=2Al2O3 2Al+3S=Al2S3
2.跟某些 2Mg + CO2 =
2Al+Fe2O3=2Fe+Al2O3
化 氧化物
2MgO + C
(铝热反应)
学 3.跟水反 Mg + 2H2O =
性
应 Mg(OH)2 + H2↑
质
(冷水慢,沸水快)
很难反应
4.跟酸的 Mg + 2H+ =
反应
Mg2+ + H2↑
•
10、有些事想开了,你就会明白,在世上,你就是你,你痛痛你自己,你累累你自己,就算有人同情你,那又怎样,最后收拾残局的还是要靠你自己。
•
11、人生的某些障碍,你是逃不掉的。与其费尽周折绕过去,不如勇敢地攀登,或许这会铸就你人生的高点。
•
12、有些压力总是得自己扛过去,说出来就成了充满负能量的抱怨。寻求安慰也无济于事,还徒增了别人的烦恼。
Al(OH)3+NaOH=NaAlO2+2H2O
2×3e-
总反应式: 2Al+6H2O+2NaOH= 2NaAlO2+3H2↑+4H2O
镁和铝的重要化合物PPT教学课件
Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3 + 2OH-== 2AlO2- + H2O
2、铝的氢氧化物 [ Al(OH)3 ]
(1) Al(OH)3的吸附性 Al(OH)3是一种白色胶状物质,能
凝聚水中的悬浮物,又有吸附色素的 性能。
(2) Al(OH)3 的热稳定性
▲
2Al(OH)3 === Al2O3 + 3H2O
3、硫酸铝钾 [ KAl(SO4)2 ] 明矾: KAl(SO4)2 ·12H2O
解释:明矾为何可以净水
根据平衡移动原理可推出以下结论:
Al3+、AlO2-、H+、OH-中可以共存的有哪些?
①Al3+和H+可以共存;在碱性条件下因发生 反应Al3+ + 3OH- == Al(OH)3↓, Al3+ + 4OH-(过量) == AlO2- + 2H2O 而不能存在。即 Al3+应存在于酸性条件下。
谁知盘中餐,粒粒皆辛苦。 3、学会理财是每个人都必须具备 的生存技能。
读故事,谈感悟。
洛克非勒是美国著名的石油大亨, 尽管其家族非常富有,但却一直保持着 重视节俭、严格教育子女的家规。在入 学之前,父母从不给孩子零花钱,孩子 上学以后,才给他们少量的零花钱。发 给的零用钱根据年龄而变化,7-8岁时, 每周3角;11-12岁时,每周一元;13岁 以后,每周2元,每周发一次。
+ 3H+
+OH- AlO2- 4H+
Al(OH)3+3H+==Al3++3H2O
Al(OH)3+NaOH==NaAlO2+2H2O
2、铝的氢氧化物 [ Al(OH)3 ]
(1) Al(OH)3的吸附性 Al(OH)3是一种白色胶状物质,能
凝聚水中的悬浮物,又有吸附色素的 性能。
(2) Al(OH)3 的热稳定性
▲
2Al(OH)3 === Al2O3 + 3H2O
3、硫酸铝钾 [ KAl(SO4)2 ] 明矾: KAl(SO4)2 ·12H2O
解释:明矾为何可以净水
根据平衡移动原理可推出以下结论:
Al3+、AlO2-、H+、OH-中可以共存的有哪些?
①Al3+和H+可以共存;在碱性条件下因发生 反应Al3+ + 3OH- == Al(OH)3↓, Al3+ + 4OH-(过量) == AlO2- + 2H2O 而不能存在。即 Al3+应存在于酸性条件下。
谁知盘中餐,粒粒皆辛苦。 3、学会理财是每个人都必须具备 的生存技能。
读故事,谈感悟。
洛克非勒是美国著名的石油大亨, 尽管其家族非常富有,但却一直保持着 重视节俭、严格教育子女的家规。在入 学之前,父母从不给孩子零花钱,孩子 上学以后,才给他们少量的零花钱。发 给的零用钱根据年龄而变化,7-8岁时, 每周3角;11-12岁时,每周一元;13岁 以后,每周2元,每周发一次。
+ 3H+
+OH- AlO2- 4H+
Al(OH)3+3H+==Al3++3H2O
Al(OH)3+NaOH==NaAlO2+2H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3 + 2OH- == 2AlO2 -+ H2O
2.氢氧化铝.
(1)受热分解:2 Al(OH)3 △ Al2O3 + 3 H2O (2)两性氢氧化物
Al(OH)3的电离 Al3+ + 3 OH-
Al(OH)3
AlO2- + H2O + H+
。
【例题4】某学生用铝片分别与c(H+)均为3 mol/L的稀盐酸和稀硫
酸反应,其实验过程:往装有相同铝片的2支试管中分别加入等体积, 且c(H+)=3.0 mol/L的盐酸和硫酸,观察反应进行到1、2、5、15、 20 min时铝片与酸反应的情况。实验结果如下表:
反应进程(min)
1
2
5
15
20
假设(猜想)二:_假__设_二__:__S_O_42_—_对__H_+_与_金__属__铝_的__反__应_起_ 阻碍作用。
例题剖析
【例1】下列叙述正确的是
( CD)
A.铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下 铝和浓硫酸、浓硝酸不反应。
B.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧 化钠溶液反应,产生的氢气前者多。
注:Al(OH)3只溶于强酸强碱,不溶于弱酸弱碱
Al(OH)3 + 3H + == Al3+ + 3H2O Al(OH)3 + OH - == AlO2- + 2H2O
(3)制备 a. Al3+ + 3NH3·H2O == 3NH4+ Al(OH)3
b. 2AlO2- + CO2+ 3H2O == CO32- + 2Al(OH)3 c. 3AlO2- + Al 3+ + 6H2O == 4Al(OH)3
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存 在形式为 AlO2- (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
Zn+2NaOH=Na2ZnO2+H2
(3)下列各组中的两种溶液,用相互滴加的实验方法 即可鉴别的是 ①③④ 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和 氢氧化钠 ④ 硫酸锌和氨水
与碱反应
2Al+2H2O+2OH— = 2AlO2— +3H2↑
【思考1】 试分析铝与强碱溶液反应的实质,该反应还原 剂、氧化剂分别是何物质? [解析]铝和强碱溶液反应,通常认为是铝先和
强碱溶液中的水反应生成氢氧化铝,然后氢氧化铝再和 强碱反应生成偏铝酸盐。
6e-
2Al+6H2O=== 2Al(OH)3 +3H2↑
②向NaAlO2溶液中滴加HCl溶液直至过量
AlO2ˉ+H2O+H+(少量)= Al(OH)3↓
1mol Al(OH)3 +3H+ = Al3++3H2O
3mol
n[Al(OH)3]
0 1 2 3 4 n(HCl)
向HCl溶液中滴加NaAlO2 溶液直至过量
AlO2ˉ+4H+(过量)= Al3++2H2O 1mol
该装置将 化学能 能转化为 电能能。 (2)若烧杯中溶液为氢氧化钠溶液,则负极为 Al , 总反应方程为 2Al+2NaOH+2H2O=2NaAlO2+3H。2↑
存在
光卤石
(KCl·MgCl2·6H2O)
菱镁矿
(MgCO3)
铝土矿
(Al2O3·Fe2O3·SiO2等)
冶炼
海水
Mg(OH)2
HCl MgCl2 电解
Al3++3AlO2-+6H2O=4Al(OH)3↓
铝三角
Al3+
❖
AlO2-
3反应图像,并写出各阶段离子方 程式。
①向AlCl3溶液中滴加NaOH溶液直至过量
Al3+ + 3OHˉ(少量) = Al(OH)3↓ 3mol
Al(OH)3
+ OHˉ 1mol
请说明理由.
[解析]将镁粉加入NH4Cl溶液中,有氢气和刺激性的 氨气生成,这是由于NH4Cl水解呈酸性,镁与水解产生的 H+反应生成氢气而破坏了NH4Cl的水解平衡,NH3•H2O浓度 不断增大而分解放出NH3.反应的化学方程式可表示为:
Mg +2NH4Cl === 2NH3↑+MgCl2 +H2↑
高中化学总复习
镁铝及其化合物
知识要点:
镁
铝
光泽 密度 原子或离子半径
金属键能
Mg
Al
银白色轻金属
> <
的 物 理
熔、 沸 点
性
硬度
<
质
小结:
共性: 银白色轻金属,固体,熔点较低,硬度较小,密度较
小,有良好的导电、导热、延展性和韧性
异性: 铝比镁硬度稍大、熔沸点稍高(铝的金属键比镁强)
镁铝的化学性质
金属的分类:
1.冶金工业的分类方法:
黑色金属(铁.铬.锰) 2.根据密度的大小分类: 有色金属(除以上三种) 轻金属(小于4.5g/cm3)如:铝.钾.镁.钠 3.根据地壳中的含量: 重金属(大于4.5g/cm3)如:铁.铜.银.汞 常见金属如:铁.铜.锡
金属的物理性质:
1. 常温时,除汞外,其它都是固体。 2. 有金属光泽(粉末状时呈暗灰色或黑色) 3. 导电、导热性良好 4. 延展性良好 5. 熔沸点高、硬度大。
在实验室制备一定量的氢氧化铝。可分别采用如下化学 方程式所表示的两种方法:
Mg(OH)2+2H+= Mg2++H2O 2Al(OH)3+6H+=2Al3++3H2O
Al(OH)3+OH—=AlO2ˉ+2H2O
类别
中强碱
两性氢氧化物
主要用途
实验室 制法
制MgO和镁盐
Mg2++2OHˉ = Mg(OH)2↓
制备Al2O3和净水剂
Al3++3NH3•H2O=Al(OH)3↓+3NH4+ 2AlO2ˉ+CO2+2H2O=2Al(OH)3↓+CO32ˉ AlO2ˉ+CO2+2H2O=Al(OH)3↓+HCO3ˉ 3 AlO2ˉ+Al3++6 H2O=4Al(OH)3↓
① Al3+ OH- 适量
Al(OH)3
OH-
过量
AlO2-
② Al3+
NOH足3量·H2Al(OH)3
NH3 ·H2 O过量
不溶解
法②优于法①
(2)偏铝酸盐与酸反应:
① AlO2-
H+ 适量
Al(OH)3
H+ 过量
②
AlO2-
CO2 适量
Al(OH)3
CO2 过量
Al3+ 不溶解
法②优于法①
(3)互相促进水解反应:
第二部分 镁铝化合物
(1)Mg、Al的氧化物
MgO
物理性质
白色粉末,难熔
化 H2O
学 性
H+
质 OH—
类别
MgO+H2O= Mg(OH)2 (缓慢) MgO+2H+=Mg2++H2O
碱性氧化物
主要用途 耐火材料,制备镁盐
工业制法
煅烧MgCO3
Al2O3
白色粉末,难熔,不溶于水
Al2O3+6H+=2Al3++3H2O Al2O3+2OHˉ=2AlO2ˉ+ H2O
C.合金的熔点一般比组成它的各成分的熔点都低。
D.工业上常利用铝热反应冶炼难熔金属,如钒、铬、 锰。
四 重要化合物:
1.氧化铝 典型两性氧化物
白色粉末,熔点高,可做耐火材料。 自然界中纯净的为无色晶体,硬度仅次与金刚石, 俗称刚玉。
练习:写出Al2O3分别与盐酸、NaOH溶液反应 的化学方程式及离子方程式。
2Al(6Oe-H)3 + 2NaOH===2NaAlO2 +4H2O
2Al+6H2O+2NaOH===2NaAlO2+3H2↑+4H2O
此反应中,还原剂是 铝 ,氧化剂是 水
【思考2】 如图
(1)若烧杯中溶液为稀硫酸,则观察到的现象。 镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;
两极反应式为:正极 2H++2eˉ=H2↑ ; 负极 Mg-2eˉ=Mg2 + 。
n(NaOH)
④向含Mg2+、Al3+的混合溶液中滴加NaOH溶液直至
过量
Mg2+ + 2OHˉ = Mg (OH)2↓
Al3+ + 3OHˉ(少量) = Al(OH)3↓
Al(OH)3、 Mg(OH)2 Mg(OH)2
Al(OH)3 + OHˉ = AlO2ˉ+2H2O
n(NaOH)
【例1】今用铝、稀硫酸和氢氧化钠溶液为原料,
两性氧化物
耐火材料,冶炼原料,制备铝盐, 制备偏铝酸盐,刚玉为耐磨材料
从铝土矿中提取
(2)Mg、Al的氢氧化物
Mg(OH)2
Al(OH)3
物理性质
热稳
化 定性
学
性
H+
质 OH—
白色,不溶于水(溶解部 分电离出的OH—可使酚酞 变红)
2.氢氧化铝.
(1)受热分解:2 Al(OH)3 △ Al2O3 + 3 H2O (2)两性氢氧化物
Al(OH)3的电离 Al3+ + 3 OH-
Al(OH)3
AlO2- + H2O + H+
。
【例题4】某学生用铝片分别与c(H+)均为3 mol/L的稀盐酸和稀硫
酸反应,其实验过程:往装有相同铝片的2支试管中分别加入等体积, 且c(H+)=3.0 mol/L的盐酸和硫酸,观察反应进行到1、2、5、15、 20 min时铝片与酸反应的情况。实验结果如下表:
反应进程(min)
1
2
5
15
20
假设(猜想)二:_假__设_二__:__S_O_42_—_对__H_+_与_金__属__铝_的__反__应_起_ 阻碍作用。
例题剖析
【例1】下列叙述正确的是
( CD)
A.铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下 铝和浓硫酸、浓硝酸不反应。
B.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧 化钠溶液反应,产生的氢气前者多。
注:Al(OH)3只溶于强酸强碱,不溶于弱酸弱碱
Al(OH)3 + 3H + == Al3+ + 3H2O Al(OH)3 + OH - == AlO2- + 2H2O
(3)制备 a. Al3+ + 3NH3·H2O == 3NH4+ Al(OH)3
b. 2AlO2- + CO2+ 3H2O == CO32- + 2Al(OH)3 c. 3AlO2- + Al 3+ + 6H2O == 4Al(OH)3
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存 在形式为 AlO2- (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
Zn+2NaOH=Na2ZnO2+H2
(3)下列各组中的两种溶液,用相互滴加的实验方法 即可鉴别的是 ①③④ 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和 氢氧化钠 ④ 硫酸锌和氨水
与碱反应
2Al+2H2O+2OH— = 2AlO2— +3H2↑
【思考1】 试分析铝与强碱溶液反应的实质,该反应还原 剂、氧化剂分别是何物质? [解析]铝和强碱溶液反应,通常认为是铝先和
强碱溶液中的水反应生成氢氧化铝,然后氢氧化铝再和 强碱反应生成偏铝酸盐。
6e-
2Al+6H2O=== 2Al(OH)3 +3H2↑
②向NaAlO2溶液中滴加HCl溶液直至过量
AlO2ˉ+H2O+H+(少量)= Al(OH)3↓
1mol Al(OH)3 +3H+ = Al3++3H2O
3mol
n[Al(OH)3]
0 1 2 3 4 n(HCl)
向HCl溶液中滴加NaAlO2 溶液直至过量
AlO2ˉ+4H+(过量)= Al3++2H2O 1mol
该装置将 化学能 能转化为 电能能。 (2)若烧杯中溶液为氢氧化钠溶液,则负极为 Al , 总反应方程为 2Al+2NaOH+2H2O=2NaAlO2+3H。2↑
存在
光卤石
(KCl·MgCl2·6H2O)
菱镁矿
(MgCO3)
铝土矿
(Al2O3·Fe2O3·SiO2等)
冶炼
海水
Mg(OH)2
HCl MgCl2 电解
Al3++3AlO2-+6H2O=4Al(OH)3↓
铝三角
Al3+
❖
AlO2-
3反应图像,并写出各阶段离子方 程式。
①向AlCl3溶液中滴加NaOH溶液直至过量
Al3+ + 3OHˉ(少量) = Al(OH)3↓ 3mol
Al(OH)3
+ OHˉ 1mol
请说明理由.
[解析]将镁粉加入NH4Cl溶液中,有氢气和刺激性的 氨气生成,这是由于NH4Cl水解呈酸性,镁与水解产生的 H+反应生成氢气而破坏了NH4Cl的水解平衡,NH3•H2O浓度 不断增大而分解放出NH3.反应的化学方程式可表示为:
Mg +2NH4Cl === 2NH3↑+MgCl2 +H2↑
高中化学总复习
镁铝及其化合物
知识要点:
镁
铝
光泽 密度 原子或离子半径
金属键能
Mg
Al
银白色轻金属
> <
的 物 理
熔、 沸 点
性
硬度
<
质
小结:
共性: 银白色轻金属,固体,熔点较低,硬度较小,密度较
小,有良好的导电、导热、延展性和韧性
异性: 铝比镁硬度稍大、熔沸点稍高(铝的金属键比镁强)
镁铝的化学性质
金属的分类:
1.冶金工业的分类方法:
黑色金属(铁.铬.锰) 2.根据密度的大小分类: 有色金属(除以上三种) 轻金属(小于4.5g/cm3)如:铝.钾.镁.钠 3.根据地壳中的含量: 重金属(大于4.5g/cm3)如:铁.铜.银.汞 常见金属如:铁.铜.锡
金属的物理性质:
1. 常温时,除汞外,其它都是固体。 2. 有金属光泽(粉末状时呈暗灰色或黑色) 3. 导电、导热性良好 4. 延展性良好 5. 熔沸点高、硬度大。
在实验室制备一定量的氢氧化铝。可分别采用如下化学 方程式所表示的两种方法:
Mg(OH)2+2H+= Mg2++H2O 2Al(OH)3+6H+=2Al3++3H2O
Al(OH)3+OH—=AlO2ˉ+2H2O
类别
中强碱
两性氢氧化物
主要用途
实验室 制法
制MgO和镁盐
Mg2++2OHˉ = Mg(OH)2↓
制备Al2O3和净水剂
Al3++3NH3•H2O=Al(OH)3↓+3NH4+ 2AlO2ˉ+CO2+2H2O=2Al(OH)3↓+CO32ˉ AlO2ˉ+CO2+2H2O=Al(OH)3↓+HCO3ˉ 3 AlO2ˉ+Al3++6 H2O=4Al(OH)3↓
① Al3+ OH- 适量
Al(OH)3
OH-
过量
AlO2-
② Al3+
NOH足3量·H2Al(OH)3
NH3 ·H2 O过量
不溶解
法②优于法①
(2)偏铝酸盐与酸反应:
① AlO2-
H+ 适量
Al(OH)3
H+ 过量
②
AlO2-
CO2 适量
Al(OH)3
CO2 过量
Al3+ 不溶解
法②优于法①
(3)互相促进水解反应:
第二部分 镁铝化合物
(1)Mg、Al的氧化物
MgO
物理性质
白色粉末,难熔
化 H2O
学 性
H+
质 OH—
类别
MgO+H2O= Mg(OH)2 (缓慢) MgO+2H+=Mg2++H2O
碱性氧化物
主要用途 耐火材料,制备镁盐
工业制法
煅烧MgCO3
Al2O3
白色粉末,难熔,不溶于水
Al2O3+6H+=2Al3++3H2O Al2O3+2OHˉ=2AlO2ˉ+ H2O
C.合金的熔点一般比组成它的各成分的熔点都低。
D.工业上常利用铝热反应冶炼难熔金属,如钒、铬、 锰。
四 重要化合物:
1.氧化铝 典型两性氧化物
白色粉末,熔点高,可做耐火材料。 自然界中纯净的为无色晶体,硬度仅次与金刚石, 俗称刚玉。
练习:写出Al2O3分别与盐酸、NaOH溶液反应 的化学方程式及离子方程式。
2Al(6Oe-H)3 + 2NaOH===2NaAlO2 +4H2O
2Al+6H2O+2NaOH===2NaAlO2+3H2↑+4H2O
此反应中,还原剂是 铝 ,氧化剂是 水
【思考2】 如图
(1)若烧杯中溶液为稀硫酸,则观察到的现象。 镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;
两极反应式为:正极 2H++2eˉ=H2↑ ; 负极 Mg-2eˉ=Mg2 + 。
n(NaOH)
④向含Mg2+、Al3+的混合溶液中滴加NaOH溶液直至
过量
Mg2+ + 2OHˉ = Mg (OH)2↓
Al3+ + 3OHˉ(少量) = Al(OH)3↓
Al(OH)3、 Mg(OH)2 Mg(OH)2
Al(OH)3 + OHˉ = AlO2ˉ+2H2O
n(NaOH)
【例1】今用铝、稀硫酸和氢氧化钠溶液为原料,
两性氧化物
耐火材料,冶炼原料,制备铝盐, 制备偏铝酸盐,刚玉为耐磨材料
从铝土矿中提取
(2)Mg、Al的氢氧化物
Mg(OH)2
Al(OH)3
物理性质
热稳
化 定性
学
性
H+
质 OH—
白色,不溶于水(溶解部 分电离出的OH—可使酚酞 变红)
