化学键理论概述
化学中的化学键理论

化学中的化学键理论化学键是指原子间的吸引力力,是分子形成的基础。
化学键的形成、性质和断裂是化学反应的重要环节,也是化学研究的核心内容。
化学键理论是化学学科中的重要分支之一,它揭示了化学键的性质和本质,为化学科学的发展和应用提供了理论基础。
1. 传统化学键理论在传统的化学中,原子间的化学键是指开尔文的“亲和力”理论。
它将原子的吸引力定义为原子核和共享了某些电荷的电子间的作用力,是一个纯经验的观点。
它不是一个特别准确的预测性理论,但是仍然在一些情况下被广泛使用。
2. 共价键理论共价键理论是指两个原子通过共享电子共同发展出的化学键。
这一理论揭示了共价键的本质,即原子间电子的共享。
共价键通常用杂化轨道理论来解释。
杂化轨道理论认为,原子的价电子空壳轨道中的电子可能会混合成新的、更稳定的轨道,称为杂化轨道。
杂化轨道提供了一个更准确的方法来描述共价键——如在氨分子中,氮原子价电子空壳轨道和氢原子的原子轨道混合,产生了四个杂化轨道,分别用于和四个氢原子组成共价键。
3. 离子键理论离子键理论是指形成离子键的原理。
它是一种典型的原子或分子排斥的现象。
当两种化学物质中含有带电离子时,离子间会产生电吸引力,因此导致它们结合到一起,而这些带电离子被称为离子。
离子键通常发生在化合物中,如氯化钠(NaCl)和硫酸二钾(K2SO4)。
4. 金属键理论金属键是指金属中的化学键,通常是由金属离子通过共享电子形成金属键。
金属离子在结晶中排列成空间有序的三维结构,形成晶格。
这种排列方式为金属提供了良好的机械性能和导电性能,在大规模制造工业用金属和合金方面有着重要的应用。
总之,化学键理论是化学学科的核心,它揭示了化学键的本质及其反应机理,为探索化学反应规律和推进实用化学技术发展提供了基础。
为了更好地掌握化学反应过程,我们需要深入了解化学键理论,并将其应用于实践中。
化学键理论

化学键理论1. 引言化学键理论是化学的基础理论之一,用于解释物质中原子如何通过共用、离子、金属等键形成化合物。
本文将介绍化学键的概念、类型、强度和特点,以及相关的分子轨道理论和晶体结构中的键。
2. 化学键的概念化学键是由原子之间的相互作用力形成的,用于稳定原子之间的连接,以形成化合物。
它是化学反应和化学转化的基础。
根据原子之间电子的共享或转移方式,化学键可分为共价键、离子键和金属键三种类型。
2.1 共价键共价键是由两个原子共用一对电子而形成的。
在共价键中,原子之间的电子密度共享,以形成一个稳定的化合物。
共价键的强度取决于原子间的电子云重叠程度。
2.2 离子键离子键是由正负电荷之间的相互作用力形成的。
离子键通常存在于由金属和非金属元素组成的化合物中,其中金属原子失去电子形成阳离子,非金属原子获得电子形成阴离子。
离子键的强度取决于产生的离子之间的吸引力。
2.3 金属键金属键是金属原子之间的强电子云相互作用力形成的。
金属键的特点是原子之间的电子云重叠形成一个导电的金属电子海,这种电子海使得金属具有良好的导电性和延展性。
3. 化学键的强度和特点化学键的强度决定了化合物的稳定性和性质。
共价键通常强于离子键和金属键。
化学键的强度可以通过键能来衡量,键能是在形成化学键时放出或吸收的能量。
化学键的特点还包括键长和键角。
键长是指两个原子之间的距离,它通过实验或计算得到。
键角是指连接三个原子的两个化学键之间的夹角,它决定了分子的形状和空间结构。
4. 分子轨道理论分子轨道理论是用于描述共价键形成和分子性质的理论。
根据分子轨道理论,原子中的原子轨道会线性组合形成分子轨道。
分子轨道存在于整个分子中,描述了共价键中电子的分布情况。
常见的分子轨道包括Sigma(σ)轨道和Pi(π)轨道。
Sigma轨道是由轴向重叠形成的,是共价键中电子密度最高的轨道。
Pi轨道则是通过平面上的侧向重叠形成的,通常存在于双键和三键中。
5. 晶体结构中的键除了在分子中形成化学键外,化学键也存在于晶体结构中。
无机化学7.3化学键理论
n
价轨道数
最大成键数
2
4(2s,2px,2py,2pz)
4
3 9 (3s,3px,3py,3pz,3dz2,3dx2-y2,3dxy,3dxz,3dyz) 6
(2) 方向性
除s 轨道(角度部分为球形)外,p 、 d、f 原子轨 道在空间只有沿着一定的方向与别的原子轨道重叠, 才会产生“最大重叠”;两轨道重叠面积↑,电子在两 核间出现的几率密度↑,共价键强度↑。
键级=
成键分子轨道电子数
反键分子轨道电子数
2
20 2
1
(相当于共价单键)
2键. 级H2=+(1 氢2 0分子0.离5单子电)子键(HV2B[(无1S此)1说] 法)
3.He2 He 2 [( 1S )2 (1*S )2 ]
键级= 2 2 0 (不成键) 2
不能稳定存在
4. He2+
He2
(
1S
7.3 化学键理论
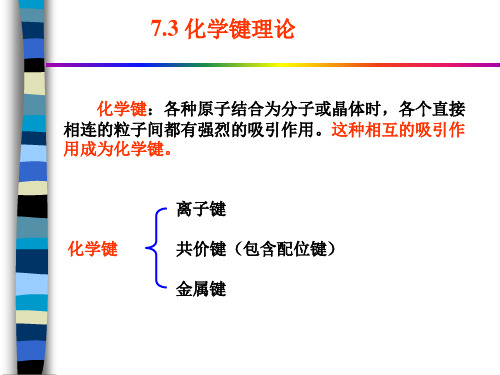
化学键:各种原子结合为分子或晶体时,各个直接 相连的粒子间都有强烈的吸引作用。这种相互的吸引作 用成为化学键。
化学键
离子键 共价键(包含配位键) 金属键
化学键理论
离子键理论: 共价健理论:
金属键理论:
Na+Cl-
, Ca2+O2-
H-H , H-Cl,
NN , H3C-CH3 , H2C=CH2 , HCCH Na, Mg, Al, K, Ca,
O2 , F2 , Ne2 :
E (2p) > E (2p)
第二周期元素分子轨道的形成
Li2 – N2
O2 – Ne2
第二周期同核双原子分子的分子轨道能级
Li2,Be2, B2, C2,N2 分子轨道能级顺序为:
化学键的价电子对排斥理论

化学键的价电子对排斥理论化学键是不同元素之间的相互作用力,让原子能够形成稳定的分子。
在化学键的形成过程中,原子的价电子对的排列有着非常重要的影响。
本文将介绍化学键的价电子对排斥理论,并探讨其在化学反应和分子结构中的应用。
一、化学键的概念与价电子对化学键是原子之间由于电子重新分配而形成的相互作用力。
原子的外层电子数目直接决定了其化学性质,而形成化学键的主要是原子的外层价电子。
原子通过与其他原子共享或转让电子来达到稳定的电子构型。
原子中的价电子对是指参与化学键形成的电子对。
对于主族元素,它们的外层电子数等于它们的主族号,即它们的电子构型为ns^2np^6。
原子需要充满外层电子轨道的电子数等于该原子主族号。
比如氧原子(O)的主族号为16,因此氧原子中的价电子对数为6。
二、价电子对排斥理论的提出价电子对排斥理论是由盖伦-赛克斯(Gillespie)和纳伊伯(Nyholm)于1957年提出的。
该理论认为,在分子中,原子上的价电子对会相互排斥,使得它们尽可能地远离彼此,以减小排斥力的作用。
这种排斥力对分子的结构和化学反应产生了重要影响。
三、价电子对排斥理论对分子几何结构的影响根据价电子对排斥理论,分子中电子对的互相排斥会导致分子的几何结构发生调整,以最大程度地降低电子对之间的排斥力。
根据电子对的排布情况,常见的几何结构可以分为线性、三角形平面、四面体、五角形平面等。
以水分子(H2O)为例,氧原子中有2对非共享的孤对电子和2对与氢原子共享的电子对。
这些电子对的排列使得水分子呈现出角度为104.5度的V型结构。
这是因为两对孤对电子通过与两个氢原子的电子云产生静电斥力,使得氢原子之间的角度变成了近似109.5度而不是预期中的120度。
四、价电子对排斥理论在分子极性和化学反应中的应用价电子对排斥理论有助于解释分子的极性和化学反应的发生。
在分子中,如果化学键中的电子对较多,则分子呈极性。
例如,二氧化碳(CO2)分子由于氧气原子周围有两对非共享电子对,因此CO2是无极性分子。
分子结构-化学键理论概述

共价键的本质——从上面分析可知, 共价键依然是电性的,本质是轨道重 叠和电子共用,但这时是共用电子形 成的负电区域的引力,而不是库仑静 电引力。
11-2-3 现代价键理论(电子配对法) 的要点
1 共价键的形成
鲍林等人将海特勒-伦敦氢分子方法推 广到其他复杂分子系统中,认为共价键的形 成必须符合以下原理:
11-1 离子键理论
11-1-1 离子键的形成
1916年德国化学家柯塞尔(科塞尔) 根据稀有气体具有稳定结构的事实提 出了离子键理论。
离子键的形成机制
稳定倾向——活泼金属原子和活泼非金属原子接近 时,都有达到稳定稀有气体结构的倾向。
电子转移——这时活泼金属原子易失去价电子,成 为带正电荷的正离子 (阳离子);活泼非金属原子易 得到相应电子,成为带负电荷的负离子 (阴离子), 即电子转移。一旦形成正负离子,两者继续靠近时 电子结构变化不大。
d = r++r就可以得到其他离子的半径。
离子半径(pm)
离子半径变化规律
同主族上下同电荷离子半径增加; 同周期中,正离子电荷越高越小, 负离子电荷越高越大。
同元素:正离子<原子<负离子。
对性质的影响——离子半径越小,引力 越大,熔点和沸点越高(限于典型的离 子晶体)。同时影响化学性质,如I-、 Br -、Cl -、 F-的还原性依次降低。
计算——晶格能难以直接测量,可应 用玻恩-哈勃循环间接测量得到(实际
得到的是ΔH,但和ΔU相差不大,因此忽略 了差别 )。
玻恩-哈勃循环(重要) Q Na ( s ) + 1/2 F2 ( g )
S
D/2
Na ( g )
F (g)
I
E
NaF ( s ) U0
化学键理论概述

波恩-哈伯循环 Na ( s ) + 1/2Cl2 ( g )
Δ f HӨm NaCl ( s )
ΔH1=ΔHvap ΔH2 =1/2 E Na ( g ) ΔH3=I1 Cl ( g ) ΔH4 =-Eea,1 ΔH5= - U
Na+( g ) + Cl-( g )
ΔfHӨm = ΔH1 + ΔH2 + ΔH3 +ΔH4 + ΔH5 = ΔHvap + 1/2E+ I1- Eea,1-U
V吸引 = -
q+ · q4 πε0 r
正、负离子之间的总势能与距离 r 关系的势能曲线。
Vp
NaCl 的势能曲线
0
Vp r0
r0
r
近距离相互排斥,远距离相互吸引, 在某一平衡距离时,吸引排斥处于动态平衡,体系势能最小,最稳定。 平衡距离 r0 —— 化学键
配位数 Na+ 6 Cl- 6 无方向性: 电荷球形对称分布 无饱和性: 空间条件允许的情况下,尽可能多的吸引相反的离子。 每个离子周围排列的异号离子的数目是一定的,实际数目与离子半 径及所带的电荷有关。
正离子和负离子之间通过静电引力结合在一起,形 成离子化合物。这种正、负离子间的静电吸引力就叫做 离子键。 当不同的原子通过离子键结合形成分子时,必然伴随 着体系能量的变化,而且新体系的能量大大低于旧体系。 根据库仑定律,两个距离为r,带有相反电荷 q+ 和 q- 的正、 负离子之间的势能 V吸引为:
缺电子体系
奇数电子体系 多电子体系
Be原子半径小,不能有大的形式电荷。
+1 -2 +1
F = Be = • F • •
•
第七章 化学键理论概述

3
BF CH BeCl 3 4 2 实例 HgCl2 BCl3 SiCl4 Be(ⅡA) B(ⅢA) C,Si 中心原子 Hg(ⅡB) (ⅣA)
PH3 N,P
(ⅤA)
NH 3
H2O H2S O,S
(ⅥA)
(5)sp3d2杂化
定义:同一原子内,由1个ns轨道与3个np轨道、 2个nd轨道间发生的杂化叫sp3d2杂化。杂化后形成 的6个新轨道叫sp3d2杂化轨道。 特点:每个sp3d2杂化轨道中含有1/6s成分和 3/6的p成分、2/6的d成分。
2.杂化轨道类型与分子的空间构型 ①sp杂化
由1个ns轨道和1个np轨道进行杂化,组成2个等同的sp杂化轨道。
每个sp杂化轨道中含1/2 s成分和1/2 p的成分。 两个sp杂化轨道之间夹角为180°,分子空间构型为直线型。
BeCl2分子形成过程
②sp2杂化
1个ns轨道和2个np轨道经杂化组成3个等同的sp2杂化轨道。
第七章
分子结构
离子键理论 化学键理论 共价键理论 金属键理论
§7 - 1 离子键理论
一、离子键的特点 1. 离子键的本质是库仑静电作用力 + f ∝ q q /r
q+、q-为离子所带电荷, R为离子间距离。
离子键强度是用晶格能来描述的。
2.离子键的特点:
既无方向性,也无饱和性。 离子化合物是由正负离子通过离子键相互交替连 结而成的晶体结构。
Na(s) + 1/2F2(g) S Na(g) I 1/2D F(g) A
ΔH
NaF(s)
U
Na+(g)
+ F-(g)
式中 S为 Na 的升华热 (108.8 kJ· mol - 1) , I 为 Na 的电离势( 495.8 kJ· mol - 1) , D 为 F 的 键 能 (141.8 kJ· mol - 1 ) , A 为 F 的 电 子 亲 合 势 (-328.0 2 kJ· mol-1),ΔH为NaF的生成焓(-573.65 kJ· mol-1),U为NaF的晶格能。
第七章化学键理论概述

化学键理论概述7-1 离子键理论1916 年德国科学家科塞尔(Kossel )提出离子键理论。
7-1-1 离子键的形成电子转移形成离子,相应的电子构型变为稀有气体原子的电子层构型,形成稳定的离子。
正、负离子在静电引力的作用下结合在一起,形成离子化合物。
正、负离子之间的静电引力就是离子键。
r q q V 04ε -+∙-=吸引离子间距与势能V 的变化曲线7―1―2 离子键的性质离子键的本质是静电作用力。
离子的电荷越大,离子间的距离越小,离子间的静电引力越强。
静电引力的实质,决定了一个离子与任何方向的电性不同的离子相吸引而成键,所以离子键无方向性;而且只要是正负离子之间,则彼此吸引,即离子键无饱和性。
但是每个离子周围排列的相反电荷离子的数目是一定的,这个数目是与正负离子半径的大小和所带电荷多少等有关。
离子键形成的重要条件就是元素之间的电负性差值较大。
一般来说,元素的电负性差越大,形成的离子键越强。
化合物中不存在百分之百的离子键一般用离子性百分数来表示键的离子性的相对大小。
一般认为,∆χ> 1.7,发生电子转移,主要形成离子键。
∆χ< 1.7,不发生电子转移,主要形成共价键。
7―1―3 离子键的强度键能 1 mol 气态分子,离解成气态原子时,所吸收的能量,为离子键的键能,用E i表示。
键能E i越大,表示离子键越强。
晶格能在标准状态下,将1mol 离子型晶体分解成 1 mol 气态正、负离子时需要的能量,用U表示。
晶格能U越大,表示晶体分解成离子时吸收的能量越多,说明离子键越强。
离子键的强度通常用晶格能的大小来衡量。
所以,离子化合物中离子键力是晶体中吸引力和排斥力综合平衡的结果。
离子型化合物在通常状态下是以阴、阳离子聚集在一起形成的巨分子的形式存在。
所以离子化合物的化学结合力不是简单的两个阴、阳离子之间的结合,而是整块晶体之内的整个结合力。
因此,用晶格能描述离子键的强度经常比离子键的键能来得更好。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
F
sp杂化轨道
激 发
杂 化
SP3d2杂化(以SF6的分子结构为例)
激发
杂化
重叠 SF6的分子形成过程
sp3d2杂化轨道是由一个s轨道、三个p轨道和两个d轨道组合而成,其特点是6 个sp3d杂化轨道指向正八面体的六个顶点,相邻的夹角为90º 。
F
SF6分子的空间结构
F
F S F
F
sp3d2杂化轨道示意图
NH
3
H2 O
杂化轨道总结
(1)轨道杂化是指同一个原子中相关轨道的混合由此产生的 杂化轨道也是原子轨道。
(2)参与杂化的轨道中电子所处的能级略有不同,而杂化后 的电子则处于相同能级。杂化后能级相当于杂化前有关 电子能级的中间值。 (3) 杂化只能发生在能级接近的轨道之间,如能层数相同的 s、p、d轨道之间,或(n-1)d与ns、np之间,能量也是相 近的。亚层符号按能层、能级升高的顺序排列,例如 d2sp3和sp3d2代表不同杂化轨道。
⑷ 周期表中相邻族左上与右下斜对角线上的正离 子半径近似相等; 如:r(Mg 2+ )=65pm ≈ r(Li + )= 60pm ⑸ 负离子半径一般较大,约130-250pm 正离子半径一般较小,约10-170pm.
四、离子晶体
1、离子晶体的特征和性质 类型:活泼金属的氧化物和盐类 特征: 晶格结点上的质点—正、负离子; 质点间作用力—离子键; 配位数 — 6、8、4等;
Na(s)+1/2Cl 2 (g) 298K,标准态 NaCl(s) △f Hm°
S↓ ↓ 1/2D
Na(g)
I↓
+
Cl(g)
↓E
-
-U ° △ f Hm =S+I+1/2D+( - E)-U U=109+496+121- 34பைடு நூலகம்+411 =788( KJ · mol
-1
Na (g)+ Cl (g)
)
玻恩朗德公式:
同类型晶体,离子电荷 越高,核间距越短,离 子键越牢固,晶体的熔、 沸点、硬度越高。
Z1 Z 2 NAe 2 1 U (1 ) r0 n 138490 Z1 Z 2 A 1 (1 )kJ / mol r0 n
其中r0为正负离子半径和,A为玛德隆常数, n为玻恩指数.
F
杂化轨道的主要类型
sp 直线型 键角180 CO2, C2H2
sp2 sp3
平面三角形 正四面体形
键角120 键角109 28’
键角90 90
BF3, NO3-,
C6H6 ,C2H4
CH4, H2O,
Ni(CN)42PCl5 SF6
NH3 dsp2 平面四方形 d2sp3(sp3d2) 正八面体 dsp3(sp3d) 三角双锥 120和90
键
键
三、共价键参数
键能:键能越大,键越牢固,分子越稳定 键长:键长越短,键越牢固,分子越稳定 键角:反映分了空间结构 键的极性:成键原子的电负性差越大,键的极 性越大 键级:键级越大,键越牢固,分子越稳定 (键级:分子中两原子共享的电子对数目)
四、杂化轨道理论
实验测得 CCl4、 CH4等的立体构型为正四面体
5.影响离子晶体性质的因素: 晶格能:
因素:离子电荷,离子半径,配位数,(极化作用)
性质:硬度,熔点,化合物的稳定性
离子晶体的空间构型:
因素:离子半径,离子的电子构型,组成元素的比例,
外界条件
性质:稳定性,溶解度等
第二节 共价键理论
一、共价键的本质和特点 共价键的本质是由于原子相互接近时轨道 重叠,原子间通过共用自旋相反的电子对使 能量降低而成键。 共价键的主要特点是具有饱和性和方向性。
9-17电子构型:ns2np6nd1-9 Cr3+,Mn2+ 等
在离子电荷和半径大致相同的条件下,不同构
型的正离子对同种负离子的结合力的大小是: 18或18+2电子构型的离子>9-17电子构型的离 子>8电子构型的离子 CuCl r+ /pm 溶解性 96 难 NaCl 95 易
原因:电子构型不同,CuCl的键能大一些,水 分子的作用力不能破坏这个离子键。
正负离子半径比与配位数的关系
a
b
c
半径比 r+/r-<0.414 配位数 4 :4 晶体构型 立方ZnS型
r+/r-=0.414 6 :6 NaCl型
r+/r->0.414 8 :8 CsCl型
4、晶格能(U)
定义:指相互远离的气态正离子和负离子结合成
离子晶体时所释放的能量。 另定义:标准态下,拆开1 mol离子晶体,使其变 为气态组分离子时所需能量。 例:NaCl(s)→Na+(g)+Cl-(g) U=786 kJ· mol-1 晶格能多以波恩-哈伯循环法通过热化学计算求得。
杂化:在形成分子时,由于原子的相互影响,若干 不同类型能量相近的原子轨道混合起来,重新组合 成同等数量的能量完全相同一组新的轨道,这种轨 道重新组合的过程叫做杂化。 杂化轨道:通过杂化所形成的新轨道就称为杂化轨道。
注意两点: (1)原子轨道的杂化只有在形成分子的过程中才会发生; (2)能量相近通常是指:ns与np、ns,np与nd或(n-1)d。
二、离子键的特点 1、离子键的本质是静电作用
一般说来,正负离子所带的电荷越高,半 径越小,形成的离子键越强。
2、离子键没有方向性(电荷球形对称分布) 3、离子键没有饱和性(空间许可) 4、键的离子性与元素电负性有关
三、离子的特征 1、离子的电荷
正离子的电荷数就是相应原子失去的电子数。
+1,+2,最高+3,+4。 负离子的电荷数就是相应原子获得的电子数。 一般-1,-2;-3、-4多为含氧酸根或配离子的电荷。 2、离子的电子层构型
共价键的方向性: 原子轨道的分布具 有方向性,成键原子 轨道只有沿着一定的 方向进行最大程度的 重叠,才能保证对称 性一致,形成稳定的 共价键。
_ +
+
_
+
+
_ + +
二、共价键的键型
键( 成键轨道)头碰头
原子核连线为对称轴
键,肩并肩 穿过原子核连线有一节面
共价键形成实例
HF的生成
N2的生成
(4) 杂化轨道的数目等于参与杂化的轨道的总数。 (5)杂化轨道成键时,要满足化学键间最小排斥原理,键角 越大,排斥力越小。杂化轨道类型不同,成键时键角不同, 分子的空间结构也不同。
等性杂化:参与杂化的原子轨道均是未成对电子的轨道。 不等性杂化:参与杂化的原子轨道不仅包含未成对电子的轨道, 也包含成对电子的轨道。如NH3分子的杂化轨道中,孤对电子 占有的杂化轨道而不参与成键。
N ( 1s22s22px12py12pz1 )
O ( 1s22s22px22py12pz1 )
均为sp3 轨道
SP3杂化
CH4分子的形成
杂化
2s
2p
激发
成键 + 4H
2s
2p
Sp3 杂化轨道
CH4分子
杂 化
成键
SP2杂化
激发 Sp2杂化
重叠
形成3个(sp2-s) σ键
BF3分子形成过程 一个s轨道和二个p轨道杂化,产生三个等同的sp2杂化轨道, sp2杂化轨道间夹角120º ,呈平面三角形。
F B F
BF3分子的结构示意图
化学键与分子结构
§1 离子键理论
一、离子键的形成 电负性相差较大(△x>1.7)的两个元素的原 子相遇时,就会发生电子的转移而形成正、负离 子。 eNa
ClCl
Na+ Cl-
Na+ ClNa+
-
Na+ClCl-
Na+ Cl
离子键:正、负离子间通过静电作用而形成的化 学键。由离子键形成的化合物为离子型化合物。
3、离子半径 ⑴ 各主族元素,自上而下,电荷数相同的离子半径 依次增大; Li+<Na+<K+<Rb+<Cs+ ⑵ 同一周期的主族元素,自左而右,正离子电荷增 大半径减小; r(Na+)>r(Mg2+) ⑶ 同一元素,高价离子的半径<低价离子的半径; r(Fe3+)(60pm)<r(Fe2+)(75pm)
杂化轨道的形成与分子的组成有关
C2H4(sp2杂化)
C2H2 (sp杂化)
乙烯
请分析下列分子中的中心原子杂化情况:
HgCl2 Hg原子序数为80: 6S 直线型分子 CO2 :
直线型分子
6P 2P 2P
杂化
SP杂化
杂化
SP杂化
2S 2S 2S 3d
BCl3 :
平面三角形型分子 正四面体分子 SiF62-:
晶体中不存在独立的简单分子。 2、一般性质: ⑴ 较高的熔沸点与静电力有关,库仑力越大,熔、沸点越 高;而硬度与电荷、离子半径相关。 ⑵ 受机械力作用,结点离子位移,由异性相吸变为同性相 斥 ⑶ 水溶性差别很大,水溶液及熔融态发生电离;
3、离子半径与配位数的关系
ac=4r- ab=bc=2r-+2r+ 令r- = 1, 则:(ab)2+(bc)2=(ac)2 2×(2r-+2r+)2=16 r+=0.414
负离子:简单负离子的最外电子层都是8电子构型。
* 正离子:
2电子构型: 1s2 Li+,Be2+
8电子构型: ns2np6
18电子构型: ns2np6nd10
Na+,Mg2+,Al3+等
