无机化学化学键理论概述2
无机化学7.3化学键理论
n
价轨道数
最大成键数
2
4(2s,2px,2py,2pz)
4
3 9 (3s,3px,3py,3pz,3dz2,3dx2-y2,3dxy,3dxz,3dyz) 6
(2) 方向性
除s 轨道(角度部分为球形)外,p 、 d、f 原子轨 道在空间只有沿着一定的方向与别的原子轨道重叠, 才会产生“最大重叠”;两轨道重叠面积↑,电子在两 核间出现的几率密度↑,共价键强度↑。
键级=
成键分子轨道电子数
反键分子轨道电子数
2
20 2
1
(相当于共价单键)
2键. 级H2=+(1 氢2 0分子0.离5单子电)子键(HV2B[(无1S此)1说] 法)
3.He2 He 2 [( 1S )2 (1*S )2 ]
键级= 2 2 0 (不成键) 2
不能稳定存在
4. He2+
He2
(
1S
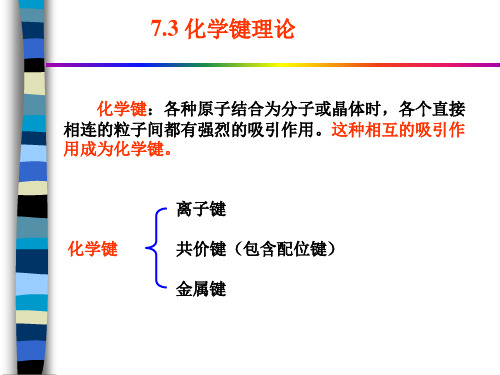
7.3 化学键理论
化学键:各种原子结合为分子或晶体时,各个直接 相连的粒子间都有强烈的吸引作用。这种相互的吸引作 用成为化学键。
化学键
离子键 共价键(包含配位键) 金属键
化学键理论
离子键理论: 共价健理论:
金属键理论:
Na+Cl-
, Ca2+O2-
H-H , H-Cl,
NN , H3C-CH3 , H2C=CH2 , HCCH Na, Mg, Al, K, Ca,
O2 , F2 , Ne2 :
E (2p) > E (2p)
第二周期元素分子轨道的形成
Li2 – N2
O2 – Ne2
第二周期同核双原子分子的分子轨道能级
Li2,Be2, B2, C2,N2 分子轨道能级顺序为:
无机化学基本原理

无机化学基本原理无机化学基本原理涉及无机化合物及其特性、反应性质和应用等方面的知识。
无机化学是研究无机物质的组成、结构、性质、制备和应用的科学。
无机化学的基本原理包括:1. 元素周期律:元素周期律是对元素周期系统的整体性规律进行总结和归纳的理论。
根据元素周期律,元素按照原子核电荷数的增加顺序排列,呈阶梯状,可以划分为不同的周期和族。
2. 化学键:化学键是原子之间形成的一种特殊的化学连接。
常见的化学键有离子键、共价键和金属键等。
离子键是由带正电荷的金属离子和带负电荷的非金属离子之间的电荷吸引力形成的。
共价键是由原子之间的共用电子形成的。
金属键是由金属原子之间的电子云形成的。
3. 化学反应:化学反应是发生在物质之间的转化过程。
常见的化学反应包括氧化还原反应、酸碱中和反应、沉淀反应等。
在化学反应中,物质发生新的化学键的组合、断裂和重新排列。
4. 晶体结构:晶体是由周期性排列的离子、分子或原子组成的有序固体。
晶体结构是晶体中原子、分子或离子的排列方式,包括离子晶体、共价晶体和金属晶体等。
晶体的结构决定了其特定的物理和化学性质。
5. 配位化合物:配位化合物是由中心金属离子和其周围配体形成的化合物。
配位化合物的性质和结构取决于中心金属离子和配体之间的配位键类型、配位数以及配位构型。
6. 化学电池:化学电池是利用化学反应产生的电能来进行能量转换和储存的装置。
化学电池包括原电池和电解池两种类型。
原电池通过化学反应直接转化化学能为电能。
电解池则利用外加电压来促使非自发性化学反应发生。
无机化学的基本原理对于理解和应用无机化学具有重要意义,并为无机化学的研究和发展提供了理论基础。
无机化学 第3章 分子结构与化学键理论

O3 ; PCl3 ; CO2 ; OF2 。
O3分子的结构
O3 中心原子 O 价层电子对数: (6+0×2)/2=3
价电子对构型平面三角形。分子构型为V型
O 127.8pm
O
O
O
O
O
116.80
价电子对构型和分子构型都为线形。
O
C
O
CO2以sp杂化成键:一个
键,两个
4 3
键。
OF2的分子结构
OF2 中心原子O的价层电子对数为: (6+1×2)/2=4
价电子对构型为四面体,分子构型为V型
O
F
F
OF2以sp3不等性杂化成键。
3.4 分子轨道理论
分子轨道理论的基本要点
原子轨道的线性组合—s-s重叠
原子轨道的线性组合—s-p重叠
原子轨道的线性组合—p-p重叠(1)
原子轨道的线性组合—p-p重叠(2)
能量近似原则
最大重叠原则
对称性原则
同核双原子分子的分子轨道能级图(1)
同核双原子分子的分子轨道能级图(2)
同核双原子分子的分子轨道能级图
N2分子的分子轨道能级图
O2分子的分子轨道能级图
CO的分子轨道能级图
3.5 分子间力和氢键
分子间作用力——范德华力
取向力
诱导力
色散力
化学视野——光电子能谱(PES)
PES——Photoelectron Spectroscope
光电子能谱技术是光电效应的现代应用。
可见光源照射物质可将价电子射出。短波光 源(紫外或X射线)产生的高能光子能将分 子或原子内层具有各种结合能的电子射出, 通过这些结合能的大小可提供分子中能级的 细节。
《无机化学》化学键理论与分子结构

《无机化学》化学键理论与分子结构无机化学是研究无机化合物的组成、结构、性质和反应的学科。
化学键理论与分子结构是无机化学的重要基础和核心内容,它们对于理解无机化合物的物理和化学性质具有重要意义。
化学键是指原子之间通过共享电子或电子转移而形成的力。
常见的化学键包括离子键、共价键和金属键。
离子键是电荷相反的离子之间的相互作用力。
它的形成是离子化反应过程中,金属元素失去电子变成阳离子(阳离子)和非金属元素获得电子成为阴离子(阴离子)所形成的。
离子键的特点是电负性差异较大,具有很强的极性,在固态下成为离子晶体,具有高熔点和良好的导电性。
共价键是非金属原子通过共用电子对形成的化学键。
共价键的形成依赖于原子之间电子互相吸引的作用力。
根据电子的共享程度,共价键又可分为极性共价键和非极性共价键。
极性共价键的特点是原子的电负性差异较小,共享电子不平均分布,云地带呈现部分离子性质,它的形成使得分子有极性;而非极性共价键的特点是原子的电负性差异极小,共享电子均匀分布,云地带不存在电荷分离,分子呈现非极性。
金属键是金属原子通过电子云中的自由电子形成的化学键。
金属原子的外层电子非常松散,可以自由移动,形成电子海。
金属键的特点是具有很好的导电性、热导性和延展性,而且金属键的强度也很高。
分子结构是指分子内原子的相对位置和连接关系。
分子结构的确定有助于揭示物质的物理性质和化学性质。
在无机化学中,分子结构可通过实验和理论计算等手段进行研究。
实验方法主要包括X射线衍射、中子衍射、质谱和核磁共振等。
其中,X射线衍射是最常用的手段,通过测量晶体中X射线的衍射图样,可以得到晶体结构的信息。
中子衍射则是通过测量中子与晶体相互作用过程中所发生的衍射现象,得到晶体结构的信息。
质谱和核磁共振则是通过测量分子中原子的质量和能级差等可以得到分子结构的信息。
理论计算的方法包括量子化学计算和分子力学计算。
量子化学计算是通过量子力学原理,计算分子的能量、电子结构和反应性等。
无机化学知识点整理

无机化学知识点整理无机化学是化学的一个分支,与研究机体化学性质的有机化学不同,无机化学主要是研究无机物质,如金属、非金属化合物、盐类和氧化物等。
学习无机化学需要掌握一些重要的知识点,本文将对无机化学的重要知识点进行整理。
一、化学键化学键是分子或离子的原子之间的连接,它决定了物质的化学性质。
根据价电子的共享情况可以将化学键分为共价键和离子键两种。
1. 共价键共价键指两个原子之间通过共享电子建立的化学键。
共价键的特征是结合原子之间的电荷分布呈现相互穿插的状态。
共价键的结构形式有单键、双键和三键。
单键是最常见的共价键类型,例如氢气,每个氢原子与另一个氢原子共享一个电子。
双键和三键包括多个共享的电子对,例如氮分子中有三个共价键,其中有一个双键和两个单键。
2. 离子键离子键指两个离子之间的化学键,其中一个离子通常是金属离子,另一个通常是非金属离子。
离子键的形成通常是由于离子之间电荷分布的相互吸引而建立的。
以氯化钠为例,钠离子和氯离子电荷相互吸引形成氯化钠分子,其中钠离子的电子数比氯离子少1个,在化学式中以+和-来表示。
二、化合物命名在学习无机化学时,孩子们还需要学习如何为每种化合物命名。
通常,化合物由正离子和负离子组成。
正离子通常是金属离子,负离子则是非金属离子。
命名化合物的过程取决于化合物的类型:1. 离子化合物命名离子化合物是由正离子和负离子组成的,通常是由金属和非金属元素组成的,如氯化钠。
虽然正离子的名称不变,但负离子的名称通常要以“-ide”作为结尾。
例如,氯离子的化学式为Cl--,则把这个离子与钠的离子Na+相结合,形成NaCl(氯化钠)。
2. 共价键化合物命名共价键化合物是由非金属元素共享电子而形成的,如二氧化碳(CO2)。
当命名这种化合物时,使用墨菲亚法则是一种有用的技术。
这种法则规定,一个离子的名字(例如,氧)被保留,然后在前面加上一个前缀来指示它的数量(例如二氧化碳)。
三、反应类型在无机化学中,反应类型通常涉及化学键的断裂和可能的新键的形成。
第7章 化学键理论概述

3)形成离子键, 释放能量大
在形成离子键时, 以放热的形式, 释放较 大的能量.
7-1-2
离子键的特征
1. 作用力的实质是静电引力
2. 离子键无方向性, 无饱和性 因为是静电吸引, 所以无方向性; 且 只要是正负离子之间, 则彼此吸引, 即无 饱和性.
7-1-3 离子键的强度
1. 键能和晶格能 :以 NaCl 为例: 键能:1mol 气态 NaCl 分子, 离解成气体原子时, 所吸 收的能量. 用Ei 表示: 晶格能:气态的正负离子, 结合成 1mol NaCl 晶体时, 放出的能量. 用 U 表示: 晶格能 U 越大, 则形成离子键时放出的能量越多, 离子键越强.键能和晶格能, 均能表示离子键的强度, 而且大小关系一致. 通常, 晶格能比较常用. 如何求得 晶格能?
3. 立方晶系 AB型离子晶体的空间结构 晶胞的平行六面体是正六面体时, 我们称它属于 立方晶系, 用来表示平行六面体的三度的三个轴, 称 为晶轴, 三个晶轴的长度分别用a, b, c表示, 三个晶轴 之间的夹角分别用α,β,γ表示.
我们讨论的AB型晶体指正负离子数目相同, 包括 NaCl, CsCl, ZnS.
1926年, 哥德希密特(Goldschmidt)用光学方法测定, 得到 了F-和O2-的半径, 分别为133pm 和132pm,结合X射线衍射数据, 得到一系列离子半径: 这种半径为哥德希密特半径.
1927年, Pauling 用最外层电子到核的距 离, 定义为离子半径, 并利用有效核电荷 等关系, 求出一套离子半径数据, 称为 Pauling 半径. 教材上两套数据均列出. 一般在比较 半径大小和讨论规律变化时, 多采用 Pauling 半径.
2)易形成稳定离子 Na+ 2s22p6, Cl- 3s23p6 , 达到稀有气体稳定 结构. Ag+ 4d10 轨道全充满的稳定结构. 而: C和Si 原子的电子结构为s2p2, 要失去全部 的4e, 才能形成稳定离子, 比较困难. 所以一般 不形成离子键.如 CCl4, SiF4 等, 均为共价化合 物。
《无机化学》第7章化学键理论与分子结构
《无机化学》第7章化学键理论与分子结构无机化学是研究无机物质的性质、结构和合成方法的科学。
无机化学中的化学键理论与分子结构是无机化学的重要内容之一化学键是由原子之间电子的相互作用而形成的,在无机化学中,电子主要通过离子键、共价键和金属键来相互作用。
化学键的类型取决于参与形成键的原子的电子数目和结合能力。
离子键是由阳离子和阴离子之间的静电相互作用形成的。
在化学键中,金属原子失去电子成为阳离子,非金属原子获得电子成为阴离子,从而形成的化合物具有离子晶体结构。
离子键通常具有高熔点和可溶性的特点。
共价键是由非金属原子之间的共享电子形成的。
共价键的形成过程涉及到原子间的电子云的重叠,从而共享外层电子。
共价键可以根据电子云的叠加程度分为σ键和π键。
σ键是主要的共价键,π键则是由额外的p轨道重叠形成。
在分子中,共价键的形成能够使得原子达到稳定的价电子层结构。
金属键是由金属原子之间的电子云形成的。
金属原子的价电子在整个金属晶体中自由移动,形成了金属键。
金属键的形成使得金属具有良好的导电性和热导性。
分子结构是由化学键连接在一起的原子的组合。
分子结构决定了分子的性质和反应行为。
分子结构的研究可以通过实验方法,如X射线晶体结构分析、核磁共振谱等技术,也可以通过计算化学方法进行预测和模拟。
简单分子的结构可以由初始条件和分子对称性来确定,而复杂分子的结构则需要借助实验和计算方法的综合分析。
通过对化学键理论和分子结构的研究,我们可以了解无机化合物的形成和性质,为无机化学的应用和发展提供理论基础。
此外,还可以通过对分子结构的研究来设计和合成具有特定性质和功能的无机化合物。
综上所述,化学键理论与分子结构是无机化学中的重要内容,通过研究化学键的类型和分子结构,可以揭示无机物质的性质和反应行为,并为无机化学的应用和研究提供基础。
无机化学的发展离不开对化学键理论和分子结构的深入研究。
《无机化学》第7章化学键理论与分子结构
根据共用电子对来源不同, 可分为: 一般共价键 共价键 特殊共价键(配位键)
◎配位共价键(共价键的一个特例) ◆定义:在成键的两原子中,由一方单独 提供孤对电子进入另一方的价层空轨道共 用所形成的共价键。 ◆形成条件 (1)一个原子的价电子层有孤对电子。 (2)另一个原子的价电子层有空轨道。
现代价键理论 NH3 + H+ NH4+
2 Be 的外层电子排布: 2s 4
已知实验事实: 有2个等同的Be—Cl键
键角180。
直线形分子
BeCl2分子空间构型—等性sp杂化 2p 2p
激发
2s (基态)
2s (激发态)
杂 化
2p
σ sp—p
与2个Cl的3p (化合态)轨道重叠成键
2pLeabharlann sp (杂化态)2个sp杂化轨道
BeCl2的空间构型—sp杂化
■当相互靠近的两个氢原子中的单电子自
旋方向相同时
不能成键 ψ2
排斥态 0
0
电子云稀疏区
r(pm)
排斥态:
图9-2 两个氢原子接近时的能量变化曲线(排斥态)
【例】两个H原子所处状态
n=1, l=0, m=0, ms = +1/2 可配对成键 n=1, l=0, m=0, ms = -1/2
若两个H原子的ms同为+1/2 (或-1/2), 则不能配对成键。
原子轨道杂化后,其角度分布发生 了变化。 杂化轨道的角度波函数在某个方向 的值比杂化前大得多(从角度分布图形 可看出),更有利于原子轨道间最大程 度的重叠,提高了成键能力。其大小顺 序为:
s<p<sp<sp2<sp3
杂化轨道理论
y
+ x y
无机化学-共价键与分子结构
(二)共价键理论:共价键的类型
◆ π键:成键轨道以“肩并肩”的方式发生轨道的重叠。
重叠部分对通过键轴的平面具有镜面反对称性。
(二)共价键理论:共价键的类型
两个原子之间必须有一个键,但可以形成多个π键,π键稳 定性相对于键较弱。
N原子: 2s2 2p3 2px1 2py1 2pz1
(二)共价键理论:杂化轨道理论(Pauling)
1、理论基本要点
成键时同一原子中能级相近的不同类型的原子轨道混合后,重
新形成一组同等数量的能量完全相同的新轨道 ——杂化轨道
● 杂化前后轨道数目不变 ● 杂化后轨道伸展方向,形状和能量发生改变
● 轨道成分变了
● 轨道的能量变了
结果是更有利于成键!
● 轨道的形状变了
(二)共价键理论:杂化轨道理论
在原子形成分子的过程中,经过激发、杂化、轨道重迭等过程
CH4 C(2s22p2)
激发
2s, px, py, pz
激发所需能量可由形成共价键数目 的增加而释放出更多的能量来补偿
杂化
sp3杂化轨 道
4个能量完全相 同的杂化轨道
(二)共价键理论:杂化轨道理论
杂化类型(s-p杂化):由s轨道和p轨道参与杂化, 根据参与杂化的p轨道数目又可分为sp、sp2、sp3
➢sp杂化(直线型)
2s
H: s
2p 2s
excited
O: px
2p
2p
sp
hybridization two sp hybrid orbital
+
+
Be-s
-+
- + +- -++ -
无机化学-配位化学基础-配合物的化学键理论
解得: Et2 = + 1.78 Dq Ee = - 2.67 Dq
dxy ,dxz 和 dyz 轨道(即t 轨道) d x2-y2和 d z2轨道(即e 轨道)
( 3 ) 正方形场
sq = 17.42 Dq
四面体、八面体或正方形场中,中心金属离子5个d 轨道的能级分裂
t = 4.45 Dq
sq = 17.42 Dq
中心离子
电荷↑,半径↑, △ ↑
同一几何构型配合物的 △ : 八面体场△o
第二过渡系列中心离子 > 第一过渡系列(40 - 50%)
第三过渡系列中心离子 > 第二过渡系列(20 - 25%)
正八面体配合物ML6的△o (cm-1)
1 cm-1 = 1.23977 10-4 eV = 1.19 10-2 kJ.mol-1
电荷迁移跃迁: KMnO4 , K2CrO4 , HgO 等
(中心离子为d 0 或d 10的化合物)
互相极化 e(荷移跃迁) Mn+ ——— O2- ———→ Mn+
h
→ 显示互补色
E
hν e
O2-
1951年,几位化学家用CFT解释了 [Ti(H2O)6]3+的吸收光谱,应用于配合物,迅 速发展。
9.3.2.1 要点
1. 静电模型:配合物中Mn+ - L纯粹是静电作用,均
为点电荷,L是阴离子成偶极分子.
2. d 轨道能量分裂:
中心离子的d 轨道的能量在非球形对称的配位体形成
的晶体场中都升高,且发生分裂,分离能为 △ :
d4 – d7 构型中心离子在 八面体强场和弱场中d电子的排布
弱 场 ( △o < P )
d4
