第4讲 配合物的化学键理论
配合物的化学键理论

配合物的化学键理论配合物的化学键理论摘要:化学键理论在配位化学中有着重要的运用,它现在主要有三大流派。
本文就回顾化学键的发展历程,并对三大化学键理论做出仔细的阐述。
关键字:化学键价键理论分子轨道理论晶体场理论配位场理论化学键的发展历程最早化学家假设原子和原子之间是用一个神秘的钩钩住的,这种设想至今仍留下痕迹,化学键的键字就有钩的意思。
1916年,德国科学家柯塞尔考察大量的事实后得出结论:任何元素的原子都要使最外层满足8 电子稳定结构。
柯塞尔的理论能解释许多离子化合物的形成,但无法解释非离子型化合物。
1923 年,美国化学家路易斯发展了柯塞尔的理论,提出共价键的电子理论:两种元素的原子可以相互共用一对或多对电子,以便达到稀有气体原子的电子结构,这样形成的化学健叫做共价健。
柯塞尔和路易斯的理论常叫原子价电子理论。
它只能定性地描述分子的形成,化学家更需要对化学键做定量阐述。
1927 年,海特勒和伦敦用量子力学处理氢分子,用近似方法计算出氢分子体系的波函数和能量获得成功,这是用量子力学解决共价键问题的首例。
1930 年,鲍林更提出原子成键的杂化理论(杂化轨道理论),洪德把单键、多键分成δ和∏键两类。
δ健是指在沿着连接两个原子核的直线(对称轴)上电子云有最大重叠的共价键,这种键比较稳定。
∏键是指沿电子云垂直于这条直线方向上结合而成的键,这种键比较活泼。
这就使价键理论进一步系统化,使经典的化合价和化学键有机地结合在一起了。
由于上述的价键理论对共扼分子、氧气分子的顺磁性等事实不能有效解释,因此本世纪30 年代后又产生一种新的理论——分子轨道理论。
分子轨道理论在1932 年首先由美国化学家马利肯提出。
他用的方法跟经典化学相距很远,一时不被化学界接受,后经密立根、洪德、休克尔、伦纳德等人努力,使分子轨道理论得到充实和完善。
它把分子看作一个整体,原子化合成分子时,由原子轨道组合成分子轨道,原子的电子属于分子整体。
分子轨道就是电子云占据间,它们可相互重叠成键。
13-2配位化合物

(二)配合物的形成和空间构型
1、 sp杂化(配位数为2,直线型)
[Ag(NH3)2]+:Ag+的外围电子构型 4d105s05p0
2
中心离子Ag+的结构
4d
5s
5p
[Ag(NH3)2]+的结构
4d
sp杂化
5p
结果: [Ag(NH3)2]+形成之前和之后, 中心原子的d电子排
布没有变化 。配合物是直线型,μ = 0
H2O以前------弱场 H2O ~ NH3之间------中间场 NH3以后------强场
37
(三) d 轨道能级分裂后,d 电子在轨道上排布 遵循的原则 (重点掌握)
概念:电子成对能( p ) 分裂能()
1、能量最低原理 2、 p > ,弱场 3、 p < ,强场
电子尽可能以自旋相同方式分占不同的轨道 弱场—高自旋排布方式 如:[FeF6]3-
CN
中心原子的d电子
CN
CN CN
Question
Solution
1s
试画出[BeF4]2–或[Be(H2O) 4]2+ 的结构。
2s 2s
2p 2p
Be 2
[BeX4 ]
2
1s
F(H 2 O)
F-
F-
F-
( ( (H 2 O) H 2 O) H 2 O)
sp3杂化
4, sp3d2杂化(配位数为6, 八面体构型) [FeF6]3–
d
z
2
能 量
= 4.45 Dq d E = -2.67 Dq
d xy
s = 17.42Dq
四面体场
八面体场
配合物的化学键理论

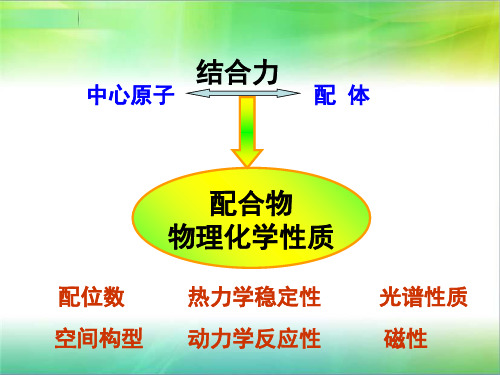
• 配合物的化学键理论是研究中心原于与配体 之间结合力本质的学说,它应能阐明配合物 的配位数、空间构型、热力学稳定性,动力 学反应性、光谱及磁性等一系列物理化学性 质与这种结合力之间的内在联系。目前这方 面的理论主要有:价键理论;晶体场理论 (以及改进后的配体场理论)和分子轨道理论。 下面分别予以介绍。 ·
晶体场理论(CFT)
价键理论(VBT)
• 一、Pauling价键理论的基本要点 · 配合物中心原于和配体之间的化学键有电价配键和 共价配键两种相应的配合物叫电价配合物和共价配 合物. 电价配合物中,中心离子和配体之间靠离子一离子 或离于一偶极子静电相互作用而键合。这时,中心 离子的电子层结构并不因电价配键的形成而发生变 化,d电子的分布仍然服从Hund规则,即尽可能使 自旋平行的电子数目最多.因此,电价配合物是高 自旋配合物。 共价配合物中,共价配键(—配键)由中心原子一 个适当的空价轨道和配体的一个充填轨道重叠而成。
配合物的化学键理论

杂化
轨道 sp3d2 d2sp3
sp3
dsp2
配键 类型 外轨型 内轨型
外轨型
内轨型
Kf 1014
稳定性
<
1042
107. 96
1031. 3
<
磁性
Ni2+的d电子构型 杂化轨道 配键类型
未成对电子数 磁性
[Ni(NH3)4]2+ [Ni(CN)4]2 d8
sp3 外轨型
dsp2 内轨型
2 顺磁性
弱场配体
强场配体
——以上称为光谱化学序列
4. 电子成对能和配合物高、低自旋
电子在分裂后轨道上的分布遵循: 能量最低原理和洪特规则
如 Cr3+ d3
eg
E t2g
八面体场
d4d7构型的离子, d电子分布有高、低自旋两种方式。
如 Cr2+ d4
[Cr(H2O)6]2+
eg
△o t2g
[Cr(CN)6]4-
中心离子和配体之间以静电引力相互作用而形 成化学键。
中心离子的5个能量相同的d轨道受配体负电场 的排斥作用,发生能级分裂(有的轨道能量升 高,有的能量降低)。
2. 正八面体场中d轨道的能级分裂
无外电场作用下的d轨道 Edxy= Edxz= Edyz= Edx2-y2= Edz2
在带负电荷均匀球形场的作用下,d轨道能量 均升高相同值,能级不发生分裂。
请问: [Zn(NH3)4]2+、 [Ag(NH3)2]+呈现什么颜色?
中心离子d 轨道全空(d0)或全满(d10), 不能发生 d-d跃迁,其水合离子为无色。
解释配合物的稳定性
Eeg=+0.
配合物的价键理论

sp sp2 sp3 d2sp2 d2sp3
直线型 三角形 正四面体 四方锥
正八面体 [Fe(CN)6]4-
一定程度上解释了配合物的磁学性 质
顺磁性的[Ni(H2O)6]2+:
•• •• •• •• •• ••Fra bibliotek3d4s
4p
4d
sp3d2杂化,外轨型
3、 价键理论的缺点
i. 不能预测配合物的高、低自旋状态
称为光谱化学序列 说明: (1)即配位场强的顺序,几乎和中心离子无关。 说明: )即配位场强的顺序,几乎和中心离子无关。 (2)强场配位体:∆o大 )强场配位体: 者 弱场配位体: 弱场配位体:∆o小者
值随中心离子而改变。 ②当配位体固定时, △o值随中心离子而改变。 当配位体固定时, A、中央离子电荷愈高,△o值愈大。 、中央离子电荷愈高, 值愈大。 例如
个配体需要6个杂化轨道 解:6个配体需要 个杂化轨道 d2sp3或 sp3d2 个配体需要 或
Mn2+ 3d5:
µ实测表明有1个单电子:
有2个内层空d轨道,采取d2sp3杂化; 八面体,内轨型,较稳定
2、价键理论的优点 很好地解释了配合物的空间构型和配位数
配位数 2 3 4 5 6 杂化轨道 空间构型 举例 [Ag(CN)2][CuCl3]2[MnCl4]2NiBr3(PR3)
⑴定义 d电子从未分裂的d轨道进入分裂的d轨道所产生的总能量下降 值,称为晶体场稳定化能,并用CFSE表示。 dz2, d(x2-y2) eg 10Dq
6Dq
Es
自由离子d轨道 球形场
4Dq
dxz,dxy,dyz
t2g
d轨道在Oh场中轨道能级的分裂图
量子力学指出:
《配合物的价键理论》课件

能量最低原则
总结词
能量最低原则是指在形成配合物时,系 统会自发地向着能量最低的状态演化。
VS
详细描述
能量最低原则是化学中的基本原理之一, 它指出在自然演化过程中,系统会自发地 向着能量最低的状态演化。在配合物的形 成过程中,这个原则同样适用。配合物通 常会形成能量最低的稳定结构,这是因为 能量较低的稳定状态可以使整个系统的能 量降低,使其更加稳定。
美国化学家鲍林提出现代价键理论。
1950年代
量子化学计算方法的出现,为价键理论提供 了更精确的理论框架。
价键理论的重要性
解释配合物的结构和性质
价键理论能够解释配合物的空间构型、稳定 性、磁性等性质,帮助人们更好地理解配合 物的结构和性质之间的关系。
指导新材料的合成与应用
通过价键理论,可以预测和设计具有特定性质和功 能的配合物新材料,为实际应用提供指导。
《配合物的价键理论 》ppt课件
目 录
• 配合物的价键理论简介 • 配合物的价键理论基本原理 • 配合物的价键理论的应用 • 配合物的价键理论的挑战与展望 • 配合物的价键理论案例分析
01
配合物的价键理论简介
定义与概念
配合物的价键理论
价键理论是研究配合物结构的理论之一,主要关注配 体与中心原子之间的相互作用和电子配置。
THANKS
感谢观看
泡利不相容原理
总结词
泡利不相容原理是指在同一个原子或分子中,不可能 存在两个或以上具有相同量子状态的电子。
详细描述
泡利不相容原理是量子力学中的基本原理之一,它指出 在同一个原子或分子中,不可能存在两个或以上具有相 同量子状态的电子。这个原理的原因是基于电子的自旋 和波函数的性质。由于电子是费米子,它们的自旋状态 必须是正或负,因此在一个有限的空间范围内,不可能 存在两个完全相同的电子状态。这个原理在配合物的价 键理论中也非常重要,因为它是保证配合物中电子配置 稳定的一个重要因素。
配合物的化学键理论ppt课件
[Co(NH3)6]Cl2在水溶液中离解
[Co(NH3)6]2++6H2O [Co(H2O)6]2++6NH3
[Co(NH3)6]Cl2容易被空气氧化; 受热易分解:
150C
[Co(NH3)6]Cl2
• 负电荷集中在球的内接正八面体的六个顶点 ,每个顶点的电量为q,球壳上的总电量仍 为6q,不会改变对d电子的总排斥力和d轨道 的总能量。
但单电子处在不同d轨道上 时所受到的排斥作用不再 完全相同。
八面体晶体场下d轨道的分裂
eg轨道
t2g轨道
重心守恒原理——原来简并的轨道在外电 场作用下如果发生分裂,则分裂后所有轨道能 量改变值的代数和为零。
Ni—CONi+CO
金属原子的d轨道与CO的碳原子的p轨道发生
重叠,金属的d电子部分移向碳原子,即中心 原子向配体反馈电子,形成了反馈键。
CO同金属生成羰基配合物的原因
• 有部分双键存在,过渡金属离子的外层或次 外层有d电子,CO的碳原子有空的p轨道,碳 的p轨道可与金属的d轨道重叠,接受金属的d 电子而形成d—p反馈键。
四面体场和八面体场中中心原子d轨道能级分裂图
3、平面正方形场
• 是八面体配合物的特殊情况,即八面体z轴方向 上处于相反位置的两个配体移到无限远处时就成 为平面正方形。
中心原子dx2-y2轨道极大值处于与配体迎头相撞的
位置,受到配体排斥力最大,能级升高最多;
dxy的电子云夹在两个配体之间所受到的排斥力要
二、晶体场稳定化能 (CFSE)
1.晶体场稳定化能(CFSE)的定义
配合物化学键理论

强场:o > P 弱场:o < P
d5 型
强场o > P
弱场o < P
(4) 影响CFSE的因素 ① d电子数目; ② 配位体的强弱; ③ 晶体场的类型
表1 过渡金属络离子的稳定化能(CFSE)
弱场CFSE/Dq
dn d0 离子 Ca2+,Sc3+ 正方型 0 正八面体 0 正四面 体 0 正方型 0
中心离子用外层(n-1)d,ns,np杂化轨道与电负性 较小的配位原子,如CN-、NO2-等形成内轨型配合 物。例如[Fe(CN)6]3-配离子,Fe采用d2sp3内轨型 杂化轨道,配合物的键能大,稳定,在水中不易 离解。
(3)内、外轨型配合物的测定---磁矩
由磁矩可判断内轨或外轨型配合物
s n—分子中未成对电子数
z
y
x
x
dz2
y z
dx2-y2
z
x
x
y
dxy
dxz
dyz
1.分裂能 (1)分裂能与配合物几何构型的关系
八面体型的配合物
在八面体型的配合物中,6个配位体分别占据八 面体的6个顶点,由此产生的静电场叫做八面体场。
(1)八面体场
八面体场中d轨道能级分裂
dz2 dx2-y2 eg 3 5 Δo =6Dq Δ o =10Dq 2 5 Δ o = 4Dq t2g dxy dxz dyz
[CrCl6]313600
[MoCl6]319200
分裂能与配位体的关系:光谱化学序列
[CoF6]3- [Co(H2O)6]3+ [Co(NH3)6]3+ o/cm-1 13000 18600 22900 [Co(CN)6]334000
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中心金属轨道 (n-1)d, ns, np
cMM cL L
配位体群轨道: 根据配合物构型,由配体 的轨道组合成对称性匹配的群轨道 这个理论虽然可以得到较满意的结果,但处理过程过 于冗长、复杂,且要用到较多的数学知识。所以,不 易于推广应用。
化的轨道: ns np
杂化特点: 全部用外层轨道
成键类型: 外轨配键
成单电子状态: 高自旋
杂化类型:
sp3
空间构型: 正四面体
②[Ni(CN)4]2(4-1)d 4s 4p (n-1)d ns np 使用内层d轨道
内轨配键 低自旋 dsp2
平面正方形
洛阳师范学院
➢ 6配位的配合物 例:FeF63-: Fe3+:3d54s0
洛阳师范学院
第4讲 配合物的化学键理论
3-1配合物的化学键理论简介 ➢ 配合物的化学键理论,主要研究中心原子和配体之 间结合力的本性;
➢ 并用来说明配合物的物理和化学性质:如配位数、 几何构型、磁学性质、光学性质、热力学稳定性、动 力学反应性等。
➢ 静电理论
价键理论
晶体场理论
分子轨道理论
配位场理论
洛阳师范学院
② 成键特征:(n-1)d 轨道参与杂化,形成内轨配键, 配合物属内轨型,低自旋态。
③ 规律:中心离子 sp3d2 与d2sp3杂化,配离子的空 间构型均为正八面体形。
洛阳师范学院
(二)判断配合物的成键类型 1、中心原子的结构不发生变化,仅使用其外层
的空轨道与配体结合,形成的配合物称为外轨型配 合物(高自旋配合物)。
洛阳师范学院
➢ 配体场理论
➢ 配位场理论是晶体场理论的发展,分别取其晶体 场理论和分子轨道理论的优点结合而成。对中心离 子与配体静电作用部分用晶体场理论来处理,而共 价作用部分用分子轨道理论来处理。 ➢遵循成键三原则:能量近似、最大重叠和对称性匹 配原则。 ➢ 在理论上比晶体场理论等方法更为严谨,所得的 结果常用来补充晶体场理论的不足。
sp杂化 5p
H3N NH3
结果: [Ag(NH3)2]+形成前后, 中心原子的d电子排 布没有变化 ,络合物是直线型(μ = 0)。
洛阳师范学院
➢ 4配位的配合物 [Ni(NH3)4]2+
Ni2+(3d8)的电子构型: 3d
4s
4p
[Ni(NH3)4]2+的结构:
3d
sp3杂化
NH3 NH3 NH3
空轨道(ns, np, nd)进行杂化,并与配体结合而 形成的配合物。 ➢ 特点: (a) 中心离子仅采用外层空轨道(ns, np, nd)进行 杂化成键; (b) 杂化类型为:sp3和sp3d2杂化; (c) 配合物有较多的未成对电子。
2、中心原子的价电子轨道发生重排,空出的内 层轨道参与和配体的结合,形成的配合物称为内轨 型配合物(低自旋配合物)。 ➢ 外轨型配合物键长更长,键能更小,相对不稳定; ➢ 内轨型配合物键长更短,键能更大,相对稳定。
洛阳师范学院
外轨型和内轨型总结 ① 外轨型配合物: ➢ 定义:指形成配合物时,中心离子全部采用外层
➢能解释配合物的配位数、几何构型、磁性等性质; ➢而不能说明与激发态有关的性质(如配合物的各种 颜色和光谱); ➢对光谱化学序列也无法给出合理的解释。
洛阳师范学院
三、晶体场理论 ➢ 在Van Vleck(1923) 和H.Bethe(1929)等人的工作基础 上发展起来。 ➢ 改进的静电理论:考虑了中心原子的电子结构,但 仍将配体看作是点电荷或偶极子;
洛阳师范学院
二、价键理论的应用
(一)判断配合物的空间构型 (二)判断配合物的成键类型 (三)判断配合物的磁性 (四)价键理论的特殊应用
洛阳师范学院
(一) 判断配合物的空间构型 杂化类型决定配离子的空间构型;杂化轨道数
等于中心原子的配位数。
价键理论顺利地解释了配合物的分子构型:
配位数 杂化轨道
分子构型
2 sp 直线
3
4
4
sp2
sp3
dsp2
三角形 正四面体 正方形
配位数 5 杂化轨道 sp3d d2sp2, 分子构型 三角双锥
5
d4s 四方锥
6
sp3d2, d2sp3 正八面体
洛阳师范学院
➢ 2配位的配合物
[Ag(NH3)2]+
Ag+(d10)的电子结构:
4d
5s
5p
[Ag(NH3)2]+的结构: 4d
➢ 晶体场理论没有考虑中心原子和配体的轨道的重叠: ① 因此,用它来说明中心原子和配体的轨道重叠得很少
的配合物是比较成功的; ② 配位场的光谱、磁性、稳定性、几何构型等性质; ③ 晶体场理论不能用于特殊低价和特殊高价的配合物; ④ 也不能用于羰基配合物、夹心配合物及烯烃配合物。
洛阳师范学院
四、分子轨道理论
3d
4s 4p
4d
FeF63-
Fe3+取sp3d2杂化,为正八面体的构型。 例:Fe(CN)63- :
3d 4s 4p 4d Fe (CN) 63-:
Fe3+d2sp3杂化,为正八面体的构型。
洛阳师范学院
6配位成键特点
① 成键状态特征:M全部使用外层轨道ns、np、nd 杂化,形成外轨道配键,配合物属外轨型,高自 旋态。
NH3
[Ni(NH3)4]2+ 为四面体构型
洛阳师范学院
➢[Ni(CN)4]2–的结构 Ni2+(3d8)的电子构型: 3d
[Ni(CN)4]2+的结构:
3d
4s
4p
dsp2杂化
CN CN CN CN
[Ni(CN)4]2- 为平面正方形构型
ห้องสมุดไป่ตู้
洛阳师范学院
4配位成键结果比较
Ni用以杂
①[Ni(NH3)4]2+ 4s 4p
洛阳师范学院
3-2 价键理论(VB理论) 一、理论要点:
1. 中心原子能量相近的空价轨道发生杂化,接受 配体的孤电子对以形成配合物; 2. 配离子的空间结构、配位数以及稳定性,主要 取决于杂化轨道的数目和类型。 3. 如果中心原子还有合适的孤对电子, 而配体又有 合适的空轨道, 这时将形成反馈配键。
一、静电理论 1916年提出,假定中心原子和配体都是点电荷或偶极 子,利用静电的静电公式对配合物进行定量计算。
优点:能够说明一些配合物的配位数、几何构型和 稳定性。 缺点:将中心原子和配体都看作是没有内部结构的 点电荷,不能说明配合物的磁学性质和光学性质。
洛阳师范学院
二、价键理论 Sidgwick(1923)和Pauling(1928)提出配位共价模型,考 虑了中心原子和配体的结构。
