大学有机化学第三章烯烃 ppt课件
合集下载
第03章烯烃ppt课件

(4) 其它命名原那么同烷烃, 如:
●烯基:烯烃上去掉一个氢原子后剩下的基团。
●几个重要的烯基: CH2 CH
CH3CH CH CH2 CH CH2
乙烯基 1-丙烯基 2-丙烯基(烯丙基)
H3C C
H3C CH Cl
CH2 C CH3
CH2 C10H3 C
CH2 Cl
1-甲基乙烯基(异丙烯基)
普通不用顺反命名法
—当多烯烃主链的编号有两种能够时,规定编号由 Z 型双键一端起始。 例如:
3. 顺、反异构体的命名与〔Z〕、〔E〕构型的命名区别:
●Z/E命名法为IUPAC系统命名(适用于一切构造) ●顺、反异构体的命名指的是一样原子或基团在双键平面同一侧时 为“顺〞,在异侧时为“反〞。 ● Z、E构型指的是原子序数大的原子或基团在双键平面同一侧时 为"Z",在异侧时为"E"。
α C3H C H C2H+
XX
O NB( r 简 称 N B S ) h ν α C2H C H C2H
O
Br
2 α氢原子的氧化 —烯烃的α氢原子易被氧化,在烯烃氧化的讨论中已提到丙烯在一定条 件下可被空气催化氧化为丙烯醛。但在不同条件下,丙烯还可被氧化为 丙烯酸。
3 氨氧化反响 —丙烯在氨存在下的氧化反响叫做氨化氧化反响,简称氨氧化反响。 由此可以得到丙烯腈。 —丙烯中的甲基氧化为氰基(-CN)
a
aa
a
CC
b
b
CC
b
d
a
aa
d
CC
a
b
bCCd
有 顺 反 异 构 的 类 型
无 顺 反 异 构 的 类 型
●烯烃具有双键,其异构景象较烷烃复杂,主要包括: —碳干异构; —双键位置不同引起的官能团位置异构〔position isomerism〕; —双键不能自在旋转产生的立体异构景象--顺反异构。如:
有机化学课件烯烃

a) 醇脱水——分子内脱水
CH3CH2OH H2SO4 CH2=CH2 + H2O 170℃
CH3CH2OH Al2O3 CH2=CH2 + H2O 350-360℃
条件:浓酸或氧化铝催化 常用的酸性催化剂:H2SO4, KHSO4 , H3PO4 , P2O5 .
烯烃的实验室制法 b) 卤代烷脱卤化氢
CH3CH H
CHCH2CH3 + KOH CH3CH2OH CH3CH=CHCH2CH3 + KBr + H2O Br
条件:强碱的醇溶液
§3 烯烃的物理性质
物态:
2~4碳为气态;5~18碳为液态。
异构体的沸点:
沸点与分子极性有 关,熔点与分子对
称性有关。
末端烯烃沸点低; 支链烯烃沸点低; 反式异构体沸点低,熔点高。
➢ 烯基:烯烃分子去掉C=C键上连接的一个氢原子后的基团
H2C CH
按
系
H3C HC CH CH2
统
命
H2C C(CH3)
名 法
H3C HC CH
来
H2C CH CH2
乙烯基 vinyl 或 ethenyl 丁-2-烯基 1- 甲 基 乙 烯 基 ( 异 丙 烯 基 ) 丙烯基 烯丙基
➢ 亚基:烃去掉两个氢后,剩下的基团
CCH HH
较优基团: 次序大的基团
92023/8/9
烯烃的命名
➢ IUPAC命名法
① 选母体:选择最长的碳链为主链。如果C=C包含在主链中,按主链中所
含碳原子数命名为某烯,否则命名为某烷,主链上的支链作为取代基。
② 编号:如果C=C包含在主链中,从靠近C=C的一端开始,使双键碳原子 的编号较小,并且由最靠近端点碳的那个双键碳原子所得的编号来命名, 其编号写在烯的前面,否则根据链烷烃命名规则对主链进行编号,含双 键部分作为取代基。
有机化学课件 第三章 烯烃3
应经历溴 离子、反式加成。 • 反应经历溴鎓离子、反式加成。
Br H C C CH3 H H3C H C Br
+
H3C C C
H
H C
Br2
CH3
H Br
-
CH3 H CH3 C
Br
CH3
Br C H CH3
CH3 Br H (R) H Br (R) CH3 dl-
CH3 H Br (S) Br H (S) CH3
CH3 CH3 C CH=CH2 CH3 CH3 CH3 C CH CH3 + CH3 H3C Cl CH3 C CH CH3 Cl CH3 83%
HCl
17%
反应经历碳正离子中间体。 反应经历碳正离子中间体。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。
试比较下列分子或离子的超共轭效应大小。 [讨论] (1) 试比较下列分子或离子的超共轭效应大小。 讨论]
1) CH3CH=CH2 CH3CH2CH=CH2 (CH3)2CHCH=CH2 A B C 2) (CH3)3C (CH3)2CH CH3CH2 CH3 A B C D
+ + + +
(2) 试静态分析烯烃双键碳原子上电子云密度的大小。 试静态分析烯烃双键碳原子上电子云密度的大小。
碳正离子稳定性次序: 碳正离子稳定性次序: 3o C+ > 2o C+ > 1oC+ >CH3+
G
C
+
G
C
+
给电子基,使正电荷分散,碳正离子稳定: 给电子基,使正电荷分散,碳正离子稳定: 吸电子基,使正电荷更集中 碳正离子不稳定 碳正离子不稳定; 吸电子基,使正电荷更集中,碳正离子不稳定;
有机化学课件——第三章 烯烃

2、与烷烃的差异
由于烯烃中有π键,其物理性质与烷烃 又有差异。例如,端烯烃的沸点比相应的 烷烃略高;烯烃的折射率比相应的烷烃大; 烯烃在水中的溶解度比相应的烷烃略大; 相对密度也比相应的烷烃大,但仍小于1。 这主要是它们的极性大于烷轻。
3、顺反异构体的差异
烯烃的顺、反异构体的物理性质也有差 异。一般说来反式异构体的沸点比顺式异 构体的沸点低,而反式异构体的熔点却比 顺式异构体的高。这是由于反式异构体分 子极性小,对称性好;反式异构体热力学 能低,比较稳定。
命名规则 例子
命名规则
一般在烯烃名称前面加“顺”(cis-) 或“反”(trans-)
例子
顺-2-丁烯
反-2-丁烯
反-3-甲基-2-戊烯
?
(2)Z/E标记法
Z式:双键碳原子上两个较优基团或原子处于双键 同侧。 E式:双键碳原子上两个较优基团或原子处于双键 异侧。
次序规则 命名规则 例子
次序规则
Methylene
CH3CH= 亚乙基
ethylidene -CH2CH2- 1,2- 亚乙基 ethylene (dimethylene)
(CH3)2C= 亚异丙基
isopropylidene -CH2CH2CH2-
1,3- 亚丙基 trimethylene
1、构造异构体的命名
(1)衍生命名法 (2)系统命名法
位次,写在烯烃名称之前。
例子
3-庚烯
5-甲基-3-庚烯
2-乙基(-1-)戊烯
3,4-二丙基-1,3,5-己三烯 2-十八碳烯
2、顺反异构体的命名
(1)顺反标记法 (2)Z/E标记法
(1)顺反标记法
顺式:双键碳原子上两个相同的原子或基团处于 双键同侧。
大学有机化学第三章烯烃ppt课件

c
(E)-构型
Entgegen(相反)
3.3.2 次序规则 (1)将双键碳原子所连接的原子或基团按其原子序数的大
小排列,把大的排在前面,小的排在后面,同位素则按 原子量大小次序排列。
I, Br, Cl,, S, P, O, N, C, D, H
13
(2)如果与双键碳原子连接的基团第一个原子相 同而无法确定次序时,则应看基团的第二个 原子的原子序数,依次类推。按照次序规则 (Sequence rule)先后排列。
例如:-CH(CH3)3 > -CH2CH3 > -CH3 又例如:
Cl
O
C H> C O
Cl
C O>
Cl CC
H
C
H
C
14
(3)含有双键和叁健基团,可认为连有二个或三个 相同原子
HC CH2
HH 12
C C (C)
(C) H
C1(C,C,H) C2(C,H,H)
H 12
C CH3
CH3
C1(C,C,H) C2(H,H,H)
32
CH2=CH2
98% H2SO4
H2O
C H3C H2O H
CH3CH=CH2
80 % H2SO4
H2O
OH
65 %
H2O
H2SO4
OH
33
(3)与水的的加成: 在酸催化下,烯烃与水作用得醇,副产物多, 实验室无制备价值。 工业上乙烯水解制备乙醇(p54)
(4)与卤素的加成: a)卤素的活泼性:F2>Cl2>Br2>I2 b)Br2/CCl4溶液可鉴定烯烃(黄棕色退为无色) e)反应历程也为亲电加成*
+ HBr
有机化学【烯烃】【优质PPT】

2021/10/10
10
三、烯烃的命名
烯烃系统命名法命名原则如下: (A)选择含有双键在内的最长碳链作为主链, 支链作为取代基,根据主链所含碳原子数称为 “某烯”。 (B)将主链上的碳原子上从双键最靠边的一端 开始依次用阿拉伯数字1,2,3,…编号,双键 的位次用两个双键碳原子中编号小的碳原子的号 数表示,写在“某烯”之前,并用半字线相连。 (C)取代基的位次、数目、名称写在“某烯” 名称之前,其原则和书写格式与烷烃相同。
(E)-3-甲基-4-丙基-3-辛烯
当烯烃主链的碳原子数多于十个时,命名时 汉字数字与烯字之间应加一个“碳”字(烷烃不 加碳字),称为“某碳烯”,例如:
CH3(CH2)3CH=CH(CH2)4CH3 5-十一碳烯
2021/10/10
14
烯烃顺反异构体的命名
烯烃顺反异构体的命名可采用两种方法 ——顺反命名法和Z,E-命名法 (1)顺反命名法:
在反应中,具有亲电性能的试剂叫做亲电 试剂。
由亲电试剂的作用而引起的加成反应叫做 亲电加成反应(electrophilic addition)。
2021/10/10
32
(1)与卤素加成
CH3CH=CH2+Br2 CCl4
Br CH3-CH-CH2
Br
烯烃一般与氯或溴发生加成反应。烯烃与溴
的作用,通常以四氯化碳为溶剂,在室温下即可
2021/10/10
21
(C)当基团含有双键或三键时,可以认为双 键和三键原子连接着两个或三个相同的原子。
例:
-CH=CH2 相当于
H (C) || -C|-C| -H (C) H
O||
O-(C) |
-C-OH 相当于 -C-OH
课件有机化学第3章 烯烃

第三章烯烃Alkenes12烯烃的结构烯烃的顺反异构烯烃的命名烯烃的物理性质CONTENT1234烯烃的化学性质烯烃的制备56SP杂化轨道C C C C7乙烯键长和键角乙烷键长和键角134 pm 烯烃的键长和键角烯烃的结构特征•sp2杂化•π-键•C=C键长比C-C短•π键电子云流动性较大•存在顺反异构——相同基团在双键同侧为顺式,不同侧为反式83.3 烯烃的命名•主链应含双键称“某碳烯”•C10•主官能团的位号尽可能小•如烯烃存在位置异构,母体名称前要加官能团位号•取代基的位置、数目、名称按“次序规则”顺序写在母体前面•Z或E加圆括号,写在化合物名称最前面123.5 烯烃的化学性质1. 烯烃的亲电加成2. 烯烃的自由基加成3. 硼氢化反应4. 催化氢化5. 烯烃的氧化6. 烯烃的α−卤化7. 聚合反应21烯烃亲电加成的原则当不对称烯烃与极性试剂加成时:试剂中的正离子(或带有部分正电荷的部分)加到带有部分负电荷的双键碳原子上试剂中的负离子(或带有部分负电荷的部分)加到带有部分正电荷的双键碳原子上24可能发生重排反应重排反应( rearrangement)——在化学键的断裂和形成过程中,组成分子的原子配置方式发生了改变,从而形成组成相同,结构不同的新分子。
31结论•反应是亲电加成反应•反应是分步进行的•立体化学上表现为反式加成38反应特点•Br2, Cl2对烯烃的加成主要为环正离子过渡态的反式加成•碘加成一般不发生,但ICl, IBr可与烯键发生定量加成反应,用来监测油脂中双键的含量40。
烯烃类有机化合物ppt课件

32
化学性质
马氏规则:当不对称烯烃和不对称试剂(如:HX, H2O)发生加成反应时,不对称试剂的带正电部 分,主要加到双键中含氢较多的碳原子上。 试剂中的氢原子加到含氢较多的不饱和碳原子上。
33
马氏规则的解释
+
RCH
-
CH2
a
H ¨X: ¨
b
¨:X:-
¨
RC+H CH2
X RCH CH2
H
H
仲正碳离子 (稳定性大)
碱性或中性 RCH2CH CH2 + KMnO4
RCH2CH CH2 OH OH
39
化学性质
2.酸性高锰酸钾氧化
CH3CH CH2 KMnO4 / H+ CH3COOH + CO2
CH3C
CH2 KMnO4 / H+
O CH3CCH3 + CO2
CH3
CH3C
O CHCH3 KMnO4 / H+ CH3CCH3 + CH3COOH
CH3
CCH3 CH3
5-甲基-2-庚烯
2,4,4-三甲基-2-戊烯15
写出下列化合物的结构式 1. 3-甲基-2-戊烯
CH3CH CCH2CH3 CH3
2. 2,3-二甲基-1-丁烯
3. 反-2-戊烯
CH3 CH2 C CH CH3
CH3
CH3 C
H
H C
CH2CH3
16
第三节 烯烃的物理性质
48
用化学方法鉴别下列各组化合物
1、丁烷、1-丁烯
丁烷 1-丁烯
KMnO4/H+
紫色不褪去 紫色褪去
49
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例如:-CH(CH3)3 > -CH2CH3 > -CH3 又例如:
Cl
O
C H> C O
Cl
C O>
Cl CC
H
C
H
C
ppt课件
14
(3)含有双键和叁健基团,可认为连有二个或三个 相同原子
HC CH2
HH 12
C C (C)
(C) H
C1(C,C,H) C2(C,H,H)
H 12
C CH3
CH3
原子与其它原子(或原子团)结合,形成两个σ键。
ppt课件
17
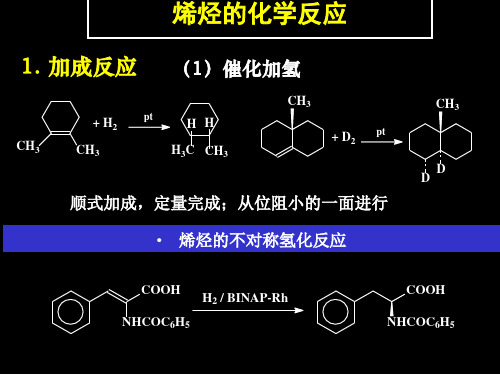
3.6.1 催化加氢
催化剂:铂、钯、镍
ppt课件
Z-
16
注意:
Cl
Cl
H C=C Br
顺-1,2-二氯-1-溴乙烯 E-1,2-二氯-1-溴乙烯
∴ Z,E-命名法不能同顺反命名法混淆。
3.4 烯烃的来源和制法(自学) 3.5 烯烃的物理性质(自学) 3.6 烯烃的化学性质
烯烃的双键中π键易断裂,导致烯烃易发生加成、氧 化、聚合反应。 加成反应:烯烃的双键中π键断裂,双键的二个碳
(H,H,C)C
CH3CH2 C=C CH3
(H,H,H)C
C(C,C,H)
CH(CH3)2
CH2CH2CH3
C(C,H,H)
(H,H,C)C,(H,H,C)C
C(C,C,C)
CH3CH2CH2 C=C C CH
CH3CH2
CH=CH2
(H,H,H)C,(H,H,C)C
C(C,C,H)
Z-3-× ¸¸ ù -4-¸ ì ± ¸¸ ù -3-¸¸
第三章 烯烃
3.1 烯烃的构造异构和命名 3.2 烯烃的结构 3.3 E/标记法—次序规则 3.4 烯烃的来源和制备 3.5 烯烃的物理性质 3.6 烯烃的化学性质 3.7 重要的烯烃
ppt课件
1
3.1 烯烃的构造异构和命名
分子中含碳碳双键或碳碳叁键的烃叫不饱和烃。 含一个碳碳双键的开链烃叫单烯烃,简称烯烃。
Br Cl
C=C
H3C
H
?
Br H C=C
H3C Cl
?
后两个的化合物的构型如何命名?
3.3 Z-E标记法—次序规则
3.3.1 Z-E标记法
(1)依次对双键碳原子上所连接基团排序。
(2)双键碳C1与C2上序数大的基团在同侧为Z,在不同
侧为E 。
ppt课件
12
a
c
CC
a>b
b
b
c>d
(Z)-构型
Zusammen (共同)
通式为CnH2n 官能团为C=C键
3.1.1 烯烃的构造异构:
(1)碳链(碳干)异构 (2)官能团位置异构
3.1.2 烯烃的命名(系统命名)
(1)选择一个含双的最长的碳链为主链。
ppt课件
2
(2)从最靠近双键的一端起,把主链碳原子依次编号
(3)双键的位次必须标明出来,只写双键两个碳 原子中位次较小的一个,放在烯烃名称的前面。
(3)顺反命名法
两个双键碳上相同的原子或原子团在双键的同一侧者, 称为顺式,反之称为反式。例:
CH3 C
H
CH3 C
H
Ⅰ
CH3
H
CC
H
CH3
Ⅱ
Ⅰ——顺式,两个甲基位于双键的同侧; Ⅱ ——反式,两个甲基位于双键的异侧。
ppt课件
11
问题:
H3C
CH3
C=C
H
H
顺-2-丁烯
H3C
H
C=C
H
CH3
反-2-丁烯
˳ -2-¶¡ Ï© ppt课件
·´ -2-¶¡ Ï©
9
(1)顺反异构体构造相同,原子或基团在空间排布方 式(构型)不同,属于构型异构或立体异构。
(2)每个双键碳原子连接两个不同的原子或基团才有 顺反异构
a
aa
aa
c
CC
CC
CC
b
bb
db
d
a C
a
a C
b
存在顺反异构体
无顺反异构体
ppt课件
10
C1(C,C,H) C2(H,H,H)
ppt课件
15
根据以上规则,常见基团优先次序如下所示:
-I > -Br > -OR……
-Cl >
-SO3H >
-F >
-OCOR >
举例:
H3C CH2 CH2
Cl
CC
H
Br
(E)-1-氯-1-溴-1-戊烯
H3C CC
H
CH2CH2CH3 CH3
(Z)-3-甲基-2-己烯
a
d
CC
b
c
(E)-构型
Entgegen(相反)
3.3.2 次序规则
(1)将双键碳原子所连接的原子或基团按其原子序数的大
小排列,把大的排在前面,小的排在后面,同位素则按 原子量大小次序排列。
I, Br, Cl,, S, P, O, N, C, D, H
ppt课件
13
(2)如果与双键碳原子连接的基团第一个原子相 同而无法确定次序时,则应看基团的第二个 原子的原子序数,依次类推。按照次序规则 (Sequence rule)先后排列。
平面的上下方。
其他烯烃分子:碳碳双键与乙烯一样,其余部分与
烷烃一样。
ppt课件
7
π键的特性:
①π键不能自由旋转。 ②π键键能小,不如σ键牢固。
碳碳双键键能为611KJ/mol,碳碳单键键能为 347JK/mol,
∴π键键能为611-347=264K/mol ③π键电子云流动性大,受核束缚小,易极化。 ∴π键易断裂、起化学反应。
C
(sp2杂化碳)
¸¸¸3¸¸s¸p 2¸¸¸¸p¸ ì¸ ì ¸¸¸¸ ±
CC
CC
ppt课件
6
H C
H
H C
H
H C
H
H C
H
故乙烯中C=C键,一条代表σ键,另一条代表π键
σ键碳原子的sp2杂化轨道头碰头重叠形成, σ键
电子云分布在两个碳原子之间; π键由碳原子的p
轨道肩并肩侧面重叠而成, π键电子云分布在分子
ppt课件
8
3.2.2 烯烃的顺反异构现象
σ键是轴对称,而π键是面对称,当转动碳碳 键时,π键被破坏,需要的能量至少为π键 键能,约需500℃的高温。因此,当双键碳 上连有不同基团时,就会产生顺、反异构。
2-¶¡ Ï© : H3C
CH3
C=C
HH
(I)¸m.p
¸
-132 C
H3C
H
C=C
H
CH3
(II)¸m.p -105¸C
激发
杂化
杂化
3个sp2
sp2杂化轨道的形状与sp3杂化轨道大致相同,只是sp2 杂化轨道的s成份更大些:
sp 2
sp 3
ppt课件
5
为了减少轨道间的相互斥力,使轨道在空间相距最远,要求平 面构型(三个sp2轨道在同一平面)并取最大键角为120°:
£¡
120
3¸sp2¸¸¸ ì ¸ ¸
¸× ¸¸ ó ¸ ü ¸¸120
2,4-二甲基-2-己烯
(4)其他与烷烃相同
ppt课件
3
3.2 烯烃的结构
3.2.1 乙烯的结构 实验事实:仪器测得乙烯中六个原子共平面:
H
¡£
116.6
0.1330nm
C ¡£ C
121.7
H
H
H
0.1076nm
ppt课件
4
(1)杂化轨道理论的描述
C2H4中,C采取sp2杂化,形成三个等同的sp2杂化轨道:
