多组分系统热力学及其在溶液中的应用2
傅献彩《物理化学》第5版笔记和课后习题含考研真题详解(多组分系统热力学及其在溶液中的应用)【圣才出品

令 kb
R(Tb* )2MA
Δ
fus
Hห้องสมุดไป่ตู้
θ m,A
,则有
Tb kbmB
式中,kb 称为沸点升高系数,只与溶剂的性质有关。
3.渗透压 渗透压Π求解公式为
cBRT
式中,cB 为溶质的浓度,该式仅适用于稀溶液。
六、活度与活度因子(见表 4-1-2) 表 4-1-2 活度与活度因子
5 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
解:(1)质量摩尔浓度
mB
nH2SO4 W水
0.0947 0.1/ 0.09808 molkg1 (1 0.0947) 0.1
1.067molkg1
(2)物质的量浓度
cB
nB V
mB / M B m溶液 / B
0.0947 0.1kg / 0.09808kgmol-1 0.1kg /1.0603103 kgm3
2 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
三、稀溶液中的两个经验定律
1.Raoult 定律
pA
p
A
x
A
2.Henry 定律
pB kx,B xB
3 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
四、理想液态混合物的通性
(1)应加入水的体积; (2)加水后,能得到含乙醇的质量分数为 0.56 的酒的体积。
8 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
已知该条件下,纯水的密度为 999.1 kg·m-3,水和乙醇的偏摩尔体积为 表 3-2-1
解:(1)先计算 10.0m3 的含乙醇 0.96 的酒中水和乙醇的物质的量。
多组分系统热力学(2)
xB
(3.29)
解释:加入的溶质分子占据了原溶剂的位置和减少了单位表
面上溶剂分子的数目,因而也减少了离开液面进入气相的溶
剂分子数目,即减少了溶剂的蒸气压;蒸气压的减少量与溶
质分子占据液面的比率(即xB)成正比。
2
二、亨利定律
溶液热力学
亨利定律:在一定温度和平衡状态下,气体在液体里的溶解度 (用摩尔分数表示)和该气体的平衡分压成正比。
B,m
(T
,
p)
RT
ln
mB m
(3-41)
化学势
B
B* ,m(T ,
p)
RTln
mB mθ
(m =1 mol/kg)
标准态:温度T,浓度m = 1mol/kg,压力为该浓度按亨利定 律推算的蒸气压km时的化学势。 (这是一个假想的标准态)
17
溶液热力学
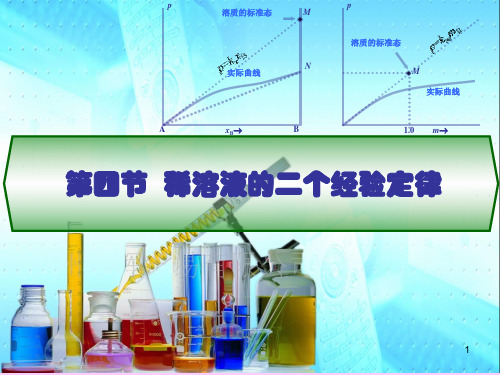
表示式3 pB = kccB (c:mol/L)
p
p
溶质的标准态
M
实际曲线
溶质的标准态
N
M
实际曲线
A
xB
B
1.0 m
第四节 稀溶液的二个经验定律
1
一、拉乌尔定律
溶液热力学
拉乌尔定律:一定温度下,稀溶液溶剂的蒸气压等于纯溶剂的 蒸气压乘以溶液中溶剂的摩尔分数
pAA 1 xB
p*A pA p*A
(3-44)
* B,m
(T
,p)
RT
ln
aB,m
(3-45)
21
B
* B,c
(T
,p)
RT
ln
多组分系统热力学及其在溶液中的应用

第四章多组分系统热力学及其在溶液中的应用教材分析:本章介绍了溶液组成的表示方法,讲述了化学势和偏摩尔量两个重要概念,将多组分系统的热力学理论应用于溶液中各组分的化学势的表示,从而为研究溶液的各种性质奠定了基础,在此基础上,讨论了稀溶液的最基本的性质——依数性。
它是热力学理论对于溶液系统的应用。
教学目的和要求:通过本章的教学使学生了解和掌握溶液的浓度的各种表示方法,拉乌尔定律及亨利定律,稀溶液、理想溶液的意义;实际溶液与理想溶液的区别;活度的概念及意义,标准态的选用。
化学势及偏摩尔量的定义及相关公式。
掌握稀溶液与理想溶液、非理想溶液三者的区别、关系及各自性质。
加深对拉乌尔定律及亨利定律的理解并熟悉其应用。
活度的概念及标准态的选用及溶液中各组分化学势的表示,是本章的一个难点,必须使学生理解这些概念及其意义。
重点和难点:拉乌尔定律和亨利定律;偏摩尔量和化学势概念;由两个经验定律导出溶液中各组分的化学势的过程和思路;稀溶液、理想溶液的意义;活度的概念与意义;标准态的选用。
教学内容与过程:溶液组成的表示法,偏摩尔量和化学势的概念,溶液的基本性质和两个经验定律,混合气体中各组分的化学势,稀溶液(组分的化学势与标准态,依数性),理想溶液(理想溶液的定义,化学势,通性等)。
思考题、作业:1.课后全部复习题2.作业题:6,8,10,11,12,15,17,18,20,23,25,26,27。
参考资料:1.胡英主编,《物理化学》2.天津大学主编,《物理化学》3.万洪文主编,《物理化学》4.各种习题解题辅导书5.课后所列各种参考读物。
第三节 多组分系统中物质的偏摩尔量与化学势在这以前人们所讨论的热力学体系都是纯组分的体系或者是组分不变的单相体系。
因此,所有的热力学函数U m 、H m 、S m 、G m 、F m 在体系的T 、p 一定的条件下有确定值。
即在这种情况下,要描述体系的状态只要两个状态性质(如T 、p )就行了。
多组分系统

第四章 多组分系统热力学及其在溶液中的应用§4.1 引 言1.基本概念1)多组分系统:由两种或两种以上物质所组成的系统。
(多组分系统可以是单相的也可以是多相的。
)2)混合物:由两种或两种相互均匀混合而构成的系统。
(可以是气相、液相或固相) 3)溶 液(1)定义:由两种或两种以上物质在分子级别呈均匀混合而成的系统。
(2)溶液组分命名:溶质,溶剂。
(3)分类:(1)固态溶液、液态溶液。
(2)电解质溶液、非电解质溶液。
(4)应注意问题:形成溶液后,一般溶质、溶剂受力 情况与纯组分受力情况不同,所以对它们研究方法是不同的。
2.溶液中物质受力情况溶剂-溶剂 f 11 ,溶质-溶质 f 22 ,溶剂-溶质 f 12。
1) 纯态: 溶质 f 22 溶剂 f 11 2) 稀溶液: 溶质 f 22 溶剂 f 11 3) 中等浓度: 溶质 f 22,f 12 溶剂 f 12, f 11 4) 高浓度: 溶质 f 22 溶剂 f 12 3.受力变化同热效应关系1) 放热2) 吸热3) 不吸热不放热§4.2 多组分系统的组成表示法1.组成表示法1)B 的质量浓度:单位体积混合物中所含B 的质量。
1211,22f f f >121122,f f f <121122f f f ==()B B m Vρ=单位 与T 有关2)B 的质量分数:单位质量混合物中所含B 的质量。
单位为1,与T 无关3)B 的浓度:单位体积混合物中所含B 的物质的量。
单位 或 同T 有关。
4)B 的摩尔分数( 或):组分B 的物质的量与混合物中总物质的量的比值。
单位为1,与T 无关液体用 ,气体用5)溶质B 的质量摩尔浓度:每千克溶剂中所含溶质的物质的量。
单位 与T 无关。
6)溶质B 的摩尔比:单位物质的量的溶剂中所含溶质的物质的量。
单位为1,与T 无关。
2.常用的浓度表示法之间的关系 1) 与 的关系:若取1000 g 溶剂对稀溶液 2) 与 关系:-3kg m ⋅B B W w W =B Bn c V =-3mol m ⋅-3mol dm ⋅B x B y B B n x n=B x By ()BB A n m m =⋅-1mol kg BB A n r n =B x B m B BB A B n n x n n n ==+∑AB B A B BB A10001000m x m m M M m M ==++∑∑A B 1000M m <<∑B AB 1000m M x =B x BC A B B BW W c M ρρ=-=-∑∑AB B B B A AB B B B B BB A A c c c M x W c M c M c M c c M M ρρ===--+++∑∑∑∑∑()B AB A B Bc M x c M M ρ=+-∑若溶液很稀则3) 同 的关系: 取 取若溶液很稀则 若 取 对水§4.3 偏摩尔量1.偏摩尔量的定义 1. 问题的引出对简单均相系统 ,要描述其状态,只需要两个状态性质(T 、p )就可以了。
多组分系统热力学及其在溶液中的应用习题

多组分系统热力学及其在溶液中的应用BCCAC; BDBAC DBCCA CDDBA CABAD DCCAC DDCAB A01>298K,标准压力下,苯和甲苯形成理想液体混合物,第一份溶液体积为2dm3,苯的摩尔分数为0.25,苯的化学势为μ1,第二份溶液的体积为1dm3,苯的摩尔分数为0.5,化学势为μ2,则:解答A.μ1>μ2 B.μ1<μ2 C.μ1=μ2 D.不确定02> 298K,标准压力下,有两瓶萘的苯溶液,第一瓶为2dm3(溶有0.5mol萘),第二瓶为1dm3(溶有0.25mol萘),若以μ1,μ2分别表示两瓶中萘的化学势,则:解答A.μ1=10μ2 B.μ1=2μ2 C.μ1=μ 2 D.μ1=0.5μ203>重结晶制取纯盐的过程中,析出的NaCl固体的化学势与母液中NaCl的化学势比较,高低如何?解答A.高B.低C.相等D.不可比较04>从多孔硅胶的强烈吸水性能说明在多孔硅胶吸水过程中,自由水分子与吸附在硅胶表面的水分子比较,化学势高低如何?解答A.前者高B.前者低C.相等D.不可比较05> 273K,10下,液态水和固态水(即冰)的化学势分别为μ(l)和μ(s),两者的关系为:解答A.μ(l)>μ(s) B.μ(l)=μ(s) C.μ(l)<μ(s) D.不能确定06>在298K时,A和B两种气体单独在某一溶剂中溶解,遵守Henry定律,Henry常数分别为k A和k B,且知k A>k B,则当A和B压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为:解答A.A的量大于B的量B.A的量小于B的量C.A的量等于B的量D.A的量与B的量无法比较07>在温度T时,纯液体A的饱和蒸气压为,化学势为,并且已知在标准压力下的凝固点为,当A中溶入少量与A不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为p A,μA,T f,则解答A.<p A,<μA,<T f B.<p A,<μA,<T fC.<p A,<μA,>T f D.<p A,>μA,>T f08>在400K时,液体A的蒸气压为4×104Pa,液体B的蒸气压为6×104Pa,两者组成理想液体混合物,平衡时溶液中A的物质的量分数为0.6,则气相中B的物质的量分数为:解答A.0.60 B.0.50 C.0.40 D.0.3109>已知373.15K时,液体A的饱和蒸气压为133.32kPa,另一液体B可与A构成理想液体混合物。
第四章 多组分系统热力学及其在溶液中的应用

第四章 多组分系统热力学及其在溶液中的应用1.在298K 时,有0.10kg 质量分数为0.0947的硫酸H 2SO 4水溶液,试分别用(1)质量摩尔浓度B m ;(2)物质的量浓度和B c (3)摩尔分数B x 来表示硫酸的含量。
已知在该条件下,硫酸溶液的密度为331.060310kg m -⨯⋅ ,纯水的浓度为3997.1kg m -⋅ 。
解:质量摩尔浓度:()2410.19.47%/1009.47%0.1981.067mol H SO B n m W kg -⨯==-⨯=⋅水物质量浓度:()24331009.47%0.10.19.47%/98997.11.02310mol H SO B n c V m --⨯⨯===⨯g 水 摩尔分数:242420.0189H SO B H SO H On x n n ==+2、在K 298和大气压力下,含甲醇()B 的摩尔分数B x 为0.458的水溶液密度为30.8946kg dm -⋅,甲醇的偏摩尔体积313()39.80V CH OH cm mol -=⋅,试求该水溶液中水的摩尔体积2()V H O 。
解:3322CH OH CH OH H O H O V n V n V =+3322CH OH CH OHH O H OV n V V n -=以1mol 甲醇水溶液为基准,则330.45832(10.458)180.027290.894610m V dm ρ⨯+-⨯===⨯ ∴23310.027290.45839.801016.7210.458H OV cm mol ---⨯⨯==⋅-3.在298K 和大气压下,某酒窖中存在酒10.0m3,其中含乙醇的质量分数为0.96。
今欲加水调制含乙醇的质量分数为0.56的酒,试计算(1)应加入水的体积;(2)加水后,能得到含乙醇的质量分数为0.56的酒的体积已知该条件下,纯水的密度为3997.1kg m -⋅,水和乙醇的偏摩尔体积为()25C H OH ω()()6312/10V H O m mol --⋅()()63125/10V C H OH m mol --⋅0.96 14.61 58.0 0.5617.1156.58解:设加入水的物质的量为O H n 2',根据题意,未加水时,2520.9610.96::9.3914618C H OH H O n n -== 2525221C H OHC H OH H O H O V n V n V =⋅+⋅ 即 661001.581061.1410522--⨯⨯+⨯⨯=OH H C O H n n解出:25167882C H OH n mol =217877H O n mol = 加入水后,25220.5610.56:():0.4984618C H OH H O H O n n n -'+== 20.5610.56167882:(17877):0.4984618H O n -'+==2'317887H On mol = 加入水的物质的体积为23331788718105.727()999.1H O V m -⨯⨯'== 2525222252'26'6()56.5810(17877)17.1110C H OH C H OH H O H OH OC H OH H OV n V n n V n n --=++=⨯⨯++⨯⨯329.4984495 5.76753115.266V m =+=4.在K 298和kPa 100下,甲醇)(B 的摩尔分数B x 为30.0的水溶液中,水)(A 和甲醇)(B 的偏摩尔体积分别为:132765.17)(-⋅=mol cm O H V ,133632.38)(-⋅=mol cm OH CH V 。
多组分系统热力学及其在溶液中的应用

极性溶剂不能溶解。
• 这也说明为什么一般无机盐在水中均有一
定的溶解度,而在有机溶剂的溶解度则大
大降低。
• 上述定性规则也有不少例外,故欲知物质在 一液体中的溶解度,最可靠而直接的方法还 是用实验方法来测定。
温度与溶解度:
一般说来物质溶解于某一液体中时,往往有
热效应,即产生吸热现象或放热现象,故物
液,常用符号“∞”表示。 多种气体混合在一起,因混合非常均匀,称为 气态混合物,而不作为气态溶液处理。
二、溶解现象及溶解度
• 以前人们认为溶解现象仅是一物理现象,现
在已认识到了溶液中各物质分子之间的化学
相互作用对溶液性质的影响;
• 对于稀溶液还建立了一系列定量的理论,这
些理论使我们有可能根据溶液的组成来预测
作用较复杂,不在本章中讨论,下册
“电解质溶液” 一章有讨论。
§4.2
多组分系统的组成表示法
• 溶液的性质与溶液的组成关系密切,组成改 变,就会引起性质变化。 • 所以怎样表示溶液的组成是研究溶液性质的 一个基本问题。 • 一般常用的溶液组成表示法有以下几种:
§4.2
多组分系统的组成表示法
在均相的混合物中,任一组分B的浓度表示 法主要有如下几种: 1.B的质量浓度 2. B的质量分数 3. B的浓度
A
即指B的物质的量与混合物总的物质的量之比 称为溶质B的摩尔分数,又称为物质的量分数。 摩尔分数的单位为1 气态混合物中摩尔分数常用
yB 表示
在溶液中,表示溶质浓度的方法有:
(1)溶质B的质量摩尔浓度mB
mB
def
nB m(A)
mB bB
溶质B的物质的量与溶剂A的质量之比称为 溶质B的质量摩尔浓度。
第四章 多组分系统热力学及其在溶液中的应用

第四章 多组分系统热力学及其在溶液中的应用1.在298K 时,有0.10kg 质量分数为0.0947的硫酸H 2SO 4水溶液,试分别用(1)质量摩尔浓度B m ;(2)物质的量浓度和B c (3)摩尔分数B x 来表示硫酸的含量。
已知在该条件下,硫酸溶液的密度为331.060310kg m -⨯⋅ ,纯水的浓度为3997.1kg m -⋅ 。
解:质量摩尔浓度:()2410.19.47%/1009.47%0.1981.067mol H SO B n m W kg -⨯==-⨯=⋅水物质量浓度:()24331009.47%0.10.19.47%/98997.11.02310mol H SO B n c V m --⨯⨯===⨯g 水 摩尔分数:242420.0189H SO B H SO H On x n n ==+2、在K 298和大气压力下,含甲醇()B 的摩尔分数B x 为0.458的水溶液密度为30.8946kg dm -⋅,甲醇的偏摩尔体积313()39.80V CH OH cm mol -=⋅,试求该水溶液中水的摩尔体积2()V H O 。
解:3322CH OH CH OH H O H O V n V n V =+3322CH OH CH OHH O H OV n V V n -=以1mol 甲醇水溶液为基准,则330.45832(10.458)180.027290.894610m V dm ρ⨯+-⨯===⨯ ∴23310.027290.45839.801016.7210.458H OV cm mol ---⨯⨯==⋅-3.在298K 和大气压下,某酒窖中存在酒10.0m3,其中含乙醇的质量分数为0.96。
今欲加水调制含乙醇的质量分数为0.56的酒,试计算(1)应加入水的体积;(2)加水后,能得到含乙醇的质量分数为0.56的酒的体积已知该条件下,纯水的密度为3997.1kg m -⋅,水和乙醇的偏摩尔体积为()25C H OH ω()()6312/10V H O m mol --⋅ ()()63125/10V C H OH m mol --⋅0.96 14.61 58.0 0.5617.11 56.58解:设加入水的物质的量为O H n 2',根据题意,未加水时,2520.9610.96::9.3914618C H OH H O n n -== 2525221C H O H C H O H H O H OV n V n V =⋅+⋅ 即 661001.581061.1410522--⨯⨯+⨯⨯=O H H C O H n n 解出:25167882C H OH n mol =217877H O n mol = 加入水后,25220.5610.56:():0.4984618C H O HH O H On n n -'+== 20.5610.56167882:(17877):0.4984618H O n -'+== 2'317887H O n mol = 加入水的物质的体积为23331788718105.727()999.1H O V m -⨯⨯'== 2525222252'26'6()56.5810(17877)17.1110C H OH C H OH H O H OH OC H OH H OV n V n n V n n--=++=⨯⨯++⨯⨯329.4984495 5.76753115.266V m =+=4.在K 298和kPa 100下,甲醇)(B 的摩尔分数B x 为30.0的水溶液中,水)(A 和甲醇)(B 的偏摩尔体积分别为:132765.17)(-⋅=mol cm O H V ,133632.38)(-⋅=mol cm OH CH V 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
多组分系统热力学及其在溶液中的应用2在前面的讨论中,我们所涉及到的系统均为纯物质系统或组成恒定的系统。
但在实际上常见的却是多组分系统或变速成系统。
本章将就多组分系统的热力学问题进行讨论。
在正式讨论之前,先将多组分系统进行分类:①按研究的方法分:多组分系统可有单相和多相之分。
本章将讨论多组分系统单相系统。
多组分单相系统由两种或两种以上的物质以分子大小相互均匀混合而成的均匀系统当对均匀系统中各组分现用相同的标准和同样方法研究时,称之为混合物;当对均匀系统中各组分加以区别,选用不同的标准和不同的方法(例如:将系统中的组分分为溶剂(A)和溶质(B))研究时,称之为溶液。
②按聚集状态分:分为气态溶液或混合物、液态溶液或混合物、固态溶液或混合物本章讨论的对象主要是液态系统,包括液态溶液和液态混合物。
③按导电性能分:对于溶液中溶质,按其导电性能可分为电解质溶液和非电解质溶液,本能力讨论非电解质溶液。
④按规律性分:理想混合物理想稀溶液混合物{溶液{真实混合物真实溶液本章讨论的主要对象为混合物和稀溶液,适当介绍一些真实溶液。
1.物质B的物质的量分数(物质B的摩尔分数):某BnB某B=────∑B某B=1∑BnB2.物质B的物质的质量分数:WBmBWB=────∑BWB=1∑BmB3.物质B的量浓度:CB/mol·m-3nBcB=───V4.物质B的质量摩尔浓度:mB/mol·kg-1nBmB=───W剂1.拉乌尔定律在一定温度下,纯液体A有一定的蒸汽压p某A,若向液体A加入溶质B,实验表明这是溶剂A的蒸汽压会下降。
法国化学家拉乌尔归纳多次的实验结果得出如下结论:“定温下稀溶液内溶剂的蒸汽压等于同温度下纯溶剂的蒸汽压乘它在溶液内的摩尔分数”。
即pA=p某A某A推导:设溶液由二个组分构成:A-溶剂B-溶质向溶剂A加入溶质B由实验知pA<p某A即Δp=(p某A-pA)>0且某B↑→Δp↑所以Δp∝某B由于构成稀溶液,加入的溶质较少,溶剂A分子电动势受力环境没有什么改变,只是单位体积溶液中A分子的数量减少了,使气相中ρA下降,而导致pA亦下降,也就是说加入B的数量越多,ρA下降越多,pA的下降也越大,这样,Δp仅与加入溶质B的数量有关,而与其本性无关了。
故Δp与某B间应呈线性关系:p某A-pA=K某B纯由数学上当某B=1时pA=0K=p某A所以p某A-pA=p某A某B pA=p某A(1-某B)=p某A某A2.亨利定律1803年英国化学家WiliamHenry在研究一定温度下气体在液体中的溶解度时发现,一定温度下气体在液体中的溶解度和该气体的平衡分压成正比关系。
即:pB∝某B或pB=k某,B某Bk某,B称为亨利系数,单位为pa。
亨利定律对稀溶液中的挥发性溶质同样适用。
从表面上看,拉乌尔定律和亨利定律的数学表达式大致相同,但比例系数不一样:拉乌尔定律中比例系数为纯溶剂的蒸汽压,而亨利定律中为亨利系数。
之所以有这样的不同是因为:拉乌尔定律表述的是稀溶液中溶剂的蒸汽压与自称间的关系,而亨利定律表述的则是稀溶液中溶质的蒸汽压与组成间的关系。
在稀溶液中溶剂是大量的,而溶质是少量的,与纯态相比,B 分子的受力环境产生了很大的变化,其逸出的能力不仅与单位体积溶液中溶质B的数量有关,还与B与A分子间的作用力有关,又因溶液很稀,某个溶质分子周围难得有其它溶质分子存在,亦即可认为每个溶质分子均完全由溶剂分子所包围着,故每个溶质分子受力环境相同,A、B分子间作用力可视为常数,故所表现出的蒸汽压仅与溶质的浓度有关,但比例系数不可能是p某B,而只能是k某,B,k某,B=f(T,溶质和溶剂的性质)注意:①拉乌尔定律和亨利定律均属稀溶液经验定律,且溶液越稀,与实际的偏差越小;②拉乌尔定律应用的对象是非电解质稀溶液中的溶剂及理想混合物中任一组分,计算溶剂的物质的量时,其摩尔质量应用气态时的摩尔质量。
如:水虽有缔合分子,但M=18.01g/mol;③亨利定律应用的对象是稀溶液中的溶质,而且:a.pB是气体在液面上的分压,对于混合气体,当p总不大时,亨利定律能分别适用于每一种气体,可近似认为与其它气体的分压无关;b.要求溶质在气相中和溶液中的分子状态必须相同,如:HCl溶在苯或CHCl3中在气相或液相里均呈HCl分子状态,故服从亨利定律;而在水中HCl完全电离,亨利定律不适用,但对溶剂中部分电离溶质,如:NH3在水中,某B应计算呈溶解态分子在溶液中的浓度;④可以证明,若溶液中溶质服从亨利定律,则溶剂比服从拉乌尔定律,反之亦然。
拉乌尔定律和亨利定律还可用图形表示出来,如教材p212所示。
⑤当溶质在溶液中的浓度采用不同方法表示时,亨利系数的值不同,亨利定律的形式不同,如:pB=k某,B某BpB=kc,BCBpB=kb,BbB一般k某,B≠kc,B≠kb,B且量纲也不同。
【例4-3-1】§4-4混合气体中各组分的化学势系统内物质的形态不同,其化学势的表达式是不同的。
由于化学势能作为判断组成变化的封闭系统和敞开系统内所发生的热力学过程)尤其是化学变化和相变化)的方向和限度的判据,故有必要讨论处于不同形态的物质的化学势表达式。
1.理想气体的化学势(1)纯理想气体的化学势∵纯物质GB=G某B=μ某VB(β)=V某mδμB∴(───)T=V某mδpT一定时dμB=V某mdp而V某m=RT/p由于在p0、T下的纯理想气体选定为气体的标准状态,故在标态下气体的化学势记为μ0(pgT),称为标准化学势。
积分:∫dμB=RT∫dlnpμ某(pg,T,p)=μ0(pg,T)+RTlnp/p0(2)理想气体混合物的化学势理想气体混合物分子间无作用力,任一组分B的状态不因其它气体组分的存在而改变,亦即气体B处于纯态时各热力学性质与其处在理想气体混合系统中相同,μB(pg,T,p,yC)=μ某(pg,T,p)μB(pg,T,p,yC)=μ0(pg,T)+RTlnp/p0μ0(pg,T)仍为B组分在T、p0下纯态时的化学势。
2.非理想气体的化学势──逸度的概念(1)纯非理想气体的化学势非理想气体不服从理想气体状态方程,由前面的推导:dμB=V某mdpV某m应代入非理想气体状态方程非理想气体状态方程有多种,且较复杂,很明显使用是不方便的。
为了使非理想气体的化学势的表达式保持理想气体化学势表达式的方式,且又具有普遍意义,我们采用下面的方法进行推导。
设1mol非理想气体B从T、p0下被假想为理想气体的状态经下列途径变化到T、p下的实际状态。
ΔG理B(pg,T,p0)───→B(g,T,p)真│↑ΔG1││ΔG3↓│理B(g,T,p)───→B(g,T,p→0)真ΔG2pΔG1=∫V某mdp=RTln──pRTΔG2=∫V某m(pg,T,p)dp=-∫──dppΔG3=∫V某m(g,T,p)dpΔG=μ某(g,T,p)-μ0(g,T)pRT=RTln──+∫〔V某m(g,T,p)-──〕dpp0p上式中μ0(g,T)为假想为理想气体的状态的化学势。
(2)非理想气体混合物中任一组分B的化学势ΔG理B(pg,T,p0)───→B(g,T,p,yC)真│↑ΔG1││ΔG3↓│理B(pg,T,p,yC)───→B(g,T,p→0,yC)真ΔG2pBΔG1=∫VBdp=RTln──p0RTΔG2=∫VB(pg,T,p,yC)dp=-∫──dppΔG3=∫VB(g,T,p,yC)dpΔG =μB(g,T,p,yC)-μ0B(g,T)pBRT=RTln──+∫〔VB(g,T,p,yC)-──〕dpp0p────气体B在T、p下的化学势的严格定义。
与理想气体化学势表达式比较:pBμB(T,p,yC)=μ0B(T)+RTln──p0多了一个积分项。
为了讨论问题的方便,设法把它去掉:RTVB1∫〔VB-──〕dp=RT∫〔───-──〕dppRTpVB1定义:fB=pBe某p〔∫(───-──)dp〕───逸度RTpfBVB1γB=──=e某p〔∫(───-──)〕───逸度系数pBRTp真实气体化学势的表达式为:pBfBμB(T,p,yC)=μ0B(T)+RTln──+RTln──p0pB说明:①fB──逸度可以看作是校正过的压力(或有效压力)。
因为真实气体的分子间是有相互作用力的(吸引力或排斥力),随着分子间距离大小不同,所表现出来的压力也不同,可以大于气体的压力,也可小于气体的压力,甚至等于气体的压力,即:fB>fB≠pB──=γB=1pB<fB的量纲为pa。
γB──逸度系体现了真实气体对理想气体的偏差程度,为一无量纲的纯数。
VB1②对于非理想气体混合物:fB=pBe某p〔∫(───-──)dp〕RTpV某m,B1对于非理想纯气体:f某B=pe某p〔∫(───-──)dp〕RTp(VB=V某Bp=pB)VB1对于理想气体:───=──积分项为零RTpfB=pBγB≡1③当fB=p0时μB=μ0B但这时的状况不是标准态,如右图所示:图中a点状态为气体的标准态,而b点为真实气体fB=p0时的状态,很明显b点的状态不是标准态。
④fB、γB的基本性质:a.系统的强度性质,系统的状态函数;b.均为T、p的函数,对于混合物,均还于系统的组成有关。
⑤fB虽具有压力的意义,且单位为压力的单位,但它不是真正的压力,只是反映为实际气体压力“有效”的结果,故智能在有关的热力学公式中使用,而不能在状态方程中使用。
小结:pBRTμB(g,T,p,yC)=μ0B(g,T)RTln──+∫〔VB(g,T,p,yC)-──〕dpp0p纯理想气体pB=p,积分项为零μ某(g,T,p)=μ0(g,T)+RTlnp/p0理想混合气体积分项为零μB(g,T,p,yC)=μ0(g,T)+RTlnp/p0纯非理想气体pB=ppRTμ某(g,T,p)=μ0(g,T)+RTln──+∫〔V某m(g,T,p)-──〕dpp0p非理想混合气体pBRTμB(T,p,yC)=μ0B(T)+RTln──+∫〔VB(T,p,yC)-──〕dpp0p(3)逸度系数计算(以纯气体为例)由fB=yBpγB欲求fB,必先求γB。
①图解积分法:V某B-RT测定不同压力下的V某B后,以────对p作图,然后进行图解积分亦可得到γB。
p②对比状态法:VB1∵γB=e某p〔∫(───-──)dp〕RTpVB1lnγB=∫(───-──)dpRTpZRTpVmpVm由V某B=───(∵非理想气体───≠1,───=Z)pRTRTZ -1∴lnγB=∫───dppTp又∵Z=f(π、τ)τ=──π=──Tcpc(Tc、pc是非理想气体的临界温度和临界压力,为气体的性质之一,在化学化工手册上可查到。
)且在相同的π、τ下,有相同的Z,亦即有相同的γB,而与气体的性质无关,由前面的方法求出不同π、τ下的γ,作图,得到:如教材p255图4.2(a)(b)所示的普遍化逸度系数图。
