《物理化学》复习题
202101003《物理化学》复习题

一、单项选择题1、热力学第一定律△U=Q+W只适用于()A.单纯状态变化B.相变化C.化学变化D.封闭物系的任何变化2、下面性质中是强度性质的是()A.CB.UC.SD.T3、第一类永动机不能制造成功的原因是()A.能量不能创造也不能消灭B.实际过程中功的损失无法避免C.能量传递的形式只有热和功D.热不能全部转换成功4、下列参数中不是状态函数的是()A.焓B.内能C.功D.体积5、在一定温度下,一定量理想气体的体积与其压力成()A.正比关系B.反比关系C.对数关系D.指数关系6、下列哪个封闭体系的内能和焓仅是温度的函数()A.理想溶液B.稀溶液C.所有气体D.理想气体7、在一定温度下,发生变化的孤立体系,其总熵()A.不变B.可能增大或减小C.总是减小D.总是增大8、下列气体溶于水溶剂中,哪个气体不能用亨利定律?()A.N2B.O2C.NO2D.CO9、已知反应3O2(g) = 2O3(g),在25△时Δr Hθm= -280J/mol,则对该反应有利的条件是()A.升温升压B.升温降压C.降温升压D.降温降压10、拉乌尔定律适用于()A.非理想溶液中的溶剂B.稀溶液中的溶质C.稀溶液中的溶剂D.稀溶液中的溶剂及溶质11、已知反应2NH3 = N2 + 3H2,在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N2 + 3/2 H2 = NH3的标准平衡常数为()A.4B.0.5C.2D.112、由CaCO3(s), CaO(s), BaCO3(s), BaO(s)及CO2(s)构成的平衡体系其自由度为()A.0 个B.1 个C.2 个D.3 个13、区别单相系统和多相系统的主要根据是()A.化学性质是否相同B.物理性质是否相同C.物质组成是否相同D.物理性质和化学性质是否都相同14、如果只考虑温度和压力的影响, 纯物质最多可共存的相有()A.1B.2C.3D.415、无限稀薄的KCl 溶液中,Cl-离子的迁移数为0.505,该溶液中K+离子的迁移数为()A.0.505B.0.495C. 67.5D.64.316、下列电池中,那一个的电池反应为H++OH-=H2O()A.(Pt)H2|H+(aq)||OH-|O2(Pt)B.(Pt)H2|NaOH(aq)|O2(Pt)C.(Pt)H2|NaOH(aq)||HCl(aq)|H2(Pt)D.(Pt)H2(p1)|H2O(l)|H2(p2)(Pt)17、离子独立运动定律适用于()A.强电解质溶液B.弱电解质溶液C.无限稀电解质溶液D.理想稀溶液18、表面活性剂是针对某种特定的液体或溶液而言的,表面活性剂的实质性作用是()A.乳化作用B.增溶作用C.降低表面张力D.增加表面张力19、物理吸附与化学吸附的根本区别在于()A.吸附力不同B.吸附速度不同C.吸附热不同D.吸附层不同20、质量作用定律适用于()A.对峙反应B.平行反应C.连串反应D.基元反应21、表面活性剂具有增溶作用是因为其()A.能降低溶液的表面张力B.具有乳化作用C.在溶液中形成胶束D.具有润湿作用22、有一真空钢筒,将阀门打开,大气冲入瓶内,此时瓶内气体的温度将()A.不变B.升高C.降低D.无法判断23、亥姆霍兹能判据应用的条件是()A.等温等压且非体积功为零的可逆过程B.可逆绝热过程C.等温等容且非体积功为零的过程D.等温等压且非体积功为零的过程24、已知反应2NH3=N2+3H2,在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应1/2N2 + 3/2 H2=NH3的标准常数为( )A.1B.2C.3D.425、雾属于分散系统,其分散介质是()A.液体B.气体C.固体D.气体或固体26、重结晶制取纯盐的过程中,析出NaCl固体化学势与母液中NaCl化学势比较,高低如何()A.高B.低C.相等D.不可比较27、对溶液内任一组分的偏摩尔体积的理解,正确的是()A.不可能是负值B.总是正值C.可能是正值,也可能是负值D.必然和纯组分的摩尔体积相等28、对于一定温度和压力下的化学反应,能用以判断其反应方向的是()A. Δr GθmB. KθC. Δr G mD. Δr H m29、下某一反应在有限时间内可反应完全,所需时间为co/k,该反应级数为()A.零级B.一级C.二级D.三级30、在一个密闭容器中,有大小不同的两个水珠,长期放置后会发生()A.大水珠变大,小水珠变小B.大水珠、小水珠均变大C.大水珠变小,小水珠变大D.大水珠、小水珠均变小31、对于理想气体间的反应,下列表示的平衡常数中,其值与温度和压力皆有关系的是()A.KnB.KcC.KpD.Kx32、对于三组分系统,在相图中实际可能的最大自由度数f 是()A 1 个 B.2 个 C.3 个 D.4 个33、对于一定温度和压力下的化学反应,能用以判断其反应方向的是()A. Δr GθmB. KθC. Δr G mD. Δr H m34、正常沸点时,液体蒸发为气体的过程中()A.△S=0B.△G=0C.△H=0D.△U=035、用补偿法测定可逆电池的电动势时,主要为了()A.简便易行B.减少标准电池的损耗C.消除电极上的副反应D.在可逆情况下测定电池电动势36、一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在洞外面以堵漏,为了延长铁箱的寿命,选用哪种金属片为好?()A.铜片B.铁片C.镀锡铁片D.锌片37、当电池的电压小于它的开路电动势时,则表示电池在()A.放电B.充电C.没有工作D.交替地充放电38、弯曲液面(非平面)所产生的附加压力()A.一定等于零B.一定不等于零C.一定大于零D.一定小于零39、表面活性剂是()A.能降低溶液表面张力的物质B.能增加溶液表面张力的物质C.溶入少量就能显著降低溶液表面张力的物质D.溶入少量就能显著增加溶液表面张力的物质40、温度对反应速率的影响很大, 温度变化主要改变()A.活化能B.指前因子C.物质浓度或分压D.速率常数41、焓是系统的状态函数,H=U+PV,若系统发生状态变化时,△H=U+△(PV),式中△(PV)指的是()A.P△VB.V△PC.P2V2-P1V1D.P△V-V△P42、在等温下,同组成的两个大小不同的液滴的饱和蒸气压p1(大液滴)和p2(小液滴)存在()A.P1<P2B.Pl>P2C.P1=P2D.不能确定43、影响化学反应标准平衡常数的因素是()A.浓度B.浓度单位C.催化剂D.温度44、通常称为表面活性物质的就是指当其加入于液体中后()A.能降低液体表面张力B.能增大液体表面张力C.不影响液体表面张力D.能显著降低液体表面张力45、区别单相系统和多相系统的主要根据是()A.化学性质是否相同B.物理性质是否相同C.物质组成是否相同D.物理性质和化学性质是否都相同46、NaCl(s),NaCl水溶液及水蒸汽平衡共存时,系统的自由度()A.0B.1C.2D.347、电池的书写方式Zn(s)|ZnCl2(c1)||CuSO4(c2)|Cu(s)指出该电池反应中的正极是()A.ZnB.ZnCl2C.CuSO4D.Cu48、烟属于分散系统,其分散介质是()A.液体B.气体C.固体D.气体或固体49、物理吸附与化学吸附的根本区别在于()A.吸附力不同B.吸附速度不同C.吸附热不同D.吸附层不同50、下列电池中,那一个的电池反应为H++OH-=H2O()A.(Pt)H2|H+(aq)||OH-|O2(Pt)B.(Pt)H2|NaOH(aq)|O2(Pt)C.(Pt)H2|NaOH(aq)||HCl(aq)|H2(Pt)D.(Pt)H2(p1)|H2O(l)|H2(p2)(Pt)51、无限稀薄的KCl溶液中,Cl-离子的迁移数为0.505,该溶液中K+离子的迁移数为()A.0.505B.0.495C.67.5D.64.352、已知某化学反应速率常数的单位是mol/(m3·s),则该化学反应的级数为()A.零级B.一级C.二级D.不能确定53、氢气进行不可逆循环()A.△U>0B.△S=0C.△S>0D.△S<054、体系中含有H2O、H2SO4·4H2O、H2SO4·2H2O、H2SO4·H2O、H2SO4,其组分数()A.1B.2C.3D.455、对任一过程,与反应途径无关的是()A.体系的内能变化B.体系对外作的功C.体系得到的功D.体系吸收的热56、物质A与B可形成低共沸混合物E,已知纯A的沸点小于纯B的沸点,若将任意比例的A+B混合在一个精馏塔中精馏,则塔顶的馏出物是()A.纯AB.纯BC.低共沸混合物D.都有可能57、在一定外压下,多组分体系的沸点()A.有恒定值B.随组分而变化C.随浓度而变化D.随组分及浓度而变化58、压力升高时,单组份体系的沸点将()A.升高B.降低C.不变D.不一定59、进行水蒸气蒸馏的必要条件是()A.两种液体互不相容B.两种液体蒸汽压都较大C.外压小于101kPaD.两种液体的沸点相近60、液体在毛细管中上升或下降,主要与下列哪个因素有关()A.表面张力B.附加压力C.液体是否润湿毛细管D.毛细管半径61、下列过程中,系统内能变化不为零的是()A.不可逆循环过程B.可逆循环过程C.两种理想气体的混合过程D.纯液体的真空蒸发过程62、体系的状态改变了,其内能值()A.必定改变B.必定不变C.不一定改变D.状态与内能无关63、下述说法何者正确()A.水的生成热即是氧气的燃烧热B.水蒸汽的生成热即是氧气的燃烧热C.水的生成热即是氢气的燃烧热D.水蒸汽的生成热即是氢气的燃烧热64、氢气和氧气在绝热钢瓶中生成水()A.△S=0B.△G=0C.△H=0D.△U=065、非理想气体进行绝热自由膨胀时,下述答案中哪一个错误()A.Q = 0B.W = 0C.△U = 0D.△H = 066、有一真空钢筒,将阀门打开,大气冲入瓶内,此时瓶内气体的温度将()A.不变B.升高C.降低D.无法判断67、263K 的过冷水凝结成263K 的冰,则()A.△S<0B.△S=0C.△S>0D.无法确定68、关于纯物质标准状态,下列说法不正确的是()A.纯理想气体的标准状态就是标准压力P(100KPa)下的状态B.纯液体物质的标准状态就是标准压力P(100KPa)下的纯液体C.纯固体物质的标准状态就是标准压力P(100KPa)下的纯固体D.不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同69、定义偏摩尔量时,规定的条件是()A.等温等压B.等熵等压C.等温,溶液浓度不变D.等温等压,溶液浓度不变70、要使一个化学反应系统在发生反应后焓值不变,必须满足的条件是()A.温度和内能都不变B.内能和体积都不变C.孤立系统D.内能、压力与体积的乘积都不变答案:1~5:DDACB 6~10:DDCCC 11~15:CADCB 16~20:CCCDD 21~25:CBCBB 26~30:CCCAA 31~35:DCCBD 36~40:CABCD 41~45:CADDD 46~50:BDCDC 51~55:BADBA 56~60:CDAAD 61~65:DCCDD 66~70:AADDD二、判断题1、热可以自发的从低温物体传给高温物体。
物理化学复习题

物理化学复习题物理化学复习题⼀、填空题1.1mol的某理想⽓体,从体积为V1的始态分别经绝热可逆膨胀过程和恒压膨胀过程到同⼀终态p2、V2、T2。
则从数值上W(绝热)W(恒压),Q(绝热)Q(恒压)。
2.当体系状态改变后,状态函数________改变(填⼀定或不⼀定),反之,状态函数改变后,体系状态_______改变(填⼀定或不⼀定)。
3.可逆循环的热温商之和等于,在⼯作于温度为T1和T2之间的所有热机中,只有热机的效率最⾼。
4.若反应A(g) + 1/2B(g) = C(g)+1/2D(g)的K pθ=100,Δr G θ=50kJ mol-1,则相同温度下反应2A(g) + B(g) = 2C(g)+ m D(g)的K pθ= ,Δr G mθ= 。
5.⽓体经节流膨胀过程后,ΔH 0,Q 0,节流膨胀后,若体系的温度升⾼,则焦⽿-汤姆逊系数µ0。
6.对单组分相图, 最多相数为;最⼤的⾃由度数为 ,它们分别是等强度变量。
7.将⼀定量NaCl(s)溶于⽔中形成不饱和溶液,假设NaCl完全电离,H2O(l) 可建⽴电离平衡,离⼦⽆⽔合反应,则系统的S =______;R =______;R′=______;C =______; =______;f =______。
1、>,<;2、不⼀定,⼀定;3、0,可逆;4、10000,100kJ ?mol -1;5、=,=,<;6、3,2,温度、压⼒;7、5,1,2,2,1,3。
⼆、选择题1. 下列公式中只适⽤于理想⽓体的是( )A. ΔU=Q VB. W=nRTln(p 2/p 1) C. ΔU=dT C m ,V T T 21? D. ΔH=ΔU+p ΔV2. ΔH 是体系的什么( )A. 反应热B. 吸收的热量C. 焓的变化D.⽣成热3. 固态的NH 4HS 放⼊⼀抽空的容器中,并达到化学平衡,其组分数、独⽴组分数、相数及⾃由度分别是( )A. 1,1,1,2B. 1,1,3,0C. 3,1,2,1D.3,2,2,24. 下列各量称做化学势的是( )A.i j n ,V ,S i )n (≠?µ? B. i j n ,V ,T i )n p (≠?? C. i j n ,p ,T i )n (≠?µ? D. i j n ,V ,S i )n U (≠??5. A 和B 能形成理想溶液。
傅献彩物理化学复习题答案

傅献彩物理化学复习题答案一、选择题1. 热力学第一定律表明,能量守恒。
以下哪项描述是正确的?A. 能量可以被创造或销毁B. 能量可以在不同形式间转换,但总量保持不变C. 能量只能从一种形式转换到另一种形式D. 能量在封闭系统中可以减少答案:B2. 根据理想气体状态方程 PV = nRT,当温度和体积保持不变时,压力和气体的摩尔数成正比。
以下哪个选项是错误的?A. 压力增加,摩尔数也增加B. 压力减少,摩尔数也减少C. 压力保持不变,摩尔数也保持不变D. 压力与摩尔数成正比答案:B二、填空题1. 热力学第二定律表明,热不能自发地从低温物体传向高温物体。
______答案:熵增加原理2. 化学平衡常数 K 是在一定温度下,反应物和生成物浓度的比值。
如果反应是可逆的,那么在平衡状态下,正反应速率等于______。
答案:逆反应速率三、简答题1. 解释什么是吉布斯自由能(Gibbs Free Energy)以及它在化学反应中的应用。
答案:吉布斯自由能是一个热力学函数,用于描述在恒温恒压条件下,系统进行非体积功(如化学反应)时的能量变化。
它定义为 G =H - TS,其中 H 是焓,T 是温度,S 是熵。
吉布斯自由能的变化(ΔG)可以判断一个反应是否自发进行。
如果ΔG < 0,则反应自发;如果ΔG > 0,则反应非自发;如果ΔG = 0,则系统处于平衡状态。
2. 描述范特霍夫方程及其在化学平衡中的应用。
答案:范特霍夫方程是描述在恒压条件下,温度变化对化学平衡常数影响的方程,形式为 ln(K2/K1) = -ΔH°/R * (1/T2 - 1/T1)。
其中 K1 和 K2 分别是在温度 T1 和 T2 下的平衡常数,ΔH° 是反应的标准焓变,R 是气体常数。
通过这个方程,我们可以预测在不同温度下反应的平衡位置。
四、计算题1. 假设一个理想气体在等压过程中从状态 A (P1, V1, T1) 变化到状态 B (P2, V2, T2)。
《物理化学》全册复习题(答案)

△rHm°(298K)为 1.9 kJ/mol;CO2(g)的标准摩尔生成热△rHm°(298K) 为 -393.4 kJ/mol。
8.在298K时反应N2O4(g)=2NO2
(g)的K°=0.1132,当p(N2O4)=
p(NO2)=1kPa时反应将向_左_移动。当p(N2O4)=10kPa, p(NO2)=1kPa
导率:
A.0.277×10-2S·m2·mol-1; B.2.721×10 -2 S·m2·mol -1 ;C. 2.253×10-
2S·m2·mol-1;
D.0.225×10-2S·m2·mol-1;
39.无限稀释的KCl溶液中,Cl-离子的迁移数为0.505,该溶液中K+离子的迁
移数为:
A. 0.505 ; B. 0.495; C.67.5; D. 64.3 。
《物理化学》复习题
一、选择题:
1.体系的状态改变了,其内能值( )
A 必定改变
B 必定不变
C 不一定改变
D
状态与内能无关
2.系统进行任一循环过程( )
A. G=0
B. ΔS=0 C. Q=0 D. μ=0
3.在一定温度下,发生变化的孤立系统,其总熵 ( )
A. 不变
B. 可能增大或减小 C. 总是减小 D. 总是增大
40. 有关活化能的下列说法正确的是:( )A、活化能与反应本性有
关 B、活化能与反应温度完全无关
C、活化能与反应途径无关
D、活化能与反应物浓度有关
41. 在相同温度下,同一液体被分散成具有不同曲率半径的分散体系时,
将具有不
面液体上的饱和蒸气压,则三者的关系是
时,反应将向_右_移动。
物理化学复习题目(含答案)
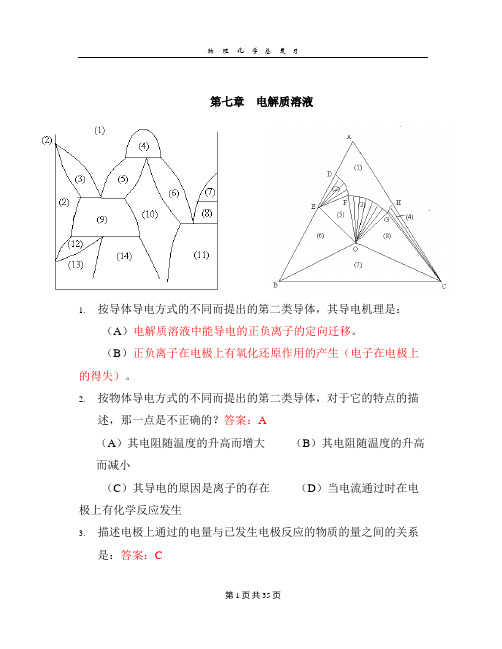
第七章电解质溶液1. 按导体导电方式的不同而提出的第二类导体,其导电机理是:(A)电解质溶液中能导电的正负离子的定向迁移。
(B)正负离子在电极上有氧化还原作用的产生(电子在电极上的得失)。
2. 按物体导电方式的不同而提出的第二类导体,对于它的特点的描述,那一点是不正确的?答案:A(A)其电阻随温度的升高而增大(B)其电阻随温度的升高而减小(C)其导电的原因是离子的存在(D)当电流通过时在电极上有化学反应发生3. 描述电极上通过的电量与已发生电极反应的物质的量之间的关系是:答案:C(A ) 欧姆定律 (B ) 离子独立移动定律 (C ) 法拉第定律 (D ) 能斯特定律4.0.1mol.kg -1的Na 3PO 4水溶液的离子强度是: 210.62i i I m Z ==∑ ;0.001m 的36K [Fe(CN)]的水溶液的离子强度是:210.0062i i I m Z ==∑。
5.用同一电导池分别测定浓度为0.01mol.dm -3和0.10.01mol.dm -3的同种电解质溶液,其电阻分别为1000Ω和500Ω,则它们的摩尔电导之比为:答案:B(A ) 1:5 (B ) 5:1 (C ) 1:20 (D ) 20:11222115:1R c R c λλ== 6.在25℃无限稀释的水溶液中,离子摩尔电导最大的是:答案:D (A ) La 3+ (B ) Mg 2+ (C ) NH +4(D ) H +7.电解质溶液的摩尔电导可以看作是正负离子的摩尔电导之和,这一规律只适用于:(A ) 强电解质 (B ) 弱电解质 (C ) 无限稀溶液 (D ) m =1的溶液 答案:C8.科尔劳施定律认为电解质溶液的摩尔电导与其浓度成线性关系为)c 1(m m β-λ=λ∞。
这一规律适用于:答案:B(A ) 弱电解质 (B ) 强电解质的稀溶液 (C ) 无限稀溶液 (D )m =1的溶液9.0.1m 的CaCl 2水溶液其平均活度系数±γ=0.219,则离子平均活度为:答案:B(A ) 3.476×10-3 (B ) 3.476×10-2 (C ) 6.964×10-2 (D ) 1.385×10-210.在HAc 电离常数测定的实验中,直接测定的物理量是不同浓度的HAc 溶液的:(A ) 电导率 (B ) 电阻 (C ) 摩尔电导 (D ) 电离度 答案:B11.对于0.002m 的Na 2SO 4溶液,其平均质量摩尔浓度±m 是:334 3.17510m m -±==⨯。
物理化学复习题

物理化学复习题一、判断下列说法是否正确(不必改正)1.系统和环境之间的界面一定是真实的。
()2.功可以全部转化为热,但热全部转化为功而不引起其它任何变化是不可能的。
()3.某系统从状态A经不可逆过程到状态B,再经可逆过程回复到状态A,则系统的ΔU、ΔH、ΔS、ΔA、ΔG、Q、W均为零。
()4.理想气体由p1、V1、T1膨胀至p2、V2、T2(V2>V1,T2≠T1,p2≠p1),则沿可逆途径的熵变最大。
()5.卡诺热机的效率与两热源的温度及工作物质有关。
()6.-2℃、100kpa的过冷水在该条件下凝结为冰,系统的熵变小于零,因此该过程不能自动发生。
()7.金属和电解质溶液都是靠自由电子来导电的。
()8.二组分系统最多可有四相共存达平衡。
()9.恒温下电解质溶液的浓度增大时,其摩尔电导率总是减小的。
()10.对于基元反应,几分子反应就是几级反应。
()11.状态函数的改变量只与系统的始态、末态有关,与变化的具体历程无关。
()12.在没有相变化和化学变化的情况下,理想气体的内能只是温度的函数。
()13.一切绝热过程的熵变均等于零。
()14.只有广延量才有偏摩尔量,强度量不存在偏摩尔量。
()15.化学平衡发生移动,化学反应的平衡常数必然发生变化。
()16.任意可逆循环过程的热温熵之和等于零。
()17.压力、惰性气体等因素均能改变标准平衡常数。
()18.系统的组分数等于物种数。
()19.电池反应的可逆热,就是该反应的恒压反应热。
()20.阿累尼乌斯活化能等于活化分子平均能量与普通分子平均能量之差。
()21.节流膨胀过程是等焓过程。
()22.质量作用定律对基元反应和复杂反应都适用。
()23.对两种不同液体来说,曲率半径相同时,曲面下的附加压力与表面张力成反比。
()24.朗格缪尔吸附等温式适合于单分子层吸附。
()25.吸附平衡即是固体表面不能再吸附气体分子,而被吸附的气体分子也不再脱附。
()26.金属和电解质溶液都是靠自由电子来导电的。
《物理化学》复习题及答案

《物理化学》复习题一.填空和选择题:1、内能是系统的状态函数,若某一系统从一始态出发经一循环过程又回到始态,则系统(Q+W)的变化是:2)(Q+W)>0;(3)(Q+W)<0;(4)不能确定2、焓是系统的状态函数,H=U+PV,若系统发生状态变化时,ΔH=ΔU+Δ(PV),式中Δ(PV)的意思是:(1)P ΔV(3)PΔV- VΔP;4、100℃,101 325 Pa的液态H2O的化学势为μl,100℃,101 325 Pa的气态H2O的化学势为μg ,二者的关系是:: (1)μl>μg;(2)μl<μg5、系统经历一个绝热可逆过程,其熵变ΔS:(1)>0;(2)<0 ;(4)不能确定6、系统经过某过程后,其焓变ΔH=Qp,则该过程是:(1)理想气体任意过程;(3)理想气体等压过程;(4)真实气体等压过程。
7、下列说法正确的是:(1)放热反应均是自发反应;(2)ΔS为正值的反应均是自发反应;(3)摩尔数增加的反应,ΔS8、下述表达不正确的是:(1)能斯特方程适用于可逆电池;(2)能斯特方程不适用于同样计划存在的电池;(3)9、Qv=ΔU,Qp=ΔH的的适用条件条件是封闭体系、非体积功为零、恒容(恒压)。
10、隔离系统中进行的可逆过程ΔS =0 ;进行不可逆过程的ΔS >0 。
11、化学反应是沿着化学势降低的方向进行。
10、在298K和100kPa下,反应3C(s)+O2(g)+3H2(g) →CH3COOCH3(l) 的等压热效应Q p与等容热效应Q v之差为(Q p=Q v + nRT )A、9911 J·mol-1B、-9911 J·mol-1 C、14866 J·mol-1D、7433 J·mol-112. 把玻璃毛细管插入水中,凹面的液体所受的压力P与平面液体所受的压力P0相比:(1)P= P0)P> P0(4)不确定13、系统经过某过程后,其焓变ΔH=Qp,则该过程是:A、理想气体任意过程;C、理想气体等压过程;D、真实气体等压过程。
物理化学复习题

物理化学复习、练习题选择题部分:电化学1、下列关于电解质溶液导电能力的叙述不正确的是:(a )随离子浓度(从零开始)增大先增大后减小(b )与离子大小成正比(c )与离子运动速度成正比(d )与离子电荷成正比2、描述电极上通过的电量与已发生电极反应的物质的量之间的关系的是:(a )欧姆定律 (b )离子独立运动定律(c )法拉第定律 (d )能斯特定律3、下列化合物的极限摩尔电导率能从摩尔电导率对 m 1/2作图外推到m =0 时而求得的是:(a )CH 3COOH (b )HCOOH(c )CH 3COONa (d )NH 4OH4、用电导仪测未知溶液的电导,将一定浓度的标准KCl 溶液注入电导池中进行测定,其目的是:(a )做空白试验 (b )校正零点(c )求电导池常数 (d )作工作曲线5、醋酸的极限摩尔电导率数值是根据下列何种方法得到的:(a )D-H 极限公式 (b )Kohlrausch 经验公式外推值(c )离子独立运动定律 (d )实验直接测得6、(1) Zn |ZnSO 4(a 1) CuSO 4(a 2)|Cu(2) Pt |H 2(p )|HCl (m)|A gCl |A g(3) Pt |H 2 (p )|HCl (m)|H 2(2p)|Pt(4) Pt |H 2(p )|HCl (a 1) HCl (a 2)|H 2 (p ) |Pt 。
上述电池中,属于浓差电池的是:(a )(1)(2) (b )(3)(4)(c )(2)(3) (d )(1)(4)7、电解下列四种物质水溶液,哪个产物与众不同:(a )H 2SO 4水溶液 (b )NaOH 水溶液(c )HCl 水溶液 (d )KOH 水溶液8、在一定温度下稀释电解质溶液,电导率 和摩尔电导率 m 将怎样变化?(a ) 增大, m 减小 (b ) 增大, m 增大(c ) 变化不一定, m 增大 (d ) 先增后减, m 增大9、下列关于摩尔电导率的说法,哪个是最为正确的 :(a )摩尔电导率是在两电极之间放入含1mol 电荷的电解质溶液的电导率(b )摩尔电导率就是1m 3溶液中含1mol 电解质溶液的电导率(c )根据m Λ=κ/c ,说明m Λ与c 成反比,溶液的浓度愈小,摩尔电导率愈大(d )引进摩尔电导率概念的最大好处是排除了离子多少对溶液导电能力的影响10、在浓度为m 的FeCl 3溶液中,FeCl 3的活度a 为:)2(m/m )2 (b)4γ±(m/m )(a)(γ±)4(m/m )4 (d)27(γ±)4 (m/m )4(c)9(γ±11、就如图所示的电池,下列说法中正确的是:(a)该电池由Cu│Cu2+电极和Zn│Zn2+电极组成(b)该电池由Cu电极和Zn电极及电解质溶液组成(c)该电池阴极反应为Zn→Zn2+ +2e-(d)该电池的符号是Zn | Zn SO4(a1)│Cu SO4 (a2)|Cu12、能测定水的离子积K W (反应:H2O=H++HO-)的电池是:(a)Pt | H2 | H2SO4(aq) | O2 |Pt (b)Pt | H2| H+ OH- | H2 | Pt(c)Pt | H2 | NaOH(aq) | O2 | Pt (d)Pt | H2O | NaOH(aq) | O2| Pt13、反应3Cu2++2Fe →2Fe3++3Cu,所对应的电池表示应为:(a)Fe(s)|FeCl3(m1)‖CuSO4(m2)|Cu(s)(b)Cu(s)|CuSO4 (m2)‖FeCl3 (m1)|Fe(s)(c)Cu(s)|FeCl3 (m2)‖CuSO4 (m1)|Fe(s)(d)2Fe(s)|2FeCl3 (m1)‖3CuSO4 (m2)|3Fe(s)14、某电池在等温和标准压力下的可逆放电过程中Q r=-100J,则焓变(a)ΔH=100 J (b)ΔH=0(c)ΔH>-100 J (d)ΔH<-100 J15、对于电池Pt│H2(p∃)│NaOH(0.01 mol·kg-1)│O2(p∃)│Pt其电极电位和电池电动势可表示为:(1) E= E∃ (O2/OH-) - (RT/F)ln[a(OH-)/a1/4(O2)](2) E左= E∃ (H2O/H2,OH-) - (RT/F)ln[a1/2(H2)·a(OH-)](3) E左= E∃ (H+/H2) - (RT/F)ln[a1/2(H2)/a(H+)](4) E = E右- E左上述表示中(a)(1) 的表示式不对(b)(2) 的表示式不对(c)(3) 的表示式不对(d)四种表示式都可以16、下图所示的极化曲线中,a,b,c,d所代表的极化曲线如表所示,其中正确的一组是:原电池电解池阴极(+) 阳极(-) 阴极阳极(a)abcd(b ) b a c d(c ) c d a b(d ) d c b a17、对于Tafel 公式的理解,错误的是:(a )Tafel 公式是电化学极化时,过电位与电流密度关系式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《物理化学》期末复习第一章热力学第一定律及其应用第二章热力学第二定律第三章多组分系统热力学第四章相平衡第五章化学平衡第六章电化学第七章表面现象第八章胶体分散系统第一章热力学第一定律及其应用(一)有关状态函数的概念第一章中提到的状态函数有:第二章中提到的状态函数有:1、若物系为1 mol 的物质,则下列各组哪一组所包含的量皆属状态函数?()A、U、Q p、C p、CB、Q V、H、C V、SC、△U、△H、Q p、Q VD、U、H、C p、G2、若物系为1 mol 的物质,则下列各组哪一组所包含的量皆属状态函数?()A、U、Q p、C p、CB、Q V、H、C V、CC、U、H、C p、C VD、△U、△H、Q p、Q V3、下列各量中,()是为零。
A、Δf Hθm(C,金刚石,298.15K,pθ)B、Δf Hθm(H2O,l,298.15K,pθ)C、Δf Hθm(N2,g,298.15K,pθ)D、Δf Hθm(N2,g,350K,pθ)4、下列各量中,()是为零。
A、Δf Hθm(C,石墨,298.15K,pθ)B、Δf Hθm(H2O,l,298.15K,pθ)C、Δf Hθm(I2,g,298.15K,pθ)D、Δf Hθm(N2,g,273.15K,pθ)5、热力学第一定律△U=Q+W的形式表达式时,其条件是( )A.任意系统工程B.隔离系统C.封闭系统D.敞开系统6..下列反应中,反应的标准摩尔焓变等于生成物的标准摩尔生成焓的是()。
A、CO2(g) + CaO(s) → CaCO3 (s)B、21H2(g) + 21I2(g) → HI(g)C、H2(g) + Cl2(g) →2HCl(g)D、H2(g) + 21O2(g) →H2O(g)7.、下列反应中,反应的Δr Hθm等于生成物的Δf Hθm的是()。
A、N2(g) + 3H2(g) 2NH3(g)B、Ag(s) + 21Cl2 (g) AgCl(s)C、21H2(g) + 21Br2 (g) →HBr(g)D、NH3(g) + 21Cl2(g) →NH4Cl (s)8、对状态函数的描述,()是不确切的?A、它是状态的单值函数,状态一定它就是具有唯一确定的值。
B、状态函数之改变只取决于过程的始终态,与过程进行的途径无关。
C、状态函数的组合仍然是状态函数D、热力学中很多状态函数的绝对值不能测定,但其在过程中的变化值确实可以直接或间接测定的。
9、热力学第一定律中的W是指()。
A、体积功B、非体积功C、各种形式功之和D、表面功10.它是热力学计算的基础,能使得热化学方程式可以像代数方程式那样进行运算的是()。
A、分配定律B、盖斯定律C、亨利定律D、拉乌尔定律11、已知若MgO(s)及SiO2(s)的生成焓Δf Hθm分别为-601.8kJ/mol及-910.9kJ/mol,则反应2MgO(s)+Si(s)→SiO2(s)+2Mg(s)的反应热为()。
A、292.7kJB、-292.7kJC、-309.1kD、309.1kJ12、若已知H2O(g)及CO(g)在298K时的标准生成焓Δf Hθm分别为-242kJ·mol1-及-111kJ·mol1-,则反应H2O(g)+C(s)→H2(g)+CO(g)的反应热为()。
A、-353kJB、-131kJC、131kJD、353kJ13.当热力学第一定律以pdV表示时,它适用于()A、理想气体的可逆过程B、封闭物系只作膨胀过程C、理想气体的等压过程D、封闭物系的等压过程14、物质中的元素C燃烧后的最终产物是;物质中的元素N燃烧后的最终产物是。
15、系统与环境之间没有物质的交换,但可以有能量的交换。
系统与环境之间没有物质的交换,也没有能量的交换。
16. Al2O3(s)在25℃和标准压力下的生成焓为-1676 kJ·mol1-, 其热化学方程式是()。
A、Al2O3 (s) → 2 Al (s) + 23O2 (g) Δr Hθm= 1676 kJ·mol1-B、2Al2O3 (s) → 4 Al (s) + 3 O2 (g) Δr Hθm= 3352 kJ·mol1-C、4 Al(s) + 3 O2(g) → 2Al2O3 (s) Δr Hθm=-1676 kJ·mol1-D、2 Al(s) + 23O2(g) → Al2O3 (s) Δr Hθm= -1676 kJ·mol1-17.Δr Hθm表示;Δr H m表示;Δf Hθm表示。
18、物质中的元素S燃烧后的最终产物是;物质中的元素H燃烧后的最终产物是。
19.Al2O3(s)在25℃和标准压力下的生成焓为-1676 k J·mol1-, 其热化学方程式为。
20、热力学规定稳定单质的熵值为零。
()21、热力学规定标准态下稳定单质的生成焓为零。
()22、任意循环过程:ΔU=0 ,ΔH=0 ,Q=0 ,W=0。
()23、凡是单质的标准生成焓都为零。
()24、因Q p=△H,Q v=△U所以Q p与O v都是状态函数。
( )25.循环过程中,状态函数的增量为零。
()26.状态函数之改变只取决于过程的始终态,与过程进行的途径无关。
()第二章热力学第二定律1.下列热力学状态函数中,其函数变化值不能用于判断任意过程的性质和方向的是()。
A、ΔHB、ΔSC、ΔA、D、ΔG2、在绝热密闭的耐压钢瓶中进行一化学反应,应采用()判据。
A、ΔS、B、ΔA、C、ΔGD、ΔH3、85℃、Pa 的1mol 水蒸汽在恒温恒压下变成85℃、Pa 的液体水,判断此过程应采用()判据。
A、ΔS、B、ΔA、C、ΔGD、ΔH4. dG =-SdT +Vdp适用的条件是A.理想气体B.等温等压下C.封闭物系D.除膨胀功外无其他封闭物系35.热力学有三个定律,请简述热力学每个定律主要研究和解决的是什么问题?6、Δr Gθm表示;Δr G m表示;Δf Gθm表示。
7、标准状态下的温度是____________K,标准压力是__________,标准浓度是__________。
8、熵是反映系统中质点运动的_____________的物理量,△G是判断的物理量。
9、凡是ΔG<0的过程一定是自发过程。
( )10、热力学第三定律认为在0 K时任何完整晶体的熵等于零。
()11、热力学第三定律认为在0 K时任何物质的熵等于零。
()12、可以根据Δr G m,T,P值大小来判断自发方向。
()13、可以根据Δr Gθm值大小来判断自发方向。
()14、可逆过程的熵变为零。
()15、不可逆过程的熵变为零。
()16、热力学有三个定律,请简述热力学每个定律主要研究和解决的是什么问题?第三章多组分系统热力学2、解释偏摩尔量的概念。
3.A物质在α相和β相的化学势分别为μαA和μβA,若发生A物质从α相自发地向β相迁移,下列正确的是()。
A、μαA=μβA;B、μαA>μβA;C、μαA<μβA;D、无法判断4.理想溶液中的任一组分在整个浓度范围内部都是服从()A、亨利定律B、拉乌尔定律C、分配定律D、盖斯定律5、溶剂服从拉乌尔定律及溶质服从亨利定律的二元溶液是()A、稀薄溶液B、理想液态混合物C、真实溶液D、真实液态混合物6、在273K 和101.325 kPa下,水的化学势μH2O(l)和水汽的化学势μH2O(g)的关系是()。
A.μH2O(l)=μH2O(g)B.μH2O(l)>μH2O(g)5C. μH 2O (l )<μH 2O (g )D. 无法知道7、下列偏导数中,下列偏导数中,既属于偏摩尔量,又属于化学势的是( )。
A 、)(,,,)(BC n p T n A C B ≠∂∂ B 、)(,,,)(B C n V S n U C B ≠∂∂ C 、)(,,,)(B C n V T n U C B ≠∂∂D 、)(,,,)(B C n p T n G C B ≠∂∂ 8、下列偏导数中,既不属于偏摩尔量,又不是属于化学势的是( )。
A 、)(,,,)(BC n p S n H C B ≠∂∂ B 、)(,,,)(B C n p T n G C B ≠∂∂C 、)(,,,)(B C n V T n U C B ≠∂∂D 、)(,,,)(B C n p T n AC B ≠∂∂ 9、P. 159 3-1(1)下列偏导数中:属于偏摩尔量的是 ;属于化学势的是 ,两者都不属于是10.偏摩尔量与化学势是同一个公式的两种不同表示方式。
( )11、在101.325 kPa 及374.2K 条件下,水的化学势为μ*(l )大于水蒸气的化学势 为μ*(g )。
( )12.在101.325 kPa 及−5℃条件下,水的化学势为μ*(l )大于冰的化学势为μ*(s )。
( )13、用相同量的萃取剂,分成多次萃取比一次萃取的效率高。
( )14 在一定温度下,在稀薄溶液中,溶剂A 的蒸汽压等于同温下纯溶剂的蒸汽压与溶液中溶质B 的摩尔分数的乘积。
( )15、理想溶液中的任一组分在整个浓度范围内部都是服从拉乌尔定律。
( )第四章相平衡1、水的三相点与水的冰点有何区别?2、在通常情况下,对于二组分系统能平衡共存的最多相为。
( )A 、1B 、2C 、3D 、43、在通常情况下,对于三组分系统能平衡共存的最多相为。
( )A 、5B 、3C 、6D 、44. 水煤气发生炉中共有C (s )、H 2O (g )、CO (g )、CO 2(g )及H 2(g )五种物质,其间能发生反应:CO 2(g )+C (s )==2CO (g ),H 2O (g )+C (s )==H 2(g )+CO (g ),CO 2(g )+H 2(g )==H 2O (g )+CO (g )在这样的平衡物系中,组分数为( )A 、5B 、4C 、3D 、25.在水相图上,当水处于( )时其液体密度和蒸汽的密度相等。
A 、恒沸点B 、冰点C 、临界点D 、三相点6、根据分配定律,若用50 mLCCl 4来萃取水中溶解的I 2则萃取效果最好的是( ).A、用50 mLCCl4萃取1次B、每次用25 mL CCl4,分2次萃取C、每次用10 mLCCl4,分5次萃取D、每次用5 mLCCl4,分10次萃取7、BaCO3(S)受热分解成BaO(S)和CO2(g),组分数K和自由度数f正确的是()A、K=3 f=2B、K=2 f=2C、K=2 f=1D、K=1 f=08、在抽空密闭容器中加热NH4Cl(s),有一部分分解成NH3(g)和HCl(g),当系统建立平衡时,其组分数K和自由度f是()A、K=1,f=1B、K=2,f=2C、K=3,f=3D、K=2,f=19、冰、水、水蒸气三相共存的平衡点称为点;该点的温度是K,压力为Pa。
