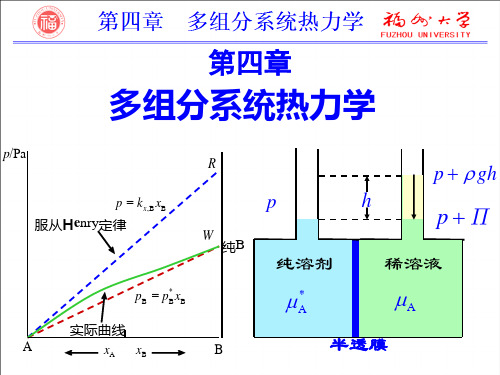
多相多组分系统热力学
第4章 多组分热力学

前面所讨论的是:单组分单相(两相)系统或多 组分组成恒定的系统。 但常见系统绝大部分是:多组分变组成系统。因 此必须研究处理多组分系统。
多组分系统除了两个变量之外,还需确定各组分 的物质的量才能确定系统的状态。 多组分系统分为:单相、多相
本章主要讨论多组分单相系统。
1
第四章 多组分系统热力学
B
dA SdT pdV BdnB
B
•适用条件 W ' 0 ,单相系统
31
2.多组分单相系统的热力学公式
•广义定义
B
U nB
S ,V ,nC
H nB
S , p,nC
A nB
T ,V ,nC
G nB
T , p,nC
保持特征变量和除B以外其它组分不变,某热力
学函数随其物质的量 nB的变化率称为化学势。
2 偏摩尔量相对于某一组分而言,本身是强度量;
3 偏摩尔量与浓度有关,与系统的总量无关。
4 偏摩尔量 X B ( nX,B )下T ,标p,n必C 须是
。T , p, nC
15
2.偏摩尔量
•偏摩尔量的物理意义
•两种理解 1 在恒温恒压下,于极大量的某恒定组成的系统中加
入1mol组分B时所引起系统广度量X的改变量。
混合物的摩尔体积:
Vm
xB M B /
B
Vm xBVB
B
21
5.吉布斯—杜亥姆方程
X
X
dX
( T
) p,nB
dT
(
p
)T ,nB
dp
B
X BdnB
•恒温恒压多组分系统
dX X BdnB
B
物理化学:第4章_多组分系统热力学_
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
多相多组分系统热力学--习题及答案

第二章 多相多组分系统热力学习题及答案§2. 1 均相多组分系统热力学(P68)1. 水溶液(1代表溶剂水,2代表溶质)的体积V 是质量摩尔浓度b 2的函数,若V = A +B b 2+C (b 2)2(1)试列式表示V 1和V 2与b 的关系; (2)说明A 、B 、A/n 1的物理意义; (3)溶液浓度增大时V 1和V 2将如何变化解:(1) 由b 2的定义“1kg 溶剂中所含溶质的物质的量”,因此本题中可视溶剂水为1kg ,从而认为将 b 2=n 2。
★112222,,,,2T P n T P n V V V B Cb n b ⎛⎫⎛⎫∂∂===+ ⎪ ⎪∂∂⎝⎭⎝⎭ 据偏摩尔量的集合公式V=n 1V 1+n 2V 2,★V 1 =2211()V n V n -=2211()V b V n - =22222211[A+Bb +C(b )-Bb -2C(b )]n =2211[A-C(b )]n = 2211A C (b )n n - (2)20lim b V A →=,故A 表示当b 2→0,纯溶剂的体积,即1kg 溶剂水的体积;220lim b V B →=,故B 表示当b 2→0,无限稀溶液中溶质的偏摩尔体积;2101lim b AV n →=,A/n 1表示溶剂水的摩尔体积。
(3)由以上V 1和V 2 的表达式可知,溶液浓度(b 2)增大时,V 2 增大,V 1减小。
2. 哪个偏微商既是化学势又是偏摩尔量哪些偏微商称为化学势但不是偏摩尔量答:化学势表达式: ,,c B B T P n G n μ⎛⎫∂= ⎪∂⎝⎭= ,,cB T V n F n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S P n H n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S V n U n ⎛⎫∂ ⎪∂⎝⎭偏摩尔量: ,,c B B T P n G G n ⎛⎫∂= ⎪∂⎝⎭,,,c B B T P n F F n ⎛⎫∂= ⎪∂⎝⎭,,,c B B T P n H H n ⎛⎫∂= ⎪∂⎝⎭,,,cBB T P n U U n ⎛⎫∂= ⎪∂⎝⎭ 可见,只有偏微商,,c B T P n G n ⎛⎫∂ ⎪∂⎝⎭既是化学势又是偏摩尔量,,,c B T V n F n ⎛⎫∂ ⎪∂⎝⎭、,,c B S P n H n ⎛⎫∂ ⎪∂⎝⎭、,,cB S V n U n ⎛⎫∂ ⎪∂⎝⎭称为化学势,但不是偏摩尔量。
第二章多相多组分系统热力学(2)

三、化学势
1. 化学势的定义
证明:
B
H nB
S , p,nc
U nB
S ,V ,nc
H U pV
dH dU pd分别代入,得
H
U
TdS Vdp
B
nB
dnB S , p,nc
TdS
pdV
B
nB
S ,V ,nc
dnB
dU
TdS pdV
B
U
nB
dnB S ,V ,nc
H
dH
TdS Vdp
B
nB
S , p,nc
dnB
G
dG SdT Vdp
B
nB
dnB T , p,nc
dF SdT pdV
B
F
nB
dnB T ,V ,nc
B组分的化学势B
,
三、化学势
1. 化学势的定义
dG
B
(dnB
)
β相:
dG
B
(dnB
)
dGT, p dG dG B dnB B (dnB )
(
B
B
)dnB
,
四、化学势判据及在相平衡和化学平衡系统中的应用
3. 化学势在相平衡系统中的应用
dGT, p (B B )dnB
①若上述过程是自发进行的
dGT, p (B B )dnB 0
三、化学势
1. 化学势的定义 单组分系统
均相多组分系统
U f (S,V ) H f (S, p) G f (T, p) F f (T,V )
U f (S,V , n1, n2,) H f (S, p, n1, n2,) G f (T , p, n1, n2,) F f (T ,V , n1, n2,)
物理化学 第四章 多组分系统热力学

Vm
T,p一定
V*m,C VC
V*m,B VB
d c· b·
0 B
a xC
C
图4.1.2 二组分液态混合物的 偏摩尔体积示意图
若B,C形成真实液态混合物: 则混合物体积为由V*m,B至V*m,C的曲线。对于任一 组成a时,两组分的偏摩尔体积可用下法表示: 过组成点a所对应的系统体积点d作Vm-xC曲线的 切线,此切线在左右两纵坐标上的截距即分别 为该组成下两组分的偏摩尔体积VB,VC。
B
系统中各广度量的偏摩尔量: 对于多组分系统中的组分B,有: 偏摩尔体积: VB=(ƽV/ƽnB)T,p,n C 偏摩尔热力学能: UB=(ƽU/ƽnB)T,p,n C 偏摩尔焓: HB=(ƽH/ƽnB)T,p,n C 偏摩尔熵: SB=(ƽS/ƽnB)T,p,n C 偏摩尔亥姆霍兹函数:AB=(ƽA/ƽnB)T,p,n C 偏摩尔吉布斯函数: GB=(ƽG/ƽnB)T,p,n
C
几点说明: (1)偏摩尔量为两个广度性质之比,所以为强度 性质; (2)偏摩尔量的定义中明确是在恒温、恒压及系 统组成不变的条件下,偏导数式的下标为T,p 时才是偏摩尔量; (3)同一物质在相同温度、压力但组成不同的多 组分均相系统中,偏摩尔量不同; (4)若系统为单组分系统,则该组分的偏摩尔量 与该组分的摩尔量相等,即: XB=X*B,m
C
=VB (数学知识:二阶偏导与求导的顺序无关) 得证。
4.2化学势 4.2化学势
1.化学势的定义 混合物(或溶液中)组分B的偏摩尔吉布斯函数GB 定义为B的化学势,用符号μB表示:
μB = GB=(ƽG/ƽnB)T,p,n
def
C
对于纯物质,其化学势等于它的摩尔吉布斯函 数。
物理化学第二章作业及答案

第二章多相多组分系统热力学2007-4-24§2.1 均相多组分系统热力学 练习1 水溶液(1代表溶剂水,2代表溶质)的体积V 是质量摩尔浓度b 2的函数,若 V = A +B b 2+C (b 2)2(1)试列式表示V 1和V 2与b 的关系;答: b2: 1kg 溶剂中含溶质的物质的量, b 2=n 2, 112222,,,,2T P n T P n V V V B cb n b ⎛⎫⎛⎫∂∂===+ ⎪ ⎪∂∂⎝⎭⎝⎭ ∵ V=n 1V 1+n 2V 2( 偏摩尔量的集合公式)∴ V 1=(1/n 1)(V-n 2V 2)= (1/n 1)( V-b 2V 2)= (1/n 1)(A+Bb 2+c(b 2)2-Bb 2-2cb 2)= (1/n 1)[A-c(b 2)2] (2)说明A ,B , A/n 1 的物理意义;由V = A +B b 2+C (b 2)2 , V=A;A: b 2→0, 纯溶剂的体积,即1kg 溶剂的体积B; V 2=B+2cb 2, b 2→0, 无限稀释溶液中溶质的偏摩尔体积A/n 1:V 1= (1/n 1)[A-c(b 2)2],∵b 2→0,V = A +B b 2+C (b 2)2, 纯溶剂的体积为A, ∴A/n 1 为溶剂的摩尔体积。
(3)溶液浓度增大时V 1和V 2将如何变化?由V 1,V 2 的表达式可知, b 2 增大,V 2 也增加,V 1降低。
2哪个偏微商既是化学势又是偏摩尔量?哪些偏微商称为化学势但不是偏摩尔量? 答: 偏摩尔量定义为,,c B B T P n Z Z n ⎛⎫∂= ⎪∂⎝⎭所以,,c B B T P n G G n ⎛⎫∂= ⎪∂⎝⎭ ,,c B B T P n H H n ⎛⎫∂= ⎪∂⎝⎭ ,,cBB T P n F F n ⎛⎫∂= ⎪∂⎝⎭ ,,cB B T P n U U n ⎛⎫∂= ⎪∂⎝⎭ 化学势定义为:,,c B B T P n G n μ⎛⎫∂=⎪∂⎝⎭= ,,c B T V n F n ⎛⎫∂ ⎪∂⎝⎭= ,,c B S V n U n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S P n H n ⎛⎫∂ ⎪∂⎝⎭ 可见,偏摩尔Gibbs 自由能既是偏摩尔量又是化学势。
化学势与热力学基本方程

dA dG d( pV ) SdT pdV
K i 1
idni
dH dG d(TS) TdS Vdp
K i 1
i
dni
dU dH d( pV ) TdS pdV
K i 1
idni
适用于组成可变的均相多组分系统, 并且不考虑除压力以外的其它广义力
A A(T , V , n1, n2 , , nK )
1
dn K ( ) ( )
i1 i
i
dH TdS Vdp
1
dn K ( ) ( )
i1
1
dn K ( ) ( )
i1 i
i
dG SdT Vdp
1
dn K ( ) ( )
i1 i
i
0 SdT Vdp
1
n d K ( ) ( )
Gi
dni
i
def
Gi
G ni
T , p,nji
K
G ni i i1
H G TS
n K
i1 i i
TS
U H pV
n K
i1 i i
TS
pV
A U TS
n K
i1 i i
pV
dG
G T
p,nj
dT
G p
T ,nj
dp
K i 1
idni
i i (T , p, x1, x2 , , xK 1 )
i i (T ,Vm , x1 , x2 , , xK 1 )
i i (Sm , p, x1 , x2 , , xK 1 )
i i ( Sm ,Vm , x1 , x2 , , xK 1 )
2.多相多组分系统的热力学基本方程
多组分多相体系热力学自测题答案

1、在恒温抽空的玻璃罩中封入两杯液面相同的糖水(A) 和纯水(B)。
经历若干时间后,两杯液面的高度将是:( A)(A) A 杯高于B 杯(B) A 杯等于B 杯(C) A 杯低于B 杯(D) 视温度而定2、在温度T时,纯液体A 的饱和蒸气压为p A*,化学势为μA*,并且已知在p∃压力下的凝固点为T f*,当A 中溶入少量与A 不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为p A,μ A,T f ,则( D)(A) p A*< p A, μA*<μA,T f* < T f(B) p A*> p A, μA*<μA,T f* < T f(C) p A*< p A, μA*<μA,T f* > T f(D) p A*> p A, μA*>μA,T f* > T f3、已知373.15 K 时,液体A 的饱和蒸气压为133.32 kPa,另一液体B 可与A 构成理想液体混合物。
当 A 在溶液中的物质的量分数为1/2 时,A 在气相中的物质量分数为2/3 时,则在373.15 K时,液体B 的饱和蒸气压应为:( A)(A) 66.66 kPa (B) 88.88 kPa (C) 133.32 kPa (D) 266.64 kPa4、关于亨利系数,下列说法中正确的是: ( D)(A)其值与温度、浓度和压力有关(B)其值与温度、溶质性质和浓度有关(C)其值与温度、溶剂性质和浓度有关(D)其值与温度、溶质和溶剂性质及浓度的标度有关5、关于亨利定律,下面的表述中不正确的是:(C)(A)若溶液中溶剂在某浓度区间遵从拉乌尔定律,则在该浓度区间组分B必遵从亨利定律(B)温度越高、压力越低,亨利定律越正确(C)因为亨利定律是稀溶液定律,所以任何溶质在稀溶液范围内都遵守亨利定律(D)温度一定时,在一定体积的溶液中溶解的气体体积与该气体的分压力无关6、298 K时,HCl(g,M r=36.5)溶解在甲苯中的亨利常数为245 kPa⋅kg⋅mol-1,当HCl(g)在甲苯溶液中的浓度达2%时,HCl(g)的平衡压力为:( A)(A) 138 kPa (B) 11.99 kPa (C) 4.9 kPa (D) 49 kPa7、下述诸说法正确的是:( D)(1) 溶液的化学势等于溶液中各组分的化学势之和(2) 对于纯组分,则化学势等于其Gibbs自由能(3) 理想溶液各组分在其全部浓度范围内服从Henry定律(4) 理想溶液各组分在其全部浓度范围内服从Raoult定律(A) (1),(2) (B) (2),(3) (C) (2),(4) (D) (3),(4)8、设N2和O2皆为理想气体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C = N - 不独立物种数
物种数中之所以有不独立者,是因为化学反应的 平衡常数和指定的浓度限制条件建立了物种数之
间的联系。若用R表示独立的平衡化学反应式数, R'表示化学平衡中同一相浓度限制条件的个数, 不独立物种数为(R+R'),则组分数:
C = N -( R + R' )。
h
4
R及 R/
所以相平衡系统中非独立变量的数目就是独立方程式的 数目。因此,
自由度 f =热力学变量总数目-热力学变量之间独立方程式数目
h
8
自由度(独立变量)f:—— 确定平衡体系的状态所必须
的独立强度变量的数目。(通常指压力、温度和浓度等) 另一种表述方式:自由度数是不引起平衡系统中原有 相数改变的条件下,可以独立变动的可变因素的数目。
(2) 在给定条件下反应 N2(g)+3H2(g)==2NH3(g) 达到平衡。系统 中有几个独立的平衡化学反应式,就有几个物种数不独立,R 即
为几。N =3、R =1、R’ =0, C = N- (R+R') = 2
(3) 在(2)条件下限制进料比[N2]∶[H2]=1∶3,如果同一相中 两种物质的数量保持一定的比例,就构成一个浓度限制条件。有几
2(P-1)+N(P-1)+R+R'= (N+2)(P-1)+R+R‘
h
11
3 相律表达式
按照自由度的定义, f =P(N+1) - [(N+2)(P-1)+R+R’ ] 可得相律(phase rule)表达式:
f =C–P+2 其中C为组分数,P 为相数,2通常对应于T 和 p这两个 强度变量。
1、化学反应限制条件R
若体系中各组分间可发生化学反应,则还应满足化学反 应平衡条件。对每一个独立的化学反应有一个独立的化学平 衡关系:
Kc (cB)B B
所以,若有R个独立的化学反应,就有R个独立的浓度关系, 即R个化学反应限制条件。
h
5
2、独立浓度限制条件R /
例如,体系中各组分间存在化学反应
NH4HCO3(s) = NH3(g)+H2O(g)+CO2(g) 且体系中开始时只有NH4HCO3(s),三种气体全部由 NH4HCO3(s)分解而来,或体系由1:1:1的NH3(g), H2O (g),CO2(g)形成,则三种气体浓度始终保持相 等,三个组成变量间存在两个独立关系,即有二个
体除外,它是单相)。
h
2
2 物种数N:系统中所有能单独存在的化学物质数目。
例如,由CO(g),CO2(g)和O2(g)构成的系统虽是一 相,但为三种物质N=3;由H2O(s),H2O(l)和H2O(g) 构成的系统,虽为三相但是一种物质,即N=1。
h
3
3 组分数C :能够表示相平衡系统中各相组成所需要
第四章
h
1
第1节 多相多组分平衡
4.1.1 描述相平衡系统状态的独立变量
1 相数 P :系统中不同相的数目称为相数。
气体: 不论多少种气体混合,只有一个气相。
液体: 按其互溶程度可以组成一相、两相或多相共存。
固体: 一般有一种固体便有一个相。两种固体粉末
无论混合得多么均匀,仍是两个相(固体溶液即固溶
所谓附加限制条件,主要是指:T、p、xi三类变量
中指定了其中的一个或二个。如指定了T 或p,则条件
自由度 f *=C – P +1。如指定了T 和 p,则条件自由度
f **=C – P。
相律的应用相当广泛,它可以用来解释实验事实,
确定系统的独立变量数目(自由度数目),确定给定系
统允许存在的最大相数目,指导相平衡系统的研究和分 析相图等。
h
13
【K例时4-达2】平若衡C,(s求)、组C分O数(g和)、自C由O2度(g数)和。O2(g)在温度为1000
解 N= 4 ;系统中实际存在的,达到平衡的化学反应有四个:
C(s)+CO2(g)=2CO(g) CO2(g)=0.5O2(g)+CO(g)、
个独立浓度限制条件,就可以减少几个描述系统的相的组成的物种
数。N =3、R =1、R‘ =1, C = 3-1-1 = 1。
h
7
4.自由度f
描述相平衡系统确定状态所需要的独立变量(T、p、
xi)的数目称为自由度数,用 f 表示。 这些变量可在有限的范围内任意改变,不消失旧相
也不产生新相。 根据代数定理,n个方程能限制或者关联n个变量,
该式表明,一个多组分多相平衡系统的自由度数随 组分数的增加而增加,随相数的增加而减小。
h
12
条件自由度
在使用相律公式时应注意;相律只适用于热力学上
的平衡系统;若考虑T,p以外的其它力场对平衡系统
的作用,相律公式应为f = C – P + n (n≥2)
平衡系统在附加某些限制条件之后剩下的自由度数
就叫做条件自由度,以f * 表示。
2 热力学平衡系统中独立方程式总数 根据热力学系统的平衡条件可求变量间方程式的总数目。
热平衡:各相的温度相等,即Tα= Tβ=…= Tr , 有(P-1)个等式。
力平衡:各相的压力相等,即pα= pβ=…= pr , 有(P-1)个等式。
h
10
相平衡:系统中含有N种物质,P个相,每一种物质在 P个相中的化学势相等,,共有N (P - 1)个等式。 化学平衡:系统中若有R个独立的平衡化学反应式。 外加R‘个浓度限制条件,就可得独立方程式总数目为
举例
T, P可以同时变化 T一定,则P随之确定
一组分单相系统—水蒸气 : f=2 一组分两相平衡系统(水,水蒸气):f=1 一组分气,液,固三相平衡共存的系统:f= 0
h
T,P 不能变化,具有确定9值。
4.1.2 相律及应用
1 相平衡系统中热力学变量总数
设有N 种物质分布在P个相中,因为Σxi=1 所以只要 (N-1)个物质的量分数就可描述某相的组成,加上T 和p, 共需[(N-1)+2]个独立变量即可描述该相的状态。系 统共有P个相,其热力学变量总数为 P(N+1)。
独立浓度限制条件,R /=2。
h
6
【的例组】分求数下:列(条1)件在下常由温N无2(g催)、化H剂2(条g)件和下NH;3((g2))所在组67成3K系有统 催化剂存在条件;(3) 在(2)的条件下再限制进料比 [N2]∶[H2]=1∶3。
解 (1) 因 N=3 、R=0 、R’=0,所以C = N-(R+R') =3,
