盐类水解的定义
盐类水解的名词解释

盐类水解的名词解释盐类水解是指在溶液环境中,通过水的氧化-还原反应,将盐类物质分解成其他化学物质的反应,常见的指的是氯化物类的盐类的水解。
盐类分解的过程可以总结为水的氧化-还原反应。
在这种反应中,氧元素将氯离子转化为氯酸,而氢离子将氢氧化物转化为氢气,这两个反应分别为氧化反应和还原反应,它们互相作用,形成水解反应。
水解反应可以分为一级水解和二级水解两种。
一级水解可以把一个来源物质分解成两个碱价离子,比如氯化钠可以分解成氯离子和钠离子。
二级水解可以把一个来源物质分解成三个碱价离子,比如氯化钙可以分解成氯离子,钙离子和氢离子。
由于水解能把盐类物质分解成其他有用的成分,因此被广泛应用在各种方面,包括化工、食品、农业等领域。
化工领域是盐类水解的主要应用领域。
通常,水解技术可以将有用的化学物质从氯离子中分离出来,从而为各种化工制品的制造提供原料。
这种技术的应用非常广泛,可以用来生产各种耐克类和阳离子表面活性剂等产品。
盐类水解技术也被用于食品加工方面,可以用来制造不同的味道,如油炸调料、汤勾芡等。
此外,也可以用来提高食物的新鲜度,因为水解反应能减少食物中的水分,从而延长食物的保质期。
此外,盐类水解技术还被应用于农业领域,可以用来制造氯化物类肥料,它们在肥料中的作用是改善土壤的营养和促进植物的生长。
另外,水解反应也可以用来生产一些抗氧化剂,因为它可以把有毒物质转化成对人体无害的物质,从而保护人体免受有害物质的危害。
总之,盐类水解是一种多用途的技术,它可以用来分解盐类物质,并将其转化成有用的产品,从而在化学、食品、农业等领域都有所贡献。
正是出于这些原因,盐类水解技术被广泛应用到了日常生活中。
优质课课件-盐类的水解

NaHCO3溶液
醋酸钠的水解:
CH3COONa = CH3COO + Na+ + _ + H2O H + OH
CH3COOH _ CH3COO +H2O CH3COOH+OH
_
CH3COONa + H2O
CH3COOH+NaOH
氯化铵的水解
NH4Cl = NH4+ + Cl+
H2O
相遇相
相遇相互促进使水解趋于完全,不能大量共存。
4.盐溶液蒸干产物的判断
如AlCl3的制备,不能通过加热溶液、浓缩结晶的方法,因为温度升高,
水解程度增大,同时由于HCl挥发,生成Al(OH)3,若对沉淀继续加热灼 烧,Al(OH)3将分解生成Al2O3。
5.盐类水解在日常生活中的应用
(1)去污:如常把某些盐当作碱使用,如纯碱、肥皂具有去污作用,且热溶液的去 污能力比冷溶液的去污能力强。这是由于纯碱、肥皂都属于强碱弱酸盐,其水解后 溶液均显碱性,升高温度水解的程度增大,溶液的碱性增强。 (2)灭火:泡沫灭火器内所盛装的药品分别是 NaHCO3溶液和Al2(SO4)3溶液,在使用 时将二者混合,能够水解彻底: Al3 + + 3HCO===Al(OH)3↓ + 3CO2↑ 。在炸油条过 程中加入纯碱、明矾,利用水解产生的CO2气体,使油条变得松脆可口。 (3)净水:明矾用于净水,这是由于铝盐水解产生的氢氧化铝具有吸附性的缘故。 其水解的离子方程式为Al3++3H2O 质,可用于净水。 Al(OH)3+3H+。铁盐也具有相类似的性
OH- + H+
NH3.H2O
NH4+ +H2O NH4Cl +H2O NH3.H2O + H+ NH3.H2O + HCl
盐类的水解和沉淀溶解平衡

盐类的水解和沉淀溶解平衡一、盐类的水解原理及其应用(一)、盐类水解的定义和实质1、定义:盐电离产生的某一种或多种离子与水电离出来的H + 或OH - 生成弱电解质的反应。
2、盐类水解的实质:盐类的水解是盐跟水之间的化学反应,水解(反应)的实质是生成弱电解质使水的电离平衡被破坏而建立起新的平衡。
3、盐类水解的条件:(1)、盐必须溶于水中;(2)、盐中必须有弱酸根阴离子或弱碱阳离子。
4、盐类水解反应离子方程式的书写(1)、一般盐类水解程度很小,水解产物也很少,通常不生成沉淀或气体,书写水解方程式时,一般不用“↓”或“↑”,盐类水解是可逆反应,写可逆号。
(2)、多元弱酸根的正酸根离子的水解是分步进行的,其水解离子方程式要分步写。
(3)、双水解反应:弱酸根和弱碱阳离子相互促进水解,直至完全的反应。
如:Al3+ + 3 HCO3- = Al(OH)3↓+ 3 CO2↑注意:常见的能发生双水解反应的离子,Al3+与CO32-、HCO3-、S2-、HS-、AlO2-等;Fe3+与CO32-、HCO3-、AlO2-;NH4+与SiO32-等。
(二)、盐类水解平衡的影响因素1、内因:盐本身的性质(1)、弱碱越弱,其阳离子的水解程度就越大,溶液酸性越强。
(2)、弱酸越弱,其阴离子的水解程度就越大,溶液碱性越强。
即:有弱才水解,都弱都水解,越弱越水解,谁强显谁性。
2、外因(1)、温度:升高温度,水解平衡正向移动,水解程度增大。
(2)、浓度:①、增大盐溶液的浓度,水解平衡正向移动,水解程度减小,但水解产生的离子浓度增大;②、加水稀释,水解平衡正向移动,水解程度增大,但水解产生的离子浓度减小。
③、增大c(H + ),促进强碱弱酸盐的水解,抑制强酸弱碱盐的水解;增大c(OH-),促进强酸弱碱盐的水解,抑制强碱弱酸盐的水解。
(三)、盐类水解原理的应用1、判断盐溶液的酸碱性。
2、判断盐溶液中离子种类及其浓度大小关系。
3、判断溶液中离子能否大量共存时,有时要考虑水解,如Al3+、Fe3+ 与HCO3-、CO32-、AlO2- 等不能大量共存。
盐类的水解知识点
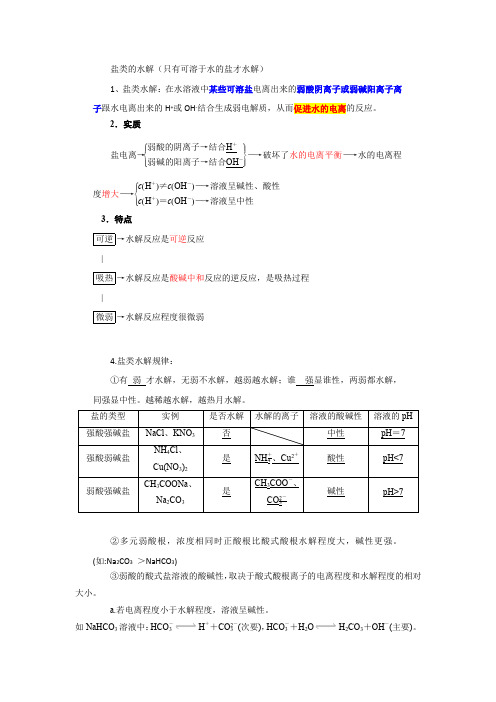
盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中某些可溶盐电离出来的弱酸阴离子或弱碱阳离子离子跟水电离出来的H +或OH -结合生成弱电解质,从而促进水的电离的反应。
2.实质盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→⎩⎪⎨⎪⎧c (H +)≠c (OH -)―→溶液呈碱性、酸性c (H +)=c (OH -)―→溶液呈中性 3.特点可逆→水解反应是可逆反应 |吸热→水解反应是酸碱中和反应的逆反应,是吸热过程 |微弱→水解反应程度很微弱4.盐类水解规律:①有 弱 才水解,无弱不水解,越弱越水解;谁 强显谁性,两弱都水解,同强显中性。
越稀越水解,越热月水解。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na 2CO 3 >NaHCO 3)③弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
a.若电离程度小于水解程度,溶液呈碱性。
如NaHCO 3溶液中:HCO -3H ++CO 2-3(次要),HCO -3+H 2O H 2CO 3+OH -(主要)。
b.若电离程度大于水解程度,溶液显酸性。
如NaHSO3溶液中:HSO-3H++SO2-3(主要),HSO-3+H2O H2SO3+OH-(次要)。
(目前必须知道HC2O4-、HSO-3、HPO32—和H2PO4—的电离大于水解)5.表示方法——水解的离子方程式(1)一般盐类水解程度很小,水解产物很少,在书写盐类水解方程式时要用“”号连接。
盐类水解一般不会产生沉淀和气体,所以不用“↓”或“↑”表示水解产物(双水解例外)。
不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
如:Cu(NO3)水解的离子方程式为Cu2++2H2O Cu(OH)2+2H+。
NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。
盐类水解的应用

盐类水解可以调节食品的酸碱度,如 柠檬酸钠、醋酸钠等,用于改善食品 口感和延长保存时间。
防腐剂
某些盐类可以水解产生酸性或碱性物 质,用于食品保存,如碳酸钠、碳酸 氢钠等。
洗涤剂与清洁剂
01
02
03
肥皂
油脂与氢氧化钠反应生成 肥皂,再通过盐类水解产 生氢氧化钾,使肥皂更加 细腻、易于溶解。
洗衣粉
洗衣粉中的成分如碳酸钠 、硅酸钠等可以水解产生 碱性物质,有助于去除衣 物上的污渍。
石油加工
在石油加工过程中,盐类水解反应可以用于生产各种石油化工产品,如用氢氧化 钠脱硫、用硫酸处理油渣等。
04
盐类水解在环境保护领域的应 用
水处理与废水处理
硬水软化
通过盐类水解反应,可以将硬水中的 钙、镁等离子转化为沉淀物,从而降 低水的硬度,使其更适合生活和工业 应用。
废水处理
盐类水解可以应用于废水处理中,通 过调节废水pH值,促进某些有毒物质 的沉淀和去除,提高废水处理效率。
冶金工业
提取金属
通过盐类水解反应,可以将矿石 中的金属元素提取出来,如用硫 酸铜溶液浸出铜矿中的铜。
金属表面处理
盐类水解反应可以用于金属表面 处理,如镀锌、镀铬等,提高金 属的耐腐蚀性和耐磨性。
石油化工
石油开采
在石油开采过程中,盐类水解反应可以用于提高石油采收率,如使用表面活性剂 降低油水界面张力。
盐类水解的原理
盐类水解的原理是中和反应的逆反应,即盐中的酸根离子或碱离子与水电离出 的氢离子或氢氧根离子结合,形成弱酸或弱碱,改变了溶液的酸碱性。
盐类水解的重要性
盐类水解在化学工业中的应用
盐类水解在化学工业中有着广泛的应用,如通过控制溶液的 酸碱性来制备和分离物质,以及在电镀、制药、纺织等行业 中应用。
盐类的水解

H2CO3+2OHA(OH)n+nH+ HB(n-1)-+OH-
已知一种酸HA,[H+]=1*10—3mol/l。一种碱BOH, [OH--]=1*10-3mol/l等体积混和,所得溶液显碱性, 则下列叙述正确的是( ) D A、该酸一定为强酸 B、该酸一定为弱酸 C、该 碱一定为强碱 D、该 碱一定弱碱 生成的盐是否能水解————若能,写出水解的 离子方程 式 B++H O BOH+H+
1.水溶液的pH值最大( A ) A. NaHCO3 B. KHSO4 C. AlCl3 D. HF
2.下列化合物中,其水溶液由于水解而显酸性的是 ( D ) A. NaHCO3 B. NaHSO4 C. HCl D. NH4Cl 3.物质的量浓度相等的下列溶液pH值由大到小的顺序是( A ) A. Na2CO3、NaHCO3、NaCl、NH4Cl B. Na2CO3、NaHCO3、NH4Cl、NaCl、 C. Na2CO3、NaCl、NH4Cl、NaHCO3 D. Na2CO3、NH4Cl、NaHCO3、NaCl、
加入 CH3COONa
平衡移动 [CH3COO-] [OH-]
向右 向右 向右 向右 向左 向左 向右 增大 减小 减小 减小 增大 增大 减小 增大 减小 增大 减小 增大 减小 减小
水解程度
减小 增大 增大 增大 减小 减小 增大
通入HCl 升温
加水 加NaOH 加HAc 加NH4Cl
CO32-+H2O
9.某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸 等体积混合后,所得溶液中各种离子浓度的关系正确的是 ( AD ) A. c(NH4+)>c(Cl-)>c(OH-)>c(H+) B. c(NH4+)>c(Cl-) >c(H+) >c(OH-) C. c(Cl-)>c(NH4+)>c(H+)>c(OH-) D. c(NH4+)+c(H+)=c(Cl-)+c(OH-)
盐类水解和沉淀溶解平衡

a、溶液显酸性(以NaH2PO4 、NaHSO3为例)
NaH2PO4
Na+ + H2PO4-
H2PO4H2PO4-+H2O
HPO42- + H+ OH- + H3PO4
(电离) ∨
(水解)
所以导致溶液中[OH-] < [H+],溶液显酸性。
② a、弱酸+盐溶液混合
如:CH3COOH+CH3COONa
2、下列盐的水溶液中,哪些呈酸性
( 134 ) 哪些呈碱性( 2 5 )
(1) FeCl3 (2) NaClO (3) (NH4)2SO4 (4) AgNO3 (5)Na2S (6)K2SO4
水解规律:
①有弱才水解,越弱越水解; 谁强显谁性,同强显中性。
。 ②第一步水解远大于第二步水解,以此类推。 ③温度越高,水解程度越大。 ④双水解程度比单水解程度大。
二、水解反应的方程式书写
1.盐类水解一般比较微弱,通常用“≒”表示,同 时无沉淀和气体产生。
2.多元弱酸的酸根离子水解是分步进行的,第一步水 解程度比第二步水解程度大得多;多元弱碱的阳离子 水解一步完成。
四、盐溶液中各种粒子的关系
1、离子浓度大小顺序 2、物料守恒(原子守恒) 3、质子守恒: [H+]水 = [OH-]水 4、电荷守恒
溶液中的一个不等式、三个等式
四、离子浓度大小顺序
1.水解、电离的程度本身很小 2.第一步为主、后面的程度小很多 3.物料/电荷/质子,三大守恒 4.常见的三个电离大于水解的酸式酸根 5.一般,酸性OH-最少,碱性,H+最少 6.NH4Cl与氨水同浓度显碱性等
电荷守恒:
1.溶液中离子要找全
盐类的水解

蒸干 蒸干
氢氧化物固体
同溶质固体
练习
1,下列阴离子,其中最易结合H+的是( C ) A.C6H5O- B.CH3COO- C.OH- D.CO32- E.Cl - F.HCO3 -
越难电离出H+, 对应的阴离子就越容易结合H+
练习
2.物质的量浓度相同的三种盐:NaX、NaY、 NaZ、的溶液,其pH值依次为8、9、10,则HX、 HY、HZ的酸性强弱的顺序是( B ) A. HX>HZ>HY B. HX>HY>HZ C. HZ>HY>HX D. HY>HZ>HX 小结
第3节
盐类的水解
1,盐类水解概述
一.盐类水解的本质
盐电离出的离子 + 水电离出的H+或OH- 生成弱电解
→打破水的电离平衡→水的电离程度增大→C(H+) ≠ C(OH-) →因而盐溶液呈酸性或碱性。
质
例: 醋酸钠在溶液中的变化 CH3COONa = CH3COO +Na+ + _ + H2O H + OH CH3COOH
c(H3PO4 )> c(H+) > c(H2PO4-) > c(HPO42-) >c(PO43 )
2、盐类的微弱水解 NH4Cl溶液中,各离子浓度关系为: C(Cl-)>c(NH4+) >c(H+) > c(OH-) Na2CO3溶液中 c(Na+)>c(CO32- ) > c(OH—) > c(HCO3-) > c(H+)
四.水解方程式的书写方法: (1)因为水解程度小,要用 ,无“↑”、无 “↓”,不稳定物(NH3〃H2O,H2CO3等)不分 解。 (2)多元弱酸盐水解分步进行的,以第一步为主, 常见的酸根离子带几个负电荷写几个水解方程式。 (3)多元弱碱盐水解:只写一个水解方程式。 (4)双水解进行到底时用“=”,气体、难溶物 用“↓”、“↑”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐类水解的定义
在溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程叫做盐类的水解。
盐类的水解所条件:盐必须溶于水,盐必须能电离出弱酸根离子或弱碱阳离子。
实质:在溶液中,由于盐电离出的离子于水电离出的离子结合生成弱电解质,从而破坏了水的电离平衡,使水的电离平衡向电离的方向移动,显示出不同浓度的酸性、碱性或中性。
规律:难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性,弱弱具体定;越热越水解,越稀越水解。
特点:
⑴水解反应和中和反应处于动态平衡,水解进行程度很小。
⑵水解反应为吸热反应。
⑶盐类溶解于水,以电离为主,水解为辅。
⑷多元弱酸根离子分步水解,以第一步为主。
