盐水解的概念
盐类的水解和沉淀溶解平衡

盐类的水解和沉淀溶解平衡一、盐类的水解原理及其应用(一)、盐类水解的定义和实质1、定义:盐电离产生的某一种或多种离子与水电离出来的H + 或OH - 生成弱电解质的反应。
2、盐类水解的实质:盐类的水解是盐跟水之间的化学反应,水解(反应)的实质是生成弱电解质使水的电离平衡被破坏而建立起新的平衡。
3、盐类水解的条件:(1)、盐必须溶于水中;(2)、盐中必须有弱酸根阴离子或弱碱阳离子。
4、盐类水解反应离子方程式的书写(1)、一般盐类水解程度很小,水解产物也很少,通常不生成沉淀或气体,书写水解方程式时,一般不用“↓”或“↑”,盐类水解是可逆反应,写可逆号。
(2)、多元弱酸根的正酸根离子的水解是分步进行的,其水解离子方程式要分步写。
(3)、双水解反应:弱酸根和弱碱阳离子相互促进水解,直至完全的反应。
如:Al3+ + 3 HCO3- = Al(OH)3↓+ 3 CO2↑注意:常见的能发生双水解反应的离子,Al3+与CO32-、HCO3-、S2-、HS-、AlO2-等;Fe3+与CO32-、HCO3-、AlO2-;NH4+与SiO32-等。
(二)、盐类水解平衡的影响因素1、内因:盐本身的性质(1)、弱碱越弱,其阳离子的水解程度就越大,溶液酸性越强。
(2)、弱酸越弱,其阴离子的水解程度就越大,溶液碱性越强。
即:有弱才水解,都弱都水解,越弱越水解,谁强显谁性。
2、外因(1)、温度:升高温度,水解平衡正向移动,水解程度增大。
(2)、浓度:①、增大盐溶液的浓度,水解平衡正向移动,水解程度减小,但水解产生的离子浓度增大;②、加水稀释,水解平衡正向移动,水解程度增大,但水解产生的离子浓度减小。
③、增大c(H + ),促进强碱弱酸盐的水解,抑制强酸弱碱盐的水解;增大c(OH-),促进强酸弱碱盐的水解,抑制强碱弱酸盐的水解。
(三)、盐类水解原理的应用1、判断盐溶液的酸碱性。
2、判断盐溶液中离子种类及其浓度大小关系。
3、判断溶液中离子能否大量共存时,有时要考虑水解,如Al3+、Fe3+ 与HCO3-、CO32-、AlO2- 等不能大量共存。
盐类的水解知识点
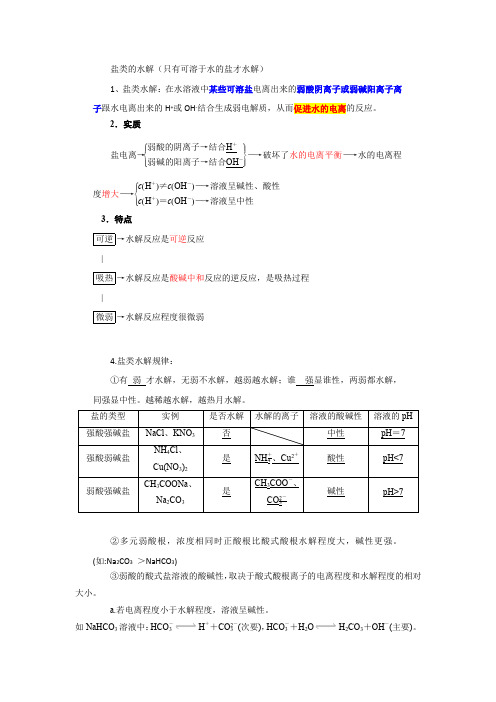
盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中某些可溶盐电离出来的弱酸阴离子或弱碱阳离子离子跟水电离出来的H +或OH -结合生成弱电解质,从而促进水的电离的反应。
2.实质盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→⎩⎪⎨⎪⎧c (H +)≠c (OH -)―→溶液呈碱性、酸性c (H +)=c (OH -)―→溶液呈中性 3.特点可逆→水解反应是可逆反应 |吸热→水解反应是酸碱中和反应的逆反应,是吸热过程 |微弱→水解反应程度很微弱4.盐类水解规律:①有 弱 才水解,无弱不水解,越弱越水解;谁 强显谁性,两弱都水解,同强显中性。
越稀越水解,越热月水解。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na 2CO 3 >NaHCO 3)③弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
a.若电离程度小于水解程度,溶液呈碱性。
如NaHCO 3溶液中:HCO -3H ++CO 2-3(次要),HCO -3+H 2O H 2CO 3+OH -(主要)。
b.若电离程度大于水解程度,溶液显酸性。
如NaHSO3溶液中:HSO-3H++SO2-3(主要),HSO-3+H2O H2SO3+OH-(次要)。
(目前必须知道HC2O4-、HSO-3、HPO32—和H2PO4—的电离大于水解)5.表示方法——水解的离子方程式(1)一般盐类水解程度很小,水解产物很少,在书写盐类水解方程式时要用“”号连接。
盐类水解一般不会产生沉淀和气体,所以不用“↓”或“↑”表示水解产物(双水解例外)。
不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
如:Cu(NO3)水解的离子方程式为Cu2++2H2O Cu(OH)2+2H+。
NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。
人教版高中化学选修四 3.3盐类的水解

双水解反应:两种盐单独水解时,一个显较 强的酸性,一个显较强的碱性,但毕竟水解程 度都很小,不能进行到底;若混合时,则因彼 此互相促进而进行到底。常见能发生双水解的 有:Al3+,Fe3+,AlO2- HCO3-,S2-,ClO-等。
问:用盐类水解的知识解释Al3+和AlO2在溶液中为什么不能共存。
(4)除杂:
问题6、除去KNO3溶液中少量的Fe3+ 离子可用加热的方法吗,说明理由?
Fe3++3H2O
Fe(OH)3+3H+
溶液中,某些离子的除杂,需考虑盐的水解。
练:为了除去氯化镁酸性溶液中的Fe3+离子,可 在加热搅拌下加入一种试剂,过滤后再加入适量
盐酸。这种试剂是( AD )
A.氧化镁
B.氢氧化钠
问题9:为什么用热的纯碱溶液 洗涤油污效果好?
在碱性条件下去油污能力强
CO32-+H2O HCO3-+H2O
HCO3- +OH- (吸热) H2CO3 +OH- (吸热)
热纯碱水去油污能力强:
在碱性条件下去油污能力强
CO32-+H2O
HCO3- +OH- (吸热)
HCO3-+H2O
H2CO3 +OH- (吸热)
Al3+ + 3HCO3- ═ Al(OH)3↓+3CO2↑ 2Al3+ + 3CO32- +3H2O═2 Al(OH)3↓+3CO2↑
2.为什么把硫酸铝放在玻璃桶内, 把碳酸氢钠放在铁桶内?
一些特殊情况分析 完成下列方程式:
FeCl3+ AgNO3== 3Fe(NO3)3+3AgCl CuSO4+ Na2S== Na2SO4+CuS ZnSO4+ Na2S ==Na2SO4+CuS 有些盐在加热时水解程度增大甚至能进 行到底。如煮沸含有Mg(HCO3)2的硬水。 问:AlO2-和HCO3-能否大量共存?
《盐类的水解》 讲义

《盐类的水解》讲义一、盐类水解的概念在溶液中,盐电离出来的离子跟水所电离出来的 H⁺或 OH⁻结合生成弱电解质的反应,叫做盐类的水解。
我们要知道,盐类水解的实质是破坏了水的电离平衡,促进了水的电离。
比如说,氯化铵(NH₄Cl)在水溶液中,NH₄⁺会和水电离出的OH⁻结合形成弱电解质一水合氨(NH₃·H₂O),使得溶液中 c(H⁺)> c(OH⁻),溶液呈酸性。
而碳酸钠(Na₂CO₃)在水溶液中,CO₃²⁻会和水电离出的 H⁺结合形成碳酸氢根离子(HCO₃⁻),使得溶液中 c(OH⁻)> c(H⁺),溶液呈碱性。
二、盐类水解的特点1、可逆性盐类的水解反应是可逆的,存在水解平衡。
以醋酸钠(CH₃COONa)为例,CH₃COO⁻与 H₂O 电离出的 H⁺结合生成 CH₃COOH,同时 CH₃COOH 也会电离出 CH₃COO⁻和H⁺,水解和电离是一个动态的平衡过程。
2、吸热性盐类的水解反应是吸热反应,升高温度会促进水解。
这是因为温度升高,水解平衡向正反应方向移动,水解程度增大。
3、微弱性盐类的水解程度一般都比较小。
例如,即使是碳酸钠这样的强碱弱酸盐,其水解产生的氢氧根离子浓度也相对较小,溶液的碱性并不是特别强。
三、盐类水解的规律1、有弱才水解只有含有弱酸阴离子或弱碱阳离子的盐才会发生水解。
比如氯化钠(NaCl),钠离子和氯离子对应的酸和碱都是强酸强碱,所以不会水解。
而醋酸铵(CH₃COONH₄),其中的醋酸根离子和铵根离子分别对应的醋酸和一水合氨是弱酸和弱碱,所以会发生水解。
2、谁弱谁水解盐中的阴离子对应的酸越弱,水解程度越大;阳离子对应的碱越弱,水解程度越大。
例如,相同浓度的碳酸钠(Na₂CO₃)和碳酸氢钠(NaHCO₃)溶液,由于碳酸的酸性弱于碳酸氢根的酸性,所以碳酸钠的水解程度大于碳酸氢钠。
3、谁强显谁性当盐中的阳离子对应的碱是强碱,阴离子对应的酸是弱酸时,溶液显碱性;反之,溶液显酸性。
高三化学一轮复习——盐类的水解
C
的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约
HS
结合H+的能力比S
强
为5
D
其他条件相同,测定等浓度的HCOOK和K2S溶液
比较Ka(HCOOH)和Ka2(H2S)的
的pH
大小
主题3 盐类的水解
目录
考点过关
真题回访
盐类的水解程度主要取决于盐本身的性质,酸(或碱)
阳离子)的水解程度
越大 ,溶液的碱性(或酸性)
越弱 ,其对应的弱酸阴离子(或弱碱
越强 ,即越弱越水解。
主题3 盐类的水解
真题回访
考点过关
目录
16
2.次要因素——外因
因素
温度
浓度
外加酸碱
水解平衡
水解程度
水解产生粒子的浓度
升高
右移__
增大__
增大
__
增大
____________________________________________________________________________
点在试纸的中部,试纸变色后,与标准比色卡对照来确定溶液的pH
__________________________________________________________________。
(2)酸式盐溶液可能呈酸性,也可能呈碱性。(
√
)
(3)某盐溶液呈酸性,该盐一定发生了水解反应。(
×)
(4)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同。(
√
)
(5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的电离程度相同。(
《盐类的水解》教案

一、教学目标1. 让学生理解盐类水解的概念和实质。
2. 使学生掌握盐类水解的规律和影响因素。
3. 培养学生运用盐类水解知识解决实际问题的能力。
二、教学内容1. 盐类水解的概念:盐类在水中溶解时,阳离子与阴离子分别与水分子发生作用,产生酸碱性质的过程。
2. 盐类水解的实质:盐类在水中溶解时,离子与水分子发生相互作用,导致溶液中H+和OH-的浓度发生变化,从而使溶液呈现酸碱性。
3. 盐类水解的规律:根据盐类离子的酸碱性质,分为强酸强碱盐、弱酸强碱盐、强酸弱碱盐和弱酸弱碱盐,它们的水解程度不同。
4. 影响盐类水解的因素:离子浓度、温度、溶剂等。
5. 盐类水解在实际中的应用:如调节土壤pH值、制备缓冲溶液等。
三、教学重点与难点1. 重点:盐类水解的概念、实质、规律及影响因素。
2. 难点:盐类水解的规律和影响因素的理解与应用。
四、教学方法1. 采用问题驱动法,引导学生思考和探讨盐类水解的相关问题。
2. 利用实例分析,让学生了解盐类水解在实际中的应用。
3. 采用小组讨论法,培养学生团队合作精神和口头表达能力。
4. 利用多媒体手段,形象地展示盐类水解的过程。
五、教学安排1. 第1-2课时:讲解盐类水解的概念和实质。
2. 第3-4课时:分析盐类水解的规律和影响因素。
3. 第5-6课时:实例分析,了解盐类水解在实际中的应用。
4. 第7-8课时:小组讨论,培养学生运用盐类水解知识解决实际问题的能力。
5. 第9-10课时:总结与复习,进行课堂测试。
六、教学评估1. 课堂问答:通过提问的方式,了解学生对盐类水解概念和实质的理解程度。
2. 小组讨论:观察学生在小组讨论中的表现,了解他们对于盐类水解规律和影响因素的掌握情况。
3. 实例分析报告:评估学生对盐类水解在实际应用中的理解,通过报告的形式进行。
4. 课堂测试:设计相关的测试题目,测试学生对盐类水解知识的掌握和应用能力。
七、教学资源1. 教材:盐类水解的相关章节。
2. 多媒体课件:用于展示盐类水解的过程和实例。
34盐类的水解
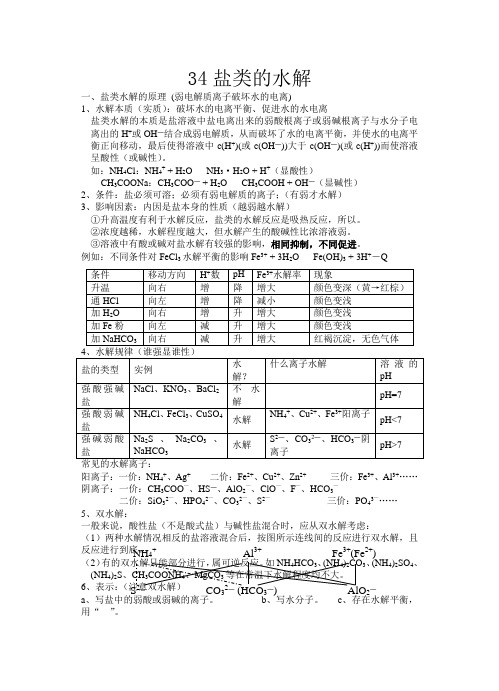
34盐类的水解一、盐类水解的原理 (弱电解质离子破坏水的电离)1、水解本质(实质):破坏水的电离平衡、促进水的水电离盐类水解的本质是盐溶液中盐电离出来的弱酸根离子或弱碱根离子与水分子电离出的H +或OH ―结合成弱电解质,从而破坏了水的电离平衡,并使水的电离平衡正向移动,最后使得溶液中c(H +)(或c(OH ―))大于c(OH ―)(或c(H +))而使溶液呈酸性(或碱性)。
如:NH 4Cl :NH 4+ + H 2O NH 3·H 2O + H +(显酸性)CH 3COONa :CH 3COO ― + H 2O CH 3COOH + OH ―(显碱性)2、条件:盐必须可溶;必须有弱电解质的离子;(有弱才水解)3、影响因素:内因是盐本身的性质(越弱越水解)①升高温度有利于水解反应,盐类的水解反应是吸热反应,所以。
②浓度越稀,水解程度越大,但水解产生的酸碱性比浓溶液弱。
③溶液中有酸或碱对盐水解有较强的影响,相同抑制,不同促进。
例如:不同条件对FeCl 3水解平衡的影响Fe 3+ + 3H 2O Fe(OH)3 + 3H +-Q 4、水解规律(谁强显谁性)盐的类型 实例 水解?什么离子水解 溶液的pH 强酸强碱盐 NaCl 、KNO 3、BaCl 2 不水解pH=7 强酸弱碱盐NH 4Cl 、FeCl 3、CuSO 4 水解 NH 4+、Cu 2+、Fe 3+阳离子 pH<7 强碱弱酸盐 Na 2S 、Na 2CO 3、NaHCO 3 水解 S 2―、CO 32―、HCO 3―阴离子pH>7 常见的水解离子:阳离子:一价:NH 4+、Ag + 二价:Fe 2+、Cu 2+、Zn 2+ 三价:Fe 3+、Al 3+……阴离子:一价:CH 3COO —、HS ―、AlO 2—、ClO —、F —、HCO 3—二价:SiO 32—、HPO 42—、CO 32—、S 2— 三价:PO 43—……5、双水解:一般来说,酸性盐(不是酸式盐)与碱性盐混合时,应从双水解考虑:(1)两种水解情况相反的盐溶液混合后,按图所示连线间的反应进行双水解,且反应进行到底。
盐类的水解

AlO2-
Fe3+
SiO32CO32-
HCO3-
AlO2-
NH4+
SiO32-
1、写出下列物质水解的离子方程式:
①FeCl3 ②Na2CO3 ③ NH4Cl ④ Al(HCO3)3
①Fe3+ + 3H2O
Fe(OH)3 + 3H+
②CO32- + H2O HCO3- +H2O
HCO3- + OHH2CO3 + OH-
草木灰不宜与铵态氮肥混合施用
草木灰的主要成分:K2CO3,水解呈碱性
CO32-+H2O
HCO3-+H2O
HCO3- +OH-
H2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O
NH3·H2O+ H+
有Na2CO3、Na2SO4、Na2S、NaOH四 种无色溶液,只用一种试剂就能把 四种无色溶液区别开,这种试剂可 能是( C) A.HCl B.BaCl2 C.AlCl3 D.酚酞
双水解:
两种水解情况相反的盐溶液混合时会互相
促进,使双方水解程度都增大
NH4++HCO3-+H2O NH3·H2O +H2CO3
2Al3++3S2-+6H2O == 2Al(OH)3↓+3H2S↑
AlO2SiO32-
CO32-
Al3+ SO32-
S2HSHCO3HSO3-
常见的、典型的双水解反应:
盐类的水解
一、盐类的水解:
1.盐类水解的本质
盐电离出的离子与水电离出的H+或OH-生成
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐水解的概念
盐水解的概念指的是盐在水中解离成离子的过程。
这个过程是化学反应的一种,涉及到电解质在水中离解成带电粒子,如阳离子和阴离子。
这些离子在水中相互吸引,从而形成溶液。
盐水解的过程通常分为两个步骤。
首先,盐的离子在水中离解成带电粒子。
这个过程取决于盐的化学性质和水的离子化程度。
例如,氯化钠(NaCl)在水中离解成钠离子(Na+)和氯离子(Cl-)。
其次,这些带电粒子在水中相互吸引,形成溶液。
这个过程取决于盐的浓度和溶液的酸碱度。
盐水解在化学、生物和环境科学中都有广泛的应用。
例如,在化学中,盐水解可以用来制备离子化合物和弱电解质。
在生物学中,盐水解可以用来维持细胞的离子平衡和渗透压。
在环境科学中,盐水解可以用来解释水体的酸碱度和离子组成。
盐水解的过程不仅涉及到化学反应,还涉及到物理过程。
例如,带电粒子在水中相互吸引,形成双电层结构。
这些结构会影响水的表面张力、电导率和光学性质等物理性质。
因此,盐水解对于理解水体的物理性质和化学性质都有重要的意义。
总之,盐水解是化学反应的一种重要类型,涉及到离子的形成和相互作用。
盐水解的过程不仅涉及到化学反应,还涉及到物理过程,对于理解水体的物理性质和化学性质都有重要的意义。
