降钙素原测定试剂盒(胶乳免疫比浊法)产品技术要求baiding
降钙素原测定试剂盒(胶乳免疫比浊法)产品技术要求zhongshengbeikong

降钙素原测定试剂盒(胶乳免疫比浊法)适用范围:本试剂用于体外定量测定人血清中降钙素原的浓度。
1.1规格液体双剂型试剂1(R1):21mL×1,试剂2(R2):7mL×1;试剂1(R1):30mL×2,试剂2(R2):10mL×2;试剂1(R1):60mL×2,试剂2(R2):20mL×2。
选配质控品冻干粉型2个水平:1mL×2;3mL×2;1mL×6;3mL×6。
1.2规格划分说明根据净含量或复溶体积划分规格。
1.3主要组成成分试剂盒由试剂1(R1)液体、试剂2(R2)液体及质控品冻干粉(选配)组成。
1.3.1试剂1(R1)主要组分:甘氨酸缓冲液 100 mmol/L1.3.2试剂2(R2)主要组分:包被PCT抗体的胶乳颗粒 0.5%1.3.3 质控品主要组分(PBS缓冲液基质):主要组分:降钙素原抗原定值范围:水平1:0~5.0 ng/mL,水平2:5.0~30 ng/mL(每批定值)。
2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b) 试剂2(R1)应为白色乳浊液,无杂质、无絮状物,外包装完整无破损。
c) 质控品为白色或浅黄色冻干粉,复溶后为无色或浅黄色透明溶液,无混浊、无未溶解物,外包装完整无破损。
2.2 试剂空白吸光度在波长600nm(580nm~620nm)(光径1cm)处,试剂空白吸光度(A)应≤1.9。
2.3准确度与已上市同类试剂分别测定40例血清样本,计算两组数据的相关系数(r)及测值的相对偏差或绝对偏差,在[0.2,60] ng/mL的检测范围内,相关系数(r)≥0.975;在(20,60] ng/mL区间内,相对偏差应不超过±15%;在[0.2,20]ng/mL区间内,绝对偏差应不超过±3ng/mL。
降钙素原(PCT)质控品产品技术要求mairui

2性能要求
2.1外观和性状
2.1.1颜色性状
质控品复溶前应为浅黄色冻干粉末,复溶后应为清澈浅黄色液体,无沉淀、悬浮物和絮状物。
2.1.2包装
试剂瓶应无泄漏;盒贴、瓶贴、标签标识应完整、清晰。
2.2装量
质控品质量(含瓶重)均应不少于18 g。
2.3均一性
2.3.1瓶内均一性
质控品瓶内均一性应不大于表 2 的要求(SD 和CV 值满足其一即可)。
表 2 质控品瓶内均一性要求
2.3.2瓶间均一性
质控品瓶间均一性应不大于表3 的要求(SD 和CV 值满足其一即可)。
表3 质控品瓶间均一性要求
2.4参考值及参考范围
每批质控品均应提供本批产品的参考值表。
经迈瑞校准品校准的BS 系列生化分析仪及配套试剂对质控品进行测定,测定结果应在给定的参考范围内。
2.5生物安全性
质控品使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂
灵敏度的检测试剂,HBsAg、HIV 抗体、HCV 抗体、梅毒螺旋体TP 抗体检测应为阴性。
1。
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求runnuosi
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中降钙素原的含量。
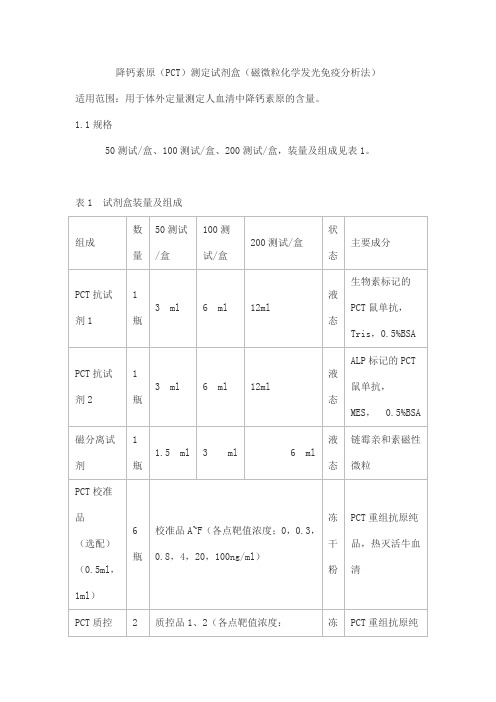
1.1规格50测试/盒、100测试/盒、200测试/盒,装量及组成见表1。
表1 试剂盒装量及组成2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,无磨损。
2.2准确度将已知浓度的PCT抗原加入到样本中,其回收率应在(85%~115%)范围内。
2.3空白检测限应不大于0.02ng/ml。
2.4线性在(0.02,100)ng/ml的测量范围内,试剂盒的相关系数r应≥0.99。
2.5重复性变异系数(CV)应不大于10%。
2.6质控品测值测值应在质控范围内。
2.7批间差批间变异系数(CV)应不大于15%。
2.8校准品瓶间差校准品的瓶间变异系数(CV)应不大于10%。
2.9分析特异性2.9.1 浓度不低于5000pg/ml白介素(IL-6)的零浓度PCT样本,在本试剂盒上测定结果应不高于0.03ng/ml。
2.9.2 浓度不低于10ng/ml降钙素(CT)的零浓度PCT样本,在本试剂盒上测试结果应不高于0.02ng/ml。
2.10稳定性2.10.1效期稳定性:试剂盒在2℃~8℃贮存,有效期为12个月,到效期后的试剂盒检测外观、准确度、空白检测限、线性、重复性和质控品测值,应符合2.1~2.6的要求。
2.10.2复溶稳定性:校准品与质控品复溶后,在2℃~8℃环境下保存3天后进行以下检测:a)校准品:进行准确度、质控品测值的检测,结果应符合2.2,2.6的要求。
b)质控品:进行质控品测值的检测,结果应符合2.6的要求。
降钙素原检测试剂盒(胶体金免疫层析法)产品技术要求huachengyuan

降钙素原检测试剂盒(胶体金免疫层析法)适用范围:本产品适用于体外半定量检测人血清/血浆/全血中的降钙素原的含量。
1. 产品型号/规格及其划分说明1.1产品型号产品型号及分类如下表1:表1 产品型号及分类U系列(卡型)G系列(条型)宽度(mm)U2 G2 2.5U3 G3 3.3U4 G4 4.0U5 G5 5.0注:产品相同系列不同型号间除试剂条宽度外,其余完全一致。
U系列是在G系列试剂条的基础上加卡壳,其余完全一致。
1.2 包装规格卡型:1人份/盒、1人份/袋;条型:100人份/盒、50人份/盒、25人份/盒、1人份/袋。
1.3主要组成成分(1)检测试剂卡/条由样品垫、金结合物垫(金垫上固定胶体金标记的PCT鼠源单克隆抗体)、硝酸纤维素膜(T线包被PCT鼠源单克隆抗体,C线包被有羊抗鼠IgG抗体)、吸水纸、PVC胶板构成。
(2)干燥剂。
2. 性能指标2.1 物理性状2.1.1 外观a)试剂盒的外观应平整、边缘无毛刺;b)测试块与基底片固定应紧密、不能有缺损或脱落;c)测试块外观整齐、色泽均匀、不能有色斑或污渍。
2.1.2膜条宽度试纸条宽度应U2、G2不小于2.5mm;U3、G3不小于3.3mm;U4、G4不小于4.0mm;U5、G5不小于5.0mm。
2.1.3液体移行速度液体移行速度应不低于10mm/min。
2.2 重复性及准确性分别用浓度为0.4ng/ml、0.5ng/ml、2.0ng/ml、10ng/ml的降钙素原质控液重复测试20次,检测结果与相应质控液标示值相差同向不超过一个量级,不得出现反向相差。
阳性质控液不得出现阴性结果,阴性质控液不得出现阳性结果,各浓度检测结果一致性不低于90%。
2.3 HOOK效应使用浓度为1000ng/ml的降钙素原的质控液重复检测3次,检测结果应不出现阴性。
2.4 批间差取三个批次的试剂盒,分别用浓度为0.4ng/ml、0.5ng/ml、2.0ng/ml、10ng/ml的降钙素原质控液进行重复测试20次,检测结果与相应质控液标示值相差同向不超过一个量级,不得出现反向相差。
降钙素原检测试剂盒(胶体金法)产品技术要求rejing

降钙素原检测试剂盒(胶体金法)
适用范围:用于体外半定量检测人血清和血浆样本中降钙素原(PCT)的含量。
1.1规格:20人份/盒和40人份/盒。
1.2组成:
2.1 外观
2.1.1液体组分应澄清透明、无沉淀或絮状物,铝箔袋应无破损漏气现象。
2.1.2 液体试剂的净含量应不少于标示量。
2.1.3试纸条宽度应为4.2±0.1mm。
2.1.4 液体移行速度应不低于10mm/min。
2.2 重复性及准确性
分别测定浓度为0.5 ng/mL、2.0ng/mL、10ng/mL的质控品进行重复测试20次,检测结果与相应质控品标示值相差同向不超过一个量级,不得出现反向相差。
阳性质控品不得出现阴性结果,阴性质控品不得出现阳性结果,各浓度检测结果一致性不低于90%。
2.3 HOOK效应
使用浓度为200 ng/mL的质控品重复测定3次,结果应不出现阴性。
2.4批间差
取三批检测卡分别测定1.0ng/mL的样本各10次,结果为阳性,检测结果之间不超过一个量级。
2.5特异性
检测C-反应蛋白(CRP)及正常阴性血清样品,反应结果应为阴性。
2.6稳定性
本试剂盒有效期18个月,取到效期产品在2个月内进行检测,测定结果应符合上述2.1、2.2、2.3、2.5项要求。
降钙素原(PCT)测定试剂盒(时间分辨荧光免疫层析法)产品技术要求注册版

医疗器械产品技术要求编号:降钙素原(PCT)测定试剂盒(时间分辨荧光免疫层析法)1.产品型号/规格及其划分说明1.1包装规格25人份/盒。
1.2主要组成成分由PCT测试卡、降钙素原(PCT)质控品、ID卡组成。
其中,PCT测试卡由试纸条、塑料盒组成;试纸条上的主要成分有硝基纤维素膜、吸水纸、样本垫、偶合物垫及PVC板;硝基纤维素膜包被有鼠抗人PCT抗体和羊抗鸡IgY抗体;样本垫上有鼠抗人红细胞抗体;偶合物垫上有荧光标记的鼠抗人PCT抗体和荧光标记的鸡IgY抗体。
降钙素原(PCT)质控品:重组人PCT蛋白。
ID卡:内含校准曲线信息。
1.3适用范围:用于体外定量测定人全血、血浆或血清中降钙素原(PCT)的含量。
临床上主要用于细菌感染性疾病的辅助诊断。
2.产品性能指标2.1试剂盒性能指标2.1.1外观a)试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
b)测试卡外观应平整、色泽均匀、边缘无毛刺,无色斑或污渍,卡固定紧密。
2.1.2膜条宽度膜条宽度应不小于 1.4mm。
2.1.3液体移行速度液体移行速度应不低于10mm/min。
2.1.4准确度测定具有溯源性的PCT工作校准品,测量结果与标定浓度的相对偏差应不超过±10%。
2.1.5空白限应不大于0.04ng/mL。
2.1.6线性范围在0.05ng/mL~100ng/mL区间内,线性相关系数r≥0.9900。
2.1.7批内精密度用同一批次的试剂盒,两个浓度工作校准品测定结果的变异系数CV<10.0%。
2.1.8批间精密度用三个不同批次的试剂盒测试,两个浓度工作校准品测定结果的变异系数CV<15.0%。
2.2质控品性能指标2.2.1外观无色澄清透明液体。
2.2.2装量质控品装量为0.5mL,应不少于标示值。
2.2.3准确度和赋值程序质控品测试结果应在靶值范围之内,赋值程序见附录1。
2.2.4均一性对一瓶质控品重复10次检测,对同一批号的10瓶质控品进行检测,批内瓶间差CV应≤15%。
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求puenguangde
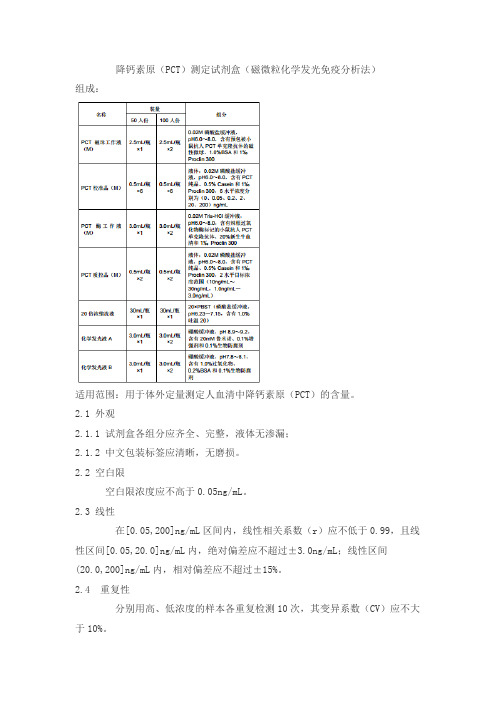
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)组成:适用范围:用于体外定量测定人血清中降钙素原(PCT)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整,液体无渗漏;2.1.2 中文包装标签应清晰,无磨损。
2.2 空白限空白限浓度应不高于0.05ng/mL。
2.3 线性在[0.05,200]ng/mL区间内,线性相关系数(r)应不低于0.99,且线性区间[0.05,20.0]ng/mL内,绝对偏差应不超过±3.0ng/mL;线性区间(20.0,200]ng/mL内,相对偏差应不超过±15%。
2.4 重复性分别用高、低浓度的样本各重复检测10次,其变异系数(CV)应不大于10%。
2.5 准确度将纯品配制的溶液(A)加入到人源样本(B)中,其回收率应在85%~115%之间。
2.6 分析特异性将下表规定浓度的干扰物质用试剂盒进行测定,检测结果的浓度值不得超过0.05ng/mL。
2.7 溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容。
校准品溯源至企业工作校准品,并与已上市产品比对赋值。
2.8 质控品赋值有效性本试剂盒质控品的测定结果应在质控范围内。
2.9 批间差用3个批号的产品分别检测同一份样本,3批产品间的相对极差(R)应不大于15%。
2.10稳定性试剂盒在(2~8)℃储存条件下的有效期为12个月,试剂盒在规定的条件下保存,取到效期后的试剂盒进行检测,检验结果应符合2.1、2.2、2.3、2.4、2.5、2.6的规定。
降钙素原(PCT)测定试剂盒(胶体金免疫层析法)产品技术要求meikang

降钙素原(PCT)测定试剂盒(胶体金免疫层析法)适用范围:用于体外定量检测人血清中的降钙素原,与南京美宁康诚生物科技有限公司生产的Mokosensor-A300型胶体金免疫分析仪配套使用。
1.1 包装规格20人份/盒、100人份/盒。
1.2 主要组成成分由相应人份的检测卡组成,其中,检测卡:检测线包被来源于小鼠的降钙素原单克隆抗体A、质控线包被羊抗鼠IgG多克隆抗体、金标垫上固定胶体金标记来源于小鼠的降钙素原单克隆抗体B。
2.1外观2.1.1外观平整,材料附着牢固,内容齐全,包装标签应清晰;2.1.2膜条宽度为4mm±0.2mm;2.1.3液体移行速度应不低于10mm/min。
2.2 空白限不高于0.10μg/L。
2.3 线性2.3.1试剂盒线性范围为[0.10,100.00]μg/L,线性相关系数r不低于0.9900;2.3.2 [0.10,0.25]μg/L绝对偏差不超过±0.02μg/L,(0.25,100.00]μg/L 线性偏差在±10%范围内。
2.4重复性检测高、低两个浓度的样本,变异系数(CV)应不大于10% 。
2.5准确度回收率在85%~115%。
2.6分析特异性检测浓度为100.00μg/L超敏C反应蛋白中降钙素原的浓度,计算交叉反应率,应小于10%。
2.7批间差检测一个高浓度的样本,相对极差应在±10%范围内。
2.8稳定性:常温(10℃~30℃)保存,有效期12个月,有效期末分别检测2.2~2.5项,其结果应符合各项要求。
2.9 校准品溯源性试剂盒校准信息所用校准品按照GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,溯源到本公司工作校准品,工作校准品通过已上市产品试剂盒比对赋值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
降钙素原测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中降钙素原的含量。
1.1 规格
校准品(选配):1×1mL;
质控品(选配):水平1:1×1mL,水平2:1×1mL。
1.2 组成:
校准品
质控
外
试剂
:无色液体,无浑浊,无不溶物。
2.1.2试剂2:乳白色液体。
2.1.3校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.4质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.5包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量
液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度
试剂空白吸光度≤2.0。
2.4 分析灵敏度
样本浓度为10ng/mL时,吸光度差值应≥0.02。
2.5 线性
在[0.3,60] ng/mL的范围内,线性相关系数r≥0.990。
测试浓度在[0.3,20] ng/mL 时,绝对偏差应不超过±2 ng/mL;测试浓度在(20,60] ng/mL 时,相对偏差应不超过±10%。
2.6 精密度
2.6.1重复性
用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差
用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度
与已上市产品进行对比试验,在[0.3,60] ng/mL的范围内,相关系数r≥0.975。
测试浓度在[0.3,20] ng/mL 时,绝对偏差应不超过±2 ng/mL;测试浓度在(20,60] ng/mL 时,相对偏差应不超过±10%。
2.8 质控品赋值有效性
测试结果在质控范围内。
2.9 校准品/质控品瓶内重复性
校准品/质控品瓶内重复性(CV)应不大于10%。
2.10 校准品/质控品批内瓶间差
校准品/质控品批内瓶间差(CV)应不大于10%。
2.11 溯源性
根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准品溯源至柏定公司内部工作较准品,并与北京九强生物技术股份有限公司生产的降钙素原测定试剂盒(胶乳免疫比浊法)比对赋值。
2.12 稳定性
2.12.1校准品复溶稳定性
校准品复溶后2℃~8℃密封避光保存可稳定24小时。
稳定期过后2小时内进行测试,测试结果与初测值的相对偏差应不超过±10%。
2.12.2质控品复溶稳定性
质控品复溶后2℃~8℃密封避光保存可稳定24小时。
稳定期过后2小时内进行测试,测试结果在质控范围内。
2.12.3效期稳定性
原包装试剂盒在2℃~8℃密封避光保存条件下有效期为12个月。
有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1、2.7、2.8、2.9和2.10的要求。
