电化学中的阴、阳离子交换膜专项练习(附解析)
经典高考原电池电解池离子交换膜问题.doc

学习必备 欢迎下载经典高考原电池电解池离子交换膜问题【试题 】以铬酸钾为原料, 电化学法制备重铬酸钾的实验装置示意图如下: 下列说法不正确的是A .在阴极室, 发生的电极反应为: 2H 2O不锈钢惰性电极+2e --+H 2↑= 2OHB .在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区 H +浓度增大,使平衡稀KOH 溶液K 2 CrO 4 溶液2 CrO 42 + 2H+Cr 2 O 72+ H 2O 向右移动 |C .该制备过程总反应的化学方程式为:阳离子交换膜4K 2CrO 4+ 4H 2O通电2K 2Cr 2O 7+4KOH + 2H 2↑+ O 2↑D .测定阳极液中K 和 Cr 的含量。
若 K 与 Cr 的物质的量之比为 d ,则此时铬酸钾的转化率为 1-d2【答案】D--(不锈钢 )发生的反应为+ H 2↑;【解析】根据实验装置图可知:阴极2H 2O + 2e = 2OH 因为 CrO 42 是最高价含氧酸根, 不可能在阳极 (惰性电极 )失去电子,阳极发生的反应为 2H 2O—4e -= 4H ++ O 2↑,产生的 H +使平衡 2 CrO 42 +2H +Cr 2 O 72 +H 2O 向右移动,即生成K 2Cr 2O 7,溶液逐渐由黄色变为橙色。
阳极室中多余的 K + 通过阳离子交换膜移向阴极室,平衡两室中的电荷。
电解过程中实质是电解水,一段时间以后,阴极室KOH 溶液浓度增大。
D 选项:在阳极室中,电解前是 K 2CrO 4 溶液,其 K 与 Cr 的物质的量之比值为 2,电解后若 K 2CrO 4 完全转化为 K 2Cr 2O 7 ,其 K 与 Cr 的物质的量之比值为 1,则 1≤ d ≤2。
在 1≤ d ≤2 时,铬酸钾的转化率 α 为 100%≤ α ≤0。
[巧解 ] 将 d 的取值范围 1≤ d ≤ 2 代入题设的 “式子: 1- d”,铬酸钾的转化率 α 为 50%≤α ≤ 100%,与事实相悖。
新教材高中化学能力练习8离子交换膜在电化学中的应用含解析新人教版选择性必修1

能力课时落实(八) 离子交换膜在电化学中的应用(建议用时:40分钟)1.(·山东枣庄八中高二月考)已知X、Y均为惰性电极,海水中富含Na+、Cl-、Ca2+、Mg2+、SO2-4等离子,用如图装置模拟海水淡化的过程。
下列叙述中不正确的是( )A.N是阴离子交换膜B.Y电极上产生有色气体C.X电极区有浑浊产生D.X电极反应式为4OH--4e-===O2↑+2H2OD[隔膜N靠近阳极,阳极上是阴离子放电,所以隔膜N是阴离子交换膜,A正确;通电后Y电极为阳极,阳极的电极反应为2Cl--2e-===Cl2↑,B正确;通电后X电极为阴极,阴极上是氢离子得到电子生成氢气,导致阴极区氢氧根离子浓度增大,OH-与Ca2+、Mg2+形成沉淀,C正确;X电极反应式为2H++2e-===H2↑或2H2O+2e-===H2↑+2OH-,D错误。
] 2.(·山东青岛月考)用多孔石墨电极电解法脱硫不仅可以脱除烟气中的SO2,还可以制得H2SO4,装置如图所示。
下列有关说法错误的是( )A.阳极放电的物质是SO2B.阳极电极反应式为SO2-2e-+SO2-4===2SO3C.电解过程电解池中SO2-4数目减少D.通N2的目的是将电解后的气体转移出来C[由示意图可知,阳极上SO2发生失电子的氧化反应生成SO3,电极反应式为SO2-2e-+SO2-4===2SO3,则阳极放电的物质是SO2,A正确,B正确;电解池中总反应为O2+2SO2===2SO3,所以电解过程电解池中SO2-4数目不变,C错误;阳极通入性质稳定的氮气,能将电解后的混合气体及时吹出,使之被水吸收生成H2SO4,达到彻底脱硫的目的,D正确。
]3.以石墨负极(C)、LiFePO4正极组成的锂离子电池的工作原理如图所示(实际上正负极材料是紧贴在锂离子导体膜两边的)。
充放电时,Li+在正极材料上脱嵌或嵌入,随之在石墨中发生了Li x C6生成与解离。
2021届高三化学二轮复习——电化学离子交换膜的分析与应用(有答案和详细解析)

2021届高三化学二轮复习——电化学离子交换膜的分析与应用(有答案和详细解析)高考真题1[2020·新高考全国卷Ⅰ(山东),13]采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。
忽略温度变化的影响,下列说法错误的是()A.阳极反应为2H2O-4e-===4H++O2↑B.电解一段时间后,阳极室的pH未变C.电解过程中,H+由a极区向b极区迁移D.电解一段时间后,a极生成的O2与b极反应的O2等量2(2020·威海一模)工业电解Na2CO3溶液的装置如图所示,A、B两极均为惰性电极。
下列说法正确的是()A.该装置可用于制备NaHCO3溶液,其中A极发生还原反应B.生成a溶液的电极室中反应为:2H2O-4e-+4CO2-3===O2↑+4HCO-3C.A极还可能有少量CO2产生,A、B两极产生的气体M和R体积比略大于2∶1D.当c2=1 mol·L-1,c1=9 mol·L-1时,则另一室理论上可制备2 mol溶质a(假设右室溶液体积为0.5 L) 3(2020·全国卷Ⅰ,12)科学家近年发明了一种新型Zn—CO2水介质电池。
电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是()A.放电时,负极反应为Zn-2e-+4OH-===Zn(OH)2-4B.放电时,1 mol CO2转化为HCOOH,转移的电子数为2 molC.充电时,电池总反应为2Zn(OH)2-4===2Zn+O2↑+4OH-+2H2OD.充电时,正极溶液中OH-浓度升高4.[2014·新课标全国卷Ⅰ,27(4)]H3PO2也可用电渗析法制备。
“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):①写出阳极的电极反应式:______________________________________。
电解池中离子交换膜的三种类型与高考真题等典例详析

电解池中离子交换膜的三种类型和作用1.离子交换膜的类型和作用2.“隔膜”电解池的解题步骤第一步:分清隔膜类型。
即交换膜属于阳膜、阴膜或质子膜中的哪一种,判断允许哪种离子通过隔膜。
第二步:写出电极反应式,判断交换膜两侧离子变化,推断电荷变化,根据电荷平衡判断离子迁移方向。
第三步:分析隔膜作用。
在产品制备中,隔膜作用主要是提高产品纯度,避免产物之间发生反应,或避免产物因发生反应而造成危险。
3.多室电解池中膜的应用(本文中重点介绍电解池膜的应用,原电池请类比练习)多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到浓缩、净化、提纯及电化学合成的目的。
(1)两室电解池①制备原理:工业上利用如图两室电解装置制备烧碱阳极室中电极反应:2Cl--2e-===Cl2↑,阴极室中的电极反应:2H2O+2e-===H2↑+2OH-,阴极区H+放电,破坏了水的电离平衡,使OH-浓度增大,阳极区Cl-放电,使溶液中的c(Cl-)减小,为保持电荷守恒,阳极室中的Na+通过阳离子交换膜与阴极室中生成的OH-结合,得到浓的NaOH溶液。
利用这种方法制备物质,纯度较高,基本没有杂质。
②阳离子交换膜的作用防止了两极产生的H2和Cl2混合爆炸。
避免了Cl2和阴极产生的NaOH反应生成NaClO而影响烧碱的质量。
(2)三室电解池利用三室电解装置制备NH4NO3,其工作原理如图所示。
阴极的NO 被还原为NH +4:NO +5e -+6H +===NH +4+H 2O ,NH +4通过阳离子交换膜进入中间室;阳极的NO 被氧化为NO -3:NO -3e -+2H 2O===NO -3+4H +,NO -3通过阴离子交换膜进入中间室。
根据电路中转移电子数相等可得电解总反应:8NO +7H 2O=====电解3NH 4NO 3+2HNO 3,为使电解产物全部转化为NH 4NO 3,补充适量NH 3可以使电解产生的HNO 3转化为NH 4NO 3。
(天津专用)2020高考化学二轮复习热点专攻9电化学中离子交换膜的应用训练(含解析)

精品文档,欢迎下载如果你喜欢这份文档,欢迎下载,另祝您成绩进步,学习愉快!热点专攻9 电化学中离子交换膜的应用1.(2019全国Ⅰ)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
下列说法错误的是( )A.相比现有工业合成氨,该方法条件温和,同时还可提供电能B.阴极区,在氢化酶作用下发生反应H2+2MV2+2H++2MV+C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3D.电池工作时质子通过交换膜由负极区向正极区移动,因此比现有工业合成氨的条件温和,同时还能提供电能,A项正确;阴极区发生的是得电子的反应,而左池中发生的是失电子的反应,B项错误;右池为正极区,氮气发生还原反应生成氨气,C项正确;左池中产生的氢离子通过交换膜向右池移动,即由负极区移向正极区,D项正确。
2.(2019天津河西高三模拟)利用电化学原理将有机废水中的乙二胺[H2N(CH2)2NH2]转化为无毒物质的原理示意图如下图1所示,同时利用该装置再实现镀铜工艺示意图如图2所示。
当电池工作时,下列说法正确的是( )A.图1中H+透过质子交换膜由右向左移动B.工作一段时间后,图2中CuSO4溶液浓度减小C.当Y电极消耗0.5 mol O2时,铁电极质量增大64 gD.X电极反应式为H2N(CH2)2NH2+4H2O+16e-2CO2↑+N2↑+16H+解析:图1是原电池,Y电极上氧气被还原成水,所以Y是正极,氢离子移向正极,H+透过质子交换膜由左向右移动,A项错误;图2是电镀池,CuSO4溶液浓度不变,B项错误;当Y电极消耗0.5molO2时,转移电子2mol,铁电极上发生反应Cu2++2e-Cu,生成1mol铜,电极质量增大64g,C项正确;X是负极,失电子发生氧化反应,电极反应式是H2N(CH2)2NH2+4H2O-16e-2CO2↑+N2↑+16H+,D项错误。
3.工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。
届高三化学期末考前复习专题训练——电化学离子交换膜的分析与应用(word版,含答案与解析)

电化学离子交换膜的分析与应用专题训练1.水系锌离子电池是一种新型二次电池,工作原理如下图。
该电池以粉末多孔锌电极(锌粉、活性炭及粘结剂等)为负极,V2O5为正极,三氟甲磺酸锌[Zn(CF3SO3)2]为电解液。
下列叙述错误的是()A.放电时,Zn2+向V2O5电极移动B.充电时,阳极区电解液的浓度变大C.充电时,粉末多孔锌电极发生还原反应D.放电时,V2O5电极上的电极反应式为:V2O5+x Zn2++2x e-===Zn x V2O52.(2020·日照市高三3月实验班联考)荣获2019年诺贝尔化学奖的吉野彰是最早开发具有商业价值的锂离子电池的日本科学家,他设计的可充电电池的工作原理示意图如图所示。
该可充电电池的放电反应为Li x C n +Li(1-x)CoO2===LiCoO2+n C。
N A表示阿伏加德罗常数的值。
下列说法错误的是()A.该电池用于电动汽车可有效减少光化学烟雾污染B.充电时,阳极反应为LiCoO2-x e-===Li(1-x)CoO2+x Li+C.充电时,Li+由B极移向A极D.若初始两电极质量相等,当转移2N A个电子时,两电极质量差为14 g3.2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2H++HO-2,K a=2.4×10-12)。
下列说法错误的是()A.X膜为选择性阳离子交换膜B.催化剂可促进反应中电子的转移C.每生成1 mol H2O2电极上流过4 mol e-D.b极上的电极反应为O2+H2O+2e-===HO-2+OH-4.最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
示意图如下所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:①EDTAFe2+-e-===EDTAFe3+②2EDTAFe3++H2S===2H++S+2EDTAFe2+该装置工作时,下列叙述错误的是()A.阴极的电极反应:CO2+2H++2e-===CO+H2OB.协同转化总反应:CO2+H2S===CO+H2O+SC.石墨烯上的电势比ZnO@石墨烯上的低D.若采用Fe3+/Fe2+取代EDTAFe3+/EDTAFe2+,溶液需为酸性5. 用惰性电极电解法制备硼酸[H3BO3或B(OH)3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。
高考中有关离子交换膜的电化学试题
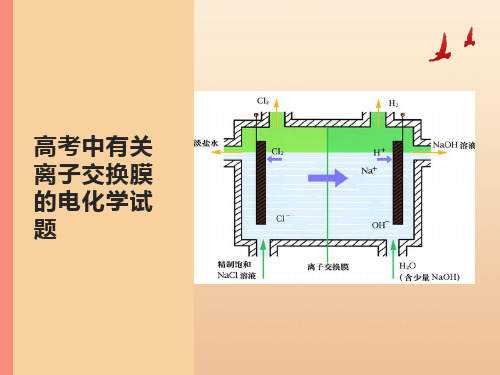
8.(节选自2014·江苏单科化 学卷,T20)硫化氢的转化是 资源利用和环境保护的重要研 究课题。由硫化氢获得硫单质 有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图-1所示的电解池的阳极区进行电解。
电解过程中阳极区发生如下反应:S2- - 2e- = S
(n—1)S+ S2- = Sn2- ①写出电解时阴极的电极反应式:2H2O + 2e- = H2↑+ 2OH- (或2H+ + 2e- = 。H2↑)
解析:
-
B.放电时,交换膜右侧溶液中有大 量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池 总反应随之改变
D.当电路中转移0.01 mol e-时, 交换膜左侧溶液中约减少0.02 mol离 子
0 1
正极反应为Cl2+2e-=2Cl-,A项错误;放电时,交换膜右侧的电极为正极,交换膜左侧的电 极为负极,负极放电产生的Ag+与电解质HCl中的Cl-结合生成AgCl白色沉淀。则负极电极反 应式:2Ag-2e-+2Cl-=2AgCl,B项错误;负极放电产生的Ag+与电解质中的Cl-结合, 若用NaCl代替盐酸不会改变电池总反应,C项错误;当电路中转移0.01 mol e-时,交换膜左 侧的电极放电产生0.01 mol Ag+,与电解质中的0.01 mol Cl-结合生成AgCl沉淀,同时约 有0.01 mol H+通过阳离子交换膜转移到右侧溶液中,则交换膜左侧溶液中约减少0.02 mol 离子,D项正确。
2.用于物质的制备、分离、提纯等。
三、离子交换膜的类型:
常见的离子交换膜为:阳离子交换膜、阴离子交换膜、特殊离子交换膜等。
四、试题赏析: 1.某同学按如图所示装置进行试验,A、B为常见金属,它们 的硫酸盐可溶于水。当K闭合时,SO42-从右向左通过阴离子 交换膜移向A极.下列分析正确的是 ( D )
专题30电化学中的交换膜-2022年高考化学毕业班二轮热点题型归纳与变式演练
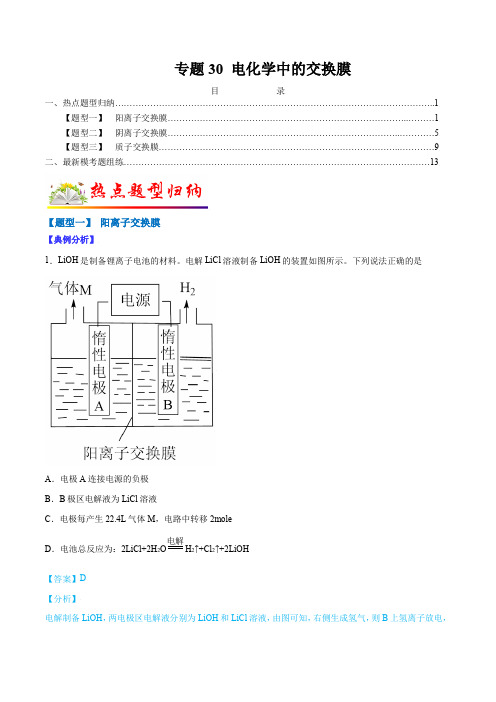
专题30 电化学中的交换膜目录一、热点题型归纳 (1)【题型一】阳离子交换膜 (1)【题型二】阴离子交换膜 (5)【题型三】质子交换膜 (9)二、最新模考题组练 (13)【题型一】阳离子交换膜【典例分析】1.LiOH是制备锂离子电池的材料。
电解LiCl溶液制备LiOH的装置如图所示。
下列说法正确的是A.电极A连接电源的负极B.B极区电解液为LiCl溶液C.电极每产生22.4L气体M,电路中转移2moleD.电池总反应为:2LiCl+2H2O 电解H2↑+Cl2↑+2LiOH【答案】D【分析】电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B上氢离子放电,可知B为阴极,在B侧制备LiOH,Li+由A经过阳离子交换膜向B移动,A中为LiCl溶液,氯离子放电生成氯气,据此分析解题。
【解析】A.由分析可知,A为阳极,与正极相连,故A错误;B.通过以上分析知,B极区电解液为LiOH,否则无法得到纯净的LiOH,故B错误;C.没有指明气体所处状态,无法计算其物质的量,所以无法计算转移电子物质的量,故C错误;电解D.电解池的阳极上是氯离子失电子,阴极上是氢离子得电子,电解的总反应方程式为:2LiCl+2H2OH2↑+Cl2↑+2LiOH,故D正确;故选D。
【提分秘籍】1.离子交换膜的功能使离子选择性定向迁移(目的是平衡整个溶液的离子浓度或电荷)。
2.离子交换膜在电化学中的作用(1)隔离某些物质防止发生反应。
(2)用于物质的制备。
(3)物质分离、提纯等。
3.阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过。
【变式演练】1.一种采用电解原理获得高浓度HI溶液的装置如图所示,下列有关说法正确的是A.玻璃碳电极a与电源正极相连B.离子交换膜为阴离子交换膜C.a极电解液为浓溶液D.该装置是通过牺牲阴极液中的HI来增大阳极液中HI的浓度【答案】A【分析】根据图示,玻璃碳电极a上I被氧化生成I2,玻璃碳电极a为阳极,玻璃碳电极b上I2被还原生成I,玻璃碳电极b为阴极,结合电解原理分析判断。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学中的阴、阳离子交换膜专项练习(附解析)
一、单选题(本大题共23小题)
1.氮氧化物具有不同程度的毒性,利用构成电池方法既能实现有效消除氮氧化物的排
放,减轻环境污染,又能充分利用化学能,发生反应6NO2+ 8NH3= 7N2+ 12H2O,装置如图所示。
下列关于该电池的说法正确的是( )
A. 为使电池持续放电,离子交换膜需选用阴离子交
换膜
B. 电子从右侧电极经过负载后流向左侧电极
C. 电极A极反应式为
D. 当有被处理时,转移电子物质的量为
2.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的
是()
A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用水溶液吸收的离子反应方程式为
3.离子交换法净化水过程如图所示。
下列说法错误的是( )
A.水中的、、通过阴离子树脂后被除去
B. 经过阳离子交换树脂后,水中阳离子的总数不变
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应
4.下图装置(Ⅰ)为一种可充电电池的示意图,其中的
离子交换膜只允许K+通过,该电池充放电的化学
S2+KI3K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,
方程式为2K
X附近溶液先变红。
则下列说法正确的是()
A. 闭合K时,从左到右通过离子交换膜
B. 闭合K时,电极A的反应式为
C. 闭合K时,X的电极反应式为
D. 闭合K时,当有通过离子交换膜,X电极上产生标准状况下气体
5.我国预计在2020年前后建成自己的载人空间站。
为了实现空间站的零排放,循环
利用人体呼出的并提供,我国科学家设计了一种装置(如下图),实现了“太
阳能→电能→化学能”转化,总反应方程式为。
关于该装置的下列说法正确的是()
A. 图中N型半导体为正极,P型半导体为负极
B. 图中离子交换膜为阳离子交换膜
C. 反应完毕,该装置中电解质溶液的碱性增强
D. 人体呼出的气体参与X电极的反应:
6.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有
关叙述不正确的是()
A. Zn电极上发生氧化反应
B. 电子的流向为电流表
C. 由乙池通过离子交换膜向甲池移动
D. 电池工作一段时间后,乙池溶液的总质量明显增加
7.某种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水(酸性)中的
有机物可用C6H10O5表示[交换膜分别是只允许阴(阳)离子通过的阴(阳)离子交换膜],下列有关说法中不正确的是
A.电池工作时,电子由a极经导线流向b极
B. 交换膜a是阴离子交换膜
C. 电极b的反应式:
D. 相同时间内相同状况下生成和的体积比为
8.电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过
性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程.如图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为石墨电极.
下列有关描述错误的是()
A. 阳离子交换膜是A,不是B
B. 通电后阳极区的电极反应式:
C. 工业上阴极使用铁丝网代替石墨碳棒,以减少石墨的损耗
D. 阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀
9.双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解
离成H+和OH-,作为H+和OH-离子源。
利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HCl,其工作原理如图所示,M、N为离子交换膜。
下列说法错误的是()
A. 阴极室发生的反应为
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜,阳极室会有生成
D. 电路中每转移1mol电子,两极共得到 mol气体
10.一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别
是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5
表示。
下列有关说法正确的是()
A.a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为
D. 中间室中移向左室,移向右室
海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子、
硫酸根等)依次通过两种离子交换树脂A、B(如图所示),而
得到淡化.已知氢型离子交换树脂(HR)可对阳离子进行交换,
而羟型离子交换树脂(ROH)可对阴离子进行交换,试分析下
列叙述中不正确的是()
A. HR与镁离子的反应可表示为:
B. ROH与氯离子的反应可表示为:
C. A为氢型离子交换树脂,B为羟型离子交换树脂
D. A为羟型离子交换树脂,B为氢型离子交换树脂
11.四室式电渗析法制备盐酸和NaOH的装置如图所示。
a、b、c 为阴、阳离子交换膜。
已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子透过。
下列叙述正确的是()
A. b、c分别依次为阳离子交换膜、阴离子交换膜
B. 通电后Ⅲ室中的透过c迁移至阳极区
C. Ⅰ、Ⅱ、Ⅲ、Ⅳ四室中的溶液的pH均升高
D. 电池总反应为
12.某小组同学设想用如图装置电解硫酸钾溶液来制取O2、H2、H2SO4和KOH。
下列说法错误的是()
X极与电源的正极相连,氢气从C口导出
B. 离子交换膜只允许一类离子通过,则M为阴离子交换膜
C. 通电后,阴极附近溶液pH会减小
D. 若在标准状况下,制得氢气,则生成硫酸的质量是49g
12.观察下列几个装置示意图,有关叙述正确的是()
A. 装置中阴极上析出浅黄绿色气体
B. 装置的待镀铁制品应与电源阳极相连
C. 装置闭合电键后,电流由b极流向a极
D. 装置的离子交换膜允许阳离子、阴离子、水分子自由通过
13.图是工业电解饱和食盐水的装置示意图,下列有关说法不
正确的是()
A. 装置中出口处的物质是氯气,出口处的物质是氢
气
B. 该离子交换膜只能让阳离子通过,不能让阴离子通过
C. 装置中发生反应的离子方程式为
D. 该装置是将电能转化为化学能
14.下列说法正确的是
A. 化学平衡发生移动,平衡常数不一定发生改变
B. 蛋白质溶液中加入溶液产生沉淀,加水后沉淀溶解
C. 室温时,醋酸溶液加水不断稀释,溶液的导电性增强
D. 用离子交换膜电解槽电解饱和食盐水制氯气和烧碱,该“膜”只能让阴离子透
过
15.微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图1为其
工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。
下列说法正确的是()
A. M为电源负极,有机物被还原
B. 电池工作时,N极附近溶液pH减小
C. 处理1 mol 时有6 mol 从交换膜左侧向右侧迁移
D. 离子浓度较大时,可能会造成还原菌失活。
