第二章-紫外吸收光谱
合集下载
紫外吸收光谱法

④K带吸收是共轭分子的特征吸收带,是紫外光谱中应用最多的吸 收带
例如:CH2=CH-CH=CH2 * λmax=217nm εmax=104
CH3-CH=CH-CHO(巴豆醛)*
λmax=217.5nm εmax=1.5×104 -CH=CH2
λmax=248nmεmax=1.4×104
第二章 紫外可见吸收光谱法
紫外吸收光谱法(ultraviolet and Visble Spectroscopy,UV-Vis)
是研究物质在紫外区(10--400nm)和可见光区(400-750nm) 的分子吸收光谱法。 §2-1分子吸收光谱 一、分子吸收光谱的产生 各种能级差之间的关系: △E电子> △E振动> △E转动
m ax
21, 000 43, 000 — 121, 000 138, 000
1 ,3 ,5 ,7 -辛 四 烯 环 己 烷
1 ,3 ,5 ,7 ,9 -癸 四 烯 1 ,3 ,5 ,7 ,9 ,11 - 十 二 烷基六烯
异辛烷 异辛烷
23
3、醛和酮 醛和酮中均含有羰基(C=O)。 能实现n* 跃迁 (λmax.270-300nm附近,ε=10-20); n* 跃迁 (λmax.180nm左右); *跃迁(λmax.150nm左右) 。
12
表9-1 某些常见发色团的吸收特性
生色团 烯 溶剂 正庚烷 /nm 177
max
13000
跃迁类型
*
炔
羧基 酰胺基 羰基 偶氮基 硝基 亚硝基 硝酸酯
正庚烷
乙醇 水 正己烷 乙醇 异辛酯 乙醚
178
204 214 186 339,665 280 300,665
10000
第二章 可见紫外吸收光谱分析1

由于玻璃可吸收紫外光,所以玻璃棱镜只能用于
用于可见光域内。 石英棱镜可使用的波长范围较宽,可从185- 4000nm,即可用于紫外、可见和近红外三个光域。
光栅是利用光的衍射与干涉作用制成的。
它可用于紫外、可见及红外光域,而且
在整个波长区具有良好的、几乎均匀一 致的分辨能力。
它具有色散波长范围宽、分辨本领高、 成本低、便于保存和易于制备等优点。 缺点是各级光谱会重叠而产生干扰。
它是分光光度法定量分析的依据。
吸光系数
朗伯-比耳定律中,当c以克/升,液层厚 度b以厘米表示时,常数K以a表示,称 为吸光系数。 a的单位为升/克.厘米。 朗伯-比耳定律 :A=abc
摩尔吸光系数
朗伯-比耳定律中,浓度用摩尔/升,液 层厚度b用厘米为单位表示,则K用另一 符号ε来表示。 ε称为摩尔吸光系数(或克分子消光系数), 单位为升/摩尔.厘米。 它表示物质的浓度为1摩尔/升,液层厚 度为1厘米时溶液的吸光度。 朗伯-比耳定律 : A=εbc
72型 721型
751型 WFD-8型
760 40000
~
硅碳棒或 辉光灯
岩盐或萤 石棱镜
WFD-3型 WFD-7型
一、组成部件
光源
单色器
样品池
记录装置
检测器
(一)光源
对光源的基本要求是应在仪器操作所 需的光谱区域内能够发射连续辐射,有足 够的辐射强度和良好的稳定性,而且辐射 能量随波长的变化应尽可能小。 常用的光源有热辐射光源(如钨丝灯 和卤钨灯)和气体放电光源(如氢灯和氘 灯)两类。
1)非单色光的影响: 光吸收定律的重要前提是入射光
第二章 紫外吸收光谱(共85张PPT)
max (己烷) =114+5M+nnR环内-10R环外 当苯环上有助色团时,向长波方向移至200 ~ 220nm。
-卤代酮的构象: -卤代环已酮有以下两个构象(A) (竖键)和(B)。 RCOOH及RCOOR的n → *比RCHO 的 小,即紫移*称为 *跃迁 ,实现 *跃迁需要吸收很多能量,约为185 千卡/克分子。
v=频率 用 周/秒(Cps)或赫兹(Hz) E=能量 单位为尔格,电子伏特eV或卡/摩尔
二、紫外光谱的特征
符合朗伯-比尔定律(Lambert-Beer’s Law),这是 吸收光谱的基本定律,用数学公式表示为:
A= ㏒(I0/I)=abc
式中:A:吸光度 I0:入射光强度 I:透射光强度 a:吸光系数 b:吸收池厚度(cm) c:被测物质浓度g/L I0/I:透射比,用T表示
CH3 CH3
N max =227nm( 900)
CH3
CH3Cl CH3OH
max =173nm( 200) max =183nm
3. *跃迁
电子由轨道跃迁到*轨道称→*跃迁,所吸收的能量比n → *小,峰位约在200nm附近,这种跃迁是强吸收, >104
例:CH2 CH2 max =162nm
近紫外区(200~400nm):在此波长范围内,玻璃有吸收,一般用石 英比色器,因此称近紫外区为石英紫外区,近紫外区最为有用,通常
所谓的紫外光谱就是指近紫外区的光谱。
2. 紫外光谱 以波长10~400nm的电磁波照射物质分子,即以紫外光照
射物质分子,由分子的电子能级跃迁而产生的光谱叫紫外光 谱。紫外光谱是电子光谱的一部分,可见光谱也是电子光谱 ,电子光谱是由电子跃迁而产生的吸收光谱的总称。
第二章 紫外光谱(UV)

K带 B带
苯环最重要的吸收带是B带,虽然强度不高但具有 精细结构很典型。
当苯环上有羟基、氨基等取代基时,吸收峰红移, 吸收强度增大,取代基不同,变化程度不同,可 由此鉴定各种取代基。 例: λmax B带 λmax E 2带
苯
甲苯
254
262
204
208
苯酚
苯甲酸
271
272
213
230
六、推测不饱和化合物λmax峰位的经验规 则
一、饱和烃
饱和烃只能产生σ→ σ* 跃迁,吸收带的位置
在150 nm左右,在远紫外区,超出仪器测定能力。
例如: 甲烷的C—H σ→ σ* 跃迁入max为125nm 乙烷的C—C σ→ σ*跃迁入max 为135nm
2、脂肪醇、胺和卤化物
当σ键与杂原子在一起时,因杂原子氧、氮、 硫、氯等具有非成键电子(n电子),所以,可发生 σ→σ*和 n → σ*两种跃迁。显然n → σ*跃迁
CH3 OH CH=CH2 E2 ´ ø £ º lmax 208nm( e 2460) E2 ´ ø £ º lmax 210nm( e 6200) K´ ø £ º lmax 244nm( e 12000)
识别上述几种吸收带,对推导有机化合物的结 构将会有很大的帮助。
五、各类有机化合物的紫外吸收
可以跃迁的电子有:电子, 电子和n电子。跃迁
的类型有: *, n *, *, n*。
各类电子跃迁的能量大小见下图:
E * > En > E
*
*
> En *
通常有机分子处于基态,电子填入成键或 非键轨道。但有机分子吸收UV后,则受激发变为
激发态,电子进入反键轨道。
苯环最重要的吸收带是B带,虽然强度不高但具有 精细结构很典型。
当苯环上有羟基、氨基等取代基时,吸收峰红移, 吸收强度增大,取代基不同,变化程度不同,可 由此鉴定各种取代基。 例: λmax B带 λmax E 2带
苯
甲苯
254
262
204
208
苯酚
苯甲酸
271
272
213
230
六、推测不饱和化合物λmax峰位的经验规 则
一、饱和烃
饱和烃只能产生σ→ σ* 跃迁,吸收带的位置
在150 nm左右,在远紫外区,超出仪器测定能力。
例如: 甲烷的C—H σ→ σ* 跃迁入max为125nm 乙烷的C—C σ→ σ*跃迁入max 为135nm
2、脂肪醇、胺和卤化物
当σ键与杂原子在一起时,因杂原子氧、氮、 硫、氯等具有非成键电子(n电子),所以,可发生 σ→σ*和 n → σ*两种跃迁。显然n → σ*跃迁
CH3 OH CH=CH2 E2 ´ ø £ º lmax 208nm( e 2460) E2 ´ ø £ º lmax 210nm( e 6200) K´ ø £ º lmax 244nm( e 12000)
识别上述几种吸收带,对推导有机化合物的结 构将会有很大的帮助。
五、各类有机化合物的紫外吸收
可以跃迁的电子有:电子, 电子和n电子。跃迁
的类型有: *, n *, *, n*。
各类电子跃迁的能量大小见下图:
E * > En > E
*
*
> En *
通常有机分子处于基态,电子填入成键或 非键轨道。但有机分子吸收UV后,则受激发变为
激发态,电子进入反键轨道。
紫外吸收光谱

第二章 紫外吸收光谱UV
紫外吸收光谱的基本知识 紫外吸收光谱的基本原理 影响紫外吸收光谱的因素
各类有机化合物的紫外吸收光谱
紫外吸收光谱的应用
一、紫外吸收光谱的基本知识
1.概述
紫外吸收光谱:分子价电子能级跃迁。
分子中价电子经紫外或可见光照射时,电子从低能级跃
迁到高能级,此时电子就吸收了相应波长的光,这样产 生的吸收光谱叫紫外吸收光谱。 波长范围:10-800 nm. (1) 远紫外光区: 10-200nm
C
n<p
O
C
C
p
n >p p
n
n
p p
p
n
p
p
C
O 非极性
C
极性
max(氯仿)
C
p
极性
max(水)
非极性
max(甲醇)
n → p*跃迁:兰移; ;e
max(正己烷)
p → p*跃迁:红移; ;e 237 309 243 305
pp* np*
即: E=Ee+Ev+Er ΔΕe>ΔΕv>ΔΕr
能级跃迁
电子能级间跃迁 的同时,总伴随有振 动和转动能级间的跃 迁。即电子光谱中总 包含有振动能级和转 动能级间跃迁产生的
若干谱线而呈现宽谱
带。
讨论:
(1) 转动能级间的能量差Δ Ε r:0.005~0.050eV,跃 迁产生吸收光谱位于远红外区。远红外光谱或分子转动光 谱; (2) 振动能级的能量差Δ Ε v约为:0.05~1eV,跃迁 产生的吸收光谱位于红外区,红外光谱或分子振动光谱; (3) 电子能级的能量差Δ Ε e较大1~20eV。电子跃迁产
只能被真空紫外分光光度计检测到;
紫外吸收光谱的基本知识 紫外吸收光谱的基本原理 影响紫外吸收光谱的因素
各类有机化合物的紫外吸收光谱
紫外吸收光谱的应用
一、紫外吸收光谱的基本知识
1.概述
紫外吸收光谱:分子价电子能级跃迁。
分子中价电子经紫外或可见光照射时,电子从低能级跃
迁到高能级,此时电子就吸收了相应波长的光,这样产 生的吸收光谱叫紫外吸收光谱。 波长范围:10-800 nm. (1) 远紫外光区: 10-200nm
C
n<p
O
C
C
p
n >p p
n
n
p p
p
n
p
p
C
O 非极性
C
极性
max(氯仿)
C
p
极性
max(水)
非极性
max(甲醇)
n → p*跃迁:兰移; ;e
max(正己烷)
p → p*跃迁:红移; ;e 237 309 243 305
pp* np*
即: E=Ee+Ev+Er ΔΕe>ΔΕv>ΔΕr
能级跃迁
电子能级间跃迁 的同时,总伴随有振 动和转动能级间的跃 迁。即电子光谱中总 包含有振动能级和转 动能级间跃迁产生的
若干谱线而呈现宽谱
带。
讨论:
(1) 转动能级间的能量差Δ Ε r:0.005~0.050eV,跃 迁产生吸收光谱位于远红外区。远红外光谱或分子转动光 谱; (2) 振动能级的能量差Δ Ε v约为:0.05~1eV,跃迁 产生的吸收光谱位于红外区,红外光谱或分子振动光谱; (3) 电子能级的能量差Δ Ε e较大1~20eV。电子跃迁产
只能被真空紫外分光光度计检测到;
第二章--紫外光谱

λmax =258nm(ε=35000),
这组数据对应于下面哪个化合物?
AC2 HC2 H B C 2 C H C H C H C H C H 2H
C
CH CH
D
CC HC HC HH
?4
乙酰乙酸乙酯存在酮式和烯醇式互变异 构体,今有两张紫外光谱图,一张在 204nm有弱吸收,另一张在245nm有强吸 收,请判断哪一张是烯醇式。
优点是仪器普及、操作 简单而且灵敏度高
Chapter 2 紫外光谱
§2-1紫外吸收光谱的基本知识 §2-2常见有机物的紫外吸收光谱 §2-3溶剂对吸收光谱的影响 §2-4紫外光谱的解析与应用
§2-1紫外吸收光谱的基本知识
紫外吸收光谱是由于分子中价电子的跃 迁而产生的。 一、紫外吸收光谱的波长范围 二、紫外光谱图的组成 三、电子跃迁的类型 四、常用术语
σ*
σ*
E
л*
n л
σ
σ
C3C H2C HH=2C C2C H H2C H C3H H CH3OC3H
N(C 2CH 3 H )3
§2-2常见有机物的紫外吸收光谱
一、饱和烃及其取代衍生物 二、不饱和烃 三、羰基化合物 四、芳香烃的紫外光谱
一、饱和烃及其取代衍生物
★饱和烃的最大吸收峰一般小于190nm,处于真空紫外 区。如甲烷125nm,乙烷135nm。
甲苯的U图
?
图2-7 a 苯的紫外光谱图 b取代苯与苯紫外光谱的比较
分析:
H C
H H
苯环与甲基的超共轭效应
3、助色团取代苯的紫外光谱
★助色团含有孤电子对,它能与苯环 π 电子 共轭。使 B 带、E 带均移向长波方向。且吸 收强度都增加,精细结构消失。例如苯胺
这组数据对应于下面哪个化合物?
AC2 HC2 H B C 2 C H C H C H C H C H 2H
C
CH CH
D
CC HC HC HH
?4
乙酰乙酸乙酯存在酮式和烯醇式互变异 构体,今有两张紫外光谱图,一张在 204nm有弱吸收,另一张在245nm有强吸 收,请判断哪一张是烯醇式。
优点是仪器普及、操作 简单而且灵敏度高
Chapter 2 紫外光谱
§2-1紫外吸收光谱的基本知识 §2-2常见有机物的紫外吸收光谱 §2-3溶剂对吸收光谱的影响 §2-4紫外光谱的解析与应用
§2-1紫外吸收光谱的基本知识
紫外吸收光谱是由于分子中价电子的跃 迁而产生的。 一、紫外吸收光谱的波长范围 二、紫外光谱图的组成 三、电子跃迁的类型 四、常用术语
σ*
σ*
E
л*
n л
σ
σ
C3C H2C HH=2C C2C H H2C H C3H H CH3OC3H
N(C 2CH 3 H )3
§2-2常见有机物的紫外吸收光谱
一、饱和烃及其取代衍生物 二、不饱和烃 三、羰基化合物 四、芳香烃的紫外光谱
一、饱和烃及其取代衍生物
★饱和烃的最大吸收峰一般小于190nm,处于真空紫外 区。如甲烷125nm,乙烷135nm。
甲苯的U图
?
图2-7 a 苯的紫外光谱图 b取代苯与苯紫外光谱的比较
分析:
H C
H H
苯环与甲基的超共轭效应
3、助色团取代苯的紫外光谱
★助色团含有孤电子对,它能与苯环 π 电子 共轭。使 B 带、E 带均移向长波方向。且吸 收强度都增加,精细结构消失。例如苯胺
第二章+紫外吸收光谱
第二章 紫外光谱与荧光光谱
物质吸收紫外/可见光引起电子能级间的 跃迁而产生的吸收光谱叫紫外/可见光谱。
2.1 紫外吸收光谱的基本概念和原理
一、紫外与可见光波波长范围:
远紫外光区
近紫外光区
可见光区
10 nm 190 nm
400 nm
800 nm
波长10-190 nm范围内的为远紫外区(真空紫外区)
波长190-400 nm范围内的为近紫外区(石英紫外区 )
芳香族化合物的π→π*跃迁。
B带波长230~ 270 nm, 中心在 254 nm, ε ≈204 E带把苯环看成乙烯键和共轭乙烯键π →π* 跃迁引
起的吸收带
2. 2 各类有机化合物的紫外吸收
一、饱和化合物
饱和烷烃 σ→σ*跃迁,λmax〈190 nm 饱和卤代烃、醇、胺等。
化合物 n→σ* εmax
3、选择定则
(1)电子自旋允许跃迁 电子在跃迁过程中,要求自旋方向保持不变。
S0 S1,S0 S2,T1 T2 跃迁允许 S0 T1,S0 T2 禁阻跃迁
(2)对称性允许 允许跃迁要求电子只能在对称性不同性的不同能级间 进行。
g u:σ σ π π 跃迁允许
g g, u u : n π禁阻跃迁
三、紫外光谱的产生和电子跃迁的类型
253 nm
1个延长双键 30
3个环外双键 3 ×5
5个取代基 5×5
323 nm
实测值 320nm
253 + 3 ×5 + 5×5 =293 nm 实测值285nm
2、α,β-不饱和醛、酮最大λmax的计算
注:
(1)环上羰基不作为环外双键。 (2)有两个可供选用的α,β-不饱和羰基母体时,应 优先选择具有波长较长的作母体。例:
物质吸收紫外/可见光引起电子能级间的 跃迁而产生的吸收光谱叫紫外/可见光谱。
2.1 紫外吸收光谱的基本概念和原理
一、紫外与可见光波波长范围:
远紫外光区
近紫外光区
可见光区
10 nm 190 nm
400 nm
800 nm
波长10-190 nm范围内的为远紫外区(真空紫外区)
波长190-400 nm范围内的为近紫外区(石英紫外区 )
芳香族化合物的π→π*跃迁。
B带波长230~ 270 nm, 中心在 254 nm, ε ≈204 E带把苯环看成乙烯键和共轭乙烯键π →π* 跃迁引
起的吸收带
2. 2 各类有机化合物的紫外吸收
一、饱和化合物
饱和烷烃 σ→σ*跃迁,λmax〈190 nm 饱和卤代烃、醇、胺等。
化合物 n→σ* εmax
3、选择定则
(1)电子自旋允许跃迁 电子在跃迁过程中,要求自旋方向保持不变。
S0 S1,S0 S2,T1 T2 跃迁允许 S0 T1,S0 T2 禁阻跃迁
(2)对称性允许 允许跃迁要求电子只能在对称性不同性的不同能级间 进行。
g u:σ σ π π 跃迁允许
g g, u u : n π禁阻跃迁
三、紫外光谱的产生和电子跃迁的类型
253 nm
1个延长双键 30
3个环外双键 3 ×5
5个取代基 5×5
323 nm
实测值 320nm
253 + 3 ×5 + 5×5 =293 nm 实测值285nm
2、α,β-不饱和醛、酮最大λmax的计算
注:
(1)环上羰基不作为环外双键。 (2)有两个可供选用的α,β-不饱和羰基母体时,应 优先选择具有波长较长的作母体。例:
紫外吸收
一分子中,σ 与 σ*的能量差最大,相应跃迁需要的能量最高;n 与 π*的能量差最 小,相应跃迁需要的能量最低。
σ*
反键轨道
π*
En
↑↓
π
↑↓
σ
↑↓
非键轨道 成键轨道
2
安徽师范大学
化学与材料科学学院
杨高升
常见有机化合物的紫外光谱吸收带主要有以下几种类型: 1. 远紫外(真空紫外)吸收带 最大吸收波长 < 200 nm,处于真空紫外区。主
2. 溶液酸度的影响 溶液酸度的变化可以改变某些有机化合物的存在形式,并导
致谱带发生位移。最典型的就是酚和芳香胺类化合物。例如
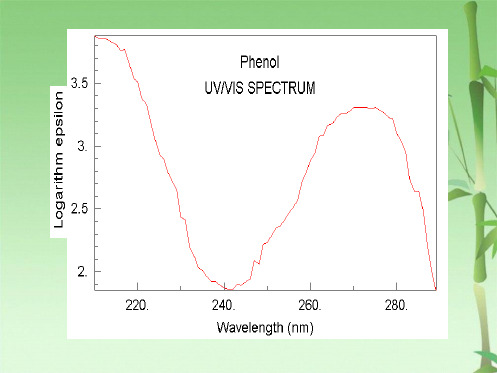
苯酚:
E2带 λmax (ε)
OH
211 nm (6200)
B 带 λmax (ε) 270 nm (1450)
−H+
苯胺:
O-
236 nm (9400)
287 nm (2600)
要是 σ→σ*跃迁引起的,是烷烃的吸收带。 2. 尾端(末端)吸收带 最大吸收波长虽在真空紫外区,但靠近 200 nm,吸收
带的尾部进入近紫外区。主要由 n→σ*跃迁引起,是含杂原子的饱和化合物的 吸收带。如饱和卤代烃、醇、胺等。 3. R 带 最大吸收波长 > 270 nm 的弱吸收带,摩尔吸光系数 ε 很小,一般 < 100。 由 n→π*跃迁引起,是含杂原子的不饱和化合物的吸收带。如醛、酮、硝基及 亚硝基化合物等。 4. K 带 最大吸收波长 > 200 nm 的强吸收带,摩尔吸光系数 ε 很大,一般 > 10000。由共轭体系的 π→π*跃迁引起,是共轭不饱和化合物的吸收带。如共 轭烯烃、共轭的不饱和羰基化合物等。 5. B 带 最大吸收波长 > 200 nm、强度中等且常伴有精细结构的宽吸收带,摩 尔吸光系数 ε 较小,一般 250 ~ 3000 之间。由芳环和芳香杂环化合物 π→π*跃 迁引起的,是芳环和芳香杂环化合物的特征吸收带。如苯的 B 带在 230 ~ 270 nm,为含有多重峰或精细结构的宽吸收带。 6. E带 也是芳香结构的特征吸收带。都是芳香体系中π→π*跃迁引起的。特点 是摩尔吸光系数ε很大,一般 > 10000。E带可分为E1带和E2带。如苯的E带就 有两个:184 nm(E1带,烯带,简单看作是乙烯的π→π*跃迁引起的)、204 nm
σ*
反键轨道
π*
En
↑↓
π
↑↓
σ
↑↓
非键轨道 成键轨道
2
安徽师范大学
化学与材料科学学院
杨高升
常见有机化合物的紫外光谱吸收带主要有以下几种类型: 1. 远紫外(真空紫外)吸收带 最大吸收波长 < 200 nm,处于真空紫外区。主
2. 溶液酸度的影响 溶液酸度的变化可以改变某些有机化合物的存在形式,并导
致谱带发生位移。最典型的就是酚和芳香胺类化合物。例如
苯酚:
E2带 λmax (ε)
OH
211 nm (6200)
B 带 λmax (ε) 270 nm (1450)
−H+
苯胺:
O-
236 nm (9400)
287 nm (2600)
要是 σ→σ*跃迁引起的,是烷烃的吸收带。 2. 尾端(末端)吸收带 最大吸收波长虽在真空紫外区,但靠近 200 nm,吸收
带的尾部进入近紫外区。主要由 n→σ*跃迁引起,是含杂原子的饱和化合物的 吸收带。如饱和卤代烃、醇、胺等。 3. R 带 最大吸收波长 > 270 nm 的弱吸收带,摩尔吸光系数 ε 很小,一般 < 100。 由 n→π*跃迁引起,是含杂原子的不饱和化合物的吸收带。如醛、酮、硝基及 亚硝基化合物等。 4. K 带 最大吸收波长 > 200 nm 的强吸收带,摩尔吸光系数 ε 很大,一般 > 10000。由共轭体系的 π→π*跃迁引起,是共轭不饱和化合物的吸收带。如共 轭烯烃、共轭的不饱和羰基化合物等。 5. B 带 最大吸收波长 > 200 nm、强度中等且常伴有精细结构的宽吸收带,摩 尔吸光系数 ε 较小,一般 250 ~ 3000 之间。由芳环和芳香杂环化合物 π→π*跃 迁引起的,是芳环和芳香杂环化合物的特征吸收带。如苯的 B 带在 230 ~ 270 nm,为含有多重峰或精细结构的宽吸收带。 6. E带 也是芳香结构的特征吸收带。都是芳香体系中π→π*跃迁引起的。特点 是摩尔吸光系数ε很大,一般 > 10000。E带可分为E1带和E2带。如苯的E带就 有两个:184 nm(E1带,烯带,简单看作是乙烯的π→π*跃迁引起的)、204 nm
第二章紫外吸收光谱
解:醇反应失水可经过下面两种途径:
CH3
H+
C OH
CH3
CH3 C OH2+ H2C H
CH3 C CH2 + H2O
A
CH3 C OH CH3
H+ H
CH3 C OH2+ CH3
CH3 C
CH3 B
+ H2O
计算:A max = 214nm + (3×5)nm = 229nm
B max = 214nm + (4×5)nm = 239nm
只能被真空紫外分光光度计检 测到,在紫外区透明,可作为溶 剂使用;
E K
s*
p*
R
n
p
s
n→σ*跃迁
所需能量较大; 吸收波长为150~250nm,大部分在远紫外区, 近紫外区仍不易观察到; 含非键电子的饱和烃衍生物(含N、O、S和卤素 等杂原子)均呈现n→σ* 跃迁。
化合物 H2O
CH3OH CH3CL
s s*
p p*
n s*
n p*
800nm
紫外光谱适用于在200-400nm 区域有吸 收的不饱和分子体系, 特别是具有共轭结构 的化合物。
σ→σ*跃迁
所需能量最大;σ电子只有吸收远紫外光的 能量才能发生跃迁; 饱和烷烃的分子吸收光谱出现在远紫外区; 吸收波长λ<200 nm;
例:甲烷的λmax为125nm , 乙烷 λmax为135nm。
化合物B更接近实验值242nm,产物应为B。
例2. 某化合物分子式为C7H10O,经红外光谱测定含有 酮羰基、甲基及碳碳双键,但不能肯定是六元环酮还
是开链脂肪酮。其紫外吸收max(EtOH)=257nm(>104), 试推测其结构。
CH3
H+
C OH
CH3
CH3 C OH2+ H2C H
CH3 C CH2 + H2O
A
CH3 C OH CH3
H+ H
CH3 C OH2+ CH3
CH3 C
CH3 B
+ H2O
计算:A max = 214nm + (3×5)nm = 229nm
B max = 214nm + (4×5)nm = 239nm
只能被真空紫外分光光度计检 测到,在紫外区透明,可作为溶 剂使用;
E K
s*
p*
R
n
p
s
n→σ*跃迁
所需能量较大; 吸收波长为150~250nm,大部分在远紫外区, 近紫外区仍不易观察到; 含非键电子的饱和烃衍生物(含N、O、S和卤素 等杂原子)均呈现n→σ* 跃迁。
化合物 H2O
CH3OH CH3CL
s s*
p p*
n s*
n p*
800nm
紫外光谱适用于在200-400nm 区域有吸 收的不饱和分子体系, 特别是具有共轭结构 的化合物。
σ→σ*跃迁
所需能量最大;σ电子只有吸收远紫外光的 能量才能发生跃迁; 饱和烷烃的分子吸收光谱出现在远紫外区; 吸收波长λ<200 nm;
例:甲烷的λmax为125nm , 乙烷 λmax为135nm。
化合物B更接近实验值242nm,产物应为B。
例2. 某化合物分子式为C7H10O,经红外光谱测定含有 酮羰基、甲基及碳碳双键,但不能肯定是六元环酮还
是开链脂肪酮。其紫外吸收max(EtOH)=257nm(>104), 试推测其结构。
有机波谱解析-第二章 紫外光谱
中,极性溶剂对电荷分散体系的稳定能力使激发态的能量降低 程度大于基态能量降低程度。导致,△E较在非极性溶剂中减 小,吸收带红移。
C
Hale Waihona Puke n<pOC
C
p*
n > p p*
n
n C
p* p
p*
n
p n 非极性
p
O 非极性
C C
p
极性
极性
n → p*跃迁:兰移; ; pp np
(4)尽量和文献中所用的溶剂一致。
(5)溶剂挥发性小、不易燃、无毒性、价格便宜。
5. 电子跃迁的类型
紫外吸收光谱是由价电子的能级跃迁而产生的,有机化 合物的紫外—可见吸收光谱是三种电子跃迁的结果:σ电子、 π电子、n电子。 s* n p* H C O
s
p E 分子轨道理论:成键轨道—反键轨道。
各种电子能级的能量及电子跃迁类型如右图
3. 紫 外 光 谱 图
横坐标:波长或频率 纵坐标:吸光度(A) 或 透过率(T)
紫外光谱(图)的特点: 吸收谱带少; 吸收谱带宽; 通常以谱带吸收最强的波长表示谱带位置,称 为最大吸收波长(λmax) ,是分子的特征常数, 与分子电子结构相关,可推测化合物中生色团类 型和共轭大小; 吸收强度以最大吸收波长处的摩尔吸光系数 (εmax)表示,也是分子特征常数和鉴定化合物 的重要依据。
H H c H
取代基 红移距离 -SR 45(nm)
c H
max=162nm 助色基团取代 p
-NR2 40(nm) -OR 30(nm)
p*(K带)发生红移。
-Cl 5(nm) CH3 5(nm)
(2)共轭烯烃中的
p → p*
C
Hale Waihona Puke n<pOC
C
p*
n > p p*
n
n C
p* p
p*
n
p n 非极性
p
O 非极性
C C
p
极性
极性
n → p*跃迁:兰移; ; pp np
(4)尽量和文献中所用的溶剂一致。
(5)溶剂挥发性小、不易燃、无毒性、价格便宜。
5. 电子跃迁的类型
紫外吸收光谱是由价电子的能级跃迁而产生的,有机化 合物的紫外—可见吸收光谱是三种电子跃迁的结果:σ电子、 π电子、n电子。 s* n p* H C O
s
p E 分子轨道理论:成键轨道—反键轨道。
各种电子能级的能量及电子跃迁类型如右图
3. 紫 外 光 谱 图
横坐标:波长或频率 纵坐标:吸光度(A) 或 透过率(T)
紫外光谱(图)的特点: 吸收谱带少; 吸收谱带宽; 通常以谱带吸收最强的波长表示谱带位置,称 为最大吸收波长(λmax) ,是分子的特征常数, 与分子电子结构相关,可推测化合物中生色团类 型和共轭大小; 吸收强度以最大吸收波长处的摩尔吸光系数 (εmax)表示,也是分子特征常数和鉴定化合物 的重要依据。
H H c H
取代基 红移距离 -SR 45(nm)
c H
max=162nm 助色基团取代 p
-NR2 40(nm) -OR 30(nm)
p*(K带)发生红移。
-Cl 5(nm) CH3 5(nm)
(2)共轭烯烃中的
p → p*
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苯在乙醇中的紫外吸收光谱
第三节 影响紫外吸收光谱的因素
一、共轭效应的影响
1. 电子共轭体系增大,max红移,max增大
共轭效应的结果是电 子离域到多个原子之 间,导致* 能量 降低,同时跃迁几率 增大, max增大。
E2带: max203nm左右, max 7400。是苯环中共轭二烯引起 的 → * 跃迁。该带相当K带。当苯环引入发色团时,与苯 环共轭,E2带移至220 ~ 250nm, ε>l0000,此时亦称为K带。
紫外光谱谱带有: B带 值约250 ~ 3000 E带 值约2000 ~ 10000 K带 值约10000 (或大于10000) R带 值<100
CH3
max=280nm
<100
电子跃迁类型与吸收峰波长关系如下:
跃迁类型
* n * π * (孤立双键) n *
吸收波长(nm)
< 200 < 200 < 200 (强吸收) 200—400 (弱吸收)
E
*
*
* 4
* 3
n
2
1
C-C
C=C C=O
能级跃迁图
C=C-C=C
四、常用光谱术语及谱带分类
A= ㏒(I0/I)=abc
式中:A:吸光度 I0:入射光强度 I:透射光强度 a:吸光系数 b:吸收池厚度(cm) c:被测物质浓度g/L I0/I:透射比,用T表示
如果浓度用mol/L为单位,则上式可写成:A= bc :为摩尔吸光系数,单位为:L·moL-1·cm-1
三、电子跃迁(transition)类型
3. 紫外吸收光谱常用于共轭体系的定量分析,灵 敏度高,检出限低。
三、紫外吸收曲线
紫外吸收光谱以波长(nm)为横坐标,以吸光度A或 吸收系数为纵坐标。见下图:
光谱曲线中最大吸收 峰所对应的波长相当于跃 迁时所吸收光线的波长称 为max和max相应的摩尔 吸收系数为max。
max>104为强吸收, max<103为弱吸收。曲 线中的谷称为吸收谷或最 小吸收(min),有时在曲 线中还可看到肩峰(sh)。
近紫外区(200~400nm):在此波长范围内,玻璃有吸收,一 般用石英比色器,因此称近紫外区为石英紫外区,近紫外区 最为有用,通常所谓的紫外光谱就是指近紫外区的光谱。
2. 紫外光谱 以波长10~400nm的电磁波照射物质分子,即以紫外光
照射物质分子,由分子的电子能级跃迁而产生的光谱叫紫 外光谱。紫外光谱是电子光谱的一部分,可见光谱也是电 子光谱,电子光谱是由电子跃迁而产生的吸收光谱的总称。
1. 常用光谱术语
(1)发色团(chromophore),也称生色团(基)。
是指分子中某一基团或体系,由于其存在能使分子 产生吸收而出现谱带,这一基团或体系即为生色团。
有机化合物分子中,这些生色基的结构特征大都是 含有π电子。如:C=C、C=O、COOH、COOR、NO2、 N=N、芳基等。
(2)助色团(auxochrome)
第二章 紫外吸收光谱
仪器
紫外-可见分光光度计
UNICO UV-2100型紫外-可见分光光度计
第一节 概述
一、紫外光与紫外光谱
1. 紫外光:介于X射线的长波区段与可见光的短波区段之间。 波长为10~400nm的光波(即电磁波)。 1nm=10-7cm=10-9m 1Å =10-1nm=10-10m
分子的紫外吸收光谱是由于分子中价电子的跃迁而产生
的,从化学键的性质上考虑,与电子光谱有关的主要是三种 电子:
(1)形成单键的电子
(2)形成双键的电子
(3)分子中非键电子即n电子
化合物不同,所含的价电子类型不同,所产生的电子跃 迁类型不同,三种电子可以用甲醛分子示例如下:
HC 电子 H
n电子
..
.O . π电子
①B吸收带
由苯的→* 跃迁和振动效应的重叠引起,为一宽 峰并出现若干小峰,在230 ~ 270nm之间,中心在254nm 处, max250左右。是苯环的特征峰。
苯环被取代后,精细结构消失或部分消失。B带常 用来识别芳香族化合物。
②E吸收带:又分为E1和E2带
E1带:即乙烯带(Ethylenic band)。 max=184nm左右, logε>4。为苯环的特征谱带,吸收强度较大。当苯环上有 助色团时,向长波方向移至200 ~ 220nm。
图 双原子分子三种能级跃迁示意图
讨论
(1)转动能级间的能量差ΔEr:0.005~0.050eV,跃 迁产生吸收光谱位于远红外区。远红外光谱或分子转 动光谱;
(2)振动能级的能量差ΔEv约为:0.05~1eV,跃 迁产生的吸收光谱位于红外区,红外光谱或分子振 动光谱;
(3)电子能级的能量差ΔEe较大1~20eV。电子跃 迁产生的吸收光谱在紫外—可见光区,紫外—可见 光谱或分子的电子光谱。
(3)红移(red shift or bathochromic shift) 由于取代基作用或溶剂效应导致生色基的吸收峰向长
波移动的现象称为红移。 红移一般是由于共轭体系延长或增加了助色基引起。
(4)蓝移(blue shift or hypsochromic shift) 生色基吸收峰向短波方向的移动称为紫移动或蓝移。
图 紫外—可见吸收曲线
吸收曲线的讨论:
同一种物质对不同波长光的吸光度不 同。吸光度最大处对应的波长称为最 大吸收波长max
不同浓度的同一种物质,其吸收曲线 形状相似max不变。而对于不同物质, 它们的吸收曲线形状和max则不同。
吸收曲线可以提供物质的结构信息,并作为物质定性分析的依据之一。
不同浓度的同一种物质,在某一定波长下吸光度A有差异,在max处吸 光度A 的差异最大。此特性可作为物质定量分析的依据。 在max处吸光度随浓度变化的幅度最大,所以测定最灵敏。吸收曲线 是定量分析中选择入射光波长的重要依据。
是指在紫外一可见光区内不一定产生吸收。但当它与 生色团相连时能使生色基的吸收谱带明显地向长波移动, 而且吸收强度也相应的增加。
助色团的特点在于通常都含有n电子。由于n电子与电 子的P-共轭效应导致→*跃迁能量降低,生色基的吸收 波长向长波移动,颜色加深。
常见的助色基有OH、OR、X、NH2、NO2、SH等含有 n电子的基团。
如:CH4 max=125nm C2H6 max=135nm
饱和碳氢化合物的紫外光谱在远紫外光区。
2. n * 跃迁
电子由n非键轨道跃迁到*轨道,称为n→*跃迁,具有未共用
电子对的取代基,例含S,N,O和X等杂原子的饱和有机化合物
会发生这类跃迁。实现跃迁需要的能量较 → *小,这类化合
物一般在紫外光区有吸收,但大部分在远紫外区,吸收带较弱。
光谱区 X-射线 远紫外 近紫外 可见光区
波长范围 1.0-100Å 10-200nm 200-400nm 400-800nm 跃迁类型 内层电子 外层电子 外层电子 外层电子
谱型 X-射线谱 紫外光谱 紫外光谱 可见光谱
紫外光区包括近紫外(200~400nm)远紫外(10~200nm)两 个区段
远紫外区(10~200nm):在此波长范围内,大气有吸收,必 须在真空条件下操作,普通仪器观察不到,对仪器要求高, 远紫外也叫真空紫外区,所以远紫外区在普通有机化合物机 构分析上没有应用。
(6)吸收谱带强度与该物质分子吸收的光子数成正 比,定量分析的依据。
(7)当分子在入射光的作用下发生了价电子跃迁, 也就是说分子中价电子由低能级E0跃迁到高能级E1 (激发态),根据量子理论电子在跃迁时所吸收的
能量不是连续的,而是量子化的,即所吸收的光子 能量等于两个能级的差值:
△E= E1- E0=hv=h·c/
第二节 紫外吸收光谱的基本原理
一、紫外吸收光谱的产生
吸光物质分子吸收特定能量(波长)的电磁 波(紫外光)产生分子的电子能级跃迁。
一个分子有一系列能级,其中包括许多电子 能级,分子振动能级以及分子转动能级。
n=2
纯转动跃迁 0.05ev以下
4 纯电子跃迁
3
1-20ev
2
1 纯振动跃迁 0.05-1ev n=1
CH2=CH-CH=CH2
max 223 (ε22600)
CH2=CH-CH=CH-CH=CH2 max 258 (ε35000)
(3)B吸收带(Benzenoid band,苯型谱带)和E吸收带 (Ethylenic band,乙烯型谱带)
均为芳香化合物的 →*吸收带,苯环有三个→* 跃 迁的吸收峰。
(v =c/)
式中:h=Plank常数=6.62×10-27尔格·秒 c=光速 3×1010cm
=波长 用nm表示
v=频率 用 周/秒(Cps)或赫兹(Hz) E=能量 单位为尔格,电子伏特eV或卡/摩尔
二、紫外光谱的特征
符合朗伯-比尔定律(Lambert-Beer’s Law), 这是吸收光谱的基本定律,用数学公式表示为:
(4)吸收光谱的波长分布是由产生谱带的跃迁能级 间的能量差所决定,反映了分子内部能级分布状况, 是物质定性的依据;
(5)吸收谱带强度与分子偶极矩变化、跃迁几率有关, 也提供分子结构的信息。通常将在最大吸收波长处测得
的摩尔吸光系数max也作为定性的依据。不同物质的λmax 有时可能相同,但max不一定相同;
CH3CHO
maxheptane 291nm, 11
CH2=CH-CHO maxEtoH
315nm, 14
(2)K吸收带(Konjugierte,德文,共轭的)
由→* 跃迁引起的吸收带,产生该吸收带的发色团是 分子中共轭系统。
该带的特点是吸收峰强度很强, ≥10000(log ≥4)。
孤立双键的→* 跃迁一般在<200 nm,共轭双键增加时, 不但发生红移,而且强度也加强。
