极性键与极性分子
键的极性和分子的极性

键的极性和分子的极性在H2(或I2)分子中,两个成键的H原子(或I原子)对共用电子对的吸引能力是相等的,整个分子的正电荷中心和负电荷中心是重合的,这种分子为非极性分子,H-H(或I-I)键为非极性共价键。
但HI分子则是极性分子,H-I键是极性共价键。
因为I的电负性(2.5)大于H(2.1),所以H-I键的共用电子对偏向于I的一端。
或者说HI分子中,I端显负性,而H端为正性。
凡由电负性不同的两个原子形成的共价键为极性共价键,它们的共用电子对偏向电负性大的一方,使电负性大的原子带部分负电荷,电成键原子的电负性差值(△χ)越大,键的极性就越大。
当0<△χ<1.7时,为极性共价键;当△χ>1.7时,电子对将完全偏于电负性大的原子一边,这就和离子键一样了。
例如Cl的电负性为3.0,Na为0.9,Mg为1.2,Na和Cl,Mg和Cl之间△χ值都大于1.7,因而都形成离子键。
由此可见离子键和共价键虽然是两种不同的化学键,但它们之间有联系,从离子键到共价键有递变关系。
例如BeCl2中的Be(χ=1.5)和Cl之间△χ为1.5,Be和Cl 原子形成极性很强的共价键,BeCl2在室温虽是固体,但熔点(405℃)比离子化合物如MgCl2(714℃),CaCl2(782℃)低得多,BeCl2的性质可以说是介于离子化合物和共价化合物之间的过渡状态。
键的极性是一种“矢量”,不但有大小,还有方向,它的方向用从正极到负极的方向表示。
分子的极性与键的极性有关,在双原子分子中,键有极性,分子就有极性,如HI,HCl等。
但以极性键结合的多原子分子,是否有极性,还要看分子的空间构型,因为它决定键的方向。
若分子结构的对称性使键的极性互相抵消,则分子没有极性。
如CO2分中的C=O键是极性键,但由于CO2分子呈直线型对称结构,两个C=O键的极性大小相等,方向相反,互相抵消,整个分子就成了没有极性的非极性分子:下图列举了CH4,NH3和H2O分子的构型和键角。
化学键的极性与分子极性的影响

化学键的极性与分子极性的影响化学键的极性与分子极性在化学中起着重要的作用。
化学键的极性指的是在共有电子对中,由于原子的电负性差异而形成的带有正负极性的键。
而分子的极性是通过化学键的极性来决定的。
本文将介绍化学键的极性如何影响分子的极性,并探讨其在化学反应、物理性质和生物活性中的重要性。
一、化学键的极性对分子极性的影响化学键的极性取决于所连接的原子的电负性差异。
一般来说,原子的电负性越高,所形成的化学键就越极性。
在共价键中,如果两种原子的电负性相等,则形成一个非极性共价键;如果两种原子的电负性不等,则形成一个极性共价键。
当一个分子中存在不同种类的化学键时,分子整体的极性由这些化学键的极性之和决定。
例如,HCl分子中的氯原子具有更高的电负性,因此与氢原子形成极性共价键。
由于氯原子吸引电子的能力较强,电子更倾向于靠近氯原子,使氯原子带有负电荷,而氢原子则带有正电荷。
因此,HCl分子是极性的。
二、化学键的极性对化学反应的影响化学键的极性可以影响分子的反应性质。
极性共价键中的电子偏移使得带正电荷的原子更容易与其他物质发生反应。
例如,极性键中的氧原子往往容易被负离子引发反应。
此外,极性化学键的极性还影响着化学反应速率。
当一个分子中存在极性化学键时,通过极性键的解离和重新组合,使得化学反应更容易进行。
例如,醇和酸之间的酯化反应中,醇中的氧原子与酸中的氧原子形成极性化学键,促使反应更快进行。
三、化学键的极性对物理性质的影响化学键的极性也会影响物质的物理性质。
极性分子在溶解度、沸点、熔点等方面与非极性分子有很大的不同。
由于极性分子带有正负电荷,它们在溶剂中的溶解度往往更高。
此外,极性分子由于相互作用力更强,通常具有较高的沸点和熔点。
四、化学键的极性对生物活性的影响化学键的极性对生物体内发生的化学反应和生化过程至关重要。
分子的极性影响了其在生物体内的相互作用和传递。
例如,极性键可确定酶与底物之间的结合性质,从而影响反应的速率和效果。
键的极性和分子的极性ppt课件
例如氯化氢易溶于水难溶于汽油,碘易溶于CCl4 , 难溶于水。
C.极性分子在电场或磁场力的作用下会发生偏移。
自学: 科学视野—表面活性剂和细胞膜
思考: 1、什么是表面活性剂?亲水基团?疏水基团?肥皂和 洗涤剂的去污原理是什么? 2、什么是单分子膜?双分子膜?举例说明。 3、为什么双分子膜以头向外而尾向内的方式排列?
性
非极性分子
H2、N2、O2、 P4、C60
极性分子 CO、HCl
非极性分子 CO2、CH4
极性分子 HCN、H2O、
NH3、CH3Cl
对于ABn型分子极性判别方法
(1)孤对电子法
在ABn型分子中,若中心原子A无孤对电子(未成对
电子),则是非极性分子,若中心原子A有孤对电子则是
极性分子。
例如:C02、CH4、SO3中心原子(C、S)无孤对电子, 是非极性分子。而像H20、NH3、NP3中心原子(O、N)有孤 对电子,则为极性分子。
直线型 直线型
非极性 极性
三原 子分 子
四原 子分 子
CO2
H2O NH3 BF3
极性 180º 直线型 非极性
极性 104º30’ V型 极性 107º18' 三角锥型
极性 极性
极性 120º 平面三角形 非极性
五原 子
CH4
极性
109º28 ' 正四面体型 非极性
(4)化合价法 ABn型分子中中心原子的化合价的绝
答案
• 1. 极性分子:HCl
• 非极性分子:H2 O2 Cl2 • 2. 都是非极性分子
• 3. 极性分子:HCN H2O NH3 • 非极性分子:CO2 BF3 CH4
键的极性与分子的极性

2.3.1 键的极性和分子的极性【学习目标】1、区分键的极性和分子的极性;2、掌握判断键的极性和分子的极性的方法;3、了解分子极性的应用。
【课前案——温故而知新】一、电负性1、含义:用来描述不同元素的原子对键合电子的大小。
2、递变规律:在元素周期表中,同主族元素,由上到下,原子的电负性依次;同周期元素,由左到右,原子的电负性依次。
3、判断化学键的类型:一般来说,当键合原子的电负性差值大于时,形成离子键;当键合原子的电负性差值小于时,形成共价键。
二、键的极性按照共价键中,将共价键分为极性共价键和非极性共价键。
1、非极性共价键:由(“相同”或“不同”)种原子形成的共价键,电子对(“有”或“无”)偏移。
2、极性共价键:由(“相同”或“不同”)种原子形成的共价键,电子对(“有”或“无”)偏移,极性键中的两个键合原子,电负性较大的原子呈(“正”或“负”,下同)电性,电负性较小的呈电性。
【课前检测】1、写出下列物质的电子式:① CCl4;②NH3;③H2O ;④CO2;⑤Na2O2;⑥Mg(OH)2。
2、有下列物质:①O2;②CO2;③NH3;④Na2O;⑤Na2O2;⑥NaOH;⑦CaBr2;⑧H2O2;⑨NH4Cl;⑩HBr,回答下列问题:(1)只含有极性键的是;(2)只含有非极性键的是;(3)含有极性键和非极性键的是;(4)只含有离子键的是;(5)含有非极性键的离子化合物是。
【课中案】一、分子的极性对于一个分子来说,可以设想它的全部正电荷集中于一点,叫做正电荷中心,它的全部负电荷集中于一点,叫做负电荷中心,但分子是电中性的。
1、极性分子:分子中正电中心和负电中心(“不重合”或“重合”),使分子的某一部分呈正电性(δ+),另一部分呈负电性(δ—)。
2、非极性分子:分子中正电中心和负电中心(“不重合”或“重合”)。
【注意】极性分子、非极性分子都显电中性,都不带电荷。
二、分子极性的判断方法1、物理模型法AB n分子,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断, F合=0,为非极性分子(极性抵消);F合≠0,为极性分子(极性不抵消)。
化学键的极性极性键与分子极性的关系

化学键的极性极性键与分子极性的关系化学键的极性与分子极性的关系化学键是分子中连接原子的力量,决定了分子的性质和化学反应。
极性是描述分子中化学键的电荷分布情况的一种概念。
极性键与分子极性之间存在着密切的关系。
一、化学键的极性化学键是由原子之间的电子共享或转移形成的。
根据电子的分布情况,化学键可以分为极性键和非极性键。
1. 非极性键非极性键是指在成键过程中,原子之间电子的共享是均等的,电子密度分布均匀。
这种化学键通常形成于两个原子电负性相等的情况下,如氢气(H2)中的两个氢原子之间的化学键。
2. 极性键极性键是指在成键过程中,原子之间电子的共享并不均等,形成了电荷分布不均的态势。
这种化学键通常形成于两个原子电负性不等的情况下。
典型的极性键包括氢氯化物(HCl)中氯原子和氢原子之间的化学键。
二、分子极性分子的极性取决于分子中所有化学键的极性以及分子的几何结构。
根据摩尔极化指数的大小,可以将分子的极性分为三种情况。
1. 非极性分子非极性分子是指分子中没有极性键或者所有极性键方向相互抵消,电荷分布均匀的分子。
这种分子的几何结构通常是线性或者正四面体,如二氧化碳(CO2)和四氟化碳(CF4)。
![二氧化碳和四氟化碳的示意图]2. 极性分子极性分子是指分子中至少存在一个极性键,导致分子中有部分正负电荷分离的情况发生。
这种分子的几何结构通常是非线性,并且具有非对称性,如水分子(H2O)和氨分子(NH3)。
![水分子和氨分子的示意图]3. 离子分子离子分子是指分子中存在正负电离子的分子。
这种分子中的极性键非常明显,分子中的正离子和负离子在空间分布上明显不对称,如氯化钠(NaCl)和硫酸铜(CuSO4)。
![氯化钠和硫酸铜的示意图]三、化学键极性与分子极性的关系化学键的极性直接影响了分子的极性。
当分子中所有化学键均为非极性键时,分子必然是非极性分子;当分子中至少存在一个极性键时,分子可能是极性分子或离子分子,取决于分子的几何结构。
键的极性与分子的极性化

键的极性与分子的极性化键的极性和分子的极性化是化学中一个重要的概念。
键的极性是指化学键中元素的电子密度分布是否不均匀,导致在键两端形成电荷分布不对称。
而分子的极性化则是指整个分子中所有键的极性叠加而形成的整体电荷分布不对称现象。
本文将探讨键的极性与分子的极性化之间的关系以及在化学中的应用。
一、键的极性及其影响键是化学反应中原子之间的相互作用,可以是共价键、离子键或金属键。
共价键中,电子是共享的,但并非始终是等量共享的,导致的结果是键两端带有部分正电荷和部分负电荷。
这就形成了键的极性。
键的极性对物质的性质有着重要的影响。
1. 电负性差异键的极性主要由连接原子的电负性差异所决定。
电负性是一个描述原子对电子亲和力的化学概念,描述的是原子吸引电子对的能力。
电负性差异越大,键的极性越强。
2. 极性化电子云键的极性导致了电子云分布的不对称。
较电负的原子更吸引电子云,导致在键两端形成一个部分正电荷,而较电负的原子附近则形成一个部分负电荷。
二、分子的极性化当一个分子中存在多个键,并且这些键的极性方向不同,这些极性会叠加而导致分子整体的极性化。
分子的极性化对分子的性质具有重要的影响。
1. 极性分子如果一个分子中所有键的极性都叠加为同一方向,那么这个分子就是极性分子。
一个极性分子往往具有部分正电荷和部分负电荷的极性部分。
2. 非极性分子如果一个分子中的键的极性叠加相互抵消,也就是说正电荷和负电荷的分布相互平衡,那么这个分子就是非极性分子。
非极性分子中并没有明显的电荷分布不均。
三、键的极性与分子的性质键的极性和分子的极性化在化学中的应用非常广泛,并且对于分子的性质有着重要的影响。
1. 溶解性极性分子通常在极性溶剂中具有较好的溶解性。
这是因为具有极性的分子可以与溶剂中的极性分子产生相互作用,从而更好地溶解。
2. 极性物质的沸点和熔点极性物质通常具有较高的沸点和熔点。
这是因为在极性分子中,分子间的作用力更强。
通过增加键的极性,可以提高分子间的作用力,进而提高沸点和熔点。
化学键的极性和分子极性的影响

化学键的极性和分子极性的影响化学键的极性和分子极性是化学中两个重要的概念,它们对于分子的性质和反应有着重要的影响。
本文将就化学键的极性和分子极性的定义以及它们对分子的性质和反应的影响进行探讨。
1. 化学键的极性化学键的极性指的是共价键中原子间电子的共享程度。
通过原子的电负性差异可以确定一个化学键的极性,电负性较高的原子会在共享电子对中吸引更多的电子,使得它在共享电子对中呈现负电荷,而电负性较低的原子则呈现正电荷。
极性化学键常见于非金属原子之间和金属与非金属原子之间的共价键中。
比如氢氟化物(HF)中,氟原子的电负性较高,呈现负电荷,而氢原子较电负性较低,呈现正电荷,因此HF的化学键是极性的。
化学键的极性对分子的性质和反应有着重要的影响。
2. 分子极性分子极性是指整个分子的极性,它取决于分子中所有化学键和它们的几何排列。
如果一个分子中存在两个或多个极性化学键,且这些化学键的方向不完全相反,那么这个分子就是极性的。
分子极性对于分子的物理性质和化学性质都有着重要的影响。
极性分子在溶剂中溶解度较高,而非极性分子在非极性溶剂中溶解度较高。
此外,极性分子具有较高的沸点和较低的融点,而非极性分子则相反。
极性分子在电场中会受到电场的影响,而非极性分子则不受电场的影响。
分子极性对于分子间相互作用也有着重要的影响。
极性分子之间的相互作用主要是静电作用,极性分子与非极性分子之间的相互作用则主要是范德华力。
这些相互作用的差异决定了分子在物理和化学反应中的行为。
3. 化学键极性和分子极性对反应的影响化学键极性和分子极性对化学反应的速率、方向和产物有着重要的影响。
在某些化学反应中,极性键的极性较高,使得键的断裂或形成更加容易,反应速率比较快。
而在非极性分子之间的反应中,键的断裂或形成相对困难,反应速率较慢。
另外,分子极性的差异也会影响反应的方向。
在极性分子中,具有较高电负性的部分会与其他分子中的正电荷或反电荷发生相互作用,从而影响反应的方向。
键的极性与分子极性
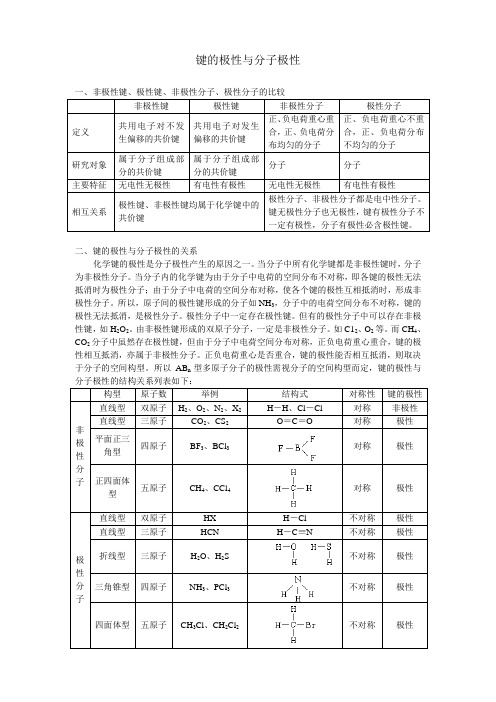
键的极性与分子极性一、非极性键、极性键、非极性分子、极性分子的比较非极性键极性键非极性分子极性分子定义共用电子对不发生偏移的共价键共用电子对发生偏移的共价键正、负电荷重心重合,正、负电荷分布均匀的分子正、负电荷重心不重合,正、负电荷分布不均匀的分子研究对象属于分子组成部分的共价键属于分子组成部分的共价键分子分子主要特征无电性无极性有电性有极性无电性无极性有电性有极性相互关系极性键、非极性键均属于化学键中的共价键极性分子、非极性分子都是电中性分子。
键无极性分子也无极性,键有极性分子不一定有极性,分子有极性必含极性键。
二、键的极性与分子极性的关系化学键的极性是分子极性产生的原因之一。
当分子中所有化学键都是非极性键时,分子为非极性分子。
当分子内的化学键为由于分子中电荷的空间分布不对称,即各键的极性无法抵消时为极性分子;由于分子中电荷的空间分布对称,使各个键的极性互相抵消时,形成非极性分子。
所以,原子间的极性键形成的分子如NH3,分子中的电荷空间分布不对称,键的极性无法抵消,是极性分子。
极性分子中一定存在极性键。
但有的极性分子中可以存在非极性键,如H2O2。
由非极性键形成的双原子分子,一定是非极性分子。
如C12、O2等。
而CH4、CO2分子中虽然存在极性键,但由于分子中电荷空间分布对称,正负电荷重心重合,键的极性相互抵消,亦属于非极性分子。
正负电荷重心是否重合,键的极性能否相互抵消,则取决于分子的空间构型。
所以AB n型多原子分子的极性需视分子的空间构型而定,键的极性与构型原子数举例结构式对称性键的极性非极性分子直线型双原子H2、O2、N2、X2 H-H、Cl-Cl 对称非极性直线型三原子CO2、CS2 O=C=O 对称极性平面正三角型四原子BF3、BCl3 对称极性正四面体型五原子CH4、CCl4 对称极性极性分子直线型双原子HX H-Cl 不对称极性直线型三原子HCN H-C≡N 不对称极性折线型三原子H2O、H2S 不对称极性三角锥型四原子NH3、PCl3 不对称极性四面体型五原子CH3Cl、CH2Cl2 不对称极性对于上述AB n型分子极性的判断也可用以下规律:⑴若中心原子(A)的化合价的绝对值等于该元素的主族序数,则为非极性分子;若不相等,则为极性分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2O2 CO2 NH3 BF3 H2O CHCl3 HCN
表观判断法
思考1:下列分子为极性分子还是非极性分子?
H2
Cl2
O2
P4
C60
以非极性键结合的非金属单质是非极性分子。
思考2:下列分子为极性分子还是非极性分子? HF HCl
以极性键结合的双原子分子是极性分子。
思考3:下列分子为非极性分子,请观察特点 SO3 CO2 CH4 BF3 BeCl2
教学目标
【知识与技能】 1.能够判断共价键的极性 2.能够判断分子的极性 【过程与方法】 举例 练习 动画 【情感态度与价值观】 本节是基础性知识,对后文的学习有重要作 用。
问题反馈
1.键有极性的根本? 2.共价键极性的大小? 3.如何判断分子的极性? 4.如何判断有机物的亲水基团和疏水基团?
一、键的极性
例题:下列元素间形成的共价键中,极性最强的是
() A.F―F
B.H―F
B
C.H―Cl D.H―O
极性:H―F > H―Cl > H―Br > H―I
二、分子的极性
问3:如何判断分子的极性?
定定义义判断法 极性分子:正电中心和负电中心不重合 非极性分子:正电中心和负电中心重合
1.画出该分子的立体构型。 2.找出所有显正价的原子和所有显负价的原子。 3.求出所有正价原子的几何中心和所有负价原子的 几何中心 4.如果重合,非极性分子;如果不重合极性分子。
ABn型且中心原子的化合价等于它的价电子数目。
[练习] 判断下列分子是极性分子还是 非极性分子:
PCl3、CCl4、CS2、SO2
非极性分子
小结:
键的极性 键角 决定 分子的空
间结构
决定 分子的 极性
三、表面பைடு நூலகம்性剂
问4:如何判断有机物的亲水基团和疏水基团?
1)易溶于水的官能团(即亲水基团)有—OH、—CHO、— COOH、—NH2。 (2)难溶于水的官能团(即憎水基团)有:所有的烃基 (—CnH2n+1、—CH=CH2、—C6H5等)、卤原子(—X)、硝基 (—NO )等。
练习:指出下列物质中键的类型 F2 HF NaOH N2 NH4Cl Na2O2 H2O2 CH3COOH
问1:键有极性的根本?
根本:原子对共用电子对的吸引力不同
依据:共用电子对是否有偏向 表象:形成共价键的两原子不同
判断共价键 极性的方法
问2:共价键极性的大小?
在极性键中, 成键元素的非金属性(电负性)差别越大,共价键 的极性越强; 成键元素的非金属性(电负性)差别越小,共价键 的极性越弱.
