药品质量标准分析方法验证指导原则
2020年版《中国药典》通则调整—9101 药品质量标准分析方法验证指导原则

2020年版《中国药典》通则调整—9101 药品质量标准分析方法验证指导原则(蓝色字体表示新增内容,红色字体表示删减内容)药品质量标准分析方法验证(analytical method validation)的目的是证明采用建立的方法适合于相应检测要求。
在建立药品质量标准时,分析方法需经验证;在药品生产工艺变更、制剂的组分变更、原分析方法进行修订时,则质量标准分析方法也需进行验证。
在建立药品质量标准、变更药品生产工艺或制剂组分、修订原分析方法时,需对分析方法进行验证。
质量控制中采用的方法包括理化分析方法和生物学测定方法,其中理化分析方法的验证原则与化学药品基本相同,所以可参照本指导原则进行,但在进行具体验证时还需要结合生物制品的特点考虑;相对于理化分析方法而言,生物学测定方法存在更多的影响因素,因此本指导原则不涉及生物学测定方法验证的内容。
验证的分析项目有:鉴别试验、限量或定量检查、原料药或制剂中有效成分含量测定,以及制剂中其他成分(如防腐剂等,中药中其他残留物、添加剂等)的测定。
药品溶出度、释放度等检查中,其溶出量等的测定方法也应进行必要验证。
鉴别试验、杂质测定(限度或定量分析)、含量测定和特性参数(如:药物溶出度、释放度等)。
验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。
在分析方法验证中,须用标准物质进行试验。
由于分析方法具有各自的特点,并随分析对象而变化,因此需要视具体情况拟订验证的指标。
表1 中列出的分析项目和相应的验证指标可供参考。
方法验证内容如下。
三一、专属性专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测物的能力。
鉴别反应、杂质检査和含量测定方法,均应考察其专属性。
如方法专属性不强,应采用多种不同原理的方法予以补充。
1.鉴别反应应能区分可能共存的物质或结构相似的化合物。
不含被测成分的供试品,以及结构相似或组分中的有关化合物,应均呈阴性反应。
2024年版《中国药典》通则调整—9101药品质量标准分析方法验证指导原则

2024年版《中国药典》通则调整—9101药品质量标准分析方法验证指导原则是对药品质量分析方法验证的指导原则进行了调整和补充。
药品品质标准是保证药品质量和安全性的重要依据,而药品分析方法则是用于检测和评价药品质量的重要手段。
因此,对药品分析方法的验证是确保药品质量标准准确可靠的关键步骤。
首先,2024年版《中国药典》通则将药品质量标准分析方法验证的目的从“验证药品标准对于药品分析方法的适用性和准确性”调整为“评估药品分析方法的准确性、精密度、线性和稳定性”。
这一调整体现了药品分析方法验证的目标是评估方法的整体性能,包括准确性、重复性、线性范围和方法稳定性等方面的指标。
其次,2024年版《中国药典》通则对药品分析方法验证的流程进行了调整和细化。
其中,药品质量标准分析方法验证的主要步骤包括方法设计、实验操作、数据分析和结论,其中实验操作包括样品制备、实验条件和仪器参数的设置等。
这一调整使得药品分析方法验证的过程更加明确和规范化。
另外,2024年版《中国药典》通则修订了关于药品分析方法验证的具体技术要求。
具体要求包括验证样品的选择、样品预处理方法、样品溶液的制备、仪器设备的使用和标定等方面。
这些具体要求的修订与更新,旨在确保药品分析方法验证的科学性和可操作性。
最后,2024年版《中国药典》通则还强调了药品分析方法验证结果的解释和报告。
验证结果的解释需要基于统计学原理和实验数据进行分析和解读,确保验证结论的准确性和可信度。
验证结果报告应包括验证目的、方法和实验条件、实验数据和数据分析、结论和建议等信息,以便于后续的药品质量评价和管理。
总之,2024年版《中国药典》通则调整—9101药品质量标准分析方法验证指导原则对药品分析方法验证进行了细化和完善。
这一调整旨在提高药品质量分析的准确性和可靠性,为确保药品质量和安全性提供科学依据。
同时,这也体现了《中国药典》不断改进和完善药品质量标准体系的追求,以适应药品质量管理的新要求和挑战。
化学药物质量控制分析方法验证技术指导原则

化学药物质量控制分析方法验证技术指导原则化学药物质量控制分析方法验证是确保药物质量稳定可靠的重要环节。
它通过验证分析方法的准确性、精密度、恢复度、线性度、特异性等指标,确保分析方法能够准确地测定药物中的活性成分或者指标物质的含量。
本文将从方法验证的目的、步骤、技术指导原则以及常见问题和挑战等方面进行介绍。
一、方法验证的目的和步骤1.目的:确保分析方法满足药品质量控制的要求,可靠稳定,可用于药物批次的检验。
2.步骤:(1)方法开发:根据药物的特性和质量控制要求,选择适当的分析方法。
(2)方法优化:对选择的分析方法进行优化,包括调整工作条件、选用合适的内标物质等。
(3)方法准确性验证:重复测定样品,评估准确性,并对结果进行统计分析。
(4)方法精密度验证:通过重复测定样品,计算相对标准偏差,评估方法的精密度。
(5)方法线性度验证:通过测定不同浓度的标准品,评估方法的线性关系。
(6)方法特异性验证:通过测定样品的含量,检查方法对其他组分的干扰情况。
(7)方法稳定性验证:评估方法在不同条件下的稳定性,包括反应时间、温度等。
(8)方法恢复度验证:通过添加已知浓度的标准品到药物样品中,评估方法的回收率。
1.确保方法的准确性:方法应具有良好的回归方程和拟合度,并通过统计分析确定测定值的范围。
2.确保方法的精密度:通过反复测定样品确定相对标准偏差,评估方法的精密度,并确保结果的重复性。
3.确保方法的恢复度:通过添加已知浓度的标准品到药物样品中,测定回收率,评估方法的准确性和恢复度。
4.确保方法的线性度:通过测定不同浓度的标准品,构建标准曲线,并通过相关系数确定方法的线性范围。
5.确保方法的特异性:通过测定样品的含量,并检查方法对其他组分的干扰情况,确保方法对药物成分的特异性。
6.确保方法的稳定性:通过评估方法在不同条件下的重复性和稳定性,确定方法的适用范围。
7.验证结果的报告和文档:方法验证应记录在正式的报告和关联文档中,并以书面形式确认。
9101药品质量标准分析方法验证指导原则
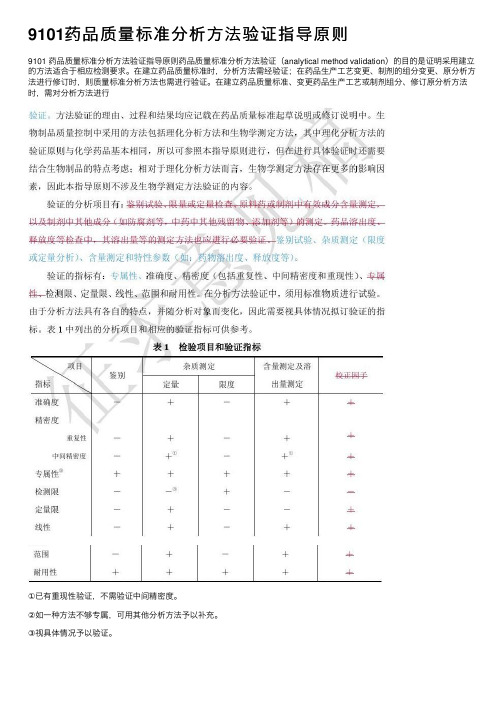
9101药品质量标准分析⽅法验证指导原则9101 药品质量标准分析⽅法验证指导原则药品质量标准分析⽅法验证(analytical method validation)的⽬的是证明采⽤建⽴的⽅法适合于相应检测要求。
在建⽴药品质量标准时,分析⽅法需经验证;在药品⽣产⼯艺变更、制剂的组分变更、原分析⽅法进⾏修订时,则质量标准分析⽅法也需进⾏验证。
在建⽴药品质量标准、变更药品⽣产⼯艺或制剂组分、修订原分析⽅法时,需对分析⽅法进⾏①已有重现性验证,不需验证中间精密度。
②如⼀种⽅法不够专属,可⽤其他分析⽅法予以补充。
③视具体情况予以验证。
⼀⼆、准确度准确度系指采⽤该所建⽴⽅法测定的结果与真实值或参⽐值接近的程度,⼀般⽤回收率(%)表⽰。
准确度应在规定的线性范围内测定试验。
准确度也可由所测定的精密度、线性和专属性推算出来。
1.化学药含量测定⽅法的准确度原料药采⽤对照品可⽤已知纯度的对照品或供试品进⾏测定,或⽤本法所得所测定结果与已知准确度的另⼀个⽅法测定的结果进⾏⽐较。
制剂可在处⽅量空⽩辅料中,加⼊已知量被测物对照品进⾏测定。
如不能得到制剂辅料的全部组分,可向待测制剂中加⼊已知量的被测物进⾏测定,或⽤所建⽴⽅法的测定结果与已知准确度的另⼀种个⽅法测定结果进⾏⽐较。
准确度也可由所测定的精密度、线性和专属性推算出来。
对⾊谱⽅法⽽⾔,绝对(或定量)校正因⼦是指单位⾯积的⾊谱峰代表的待测物质的量。
待测定物质与所选定的参照物质的绝对校正因⼦之⽐,即为相对校正因⼦。
相对校正因⼦计算法常应⽤于化学药有关物质的测定、中药材及其复⽅制剂中多指标成分的测定。
校正因⼦的表⽰⽅法很多,本指导原则中的校正因⼦是指⽓相⾊谱法和髙效液相⾊谱法中的相对重量校正因⼦。
相对校正因⼦可采⽤替代物(对照品)和被替代物(待测物)标准曲线斜率⽐值进⾏⽐较获得;采⽤紫外吸收检测器时,可将替代物(对照品)和被替代物(待测物)在规定波长和溶剂条件下的吸收系数⽐值进⾏⽐较,计算获得。
9101药品质量标准分析方法验证指导原则-15版药典

回收率 % = ( C _ A ) /S X 100 % 式 中 A 为供试品所含被测成分量;
B 为加入对照品量; C 为实测值。 4 . 校正因子的准确度 对 色 谱 方 法 而 言 ,绝 对 (或 定 量 )校 正 因 子 是 指 单 位 面 积 的 色 谱 峰 代 表 的待 测 物 质 的 量。待测定物质与所选 定的参照 物 质 的绝 对校 正 因子 之 比 ,即 为 相 对 校 正 因 子 。相对校正因 子计算法常应用于化学药有关物质的测定、中药材及其复方 制剂中 多指标 成分 的 测 定 。校 正 因 子 的 表 示 方 法 很 多 ,本指 导原则中的校正因子是指气相色谱法和髙效液相色谱法中的 相对重量校正因子。 相 对 校 正 因 子 可 采 用 替 代 物 (对 照 品 )和 被 替 代 物 (待测 物) 标 准 曲 线 斜 率 比 值 进 行 比 较 获 得 ;采 用 紫 外 吸 收 检 测 器 时 ,可 将 替 代 物 (对 照 品 )和 被 替 代 物 (待 测 物 )在 规 定 波 长 和 溶 剂 条 件 下 的 吸 收 系 数 比 值 进 行 比 较 ,计 算 获 得 。 5 . 数据要求 在 规 定 范 围 内 ,取 同 一 浓 度 (相 当 于 100%浓 度 水 平 )的 供 试 品 ,用 至 少 测 定 6 份 样 品 的 结 果 进 行 评 价 ;或 设 计 3 种 不 同 浓 度 ,每 种 浓 度 分 别 制 备 3 份 供 试 品 溶 液 进 行 测 定 ,用 9 份 样 品 的 测 定 结 果 进 行 评 价 。对 于 化 学 药 ,一 般 中 间 浓 度 加人量与所取供试品中待测定成分量之比控制在1 : 1 左右,
药品质量标准分析方法验证

分析方法验证的内容
检测限:指试样中被测物能被检测出的最低量。药品的鉴别试验和杂 质检查方法,均应通过测试确定方法的检测限。常用的方法如下。
•非仪器分析目视法:用已知浓度的被测物,试验出能被可靠地
检测出的最低浓度或量。
• 信噪比法 :用于能显示基线噪音的分析方法,即把已知低浓度
试样测出的信号与空白样品测出的信号进行比较,算出能被可靠 地检测出的最低浓度或量。一般以信噪比为3:1或2:1时相应浓度 或注入仪器的量确定检测限。
定量限:指试样中被测物能被定量测定的最低量,其测定结果应具一 定准确度和精密度。杂质和降解产物用定量测定方法研究时,应确定 定量限。
常用信噪比法确定定量限。一般以信噪比为10:1时相应的浓度:指在设计的范围内,测试结果与试样中被测物浓度直接呈 正比关系的程度。应在规定的范围内测定线性关系。制备一系列供 试样品,至少5份。以测得的响应信号作为被测物浓度的函数作图, 观察是否呈线性,再用最小二乘法进行线性回归。必要时,响应信 号可经数学转换,再进行线性回归计算。
验证检测项目的分类
1、鉴别 鉴别的目的在于判定被分析物是目标化合物,而非其它物
质,用于鉴别的分析方法要求具有较强的专属性。
2、杂质检查(限度试验、定量试验) 杂质检查主要用于控制主成分以外的杂质,如有机杂质、
无机杂质等。 杂质检查要准确反应供试品的纯度特性,可分为限度试
验和定量试验两种情况。用于限度试验的分析方法验证侧 重专属性和检测限。用于定量试验的分析方法验证强调专 属性、准确度和定量限。
分析方法验证的内容
1、准确度; 2、精密度 重复性
中间精密度 重现性
3、专属性; 4、检测限;
视具体方法拟订验证的内容
5、定量限;
2024年版《中国药典》通则调整—9101药品质量标准分析方法验证指导原则
随着药物研究的发展,中国药典也需要不断进行更新和调整,以保证药品质量的安全和有效。
近日,2024年版《中国药典》通则调整发布,并对药品质量标准分析方法验证指导原则做出了一系列的调整。
2024年版《中国药典》通则调整的目的是为了进一步提高药品质量标准分析方法的准确性和可靠性,以确保药品的质量符合要求。
具体来说,对于药品质量标准的分析方法验证指导原则做出了以下调整。
首先,2024年版《中国药典》通则明确了分析方法验证指导原则的基本要求,包括准确性、精密度、线性范围、灵敏度、特异性、系统适用性等方面。
而2024年版则进一步细化了这些要求,对各个要素提出了更加具体和严格的规定,以更好地保证分析方法的准确性和可靠性。
其次,2024年版将分析方法验证分为全面验证和局部验证两个级别。
全面验证适用于所有分析方法,其目的是对方法的准确性和可靠性进行全面的评价。
而局部验证则是根据具体的情况对一些特殊分析方法进行验证,以确保其准确性和可靠性。
此外,2024年版还对分析方法验证的具体步骤和操作进行了规范,包括实验设计、样品处理、数据分析等方面。
同时,在验证过程中要求采用合适的参考品和对照品,以增加验证结果的可靠性。
另外,2024年版还对分析方法验证的报告内容和格式进行了统一规定。
验证报告应包括验证目的、验证方法、实验设计、数据分析、验证结果等内容,并且要求按照规定的格式进行撰写和填报。
这样可以更方便地进行结果评价和审核,并确保验证结果的可靠性和可靠性。
总之,2024年版《中国药典》通则调整中对药品质量标准分析方法验证指导原则做出了一系列的调整,旨在提高分析方法的准确性和可靠性。
这些调整将有助于加强药品质量监管,确保药品的质量和安全性。
同时,这也为我国药物研发和生产提供了更好的参考依据,推动我国药物行业的健康发展。
9101药品质量标准分析方法验证指导原则
9101 药品质量标准分析方法验证指导原则药品质量标准分析方法验证(analytical method validation)的目的是证明采用建立的方法适合于相应检测要求。
在建立药品质量标准时,分析方法需经验证;在药品生产工艺变更、制剂的组分变更、原分析方法进行修订时,则质量标准分析方法也需进行验证。
在建立药品质量标准、变更药品生产工艺或制剂组分、修订原分析方法时,需对分析方法进行①已有重现性验证,不需验证中间精密度。
②如一种方法不够专属,可用其他分析方法予以补充。
③视具体情况予以验证。
一二、准确度准确度系指采用该所建立方法测定的结果与真实值或参比值接近的程度,一般用回收率(%)表示。
准确度应在规定的线性范围内测定试验。
准确度也可由所测定的精密度、线性和专属性推算出来。
1.化学药含量测定方法的准确度原料药采用对照品可用已知纯度的对照品或供试品进行测定,或用本法所得所测定结果与已知准确度的另一个方法测定的结果进行比较。
制剂可在处方量空白辅料中,加入已知量被测物对照品进行测定。
如不能得到制剂辅料的全部组分,可向待测制剂中加入已知量的被测物进行测定,或用所建立方法的测定结果与已知准确度的另一种个方法测定结果进行比较。
准确度也可由所测定的精密度、线性和专属性推算出来。
对色谱方法而言,绝对(或定量)校正因子是指单位面积的色谱峰代表的待测物质的量。
待测定物质与所选定的参照物质的绝对校正因子之比,即为相对校正因子。
相对校正因子计算法常应用于化学药有关物质的测定、中药材及其复方制剂中多指标成分的测定。
校正因子的表示方法很多,本指导原则中的校正因子是指气相色谱法和髙效液相色谱法中的相对重量校正因子。
相对校正因子可采用替代物(对照品)和被替代物(待测物)标准曲线斜率比值进行比较获得;采用紫外吸收检测器时,可将替代物(对照品)和被替代物(待测物)在规定波长和溶剂条件下的吸收系数比值进行比较,计算获得。
54. 数据要求在规定范围内,取同一浓度(相当于100%浓度水平)的供试品,用至少测定6份样品的结果进行评价;或设计*此表源自AOAC《Guidelines for Single Laboratory Validation of Chemical Methods for Dietary Supplements and Botanicals》二三、精密度精密度系指在规定的测定条件下,同一份均匀供试品,经多次取样测定所得结果之间的接近程度。
2024年版《中国药典》通则调整—9101药品质量标准分析方法验证指导原则
2024年版《中国药典》通则对9101号章节进行了调整,主要涉及药品质量标准分析方法验证指导原则。
该调整旨在提高药品质量标准分析方法的可靠性和准确性,为药品质量控制提供更可靠的依据。
以下是对该调整的详细内容的介绍。
第一部分:引言和目的该部分对该章节的目的和重要性进行了介绍。
主要包括以下几个方面:1.引言:对药品质量标准分析方法验证的定义和重要性进行了说明,强调该过程对药品质量控制的作用。
2.目的:明确了药品质量标准分析方法验证的目的是为了验证和确认该方法可适用于特定药品的质量标准控制。
第二部分:验证原则该部分对药品质量标准分析方法验证的基本原则进行了详细说明。
主要包括以下几个方面:1.可行性研究:强调在进行药品质量标准分析方法验证之前,应进行可行性研究,评估该方法是否可以适用于特定药品的质量标准控制。
2.验证参数:明确了药品质量标准分析方法验证应包括的验证参数,如准确性、精密度、线性范围、检测限、定量限等。
3.验证方案:对药品质量标准分析方法验证的具体方案进行了要求。
包括验证规程的编制、实验条件的确定、验证样品的选择等。
4.验证结果的评估:对药品质量标准分析方法验证结果的评估进行了说明。
强调验证结果应能够满足药品质量标准的要求。
5.验证文件的管理:对药品质量标准分析方法验证所涉及的文件、记录和资料的管理要求进行了详细说明。
第三部分:验证程序该部分对药品质量标准分析方法验证的具体程序进行了详细说明。
主要包括以下几个步骤:1.验证计划的编制:明确了编制药品质量标准分析方法验证计划的内容和要求。
2.验证方案的制定:对药品质量标准分析方法验证方案的制定进行了详细说明,包括实验设计、验证参数的选择、实验方法的确定等。
3.验证实验的进行:对药品质量标准分析方法验证实验的具体步骤和要求进行了详细说明。
4.验证结果的评估和分析:对药品质量标准分析方法验证结果的评估和分析进行了说明。
5.验证报告的编制:明确了编制药品质量标准分析方法验证报告的内容和要求。
中国药典2020年版 9101 分析方法验证指导原则
9101分析方法验证指导原则分析方法验证(analytical method validation)的目的是证明建立的方法适合于相应检测要求。
在建立药品质量标准、变更药品生产工艺和制剂组分、修订原分析方法时,需对分析方法进行验证。
生物制品质量控制中采用的方法包括理化分析方法和生物学测定方法,其中理化分析方法的验证原则与化学药品基本相同,所以可参照本指导原则进行,但在进行具体验证时还需要结合生物制品的特点考虑;相对于理化分析方法而言,生物学测定方法存在更多的影响因素,因此本指导原则不涉及生物学测定方法验证的内容。
验证的分析项目:鉴别试验、杂质检查(限度或定量分析)、含量测定(包括特性参数和含量/效价测定,其中特性参数如:药物溶出度、释放度等)。
验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、检测限、定量限、线性、范围、耐用性。
在分析方法中,须用标准物质进行试验。
由于分析方法具有各自的特点中,并随分析对象而变化,因此需要视具体情况拟订验证的指标。
表1列出的分析项目和相应的验证指标可供参考。
表1检验项目和验证指标项目内容鉴别杂质测定含量测定-特性参数-含量或效价测定定量限度专属性②++++准确度-+-+精密度重复性-+-+中间精密度-+①-+①检测限(LOD)--③+-定量限(LOQ)-+--线性-+-+范围-+-+耐用性++++ 1已有重现性验证,不需要验证中间精密度;2如一种方法不够专属,可用其他分析方法予以补充;3视具体情况予以验证。
方法学验证内容如下:一、专属性专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测物的能力。
鉴别反应、杂质检査和含量测定方法,均应考察其专属性。
如方法专属性不强,应采用一种或多种不同原理的方法予以补充。
1.鉴别反应应能区分可能共存的物质或结构相似的化合物。
不含被测成分的供试品,以及结构相似或组分中的有关化合物,应均呈阴性反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附录 XIX A 药品质量标准分析方法验证指导原则
药品质量标准分析方法验证的目的是证明采用的方法适合于相应检测要求 。
在建立药品质 量标准时 ,分析方法需经验证 ;在药品生产工艺变更 、制剂的组分变更 、原分析方法进行修订 时 、则质量标准分析方法也需进行验证 。
方法验证理由 、过程和结果均应记载在药品质量标准 起草说明或修订说明中 。
需验证的分析项目有 : 鉴别试验 , 杂质定量或限度检查 , 原料药或制剂中有效成分含量测 定 ,以及制剂中其他成分( 如防腐剂等 )的测定 。
药品溶出度 、释放度等检查中 ,其溶出量等 测试方法也应作必要验证 。
验证内容有 : 准确度 、 精密度 ( 包括重复性 、 中间精 密度和重现性 )、 专属性 、 检测限 、 定量限 、线性 、范围和耐用性 。
视具体方法拟订验证的内容 。
附表中列出的分析项目和相应的 验证内容可供参考 。
方法验证内容如下 。
一 、 准确度
准确度系指用该方法测定的结果与真实值或参考值接近的程度 , 一般以回收率 ( %) 表示 。
准确度应在规定的范围内建立 。
1. 含量测定方法的准确度
原料药可用已知纯度的对照品或样品进行测定 , 或用本法所得结果与已知准确度的另一方 法测定的结果进行比较 。
制剂可用含已知量被测物的各组分混合物进行测定 。
如不能得到制剂的全部组分 , 可向制 剂中加入已知量的被测物进行测定 ,或用本法所得结果与已知准确度的另一个方法测定结果进 行比较 。
如该分析方法已经测试并求出了精密度 、 线性和专属性 , 在准确度也可推算出来的情况下 , 这一项不必再做 。
2. 杂质定量测定的准确度
可向原料药或制剂中加入已知量杂质进行测定 。
如果不能得到杂质或降解产物 , 可用本法 测定结果与另一成熟的方法进行比较 ,如药典标准方法或经过验证的方法 。
如不能测得杂质或 降解产物的响应因子或不能测得对原料药的相对响应因子的 情况下 , 可用原料药的响应因子 。
应明确表明单个杂质和杂质总量相当于主成分的重量比 ( %) 或面积比 ( %)。
3. 数据要求
在规定范围内 , 至少用 9 次测定结果进行评价 , 例如 , 设计 3 个不同浓度 , 每个浓度各分 别制备 3 份供试品溶液 , 进行测定 。
应报告已知加入量的回收率 ( %), 或测定结果平均值与 真实值之差及其相对标准偏差或可信限 。
二 、 精密度
精密度系指在规定的测试条件下 , 同一个均匀供试品 , 经多次取样测定所得结果之间的接 近程度 。
精密度一般用偏差 、 标准偏差或相对标准偏差表示 。
在相同条件下 , 由同一个分析人员测定所得结果 的精密度称为重复性 ; 在同一个实验室 , 不同时间由不同分析人员用不同设备测定结果的精密度 ,称为中间精密度 ;在不同实验室由不 同分析人员测定结果的精密度 , 称为重现性 。
含量测定和杂质定量测定应考虑方法的精密度 。
1. 重复性
在规定范围内 , 至少用 9 个测定结果进行评价 , 例如 , 设计 3 个不同浓度 , 每个浓度各分 别制备 3 份供试品溶液 , 进行测定 , 或将相当于 100%浓度水平的供试品溶液 , 用至少测定 6
次的结果进行评价 。
2. 中间精密度
为考察随机变动因素对精密度的影响 , 应设计方案进行中间精密度试验 。
变动因素为不同
日期 、 不同 分析人员 、 不同设备 。
3. 重现性
法定标准采用的分析方法 , 应进行重现性试验 。
例如 , 建立药典分析方法时 , 通过协同检
验得出重现性结果 。
协同检验的目的 、过程和重现性结果应记载在起草说明中 。
应注意重现性
试验用的样品本身的质量均匀性和贮存运输中的环境影响因素 , 以免影响重现性结果 。
4. 数据要求
均应报告标准偏差 、 相对标准偏差和可信限 。
三 、 专属性
专属性系指在其他成分 ( 如杂质 、 降解产物 、 辅料等 ) 可能存在下 , 采用的方法能正确测
定出被测物的特性 。
鉴别反应 、杂质检查 、含量测定方法 ,均应考察其专属性 。
如方法不够专
属 , 应采用多个方法予以补充 。
1. 鉴别反应
应能与可能共存的物质或结构相似化合物区分 。
不含被测成分的样品 , 以及结构相似或组
分中的有关化合物 , 均应呈负反应 。
2. 含量测定和杂质测定
色谱法和其他分离方法 ,应附代表性图谱 ,以说明专属性 。
并应标明诸成分在图中的位置 ,
色谱法中的分离度应符合要求 。
在杂质可获得的情况下 , 对于含量测定 , 试样中可加入杂质或辅料 , 考察测定结果是否受
干扰 ,并可与未加杂质或辅料的试样比较测定结果 。
对于杂质测定 ,也可向试样中加入一定量
的杂质 , 考察杂质能否得到分离 。
在杂质或降解产物不能获得的情况下 , 可将含有杂质或降解产物的试样进行测定 , 与另一
个经验证了的方法或药典方法比较结果 。
用强光照射 ,高温 ,高湿 ,酸( 碱 )水解或氧化的方
法进行加速破坏 ,以研究可能的降解产物和降解途径 。
含量测定方法应比对二法的结果 ,杂质
检查应比对检出的杂质个数 , 必要时可采用光二极管阵列检测和质谱检测 , 进行峰纯度检查 。
四 、 检测限
检测限系指试样中被测物能被检测出的最低量 。
药品的鉴别试验和杂质检查方法 , 均应通
过测试确定方法的检测限 。
常用的方法如下 。
1. 非仪器分析目视法
用已知浓度的被测物 , 试验 出能被可靠地检测出的最低浓度或量 。
2. 信噪比法
用于能显示基线噪音的分析方法 , 即把已知低浓度试样测出的信号与空白样品测出的信号
进行比较 ,算出能被可靠地检测出的最低浓度或量 。
一般以信噪比为 3:1 或 2:1 时相应浓度或
注入仪器的量确定检测限 。
3. 数据要求
应附测试图谱 , 说明测试过程和检测限结果 。
五 、 定量限
定量限系指试样中被测物能被定量测定的最低量 , 其测定结果应具一定准确度和精密度 。
杂质和降解产物用定量测定方法研究时 , 应确定定量限 。
常用信噪比法确定定量限 。
一般以信噪比为 10:1 时相应的浓度或 注入仪器的量确定定量限 。
六 、 线性
线性系指在设计的范围内 , 测试结果与试样中被测物浓度直接呈正比关系的程度 。
应在规定的范围内测定线性关系 。
可用一贮备液经精密稀释 , 或分别精密称样 , 制备一系 列供试样品的方法进行测定 ,至少制备 5 份供试样品 。
以测得的响应信号作为被测物浓度的函 数作图 , 观察是否呈线性 , 再用最小二乘法进行线性回归 。
必要时 , 响应信号可经数学转换 , 再进行线性回归计算 。
数据要求 : 应列出回归方程 、 相关系数和线性图 。
七 、 范围
范围系指能达到一定精密度 、 准确度和线性 , 测试方法适用的高低限浓度或量的 区间 。
范围应根据分析方法的具体应用和线性 、 准确度 、 精密度结果和要求确定 。
原料药和制剂 含量测定 ,范围应为测试浓度的 80%~ 120%;制剂含量均匀度检查 ,范围应为测试浓度的 70%~ 130%,根据剂型特点 ,如气雾剂 、喷雾剂 ,范围可适当放宽 ,溶出度或释放度中的溶出量测定 , 范围应为限度的 ±20%; 如规定限度范围 , 则应为下限的 -20%至上限的 +20%; 杂质测定 , 研究 时 , 范围应根据初步实测 , 拟订出规定限度的 ±20%。
如果含量测定与杂质检查同时测定 , 用 百分归一化法 , 则线性范围应为杂质规定限度的 -20%至含量限度 ( 或上限 ) 的 +20%。
八 、 耐用性
耐用性系指在测定条件有小的变动时 , 测定结果不受影响的承受程度 , 为使方法可用于提 供常规检查依据 。
开始研究分析方法时 ,就应考虑其耐用性 。
如果测试条件要求苛刻 ,则应在 方法中写明 。
典型的变动 `因素有 :被测溶液的稳定性 、样品提取次数 、`时间等 。
液相色谱法 中典型的变动因素有 : 流动相的组成和 pH 值 , 不同厂牌或不同批号的同类型色谱柱 , 柱温 , 流速等 。
气相色谱法变动因素有 :不同厂牌或批号的色谱柱 、固定相 ,不同类型的担体 、柱温 , 进样口和检测器温度等 。
经试验 , 应说明小的变动能否通过设计的系统适用 性试验 , 以确保方法有效 。
附表 检验项目和验证内容
鉴别
杂质测定 含量测定及溶出
量测定
定量 限度
准确度 - + - +
精密度
重复性 - + - + 中间精密度 - +① - +① 专属性② + + + + 检测限 - -③ + - 定量限 - + - -
线性 - + - +
范围 - + - + 耐用性 + + + +
①已有重现性验证,不需验证中间精密度。
②如一种方法不够专属,可用其他分析方法予以补充。
③视具体情况予以验证。
