05第五章 酶
合集下载
酶的特性

一 实验 二 步骤 三 四 实验现象 结 论
资料2-2
• 生物体内有些酶能够催化某些分子结构相近 的物质,比如,二肽酶可以水解由任何两种 氨基酸组成的二肽 • 结合资料和实验我们可以确切地说,每一种 结合资料和实验我们可以确切地说, 酶只能催化一种化合物或一类化合物的化学 反应。这就酶的特性之二( ),这可 反应。这就酶的特性之二( ),这可 以保证细胞代谢( 地进行。 以保证细胞代谢( )地进行。
酶促反应
4产物鉴定 观察现象 分析论证
科学家通过大量实验的定量分析, 科学家通过大量实验的定量分析,分别在不同的 温度和pH值条件下测量同一种酶得到如下数据曲 温度和 值条件下测量同一种酶得到如下数据曲 线:
低温: 低温:抑制 高温: 高温:失活
过酸: 过酸:失活 过碱: 过碱:失活
如何描述曲线? 如何描述曲线
(4)分析论证: )分析论证:
提供实验材料及器具: 提供实验材料及器具:
质量分数为2%的 质量分数为2%的α-淀粉酶溶液 2% 新鲜的质量分数为20 20% 新鲜的质量分数为20%的肝脏研磨液 质量分数为3% 3%的可溶性淀粉溶液 质量分数为3%的可溶性淀粉溶液 3%的过氧化氢溶液 斐林试剂 碘液 试管,大烧杯,(量筒),滴管,温度计, ,(量筒),滴管 试管,大烧杯,(量筒),滴管,温度计, 试管夹),三脚架,石棉网,酒精灯,火柴, ),三脚架 (试管夹),三脚架,石棉网,酒精灯,火柴, 热水,蒸馏水, 热水,蒸馏水,冰块
★影响酶促反应速率的因素: 影响酶促反应速率的因素:
酶
1、温度 2、pH 酶的浓度: 3、酶的浓度:反应速率随 酶浓度的升高而加快。 酶浓度的升高而加快。 4、底物浓度:在一定浓度 底物浓度: 范围内, 范围内,反应速率随浓 度的升高而加快,但达 度的升高而加快, 到一定浓度, 到一定浓度,反应速率 不再变化
新教材高中生物第5章第2课时酶的特性pptx课件新人教版必修1
【教材微点发掘】 1 . 阅 读 教 材 第 84 页 , 说 出 酶 制 剂 适 于 在 低 温 (0 ~ 4 ℃) 下 保 存 的 原 因 :
__________________________________________________________________ __________________________________________________________________ ______________________。 答案:在0 ℃左右时,酶的活性很低,但酶的空间结构稳定,在适宜的温度 下酶的活性可以升高
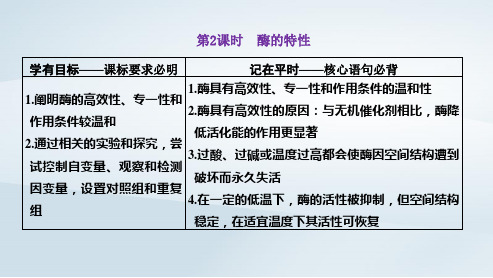
第2课时 酶的特性
学有目标——课标要求必明
记在平时——核心语句必背
1.酶具有高效性、专一性和作用条件的温和性 1.阐明酶的高效性、专一性和
2.酶具有高效性的原因:与无机催化剂相比,酶降 作用条件较温和
低活化能的作用更显著 2.通过相关的实验和探究,尝
3.过酸、过碱或温度过高都会使酶因空间结构遭到 试控制自变量、观察和检测
(2)设计方案ຫໍສະໝຸດ 项目 材料实验组对照组 等量的同一种底物
试剂
与底物相对应的酶 溶液
新知探究(一) 酶的高效性和专一性 【探究·深化】
[问题驱动] 1.验证酶的高效性 在比较肝脏研磨液(过氧化氢酶)和FeCl3对过氧化氢的 催化效率实验中(如图),试管甲产生的气泡比试管乙多, 说明 与无机催化剂相比,酶的催化作用具有高效性 。
2.验证酶的专一性 (1)实验验证:淀粉和蔗糖不是还原糖,但淀粉水解后会生成麦芽糖,蔗糖水 解后会产生葡萄糖和果糖,麦芽糖、葡萄糖、果糖都是还原糖。下表为比较新鲜 唾液(唾液淀粉酶)对淀粉和蔗糖的催化作用实验,请分析:
操作步骤 可溶性淀
生物化学05.第五章 酶

2.有的酶原可以视为酶的储存形式。在需要
时,酶原适时地转变成有活性的酶,发挥其催
化作用。
3.胃、肠黏膜及肠道寄生虫均有抵抗消化酶
的抗酶物质。
三、酶促反应的机制
(一)活化分子与活化能
1.活化能:底物分子从基态转变到活化态所需的能量。 2.活化分子:从基态转变到活化态的底物分子。
能 量 非催化反应活化能
一般催化剂催 化反应的活化能 酶促反应 活化能
底物 反应总能量改变 产物 应 过 程
反
酶促反应活化能的改变
(二)诱导契合假说
酶底物复合物
E+S
ES
E+P
酶与底物相互接近 时,其结构相互诱导、 相互变形和相互适应, 进而相互结合。这一过 程称为酶-底物结合的诱 导契合假说 。
酶的诱导契合动画
(三)邻近效应与定向排列
位于活性中心以外,维持酶活性中心应有的空间 构象所必需。
活性中心以外 的必需基团 底物
+ +
催化基团
结合基团
活性中心
二、酶原与酶原的激活
(一)酶原
有些酶在细胞 内合成或初分泌时 无活性,此无活性 前体称为酶原。
(三)激活过程
酶原
在特定 条件下
特定的肽链水解 分子构象发生改变 酶的活性中心形成
(二)酶原的激活
一些代谢物可与某些酶分子活性中心外的 某部分可逆地结合,使酶构象改变,从而改变 酶的催化活性,此种调节方式称变构调节。
1.变构酶 (allosteric enzyme) 2.变构部位 (allosteric site) 3.变构效应剂 (allosteric effector)
变构激活剂
变构抑制剂
(二) 共价修饰调节
时,酶原适时地转变成有活性的酶,发挥其催
化作用。
3.胃、肠黏膜及肠道寄生虫均有抵抗消化酶
的抗酶物质。
三、酶促反应的机制
(一)活化分子与活化能
1.活化能:底物分子从基态转变到活化态所需的能量。 2.活化分子:从基态转变到活化态的底物分子。
能 量 非催化反应活化能
一般催化剂催 化反应的活化能 酶促反应 活化能
底物 反应总能量改变 产物 应 过 程
反
酶促反应活化能的改变
(二)诱导契合假说
酶底物复合物
E+S
ES
E+P
酶与底物相互接近 时,其结构相互诱导、 相互变形和相互适应, 进而相互结合。这一过 程称为酶-底物结合的诱 导契合假说 。
酶的诱导契合动画
(三)邻近效应与定向排列
位于活性中心以外,维持酶活性中心应有的空间 构象所必需。
活性中心以外 的必需基团 底物
+ +
催化基团
结合基团
活性中心
二、酶原与酶原的激活
(一)酶原
有些酶在细胞 内合成或初分泌时 无活性,此无活性 前体称为酶原。
(三)激活过程
酶原
在特定 条件下
特定的肽链水解 分子构象发生改变 酶的活性中心形成
(二)酶原的激活
一些代谢物可与某些酶分子活性中心外的 某部分可逆地结合,使酶构象改变,从而改变 酶的催化活性,此种调节方式称变构调节。
1.变构酶 (allosteric enzyme) 2.变构部位 (allosteric site) 3.变构效应剂 (allosteric effector)
变构激活剂
变构抑制剂
(二) 共价修饰调节
《生物化学》-第五章 酶化学

亲核基团
—CH2—·O·:
H
底物中典 型的亲电 中心包括:
磷酰基
Cys-SH
—CH2—·S·:
H
脂酰基 糖基
His-咪唑基
—CH2—C=CH
HN N:
CH
(五)金属离子催化
金属离子作为酶的辅助因子起作用的方式:
1.与酶蛋白紧密结合稳定酶的天然构象,亲电催化 2.与酶结合较弱,作为激活剂存在。 3.通过价态的可逆变化,参与氧化还原反应。
其他成分的酶:
核酶(ribozyme) :具有催化活性的天然RNA。 近年还有DNA分子具有催化活性报道。
酶的概念: 酶是生物催化剂。由活细胞产生的具有高效催化能力 和催化专一性的蛋白质、核酸或其复合体。
脲酶:专一性水解尿素。
第一个被分离提取的酶,并证明其化学本质为蛋白质。 抗体酶:是用化学反应的过渡态类似物作免疫原产生 的催化性抗体,是一种具有催化能力的蛋白质,其本 质上是免疫球蛋白。
(6)对于结合酶,辅酶、辅基往往参与酶活中心的 组成。
第二节 酶催化作用的机制
一、酶与底物的结合——中间复合物学说
该学说认为,在酶促反应中,酶(E)总是先和底 物(S)结合生成不稳定的中间复合物(ES),再 分解成产物(P),并释放出酶(E)。 ——中间复合物学说能较好的解释酶为什么能降 低反应的活化能。
实际上,底物与酶结合是一种相互作用的过程, 底物可诱导蛋白质构象改变,蛋白质必需基团也可使 底物敏感键发生变化,更好“契合” 。 3.“三点附着”模型:该模型认为底物与酶活中心的 结合有三个结合位点,只有当这三个位点都匹配的时 候,酶才会催化相应的反应。
二、酶作用高效率机制
(一)底物与酶的邻近、定向效应
1)绝对专一性
—CH2—·O·:
H
底物中典 型的亲电 中心包括:
磷酰基
Cys-SH
—CH2—·S·:
H
脂酰基 糖基
His-咪唑基
—CH2—C=CH
HN N:
CH
(五)金属离子催化
金属离子作为酶的辅助因子起作用的方式:
1.与酶蛋白紧密结合稳定酶的天然构象,亲电催化 2.与酶结合较弱,作为激活剂存在。 3.通过价态的可逆变化,参与氧化还原反应。
其他成分的酶:
核酶(ribozyme) :具有催化活性的天然RNA。 近年还有DNA分子具有催化活性报道。
酶的概念: 酶是生物催化剂。由活细胞产生的具有高效催化能力 和催化专一性的蛋白质、核酸或其复合体。
脲酶:专一性水解尿素。
第一个被分离提取的酶,并证明其化学本质为蛋白质。 抗体酶:是用化学反应的过渡态类似物作免疫原产生 的催化性抗体,是一种具有催化能力的蛋白质,其本 质上是免疫球蛋白。
(6)对于结合酶,辅酶、辅基往往参与酶活中心的 组成。
第二节 酶催化作用的机制
一、酶与底物的结合——中间复合物学说
该学说认为,在酶促反应中,酶(E)总是先和底 物(S)结合生成不稳定的中间复合物(ES),再 分解成产物(P),并释放出酶(E)。 ——中间复合物学说能较好的解释酶为什么能降 低反应的活化能。
实际上,底物与酶结合是一种相互作用的过程, 底物可诱导蛋白质构象改变,蛋白质必需基团也可使 底物敏感键发生变化,更好“契合” 。 3.“三点附着”模型:该模型认为底物与酶活中心的 结合有三个结合位点,只有当这三个位点都匹配的时 候,酶才会催化相应的反应。
二、酶作用高效率机制
(一)底物与酶的邻近、定向效应
1)绝对专一性
生物化学第五章酶

第二节 酶的命名和分类
1、习惯命名 2、国际系统命名法 3、国际系统分类法及酶的编号
1、习惯命名:
根据酶的底物命名:如:淀粉酶、蛋白酶; 根据酶所催化的反应性质命名:如:转氨酶; 综合上述两原则命名:如:乳酸脱氢酶; 上述命名加酶来源或酶的其它特点:胃蛋白酶、胰蛋白酶。
2、国际系统命名法
以酶所催化的整体反应为基础,规定每种酶的名称应当明 确标明酶的底物及催化反应的性质。如果一种酶催化两个底物 起反应,应在他们的系统名称中包括两种底物的名称,并以 “:”将他们隔开,若底物中有水可以略去不写。
(3)X-衍射直接探明活性中心。
1、活性中心的实质
活性中心即酶分子中在三维结构上相互靠近的 几个aa残基或其上的某些基团。 实例:胰凝乳蛋白酶
实验:酶蛋白经水解切去部分肽链后,残留部分仍有活性。 说明:参与催化反应的只是其中一小部分,即活性中心。
胰 凝 乳 蛋 白 酶 的 活 性 中 心
Ser
His 活性中心重要基团: His57 , Asp102 , Ser195
第五章 酶 (Enzyme)
主要内容:介绍酶的概念、作用特点 和分类、命名,讨论酶的结构特征和催化
功能以及酶专一性及高效催化的策略,进
而讨论影响酶作用的主要因素 。 对酶工程 和酶的应用作一般介绍。
思考题?
目
录
第一节 酶的概念及作用特点 第二节 酶的命名和分类 第三节 酶活力测定和分离纯化 第四节 酶催化作用的结构基础和高效催化的策略 第五节 酶促反应的动力学 第六节 重要的酶类及酶活性的调控 第七节 酶工程简介
习惯单位(U):一定时间内将一定量的底物转化为产物所需 的酶量
国际单位(IU):最适反应条件下(25℃),在1分钟内把
5第五章人工模拟酶

半胱胺基酸巯基解离成负离子进攻 正电性羰基碳原子,生成S-酰化中 间体。 H2O羟基进攻正碳离子, 含Cys残 N-C酰氨键断裂,致使 基手臂 酯水解。 模拟酶兼具分子络合作用、手性识 别作用和催化作用,与天然酶十分 相似。速度提高103~104倍。
- SH H+
ROOC NH O=C O O NO2
R O O=C CH2
HOOC :N
β-Benzyme对于对-叔丁基-苯基乙酸酯 (p-NPAc)水解活性比天然酶高1倍以上, kcat/Km(底物专一性)也与天然酶相当, Bender因此闻名于世。
NH
HO
S
OH
β-Benzyme
组氨酸咪唑基是十分有效的酸碱催化剂和亲核催化剂,在水解酶活性 中心起关键性催化作用。
OH O C=C ODEAE NH2 NH DEAE
CD环包结呋喃环-识别定向
O O O C=C O O
糠偶酰 烯醇-O-与Cu2+静电或配位结 合得以稳定加速反应进行。
Cu2+
NH NH2
催化基团 催化活性中心
谷胱甘肽过氧化物酶(GPX,EC.1.11.1.9)为含硒酶,是生物体内重要 的抗氧化酶,能有效消除体内的自由基,与超氧化物歧化酶和过氧 化氢酶共同作用,防止脂质过氧化。因此GPX在治疗和预防克山病、 心血管病、肿瘤等疾病具有明显的疗效。该酶来源非常有限,而且 稳定性差,分子量大等限制了它的实际应用。 利用CD的疏水腔作为底物结合部位,硒巯基为催化部位,制备出系列 双硒侨联环糊精。表现出很高的GPX酶活性,其中C2和 C6-硒化环糊精 的GPX活力已达到4.3U/µmol和7.4 U/µmol。若将C2-硒化环糊精改变成碲 化环糊精的GPX活力已达到45U/µmol。
- SH H+
ROOC NH O=C O O NO2
R O O=C CH2
HOOC :N
β-Benzyme对于对-叔丁基-苯基乙酸酯 (p-NPAc)水解活性比天然酶高1倍以上, kcat/Km(底物专一性)也与天然酶相当, Bender因此闻名于世。
NH
HO
S
OH
β-Benzyme
组氨酸咪唑基是十分有效的酸碱催化剂和亲核催化剂,在水解酶活性 中心起关键性催化作用。
OH O C=C ODEAE NH2 NH DEAE
CD环包结呋喃环-识别定向
O O O C=C O O
糠偶酰 烯醇-O-与Cu2+静电或配位结 合得以稳定加速反应进行。
Cu2+
NH NH2
催化基团 催化活性中心
谷胱甘肽过氧化物酶(GPX,EC.1.11.1.9)为含硒酶,是生物体内重要 的抗氧化酶,能有效消除体内的自由基,与超氧化物歧化酶和过氧 化氢酶共同作用,防止脂质过氧化。因此GPX在治疗和预防克山病、 心血管病、肿瘤等疾病具有明显的疗效。该酶来源非常有限,而且 稳定性差,分子量大等限制了它的实际应用。 利用CD的疏水腔作为底物结合部位,硒巯基为催化部位,制备出系列 双硒侨联环糊精。表现出很高的GPX酶活性,其中C2和 C6-硒化环糊精 的GPX活力已达到4.3U/µmol和7.4 U/µmol。若将C2-硒化环糊精改变成碲 化环糊精的GPX活力已达到45U/µmol。
5酶
酶和一般催化剂的共性
1)用量少而催化效率高,只参加化学反应速度,不 参加化学反应 2)它能够改变化学反应的速度,但是不能改变化学 平衡常数 3)酶只能够本身能够发生的反应进行,反之则不行
二、酶的生物催化特点
(一)高效性
酶的催化作用可使反应速度比非催化反应提高107 -1020 倍。比其他催化反应高107 -1要内容
酶的一般概念 酶的组成与辅酶 酶结构与功能的关系 酶催化机理 酶促反应动力学 酶活性调节
第一节 酶的一般概念
酶的概念 酶的分类和命名 酶催化活性表示法 酶的特征
一、酶的概念
什么是酶(enzyme)?
酶是生物催化剂。绝大部分酶是蛋白质,还有一些核 糖核酸RNA具有催化作用,称为核酶(ribozyme)。
酶的转换数:Kat指每秒钟每个酶分子转换底物的
mmol数,代表酶的催化效率。
酶的活力单位(U):酶活力的度量单位。1961年国
际酶学委员会规定:1个酶活力单位是指特定条件下,在1 分钟内能转化1umol底物的酶量。
酶比活性(enzyme specific activity):每毫克酶
制剂所含的酶的国际单位数。用于比较每单位重量酶蛋白 的催化能力。比活性愈高表明酶愈纯
第二节 酶的组成和辅酶
一、简单酶( simple enzyme)单纯由氨基酸组
成。如脲酶、胃蛋白酶、淀粉酶等
二、结合酶(conjugated enzyme)
结合酶(全酶)= 蛋白质部分(酶蛋白)+ 非蛋白质部分(辅因子)
酶的辅助因子: 本身无催化作用,在酶促反应中起 运
输电子、原子或某些功能基团的作用,包括金属离子和辅 酶(基)
一)酶的命名
1 习惯命名——依据所催化的底物(substrate)、反应的 性质、酶的来源等命名。例如淀粉酶,胃蛋白酶、碱性磷 酸酶。
1)用量少而催化效率高,只参加化学反应速度,不 参加化学反应 2)它能够改变化学反应的速度,但是不能改变化学 平衡常数 3)酶只能够本身能够发生的反应进行,反之则不行
二、酶的生物催化特点
(一)高效性
酶的催化作用可使反应速度比非催化反应提高107 -1020 倍。比其他催化反应高107 -1要内容
酶的一般概念 酶的组成与辅酶 酶结构与功能的关系 酶催化机理 酶促反应动力学 酶活性调节
第一节 酶的一般概念
酶的概念 酶的分类和命名 酶催化活性表示法 酶的特征
一、酶的概念
什么是酶(enzyme)?
酶是生物催化剂。绝大部分酶是蛋白质,还有一些核 糖核酸RNA具有催化作用,称为核酶(ribozyme)。
酶的转换数:Kat指每秒钟每个酶分子转换底物的
mmol数,代表酶的催化效率。
酶的活力单位(U):酶活力的度量单位。1961年国
际酶学委员会规定:1个酶活力单位是指特定条件下,在1 分钟内能转化1umol底物的酶量。
酶比活性(enzyme specific activity):每毫克酶
制剂所含的酶的国际单位数。用于比较每单位重量酶蛋白 的催化能力。比活性愈高表明酶愈纯
第二节 酶的组成和辅酶
一、简单酶( simple enzyme)单纯由氨基酸组
成。如脲酶、胃蛋白酶、淀粉酶等
二、结合酶(conjugated enzyme)
结合酶(全酶)= 蛋白质部分(酶蛋白)+ 非蛋白质部分(辅因子)
酶的辅助因子: 本身无催化作用,在酶促反应中起 运
输电子、原子或某些功能基团的作用,包括金属离子和辅 酶(基)
一)酶的命名
1 习惯命名——依据所催化的底物(substrate)、反应的 性质、酶的来源等命名。例如淀粉酶,胃蛋白酶、碱性磷 酸酶。
第五章酶的固定化
纯化倍数 Purification
收率 Yield (%)
(fold)
2736.9
13080.2 23314.100
30 10 9
Sepharos
e柱层析 HiTrap19 42218 0.3
Q柱层析
实验 木瓜蛋白酶的固定化
实验原理:
载体:尼龙
固定化方法:共价结合法
Enzyme+N, N-甲叉双丙稀酰胺, 丙稀酰胺
引发剂--inactiation
2)半透膜包埋法(微囊型)
将酶或含酶细胞包埋在高分子半透膜中的固定化方
法。
界面聚合法
是用化学手段制备微囊的方法。利用亲水性单体和
疏水性单体在油水界面上发生聚合反应形成聚合体
而将酶包裹起来。
(3)结合法
1)共价结合法 ☆ 通过共价键将酶与载体结合的方法。 ① 结合方法
化的方法称为包埋法。
凝胶包埋法(网格型) 包埋法 半透膜包埋法(微囊型)
只适合作用于小分子底物和产物的酶。
1)凝胶包埋法(网格型)
将酶或含酶菌体包埋在高分子凝胶细微网格中,制
成一定形状的固定化酶,称为网格型包埋法。也称
为凝胶包埋法。
首先被采用的网格包埋法是:
固定化胰蛋白酶 木瓜蛋白酶 -淀粉酶
在上述条件下,每10min增加0.001个消光值为 1个酶单位(U)(以下同)。
实验 木瓜蛋白酶的固定化
酶活力测定:
(2)残留酶活力测定:方法同溶液酶活力测定。
(3)固定化酶活力测定:取一块尼龙布固定化酶, 加入2.0mL激活剂,其余步骤与溶液酶测定相同。
收率 Yield (%)
(fold)
2736.9
13080.2 23314.100
30 10 9
Sepharos
e柱层析 HiTrap19 42218 0.3
Q柱层析
实验 木瓜蛋白酶的固定化
实验原理:
载体:尼龙
固定化方法:共价结合法
Enzyme+N, N-甲叉双丙稀酰胺, 丙稀酰胺
引发剂--inactiation
2)半透膜包埋法(微囊型)
将酶或含酶细胞包埋在高分子半透膜中的固定化方
法。
界面聚合法
是用化学手段制备微囊的方法。利用亲水性单体和
疏水性单体在油水界面上发生聚合反应形成聚合体
而将酶包裹起来。
(3)结合法
1)共价结合法 ☆ 通过共价键将酶与载体结合的方法。 ① 结合方法
化的方法称为包埋法。
凝胶包埋法(网格型) 包埋法 半透膜包埋法(微囊型)
只适合作用于小分子底物和产物的酶。
1)凝胶包埋法(网格型)
将酶或含酶菌体包埋在高分子凝胶细微网格中,制
成一定形状的固定化酶,称为网格型包埋法。也称
为凝胶包埋法。
首先被采用的网格包埋法是:
固定化胰蛋白酶 木瓜蛋白酶 -淀粉酶
在上述条件下,每10min增加0.001个消光值为 1个酶单位(U)(以下同)。
实验 木瓜蛋白酶的固定化
酶活力测定:
(2)残留酶活力测定:方法同溶液酶活力测定。
(3)固定化酶活力测定:取一块尼龙布固定化酶, 加入2.0mL激活剂,其余步骤与溶液酶测定相同。
酶学与酶工程第五章酶分子修饰学生
01
十一次课
02
2
1
酶分子侧链基团修饰
酶侧链基团的修饰方法很多,主要有氨基修饰、羧基修饰、巯基修饰、酚基修饰、胍基修饰、咪唑基修饰、吲哚基修饰及分子内交联修饰等
功能基团主要有氨基、羧基、巯基.咪唑基、吲哚基、酚羟基、羟基、胍基、甲硫基
3
各种氨基酸侧链的修饰剂
氨基酸
侧链基团
修饰剂
Lys
氨基
三硝基苯磺酸,2,4-二硝基氟苯、碘乙酸、碘乙酰胺、丹磺酰氯、亚硝酸
02
分离
03
需要通过不同的方法进行分离,将具有不同修饰度的酶分子分开,从中获得具有较好修饰效果的修饰酶。
04
金属离子置换修饰 把酶分子中的金属离子换成另一种金属离子,使酶的特性和功能发生改变的修饰方法成为金属离子置换修饰。 金属离子置换修饰的方法:酶的纯化、去除原有的金属离子、加入置换离子 金属离子置换修饰的作用:
聚乙二醇是线性分子具有良好的生物相容性和水溶性,在体内无毒性、无残留、无免疫原性,并可消除酶的抗原性,使其末端活化后可以与酶产生交联,因而,它被广泛用于酶的修饰。
酶
半衰期
相对稳定性
天然SOD
6 min
1
右旋糖酐-SOD
7 h
70
Ficoll(低分子量)–SOD
14 h
140
Ficoll(高分子量)–SOD
2
引起酶活性中心的破坏,酶失去催化功能。
01
仍维持活性中心的完整构象,保持酶活力。
02
有利于活性中心与底物结合并形成准确的催化部位,酶活力提高。
03
酶蛋白的肽链被水解后,可能出现以下三种情况中的一种:
氨基酸置换修饰
将酶分子肽链上的某一个氨基酸换成另一个氨基酸的修饰方法,称为氨基酸置换修饰。
十一次课
02
2
1
酶分子侧链基团修饰
酶侧链基团的修饰方法很多,主要有氨基修饰、羧基修饰、巯基修饰、酚基修饰、胍基修饰、咪唑基修饰、吲哚基修饰及分子内交联修饰等
功能基团主要有氨基、羧基、巯基.咪唑基、吲哚基、酚羟基、羟基、胍基、甲硫基
3
各种氨基酸侧链的修饰剂
氨基酸
侧链基团
修饰剂
Lys
氨基
三硝基苯磺酸,2,4-二硝基氟苯、碘乙酸、碘乙酰胺、丹磺酰氯、亚硝酸
02
分离
03
需要通过不同的方法进行分离,将具有不同修饰度的酶分子分开,从中获得具有较好修饰效果的修饰酶。
04
金属离子置换修饰 把酶分子中的金属离子换成另一种金属离子,使酶的特性和功能发生改变的修饰方法成为金属离子置换修饰。 金属离子置换修饰的方法:酶的纯化、去除原有的金属离子、加入置换离子 金属离子置换修饰的作用:
聚乙二醇是线性分子具有良好的生物相容性和水溶性,在体内无毒性、无残留、无免疫原性,并可消除酶的抗原性,使其末端活化后可以与酶产生交联,因而,它被广泛用于酶的修饰。
酶
半衰期
相对稳定性
天然SOD
6 min
1
右旋糖酐-SOD
7 h
70
Ficoll(低分子量)–SOD
14 h
140
Ficoll(高分子量)–SOD
2
引起酶活性中心的破坏,酶失去催化功能。
01
仍维持活性中心的完整构象,保持酶活力。
02
有利于活性中心与底物结合并形成准确的催化部位,酶活力提高。
03
酶蛋白的肽链被水解后,可能出现以下三种情况中的一种:
氨基酸置换修饰
将酶分子肽链上的某一个氨基酸换成另一个氨基酸的修饰方法,称为氨基酸置换修饰。
第五章-5 酶
抗体(antibody.Ab):是机体免疫细胞被抗原激活 后,由分化成熟的B细胞,即浆细胞所合成与分泌的 一类能与相应抗原特异性结合的具有免疫功能的球蛋 白。Ab是重要的免疫分子,主要存在于血液、体液和 粘膜分泌液中,介导体液免疫效应。
Ab=Ig,Ig≠Ab;Ab是功能描述,Ig是化学结构描述;
对同一种酶来说,比活力越高,表明酶越纯。
4、催化中心活性(转换数turnover number)∶
是指酶在底物饱和时,每分钟催化中心 所转换底物的分子数。
κcat:每秒钟每个酶分子转化底物的微摩 尔数,在数值上κcat= k3
几种酶的最大转换数
κcat
二、酶活力测定法
常规测定酶活力的操作程序为: [1]、样品酶液适当稀释。 [2]、在最适条件下进行酶促反应,并通过化学分析或 仪器分析的方法测定反应物的消耗量或产物的生成量。 [3]、根据酶单位定义和实验数据计算出酶活力。
这个催化反应是在完全没有任何蛋白质的存 在下发生的,称之为自我剪切,证明了RNA 具有催化功能。为了区别于传统的蛋白质催 化剂,Cech给这种具有催化活性的RNA定 名为ribozyme(ribonucleic acid enzyme)
抗体酶 (abzyme)
20世纪80年代后期才出现的一种具有催化活 力的蛋白质,其本质上是免疫球蛋白,但在易 变区赋予了酶的属性,所以又称为‘催化性抗 体’(catalytic antibody)。
2、酶活力的单位(activity unit)
1961年国际生化学会酶学委员会规定:
在酶作用的最适条件下(最适底物、最适 pH、最适缓冲液的离子强度及25 ℃)下,每 分钟内催化1.0微摩尔底物转化为产物底酶量为
一个国际酶活力的单位。
Ab=Ig,Ig≠Ab;Ab是功能描述,Ig是化学结构描述;
对同一种酶来说,比活力越高,表明酶越纯。
4、催化中心活性(转换数turnover number)∶
是指酶在底物饱和时,每分钟催化中心 所转换底物的分子数。
κcat:每秒钟每个酶分子转化底物的微摩 尔数,在数值上κcat= k3
几种酶的最大转换数
κcat
二、酶活力测定法
常规测定酶活力的操作程序为: [1]、样品酶液适当稀释。 [2]、在最适条件下进行酶促反应,并通过化学分析或 仪器分析的方法测定反应物的消耗量或产物的生成量。 [3]、根据酶单位定义和实验数据计算出酶活力。
这个催化反应是在完全没有任何蛋白质的存 在下发生的,称之为自我剪切,证明了RNA 具有催化功能。为了区别于传统的蛋白质催 化剂,Cech给这种具有催化活性的RNA定 名为ribozyme(ribonucleic acid enzyme)
抗体酶 (abzyme)
20世纪80年代后期才出现的一种具有催化活 力的蛋白质,其本质上是免疫球蛋白,但在易 变区赋予了酶的属性,所以又称为‘催化性抗 体’(catalytic antibody)。
2、酶活力的单位(activity unit)
1961年国际生化学会酶学委员会规定:
在酶作用的最适条件下(最适底物、最适 pH、最适缓冲液的离子强度及25 ℃)下,每 分钟内催化1.0微摩尔底物转化为产物底酶量为
一个国际酶活力的单位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A.竞争性抑制 B.非竞争性抑制 C.反竞争性抑制 D.正协同抑制 E.不可逆抑制 34.v-[S]曲线为S形 35.当[S]≤Km时,抑制作用不明显 36.与活性中心的必需基团共价结合
A.丙二酸 B.二巯基丙醇 C.甲硫氨酸 D.对氨基苯甲酸 E.以上都不是 37.磺胺类药物的类似物是 38.琥珀酸脱氢酶的竞争性抑制剂是 39.能保护酶的必需基团-SH的物质是 40.酶的不可逆抑制剂是 41.合成叶酸的原料之一是
12.酶促反应的初速率: A.与[E]成正比 B.与[S]无关 C.与[I]成正比 D.与Km成正比 E.与温度成正比
13.酶原激活的生理意义是: A.加速代谢 B.促进生长 C.避免自身损伤 D.恢复酶活性 E.保护酶的活性
14.在一个简单的米氏酶促反应中,当 [S] <<Km 时: A.反应速率难以测定 B.反应速率最大 C.增加酶浓度,反应速率显著变大 D.反应速率与底物浓度成正比 E. [S] 增加,Km值也随之变大
19.B,磺胺类药物的化学结构与对氨基苯甲酸相似, 后者是二氢叶酸合成酶的底物,磺胺类药物则 是该酶的竞争性抑制剂,可抑制二氢叶酸的合 成,进而达到抑菌作用.人类可直接利用食物 中叶酸,因此人体内核酸合成不受磺胺类药物 的干扰.
20. E,决定酶专一性的是酶蛋白部分,而不 是辅酶部分.转移基团,传递氢,传递 电子等辅酶的功能.
v= Km[ S ] Vmax + [ S ]
V max[ S ] K m+ V max
B. D.
v=
Vmax [ S ] Km + [ S ]
v =
v = Km v + V [ S ] max
v=
Vmax[ S ] 2Vmax+[ S ]
23.一个酶促反应最大反应速率是: A.酶完全被底物饱和时的反应速率 B.体系中的杂质并不影响Vmax C.酶的特征性常数 D.Km=2[S]时的反应速率 E.它随底物浓度的改变而改变
6.非竞争性抑制剂作用的动力学特点是: A. Km↑, Vmax↑ B. Km↓, Vmax↓ C. Km不变, Vmax↓ D. Km不变, Vmax不变 E. Km↓, Vmax↑
7.酶的化学修饰: A. 是酶促反应 B. 活性中心的结合部位发生变化后与底物 的结合能力加强或减弱 C. 活性中心的催化基团发生变化后酶的催 化活性发生改变 D. 是不可逆的共价反应 E. 只有磷酸化,去磷酸化
13. C,消化道蛋白酶以酶原形式分泌,避免了胰 腺细胞和细胞外间质的蛋白被蛋白酶水解而破 坏,避免自身损伤,并保证酶在特定环境及部位 发挥其催化作用.正常情况下血管内凝血酶原 不被激活,则无血液凝固发生,保证血流通畅 运行.一旦血管破损,凝血酶原激活成凝血酶, 血液凝固发生催化纤维蛋白酶原变成纤维蛋白 阻止大量失血,而起保护作用.因此酶原激活 有重要的生理意义.
17. E,酶分子化学修饰的主要形式是磷酸 化/脱磷酸化作用,主要发生在Ser的- OH上,还有Thr,Tyr的-OH上,使酶活性 发生改变,是酶活性调节的主要方式.
18. A,酶的不可逆抑制是一些抑制剂与酶的 活性中心的必需基团以共价键结合,使 酶失活,这种抑制剂不能用简单的透析, 超滤等物理方法除去.
4.酶的比活性是指: A. 每秒钟每个酶分子转换底物的微摩尔 数 B. 每毫克酶蛋白所含的酶活性单位数 C. 一定重量的酶制剂所具有的酶单位数 D. 在特定条件下,1分钟内催化形成 1mol产物的酶量 E. 一定体积的酶制剂所具有的酶单位数
5. Km是指:b A.当速率为最大反应速率一半时的酶浓度 B.当速率为最大反应速率一半时的底物浓 度 C.当速率为最大反应速率一半时的抑制剂 浓度 D.当速率为最大反应速率一半时的PH E.当速率为最大反应速率一半时的温度
15.有机磷农药所结合的胆碱酯酶上的基团 是指: A. —OH B. —COOH C. —CH3 D. —NH2 E. —SH
16.有机汞化合物能抑制: A.巯基酶 B.胆碱脂酶 C.碱性酶 D.含—S—S—的酶 E.羟基酶
17. 酶分子经磷酸化作用进行的化学修饰主 要发生在哪个氨基酸上? A. Phe B. Cys C. Lys D. Trp E. Ser
26. 当[S]=5Km时,v=? A. B. C. D. E. 3/4vmax 4/5vmax 5/6vmax 6/5vmax vmax
27.同工酶的特点是: A. 催化作用,分子组成和理化性质相同, 但组织分布不同的酶 B. 催化作用分子组成相同,辅酶不同 C. 多酶体系中酶组分的统称 D. 一类催化作用相同,分子组成和理化性 质不同的酶 E. 催化同一底物起不同反应的酶的总称
20. 下列哪一项不是辅酶的功能? A. 转移基团 B. 传递氢 C. 传递电子 D. 某些物质分解代谢时的载体 E. 决定酶的专一性
21.米氏酶的酶促反应呈现速率对底物浓度 的双曲线关系,较合理的解释是: A.中间产物学说 B.锁—钥学说 C.诱导契合学说 D.协同效应 E.邻近定向效应
22.米曼氏方程的数学表达式为: A. C. E.
挥催化作用,将底物转变为产物的部位 称为酶的活性中心(active center)或活 性部位(active site).
12. A,酶促反应的初速率是指反应开始时的 速率,即反应速率与反应时间呈正比阶 段,即随酶浓度增加而反应速率增高阶 段.采用初速率可避免反应进行过程中 因底物浓度消耗而导致速率下降,或因 反应产物堆积,酶被饱和及部分酶失活 而造成的反应速率下降等 .
8.酶的竞争性抑制剂具有下列那种动力学 效应: A.Vmax不变,Km增大 B. Vmax减小,Km不变 C. Vmax不变,KKm减小 D. Vmax和Km都不变 E. Vmax增大,Km不变
9.如果要求酶促反应 v=Vmax×80%,则[S]应 为Km的倍数是: A. 4.5 B.9 C.4 D.5 E.80
28.别构效应物与酶的哪一部位结合? A. 活性中心以外的调节部位 B. 酶的苏氨酸残基 C. 酶活性中心的底物结合部位 D. 任何部位 E. 别构效应物与酶的辅助因子的结合部位 相同
29.下列哪种酶不以酶原的形式分泌? A.胰蛋白酶 B.胃蛋白酶 C.弹性蛋白酶 D.胰淀粉酶 E.胰凝乳蛋白酶
A型题: 1.在生理条件下,下列哪种氨基酸可为多种酶活
性中心提供酸碱催化基团? A. Asp B. Glu C. Lys D. Ser E. His
2.全酶是指:e A.酶蛋白—底物复合物 B.酶蛋白—抑制剂复合物 C.酶蛋白—别构剂复合物 D.酶蛋白的无活性前体 E.酶蛋白—辅助因子复合物
3.尼克酰胺在体内的活性形式是: A. TPP b B. NAD+ C. FAD D. CoQ E. CoA
30.下列哪种维生素不以辅酶形式而直接作 为酶促反应的底物? A.维生素B2 B. 硫胺素 C.抗坏血酸 D.钴胺素 E.泛酸
B型题 A.pH B.底物浓度 C.酶浓度 D.最适温度 E.抑制剂 31.当酶被底物饱和时,酶促反应速率与之 成正比 32.影响酶和底物的解离状态 33.不是酶的特征性常数,与反应时间有关
24.化学毒气—路易斯气与酶活性中心结合 的基团是: A.丝氨酸的羟基 B.赖氨酸的ε-氨基 C.谷氨酸的γ-羧基 D.半胱氨酸的巯基 E.组氨酸的咪唑基
25.有机砷化合物对酶的抑制作用,可用下 列哪种方法解毒: A.加入过量的半胱氨酸 B.加入过量的GSH C.加入过量的甲硫氨酸 D.加入过量的二巯基丙醇 E.超滤
14. D,在一个简单的米氏酶促反应中,当 [S] <<Km 时, 反应速率与底物浓度成正 比,即矩形双曲线的直线阶段.
15. A,胆碱酯酶活性中心的丝氨酸羟基是该 酶的重要必需基团,有机磷农药能与其结 合,造成乙酰胆碱的堆积,引起副交感神 经兴奋症状.
16. A,有一些不可逆抑制剂与酶分子的巯基 结合,如低浓度的重金属离子(Hg2+, Ag2+,Pb2+,As3+)等,能抑制体内巯基 酶的活性发生不可逆抑制作用.有机汞可 与巯基结合发生不可逆抑制作用.
2. E, 结合酶是由蛋白质部分和非蛋白质部 分组成,其中蛋白质部分称为酶蛋白, 非蛋白质部分称为辅助因子.辅助因子 包括小分子有机化合物或金属离子.酶 蛋白与辅助因子组合成全酶(即全酶= 酶蛋白+辅助因子).酶蛋白和辅助因 子单独存在无活性,只有组合成全酶才 有活性.酶蛋白决定其催化反应的特异 性,辅助因子决定其反应的类型和性质.
9.C , v=Vmax×80%
Vmax [ S ] Km + [ S ] = Vmax × 80%
经运算[s]= 4 km
10. B,酶原的激活过程是酶原在另一蛋白 水解酶的催化下,切除部分肽段或氨基 酸残基导致分子构象改变,进而形成或 暴露酶的活性中心.
11.B,酶蛋白分子中能与底物特异结合并发
18.酶的不可逆抑制的机制是由于: A.抑制剂与酶的活性中心以共价键结合 B.抑制剂与酶的必需基团结合 C.抑制剂与酶表面的极性基团结合 D.抑制剂使酶蛋白变性 E.抑制给与活性中心的次级键结合
19.磺胺药物治病原理是: A.细菌生长某必需酶的非竞争性抑制剂 B.细菌生长某必需酶的竞争性抑制剂 C.分解细菌的分泌物 D.细菌生长某必需酶的不可逆抑制剂 E.直接杀死细菌
答案及解释: 答案及解释: 1. E, 酶分子中只有部分基团与酶活性有关, 称作酶的必需基团(essential group). 常见的必需基团有丝氨酸残基的羟基, 组氨酸残基的咪唑基,半胱氨酸的巯基, 酸性氨基酸残基的羧基如谷氨酸的γ-羧 基等.组氨酸残基的咪唑基的pKa约为6, 在体内pH 7时其酸碱形式比例接近,故 可同时作为质子供体或受体,因此组氨 酸残基的咪唑基是最重要的酸碱催化基 团,是许多酶活性中心的必需基团之一.
8.A,有些物质与酶的底物结构相似,可与底物竞 争酶的活性中心,阻碍酶与底物结合而使酶的 活性降低,这种抑制作用称为竞争性抑制,由 于抑制剂与底物结构相似,并与酶结合是可逆 的,因此其抑制程度取决于底物及抑制剂的相 对浓度,即反应体系中,如果增加底物浓度, 可降低甚至解除抑制剂的抑制作用, 因此 Vmax不变,Km增大.
