物理化学实验下复习课
大连理工大学884物理化学及物理化学实验专...考研内部资料

考研专业课系列辅导之大连理工大学884物理化学及物理化学实验强化讲义全国考研专业课教研中心编光华职业教育咨询服务有限公司目录第一部分强化阶段的“一个目标两项任务” (3)第二部分强化课程主讲内容 (4)第一章化学热力学基础 (4)第二章相平衡热力学 (8)第三章相平衡状态图 (10)第四章化学平衡热力学 (17)第五章统计热力学初步 (20)第六章化学动力学基础 (21)第七章界面层的热力学及动力学 (28)第八章电解质溶液 (29)第九章电化学系统的热力学及动力学 (31)第十章胶体分散系统及粗分散系统 (36)第十一章物理化学实验 (38)第三部分历年真题解析 (39)3.1大连理工大学884物理化学及物理化学实验2010年真题解析 (39)3.2大连理工大学884物理化学及物理化学实验2009年真题解析 (39)3.3大连理工大学884物理化学及物理化学实验2008年真题解析 (41)3.4兄弟院校试题练习 (41)第四部分结束语 (83)第一部分强化阶段的“一个目标两项任务”专业课强化阶段学习时间是9月初至11月初,通过该阶段的学习,学员要达到“一目标”完成“两任务”。
“一个目标”是指做专业课真题自我模拟成绩达到最少120分。
得到这个分数,说明学员已经全面掌握了目标学校的考研基础知识点。
“两项任务”是指掌握教材知识点,研究真题并总结思路。
具体如下:强化阶段任务一:在认真学习完考研专业课公用知识点的基础上,扩展并掌握目标院校目标专业的考研知识点,完成强化、巩固过程,并逐步建立清晰的知识框架图,形成学员自有的知识体系,具体步骤如下(1)通识教材针对指定教材,毫无遗漏的将教材的章节知识点、例题及习题,仔细完整的进行一遍自学,并对把握不准的知识点做好标记;(2)阅读讲义在听课前,先自学一遍强化班讲义,在自学过程中,将讲义中涉及到的知识点标记在教材中。
如果同学还没有完成前面两步,我建议你暂时不要听课,先完成以上两个步骤,然后再听课,这样效果甚佳。
小学科学六年级下册第二单元《物质变化》优质复习课件

化学变化速度的控制
物质变化与我们生 产生活之间的关系
世界是由物质构成的,物质是在不断地发生变化的。只不过有快有慢而已。 物质之间的相互作用,会产生物理变化和化学变化。
本质区别
常见现象
物质 变化
物理变化
不产生新物质
颜色、形状或状态 (固体、液体、气 体)发生变化
化学变化 产生了新物质
伴随着发光、 放热、变色、 产生沉淀、产 生气体等现象
1.有大量的气泡产生。 2.白醋的酸味变淡了。 3. 白色的小苏打变少了。 4.塑料瓶的外壁有点凉。
5……
小苏打和白醋混合的实验记录表
实验 方法 实验 现象
初步 结论
取一只玻璃杯倒入三匙的白醋后小心倒入一匙小 苏打稍后在玻璃杯上盖上玻璃片。
用肉眼观察,发现___反_应__剧__烈__产__生_大__量__气__泡____。 用手触摸杯壁,感觉__比__原__来__凉__一_些_____。 把白醋和小苏打混合后,它们___有____明显的变 化,__有____新物质产生。 (填“有”或“没有”)
黑色
气味变化: 无味
————
焦味
在加热的过程中,蜡烛发生了什么变化?
固态的蜡 熔化 液态的蜡烛油
物理变化
固态的蜡 燃烧 水和二氧化碳 (碳)
化学变化
燃烧充分的蜡烛生成水和二氧化碳
如果蜡烛燃烧不充分,还会产生部分碳的成分
小资料:蜡烛燃烧中的秘密
燃烧充分的蜡烛生成水和二氧化碳,蜡烛 中的氢元素与氧元素形成水,由于温度高,转 化成水蒸气飞散到空中。由于水蒸气和二氧化 碳都是无色的,所以看不到。如果蜡烛燃烧不 充分,还会产生部分碳的成分,可以拿铁器在 烛焰上掠过,上面会留下碳黑的痕迹。
南京大学物理化学下册(第五版)复习题解答:最新整理

物理化学下册课后复习题答案第八章电解质溶液第九章可逆电池电动势及其应用第十章电解与极化作用第十一章化学动力学(一)第十二章化学动力学基础(二)第十三章1.比表面有哪能几种表示方法?表面张力与表面Gibbs自由能有哪些异同点?答:A0= As/m或A0= As/V;表面张力又可称为表面Gibbs自由能,二者数值一样。
但一个是从能量角度研究表面现象,另一个是从力的角度研究表面现象;故二者物理意义不同;单位不同。
2.为什么气泡、小液滴、肥皂泡等都呈圆形?玻璃管口加热后会变得光滑并缩小(俗称圆口),这些现象的本是什么?用同一滴管滴出相同体积的苯。
水和NaCl 溶液,所得的液滴数是否相同弯曲液面有附加压力,其最终会将不规则的液面变为圆形或球形;球形表面积最小,表面自由能最低,最稳定;不相同。
3.用学到的关于界面现角的知识解释以下几种做法或现象的基体原理:①人工降雨;②有机蒸馏中加沸石;③多孔固体吸附蒸气时的毛细凝聚;④过饱和溶液,过饱和蒸气,过冷液体等过饱和现象;⑤重量分析中的“陈化”过程;⑥喷洒农药时,为何常常在农药中加入少量表面活性剂这些现象都可以用开尔文公式说明,①、②、④、⑤是新相刚形面时的体积小,曲率半径小,对与之平衡的旧相有更加苛刻的条件要求。
③多孔固体吸附蒸气时,被吸附的气体的液相对毛细管是润湿的,其曲率半径小零,当气体的分压小于其饱和蒸气压时,就可以发生凝聚。
⑥喷洒农药时,在农药中加入少量表面活性剂,可以降低药液的表面张力,使药液在叶面上铺展。
4.在三通活塞的两端涂上肥皂液,关断右端通路,在左端吹一个大泡,然后关闭左端,在右端吹一个小泡,最后让左右两端相通。
试问当将两管接通后,两泡的大小有何变化?到何时达到平衡?讲出变化的原因及平衡时两泡的曲率半径的比值。
小球更小,大球更大;最后小泡变成一个与大泡曲率半径相同的弧;由于小泡的附加压力大,所以大泡变大,小泡变小,最后使两泡的曲率半径相同5.因系统的Gibbs自由能越低,系统越稳定,所以物体总有降低本身表面Giibs自由能的趋势。
物理化学
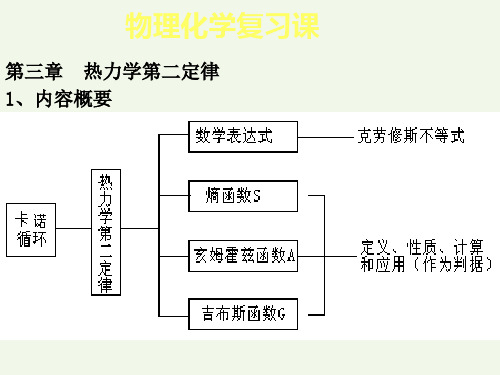
物理化学复习课
已知理想气体系统符合,CV ,m ln( T2 ) R ln(V2 )
T1 V1 及C p ,m CV ,m R
T2 p2 求证:C p ,m ln( ) R ln( ) 证:因为:CV,m = Cp,m-R T1 p1
CV , m C p,m T2 T2 T2 ln( ) C p , m ln( ) R ln( ) T1 T1 T1 T2 T2 V2 ln( ) R ln( ) R ln( ) T1 T1 V1 T 2V1 R ln T1V2 p2 R ln p1
基本计算题类型及Q、W、U、H、S、G 主要计算公式
物理化学复习课
一、选择题 1、下列各式中既是偏摩尔量又是化学势的是( D
U A. n B S ,V ,nC H B. n B S , p ,nC A C. n B T ,V ,nC
物理化学复习课
4.1mol液态水在373.15K、101.325kPa条件下蒸发为同温 同压下1mol气态水,此过程的Δ G = 0.(填<、>或 =)
5. 1mol某单原子理想气体从体积为V1的始态开始,经历 0 绝热可逆膨胀后变至10V1,则该过程的S= J。
(填入具体数值)
三、判断题 1. 封闭系统中Δ S = 0的过程不一定是可逆过程。 × 2. 物质的规定熵就是该状态下其熵的绝对值。 3. 在封闭系统中进行的恒温、恒压、Δ G<0的过程一定 × 是自动进行的不可逆过程。
物理化学复习课
七、判断下列各题说法或结论是否正确,并说明原因。 (1)功可以全部变成热,但热不能全部转化为功。 解:不正确。功可以全部变成热,热也可以全部转化 为功。但热全部转化为功肯定会引起其他变化。例如理想 气体等温膨胀时,U=0,Q= -W,热全部转化为功,但系 统的体积增大,压力减少了。 (2)自然界中存在温度降低,但熵值增加的过程。 解:正确。熵不仅与温度有关,还与其他状态性质如 体积、压力有关。熵值的改变将取决于这些因素ห้องสมุดไป่ตู้化的综 合效果。例如绝热膨胀过程就是温度降低,但熵值增加的 过程。
南京大学物理化学下册(第五版)复习题解答:最新整理

物理化学下册课后复习题答案第八章电解质溶液第九章可逆电池电动势及其应用第十章电解与极化作用第十一章化学动力学(一)第十二章化学动力学基础(二)第十三章1.比表面有哪能几种表示方法?表面张力与表面Gibbs自由能有哪些异同点?答:A0= As/m或A0= As/V;表面张力又可称为表面Gibbs自由能,二者数值一样。
但一个是从能量角度研究表面现象,另一个是从力的角度研究表面现象;故二者物理意义不同;单位不同。
2.为什么气泡、小液滴、肥皂泡等都呈圆形?玻璃管口加热后会变得光滑并缩小(俗称圆口),这些现象的本是什么?用同一滴管滴出相同体积的苯。
水和NaCl 溶液,所得的液滴数是否相同弯曲液面有附加压力,其最终会将不规则的液面变为圆形或球形;球形表面积最小,表面自由能最低,最稳定;不相同。
3.用学到的关于界面现角的知识解释以下几种做法或现象的基体原理:①人工降雨;②有机蒸馏中加沸石;③多孔固体吸附蒸气时的毛细凝聚;④过饱和溶液,过饱和蒸气,过冷液体等过饱和现象;⑤重量分析中的“陈化”过程;⑥喷洒农药时,为何常常在农药中加入少量表面活性剂这些现象都可以用开尔文公式说明,①、②、④、⑤是新相刚形面时的体积小,曲率半径小,对与之平衡的旧相有更加苛刻的条件要求。
③多孔固体吸附蒸气时,被吸附的气体的液相对毛细管是润湿的,其曲率半径小零,当气体的分压小于其饱和蒸气压时,就可以发生凝聚。
⑥喷洒农药时,在农药中加入少量表面活性剂,可以降低药液的表面张力,使药液在叶面上铺展。
4.在三通活塞的两端涂上肥皂液,关断右端通路,在左端吹一个大泡,然后关闭左端,在右端吹一个小泡,最后让左右两端相通。
试问当将两管接通后,两泡的大小有何变化?到何时达到平衡?讲出变化的原因及平衡时两泡的曲率半径的比值。
小球更小,大球更大;最后小泡变成一个与大泡曲率半径相同的弧;由于小泡的附加压力大,所以大泡变大,小泡变小,最后使两泡的曲率半径相同5.因系统的Gibbs自由能越低,系统越稳定,所以物体总有降低本身表面Giibs自由能的趋势。
【通用】《物理化学(第五版)》第九章复习题答案.ppt
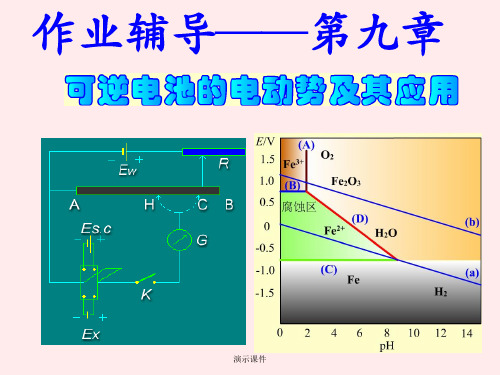
演示课件
复习题
7.在公式ΔrGmΘ=-zEΘF中,ΔrGmΘ是否表示 该电池各物都处于标准态时,电池反应的 Gibbs自由能变化值?
答:在公式ΔrGmΘ=-zEΘF中,ΔrGmΘ表示该 电池各物都处于标准态时,在T,p保持不变 的条件下,按电池反应进行1mol的反应时 系统的Gibbs自由能变化值。
ln
m m'
高价型:Mz+Az-(m1)|Mz+Az-(m2)
E
j=
t z
- t- z 演示课-件
RT F
ln
m1 m2
基本公式
用可逆电池的测定值计算热力学函数变化
值
rGm zFE , rGm zFE
E
RT zF
ln
K
a
r Sm
( r Gm T
)p
E zF (T ) p
E
QR
T rSm
答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如:
Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极
反应所依附的惰性金属。
演示课件
复习题
2.什么叫电池的电动势?用伏特表侧得的电 池的端电压与电池的电动势是否相同?为何 在测电动势时要用对消法?
物理化学——期末考试复习资料(中南大学)

《物理化学》课程复习资料一、单项选择题:1。
对隔离体系而言,以下说法正确的是[ A.体系的热力学能守恒,焓不一定守恒]2.经下列过程后,体系热力学能变化不为零(ΔU≠0)的是 [ D。
纯液体的真空蒸发过程]3。
下列关于理想溶液的混合热力学性质正确的是 [ C。
Δmix S > 0,Δmix G 〈 0 ]4.理想气体恒压膨胀,其熵值如何变化?[ B.增加]5.在下列热力学函数中,可以用于判断过程自动与否的是[ C。
ΔG T, ]6.若反应2H2(g) + O2(g) ==== 2H2O(g) 的热效应为△r H m,则[ B.Δf H m[H2O(g)]= 0.5Δr H m]7.已知反应H2(g) + 0.5O2(g) == H2O (g)在298K、pΘ下的反应焓变为,下列说法中不正确的是[ B.H2(g)的标准摩尔燃烧焓 ]8。
某化学反应在298K时的标准Gibbs自由能变化为负值,则该温度时反应的标准平衡常数KΘ值将[B.K Θ〉1]9。
合成氨反应 N2(g)+ 3H2(g)== 2NH3(g)达平衡后加入惰性气体,保持体系温度和总压不变(气体为理想气体),则有 [ C.平衡左移,K pΘ不变]10.在一定的温度T和压力p下,反应3O2(g)⇌ 2O3(g)的以组元分压表示的平衡常数K p与以组元物质的量分数表示的平衡常数K y之比为 [ D。
p-1 ]11。
在373K、 pΘ下,水的化学势为μl,水蒸气的化学势为μg,则 [ A。
μl = μg]12.在α、β两相中均含有物质A和B,A和B在α相中的化学势分别为μA(α)和μB(α),A和B在β相中的化学势分别为μA(β)和μB(β),当两相达到平衡时应有 [ B.μB(α) = μB(β)]13.FeCl3和H2O能形成FeCl3·2H2O、FeCl3·6H2O、2FeCl3·5H2O和2FeCl3·7H2O四种水合物,该体系的组元数和在恒压下最多可能平衡共存的相数为[ B.C = 2,Φ= 4 ]14。
物理化学总复习1公开课获奖课件

(2)单纯p、V、T变化过程中系统Δ S
恒温过程:
S nR ln V2 nR ln p1
V1
p2
对凝聚系统,在压力变化不很大时, Δ U≈0, Δ V
≈0,因此Δ S≈ 0
❖恒压变温过程:
S
nC p,m
ln
T2 T1
❖恒容变温过程:
S
T2 T1
nCV
,m
ln
T2 T1
第19页
❖对p、V、T同步变化过程
8.314
273.2
ln
1013.25 101.325
103 103
23.33kJ
Q1 W1=23.33kJ
第13页
(2)绝热可逆
Cp,m 5
CV ,m 3
V2
(
p1 p2
1
)
V1
[(1013.25 101.325
103 103
)
3 5
10 103 ]
39.81dm3
T2
p2V2 nR
101.325103 39.81103 4.461 8.314
第11页
12. 对于一定量理想气体,当温度一定期,内能与焓
值一定,其差值也一定。()
对
13. 根据道尔顿分压定律 p pB ,压力具有加和
性,因此压力是广延性质。()B 错
第12页
1. 10 dm3单原子分子理想气体从0℃、1013.25kPa初态通过(1) 恒温可逆膨胀;(2)绝热可逆膨胀;(3)对抗恒定外压 pamb=101.325kPa下绝热膨胀,最终压力为101.325kPa。计算各 过程中气体最终体积,温度及过程Q、W、ΔU、ΔH。
第21页
(2)吉布斯函数(G) G = H-TS ΔG≤ 0 自发(不可逆) 平衡(可逆)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.在最大泡压法测定溶液的表面张力实验中,用什么公式 计算溶液的表面张力?如何计算? 毛细管常数用什么来标定?
8.温度对表面张力有什么影响?用什么方法控制温度?
9.根据朗缪尔吸附等温式如何求饱和吸附量及分子截面积?
10.拉普拉斯公式中各符号的含义是什么?什么是毛细管
常数?
11.写出表面吸附量与浓度的关系式,其中 d 如何得到?
应
3.测定蔗糖转化反应过程旋光度前,旋光仪的 零点是否需要校正?在蔗糖转化反应过程中, 所测的旋光度αt是否需要零点校正?为什么? 4.蔗糖溶液需要准确浓度吗?为什么? 5.蔗糖的转化速度和哪些因素有关?测量过程 为什么要恒温?
浓度\温度\催化剂
6.实验中能直接测定不同t时的蔗糖浓度吗?能直接测量 的物理量是什么?根据什么来度量反应的进程?
的相对分子质量?
8. 为什么粘度计在恒温槽内必须垂直放置?
粘度与压力、毛细管的长度有关。
9. 粘度计毛细管的粗细对实验有何影响?
毛细管粗,实验误差大。直径与长度应合适,保证液体流出时间在 100s以上。
实验二十七 电导法测定水溶性表面活 性剂的临界胶束浓度
1.什么叫表面活性剂?表面活性分子的结构有什么特点? 可分为多少类?
装样品时,旋光管管盖旋至不漏液体即可,不要用力过猛,以免压碎玻 璃片。
2.在测定 时,通过加热使反应速度加快转化完全。
加热温度在什么范围为宜?是不是越高越好?为什么?
在测定 时,通过加热使反应速度加快转化完全。加热温度在50至
60℃为宜。不要超过60℃,太高会产生副作用,溶液变黄,还会发生脱水反
2.表面活性剂在水中的存在方式有多少种?与溶液浓度 有什么关系?什么叫做临界胶束浓度?
3.测定临界胶束浓度的方法有哪些?其中哪些方法较简便 准确?这些方法对不同类型的表面活性剂是否都适用?
4.电导法适合测定哪类表面活性剂的临界胶束浓度?要知 道所测的临界胶束浓度是否准确,可用什么方法验证之?
5.非离子型表面活性剂的临界胶束浓度能否用电导法测定? 若不能,应用哪种方法测定?
6.如果NaOH和CH3COOC2H5溶液为浓溶液时,能否 用此法求k值,为什么?
7. 本实验中,直接测量的物理量是哪些?测定这些物理量 使用的测量仪器是什么?对所使用的乙酸乙酯和氢氧化钠 的浓度有什么要求? 8.为什么乙酸乙酯与NaOH溶液浓度必须足够稀?
答:为保证与浓度呈线性关系,溶液浓度必须足够稀
10、根据测定结果如何判断一旋光物质是右旋还是左旋?
答:根据旋光仪的读数来判断,右旋大于零,左旋小于零
11.根据测定结果进行数据处理,计算速率常数、反应半 衰期、反应的活化能
实验十八 电导法测定乙酸乙酯皂化反
应的速率常数
1.本实验为什么要使用电导水?对水质有什么要求?
实验使用电导水,是为了确保测得的电导是反应体系的电导,还要避免接触
8、为什么可以用蒸馏水校正旋光仪的零点? 若不进行校正,对结果是否有影响?
答: 蒸馏水为非旋光物质,可用来校正旋光仪的零点 若不校正,对结果有影响,使读数不准, 造成系统误差
9.一级反应有那些特点?配制蔗糖溶液时 用什么来称量?为什么?
答:由于t1/2只跟k有关,和初始浓度无关,
所以可用托盘天平(上皿天平)称量
什么作用? 7.有关电池电动势的计算.
8.在电动势的测量为什么要对所使用的锌电极和铜电极 进行预处理?如何处理?
9.在电动势的测量过程中,应尽可能做到在可逆条件下 进行,为此,要注意哪些问题?
实验十六 旋光法测定蔗糖转化反应的速 率常数
1.往旋光管中装入反应液后,应注意什么,旋盖套时是 不是旋得越紧越好?旋到什么程度为宜?
2.溶液黏度的表示方法有哪些?用什么符号表示?它们 之间的关系如何? 3.本实验中,直接测定的物理量哪些?与相对黏度的关系如何
4.在乌氏粘度计中C管的作用是什么?能否将C管去掉, 为什么?
乌氏计的C管与大气相通,液体下落时,因大气压一定, 阻力一定,与流体量无关,即流经 AB 两刻度的时间只与粘度有关;去掉C管,流 体下落时,与另一管中残留的液体相连,量不同阻力不同,只有固定粘度计中液
如何根据 d
dc
的符号判断正负吸附或表面浓度与本体浓度
dc
的关系?
实验二十六 粘度法测定水溶性高聚物 相对分子质量
1.测定粘度的方法有哪些?本实验用什么方法?
测定粘度的方法主要有:⑴毛细管法(测定液体在毛细管里的流出时 间);⑵落球法(测定圆球在液体里下落速度);⑶旋转法(测定液 体与同心轴圆柱体相对转动的情况)等,而测定高聚物溶液的粘度以 毛细管法最方便,本实验采用乌氏粘度计测量高聚物稀溶液的粘度。
1.清洗毛细管时应注意什么?毛细管不干净对测 定会有什么影响?对毛细管的放置有什么要求?
清洗毛细管时,须注意不能有清洗液残留在毛细管内,可用洗耳球直 接从毛细管顶部吹一下,再用待测溶液润一下毛细管, 重复几次即 可,否则气泡不能连续形成,而影响最大压差的测量。 测定时毛细管端刚好和溶液面相切且垂直。
空气及灰尘杂质落入。
2.配好的NaOH溶液如何防止空气中的CO2气体进入? 3.为什么要取乙酸乙酯溶液和NaOH溶液浓度相同?这 样处理有什么好处? 4.本实验应注意哪些问题?
5.写出乙酸乙酯皂化反应的反应式,为什么可以认
为0.0100mol·dm-3的NaOH溶液的电导率就是 0 ? 0.0100mol·dm-3的CH3COONa的电导率就是 ?
3.盐桥有什么作用? 选择盐桥内的溶液应注意些 什么问题?本实验用什么溶液? 4.本实验中,用什么作为参比电极,选择参比电极 应具备什么条件?它有什么作用?
5.在电池1和3中 HgHg2Cl2 KCl(饱和)属于什么电极? 有什么作用?
6.在电池4中 Ag AgCl KCl(饱和 )属于什么电极?有
2.本实验直接测量的实验数据是什么?用什么仪 器测量?做好事本实验的关键有哪些? 3.测量不同浓度乙醇溶液的表面张力应先测浓的 不是先测稀的?测量前应注意什么?
由稀到浓,用待测液洗涤测定管,尤其是毛细管
4.表面张力为什么必须在恒温槽中进行测定,温度变化 对表面张力有何影响,为什么? 5.用最大气泡法测量表面张力时为什么要读最大压差? 6.毛细管中气泡的形成速度应控制在多少为宜?通过什 么方法来控制?滴液漏斗的放液速度对本实验有何影响?
物理化学实验下复习课
实验十 原电池电动势的测定及其应用
1.本实验根据什么原理、使用什么主要仪器测定 电池电动势?
对消法测电动势的基本原理,电位差计
2.铜电极在测量前为什么要进行电镀?镀前要做什 么准备?铜电极在电镀时作为阳极还是阴极?
因为铜表面容易氧化,故须在测量前电镀,电镀前应先除去表面氧化层 和杂质.铜电极阴极
体总量,在其它条件相同时流经刻度 A、B 的时间 才只与时间有关。
5.高聚物溶液的0
r
Байду номын сангаасsp
有什么联系和区别?
如何求得?
6.试举例说明影响粘度测定的因素?粘度计毛细管的粗
细有何影响?
7.特性粘度 就是溶液无限稀释时的比浓粘度,它和纯 溶剂的粘度 0 是否一样?为什么要用 来测求高聚物
每个实验的数据处理、评注启示、提问思考
谢谢
9.若乙酸乙酯与NaOH溶液的起始浓度不等时, 应如何计算k值?试设计如何进行实验?
10.根据什么公式以什么对什么作图可求出反应速率常数k? 如何求出反应的活化能? 11.为什么实验要在恒温条件下进行?
12.测定电导率使用的电极是什么电极?电导率仪使用前应 起先哪些校正和设置?
实验二十四 最大泡压法测定溶液的表面张力
不能,能直接测量的是反应体系的旋光度,因为蔗糖及其转化产物都具有旋光 性,且旋光能力不同.根据蔗糖、葡萄糖、果糖的旋光能力不同,可从旋光度 的变化来量度反应进程.
7.写出蔗糖转化反应的反应式,指出反应是几级反应? 可看作几级反应处理?为什么?可以用什么作催化剂?. 在本实验中,选用什么作为催化剂?混合溶液时,应将 蔗糖溶液加到催化剂中还是将催化剂加到蔗糖溶液中? 为什么?
