工艺流程习题
高中化学工艺流程题

高中化学工艺流程题
《高中化学工艺流程》
高中化学课程中,学生将学习化学工艺流程,这是一个重要的主题,涵盖了化学原理在实际生产中的应用。
化学工艺流程是指将化学原料转化成最终产品的整个过程,它涉及到许多化学反应、控制条件、设备和安全措施。
首先,化学工艺流程需要确定原料和产物的化学成分和结构,然后设计和选择合适的反应条件和催化剂,以提高反应效率和产物纯度。
同时,需要考虑到反应的热力学和动力学条件,以便进行反应控制和优化。
其次,化学工艺流程需要设计和选择合适的反应设备,确保反应可以高效进行,并且保障操作人员的安全。
例如,需要考虑反应器的尺寸、材料、加热和冷却方式等因素。
随后,化学工艺流程还需要考虑产物的分离和纯化,以及废物处理。
这包括蒸馏、结晶、萃取、膜分离等技术,以及废物的处理和回收利用。
最后,化学工艺流程还需要考虑生产规模、成本和环境影响等因素。
这需要对生产过程进行经济性分析和环境评估,以找到合适的生产规模和工艺条件。
总的来说,化学工艺流程是化学学科的一个重要内容,它涉及到化学原理、工程技术和经济管理等多个方面。
通过学习化学
工艺流程,学生可以更好地理解化学在工业生产中的应用,为未来的学习和工作打下坚实的基础。
高三化学工艺流程练习题五

高三化学练习题五 一、单选题1.CuCl 为白色固体,难溶于水和乙醇,潮湿时易被氧化,常用作媒染剂。
以印刷线路板碱性蚀刻废液(主要成分为()324Cu NH Cl ⎡⎤⎣⎦)为原料制备CuCl 的工艺流程如下。
下列说法正确的是A .“沉铜”发生反应的离子方程式:()2+-3324Cu NH +4OH CuO +4NH +2H O ⎡⎤↓↑⎣⎦ B .“还原”步骤中氧化剂与还原剂的物质的量之比为2∶1C .“还原”后所得溶液中大量存在的离子有Cu +、H +、Cl -、24SO -D .“洗涤”时可使用水作洗涤剂,因为CuCl 难溶于水2.某研究团队提出的SO 2烟气脱硫工艺流程如图所示,该流程中脱硫剂反复循环,可实现对烟气中SO 2的持续脱除。
已知:脱硫塔中发生的主要反应为2CaS+3SO 2=2CaSO 3+3S ,2CaSO 3+O 2=2CaSO 4。
下列有关说法正确的是A .静电除尘的原理是用SO 2烟气中灰尘胶体粒子带电性加以清除B .经冷凝器得到的S 2、S 4、S 6和S 8互为同位素C .脱硫塔中反应生成的CaSO 3为氧化产物D .再生塔中得到的X 主要成分为CaSO 3 3.海水提溴的部分工艺流程如图所示。
下列说法错误的是A .“洗脱”工序可完成3R NCl 的再生B .水相II 中溶液呈酸性C .将有机相I 滴到湿润的淀粉-KI 试纸上,若试纸变蓝,则证明有机相中含2ClD .提取280g Br ,理论上消耗标准状况下的2Cl 22.4L4.实验室以含镍废料(主要成分为NiO ,含少量FeO 、Fe 2O 3、CoO 、BaO 和SiO 2)为原料,制备Ni x O y 和CoCO 3的工艺流程如图所示。
已知:25°C 时,K sp [Co(OH)2]=2.0×10-15。
下列说法正确的是 A .滤渣1中只含有BaSO 4 B .“氧化”、“调pH”时均需加过量的试剂C .“萃取”时,待下层液体从分液漏斗下口流出后,上层液体再从下口放出D .“沉钴”开始时,若溶液中的c(Co 2+ )=0.02 mol/L ,为防止生成Co(OH)2,应控制溶液pH <7. 5 5.高压氢还原法可直接从溶液中提取金属粉。
2020年高考专题训练-工艺流程题(一)

工艺流程练习题(一)1.锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。
以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:已知25℃,部分物质的溶度积常数如下:物质Mn(OH)2Co(OH)2Ni(OH)2MnS CoS NiSK sp 2.1×10-13 3.0×10-16 5.0×10-16 1.0×10-11 5.0×10-22 1.0×10-22(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是_______________________;(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③________________;(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是__________________;加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有_________;滤渣2的主要成分是_________;(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5mol•L-1,则应保持溶液中c(S2-)≥ _____ mol•L-1。
【答案】(1)MnCO3+H2SO4=MnSO4+CO2↑+H2O;(2)抑制Mn2+的水解;(3)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(4)烧杯;CoS和NiS;(5)1.0×10﹣6.【解析】试题分析:(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水;(2)Mn2+离子易水解;(3)据得失电子守恒有MnO2+2Fe2+﹣﹣Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+﹣﹣Mn2++2Fe3+,最后据原子守恒得MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(4)根据操作方法判断缺少的仪器;由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;(5)由于将一级沉降根据MnS的Ksp=c(Mn2+)•c(S2﹣)进行计算即可.解:向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰.(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水,步骤Ⅰ中,MnCO3与硫酸反应的化学方程式为:MnCO3+H2SO4=MnSO4+CO2↑+H2O,故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;(2)Mn2+离子易水解.加入过量硫酸,还可以抑制Mn2+的水解,故答案为:抑制Mn2+的水解;(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+﹣Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+﹣Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(4)步骤Ⅲ为过滤操作,需要用到的玻璃仪器除玻璃棒、漏斗外,还需要烧杯;由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成,故答案为:烧杯;CoS和NiS;(5)MnS的Ksp=c(Mn2+)•c(S2﹣)=1.0×10﹣11,为了将Mn2+降到1.0×10﹣5mol/L,则c(S2﹣)===1.0×10﹣6mol/L,即硫化钠的浓度是1.0×10﹣6mol/L,故答案为:1.0×10﹣6.2.高铁酸盐在能源、环保等方面有着广泛的用途。
流程的设计习题
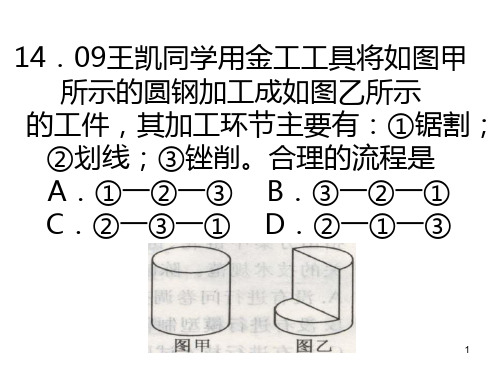
•
(2)加工图中R6的圆弧,合理的方法是:__▲__。(从①锯
割;②钻孔;③锉削中选择一种,在“
”处填写相应
的序号。)
(3)钻孔时用到的工具有:_▲__、__▲_。(从①钢锯②锉
刀③钻头④丝锥⑤手钳中选出二种,在“__▲__”处填写相
• A、划线→锯割→倒角→套丝→折弯 • B、划线→锯割→套丝→折弯→倒角 • C、划线→锯割→折弯→套丝→倒角 • D、划线→锯割→套丝→倒角→折弯
23
• 22.李明发现椅子的榫接处松动,于是设计了如图所示的连接 片,用以加固椅子的连接。现用60×60的方形钢板加工该连 接片,需要以下环节:①划线;②锯割;③钻孔;④锉削。 请分析连接片的加工工艺,回答以下问题。
采用了 ② ▲ ,从 • 而大大节省了人力。 • (2)在优化后的配送流程中,最先需要配送需求信息的环节是 ▲
(请选择一个选项,填 • 写序号) • A.自动分捡 B.自动打包 C.自动贴标签 D.送货
3
• 15.10某毛织厂的生产流程如图所示,若 产品质检不合格,则应将其移交到的环节 是
• A.材料采购 B。包装入库 C。生产 D。样品制作
•
;
;
18
• 1003李明在制作小铁锤过程中需要加工 一个螺纹孔(如图所示),其正确的工艺 流程是 A.划线→冲眼→钻孔→攻丝→孔口倒角
• B.划线→冲眼→攻丝→钻孔→孔口倒角 • C.划线→冲眼→钻孔→孔口倒角→攻丝 • D.划线→冲眼→孔口倒角→钻孔→攻丝
19
• 14一位学生发现家中灯泡不亮,于是对线 路进行检修。由于没有切断电源,导致触 电。根据这个案例,下列说法中错误的是
高考化学工艺流程练习题

26.(14分)过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。
学.科网.以下是一种制备过氧化钙的实验方法。
回答下列问题:(一)碳酸钙的制备 (1)步骤①加入氨水的目的是_______。
小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
a .漏斗末端颈尖未紧靠烧杯壁b .玻璃棒用作引流c .将滤纸湿润,使其紧贴漏斗壁d .滤纸边缘高出漏斗e .用玻璃棒在漏斗中轻轻搅动以加快过滤速度(二)过氧化钙的制备(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。
将溶液煮沸,趁热过滤。
将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得石灰石 双氧水和氨水 盐过滤滤CaCO碳酸铵溶液 过滤 白色结晶 稀盐酸、煮沸、过滤 滤液 CaCO 3过滤 氨水和双氧水到过氧化钙产品。
该工艺方法的优点是______,产品的缺点是_______。
28.(14分)以硅藻土为载体的五氧化二钒(V 2O 5)是接触法生成硫酸的催化剂。
从废钒催化剂中回收V 2O 5既避免污染环境又有利于资源综合利用。
废钒催化剂的主要成分为:物质V 2O 5 V 2O 4 K 2SO 4 SiO 2 Fe 2O 3 Al 2O 3 质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1回答下列问题:(1)“酸浸”时V 2O 5转化为VO 2+,反应的离子方程式为___________,同时V 2O 4转成VO 2+。
高三化学练习题【工艺流程题】

1.Li 4Ti 5O 12和LiFePO 4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO 3,还含有少量MgO 、SiO 2等杂质)来制备,工艺流程如下:回答下列问题:(1)“酸浸”实验中,铁的浸出率结果如下图所示。
由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以24TiOCl -形式存在,写出相应反应的离子方程式__________________。
(3)TiO 2·x H 2O 沉淀与双氧水、氨水反应40 min 所得实验结果如下表所示: 温度/℃30 35 40 45 50 TiO 2·x H 2O 转化率% 92 95 97 93 88分析40 ℃时TiO 2·x H 2O 转化率最高的原因__________________。
(4)Li 2Ti 5O 15中Ti 的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中21(Mg )0.02mol L c +-=⋅,加入双氧水和磷酸(设溶液体积增加1倍),使3Fe +恰好沉淀完全即溶液中351(Fe ) 1.010mol L c +--=⨯⋅,此时是否有Mg 3(PO 4)2沉淀生成?(列式计算)。
FePO 4、Mg 3(PO 4)2的K sp 分别为22241.310 1.010--⨯⨯、。
(6)写出“高温煅烧②”中由FePO 4制备LiFePO 4的化学方程式 。
【答案】(1)100℃、2h ,90℃,5h (2)FeTiO 3+ 4H ++4Cl − = Fe 2++ 24TiOCl - + 2H 2O(3)低于40℃,TiO 2·x H 2O 转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO 2·x H 2O 转化反应速率下降 (4)4 (5)Fe 3+恰好沉淀完全时,c (34PO -)=2251.3101.010--⨯⨯mol·L −1=1.3×10–17 mol·L −1,c 3(Mg 2+)×c 2(34PO -)=(0.01)3×(1.3×10–17)2=1.7×10–40<K sp ,因此不会生成Mg 3(PO 4)2沉淀。
化学工艺流程题
消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量
为
。(计算结果保留两位小数)
一,化学工艺流程题的结构特点
这三部分为我们提供什么信息?
题头:制什么
试
题 结
题干:怎么制
浏 览
构
题尾:设问题 详审
根据 问题 对点 详读
设问特点
1,以“点” 的形式设问。 即不需要理清工业生成流程图的主线即可以答题。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的
措施有
(写两条)
2,以“线” 的形式设问。
即必须先理解工业生产流程图主线与核心部分才能答题。
(2)滤渣I的主要成分有
。
一,化学工艺流程题的结构特点
这三部分为我们提供什么信息?
题头:制什么
试
浏 根据问题
题 结 构
题干:怎么制
览 对点详读
以“点” 设问 直接答
降低后续除杂困难
(二)工艺流程题中反应条件的控制
(2009江苏卷•16)以氯化钾和钛白厂的副产品硫酸亚铁为原料
生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较
高。其主要流程如下:
KCl
NH4HCO3溶液 FeSO4溶液 反应I 过滤
稀硫酸 反应 CO2(g)
过滤 反应III 反应IV
K2SO4(s) NH4Cl溶液 H2(g) (NH4)2S2O8溶液
CO2(g)
FeCO3(s) 空气中煅烧 Fe2O3(s)
(3)反应Ⅰ需控制反应温度低于35 ℃,其目的是________。
防止NH4HCO3分解 (或减少Fe2+的水解)
例题:某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3, MgSiO3,CaMg(CO3)2,Al2O3和Fe2O3等,回收其中镁的工艺流程 如下:
高中化学工艺流程练习题(3)
高中化学工艺流程练习题(3)1.CoCl2·6H2O是一种饲料营养强化剂。
以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:请回答下列问题:⑴在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为。
⑵加入碳酸钠调节pH至a,a的范围是。
⑶操作Ⅰ包含3个基本实验操作,它们是、和过滤。
⑷制得的CoCl2·6H2O需减压烘干的原因是。
⑸为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。
通过计算发现产品中CoCl2·6H2O 的质量分数大于100%,其原因可能是。
⑹在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是。
答案..⑴减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐⑵5.2~7.6⑶蒸发浓缩、冷却结晶⑷降低烘干温度,防止产品分解⑸样品中含有NaCl杂质;烘干时失去了部分结晶水⑹将产品溶于乙醚过滤后,再蒸馏【例10】某工厂用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如下。
回答下列问题:(1)硫酸铵在农业生产中的用途是(一种即可) ,写出利用该流程制备(NH4)2SO4的总化学方程式:。
(2)a和b分别是(填序号)。
A.足量CO2、适量NH3 B.足量NH3、适量CO2C.适量CO2、足量NH3 D.适量NH3、足量CO2(3)上述流程中,可以循环使用的物质有(写化学式)。
(4)从滤液中获得(NH4)2SO4晶体,必要的操作步骤是。
2021届高中化学二轮复习(大题)6 电解工艺流程 习题含解析
6 电解工艺流程一、典例例:SCR 催化剂是工业上广泛应用的燃煤烟气脱硝催化剂,其主要成分为TiO 2、V 2O 5,以及少量SiO 2、CaO 、Al 2O 3、Fe 2O 3等。
一种从废SCR 催化剂中回收钨的工艺如下:回答下列问题(1)“酸浸还原”中V 2O 5转化成可溶于水的VOC 2O 4,VOC 2O 4中V 的化合价是___________,该反应的化学方程式为___________。
可用浓盐酸代替草酸,但缺点是___________。
(2)“碱浸”时WO 3转化为WO 2−4的离子方程式为___________。
(3)“试剂a”可选用___________(选填“盐酸”、“氢氧化钠”或“氨水”)。
“滤渣”的主要成分是___________。
(4)常温下K sp [Ca(OH)2]=5.5×10−6,K sp (CaWO 4)=8.7×10−9。
“沉钨”过程中不断加入石灰乳,当测得“滤液”中pH=13时,c(WO 2−4)为___________mol·L −l (保留2位有效数字)(5)“熔融电解”过程中阴极反应为WO 2−4+6e −=W+4O 2−。
电解过程中石墨阳极有损耗并有气体产生,用反应方程式解释该现象___________。
【答案】(1)+4 252242422V O 3H C O =2VOC O 2CO 3H O ++↑+ 与五氧化二钒的反应速率下降,降低了回收钒的速度(2)2-342WO 2OH =WO +H O -+(3)氨水 Al(OH)3、Fe(OH)3(4)1.6×10−5mol/L(5)422CaWO 3C =3CO 2W 2CaO +↑++熔融【解析】从废催化剂中回收金属钨,首先项催化剂中加入H 2C 2O 4溶液,进行酸浸还原回收钒;再加入氢氧化钠,反应后进行过滤得到钛渣;再加入氨水调节pH ,过滤掉氢氧化铝和氢氧化铁;再加入石灰乳过滤得到CaWO 4,最后熔融状态下电解得到金属钨。
工艺流程图高三温习题2021(含答案)
化工流程题的解题策略1.一个完整的无机化工生产流程一般具有下列进程:2.各进程涉及的考点:(1)对原料进行预处置的常常利用方式及其作用:①研磨:减小固体的颗粒度,增大固体与液体或气体间的接触面积,加速反映速度。
②水浸:与水接触反映或溶解。
③酸浸:与酸接触反映或溶解,使可溶性金属离子进入溶液,不溶物通过过滤除去。
④灼烧:除去可燃性杂质或使原料初步转化。
如从海带中提取碘时的灼烧就是为了除去可燃性杂质,将有机碘转化为碘盐。
⑤煅烧:改变结构和组成,使一些物质能溶解;并使一些杂质在高温下氧化、分解,如煅烧高岭土和石灰石。
(2)核心化学反映要掌握:① 元素及其化合物知识:化工生产将原料转变成产品的进程,也是物质经历彼此转化的进程。
理解物质之间的转化关系,就要用到元素及其化合物的相关知识。
一般围绕铁、铜、铝、镁、氯、硫、磷、硅等元素的单质或化合物的工业制备来进行命题,需要掌握这些元素及其化合物的知识②还要掌握有关化工生产的知识,熟悉的有纯碱工业、氨工业、硅单质的制备、氯碱工业、海水中提取镁、海水中提取溴等;③化学反映原理:化工生产中把原料转变成产品的进程就是化学反映的进程,从化学反映原理的角度选择原料、控制条件和选择设备等,是化工生产的大体思路。
化学反映原理的相关知识包括质量守恒定律、化学反映速度、化学平衡、电化学、化学热力学等,做到能综合运用这些知识分析化工生产中化学反映的情况。
(3)化工生产进程中分离提纯、除杂等环节,与高中化学大体实验的原理紧密联系,包括过滤、洗涤、蒸发、结晶、蒸馏、萃取、分液等大体实验操作及原理,并要熟悉所用到的相关仪器。
(4)对整个工艺流程能进行评价:①表现绿色化学思想(利用无毒无害原料,采用原子利用率高的制备线路,原料的循环利用,副产物综合利用,节能,等);②高效节能方面(原料廉价,工艺简单,产品的纯度高,能耗低等)(5)化学计算:纯度,转化率、产率计算,有效数字的取舍2.解答大体步骤(1)读题头,得目的,划原料,明产品,解决“干什么”一般采用“首尾分析法”:通过阅读题头,了解流程图之外的文字描述、表格信息、后续设问中的提示性信息,通过对比分析工业流程示用意中的第一种物质(原材料)与最后一种物质(产品),弄清从原料动身,要取得最终产品,必需除去什么元素、引进什么元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工艺流程习题1.【2016年高考海南卷】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS。
某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。
采用的实验方案如下:回答下列问题:(1)在下列装置中,第一次浸出必须用____________,第二次浸出应选用____________。
(填标号)(2)第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液。
若顺序相反,会造成___________。
滤渣2的主要成分是____________________。
(3)浓缩硫酸锌、硫酸铜溶液使用的器皿名称是________________。
(4)某同学在实验完成之后,得到1.5gCuSO4﹒5H2O,则铜的回收率为__________________。
2.【2016年高考江苏卷】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。
实验过程如下:(1)酸溶过程中主要反应的热化学方程式为MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生反应的离子方程式为___________。
(3)用下图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
3.【2015年福建理综】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为_____________________。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:已知:①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_______________________ (只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是______。
③已知:Al2O3(s)+3C(s)===2Al(s)+3CO(g)ΔH1=+1 344.1 kJ·mol-12AlCl3(g)===2Al(s)+3Cl2(g)ΔH2=+1 169.2 kJ·mol-1由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为_________________________________。
④步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为________________________。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是____________________________。
4.【2017届天津五区期末考试】磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3·MgCO3。
某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图如下:请回答下列问题:(1)磷精矿分解温度_______________(填“高于”、“低于” )950℃;(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是______________________________,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是__________________________。
(3)磷精矿与SiO2、C发生反应时被还原的物质是_______________。
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。
写出石墨Ⅰ电极上发生反应的电极反应式_______________________,Na+向________(填写“石墨Ⅰ”或“石墨Ⅱ”)移动。
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1 HCOONa溶液,下列关系不正确的是____________。
a.c(H+)·c(OH-)=1×10-14b.c(H+)+c(HCOOH)=c(OH-)c.c(Na+)=c(HCOOH)+c(HCOO-) d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值______(填写“增大”“减小”或“不变”)。
5.【2017届四川资阳市期末考试】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)制备铁红(Fe2O3)的生产流程如下:试回答下列问题:(1)步骤Ⅰ所得溶液中铁元素的化合价是。
(2)实验室中实现步骤Ⅱ中分离操作需要的仪器有、铁架台、玻璃棒、烧杯。
(3)步骤Ⅲ中发生的离子方程式,向反应后的溶液中加入试剂,当观察到说明步骤Ⅲ已经进行完全。
(4)步骤Ⅳ中不能选用试剂调节溶液的pH (填字母编号)。
a .FeO 固体b .氢氧化钠溶液c .Fe 2O 3固体d .氨水(5)室温下FeCO 3达到溶解平衡时溶液pH =8.5,c (Fe 2+)=1.2×10-6mol·L -1。
则FeCO 3固体产物中(选填“有”或“无”)Fe(OH)2。
(已知:K sp =4.8×10-16)(6)步骤Ⅵ中发生反应的化学反应方程式为。
6.【2017届南京盐城市第一次模拟考试】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe 3O 4,少量碳及二氧化硅)为原料制备的流程如下:(1)废铁渣进行“粉碎”的目的是 ▲ 。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、 氧流量等,其中酸浸温度对铁浸取率的影响如下图所示:①加热条件下酸浸时,Fe 3O 4与硫酸反应的化学方程式 为 ▲ 。
②酸浸时,通入O 2的目的是 ▲ 。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是 ▲ 。
(3)滤渣的主要成分为 ▲ (填化学式)。
(4)“Fe 3+浓度检测”是先用SnCl 2将Fe 3+还原为Fe 2+;在酸性条件下,再用K 2Cr 2O 7标准溶液滴定Fe 2+(Cr 2O 72-被还原为Cr 3+),该滴定反应的离子方程式为 ▲ 。
7.【2017届长沙市期末考试】亚氯酸钠(NaClO 2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。
以下是制取亚氯酸钠的工艺流程:废铁渣滤渣聚硅酸铁8~9mol L -1工业硫酸已知:ClO2气体在中性和碱性溶液中不能稳定存在,且只能保持在浓度较低状态下以防止爆炸性分解,需现合成现用。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式:。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为。
A.稀硫酸 B.盐酸 C.硝酸 D.H2C2O4溶液(3)ClO2吸收塔内的温度不能过高,其原因为:(4)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。
某工厂污水中含CN-amg/L,现用ClO2和CN-氧化,生成了两种无毒无害的气体,其离子反应方程式为;处理100m3这种污水,反应过程转移的电子数为。
1(1)D A (2)H2O2与固体颗粒接触分解(3)蒸发皿(4)30%2(1)加快酸溶速率;避免制备MgCO 3时消耗更多的碱(2)H 2O 2+2Fe 2++2H +=2Fe 3++2H 2O (3)①分液漏斗;②充分振荡(4)至5.0<pH <8.5,过滤,边搅拌边向滤液中滴加Na 2CO 3溶液至有大量沉淀生成,静置,向上层清液中滴加Na 2CO 3溶液,若无沉淀生成,3(1)Al 3++3H 2O Al(OH)3(胶体)+3H +(2)①防止后续步骤生成的AlCl 3水解或增大反应物的接触面积,加快反应速率 ②Fe 或铁③Al 2O 3(s)+3C(s)+3Cl 2(g)===2AlCl 3(g)+3CO(g) ΔH =+174.9 kJ·mol -1④NaCl、NaClO 、Na 2CO 3 ⑤除去FeCl 3,提高AlCl 3纯度4(1)高于;(2)NH 4+水解使溶液呈酸性,H +能从磷矿I 中浸取出Ca 2+(或H +与CaO 、Ca(OH)2反应生成Ca 2+);CaSO 4微溶于水,第一次若使用硫酸,不能完全浸取Ca 2+(3)Ca 5(PO 4)3F(4)CO+O 2--2e -=CO 2;石墨Ⅱ;(5)①d;②减小 5(1)+2、+3; (2)漏斗;(3)2H ++Fe =Fe 2++H 2↑, 2Fe 3++Fe =3Fe 2+;KSCN 溶液;无血红色现象; (4)bc ; (5)无; (6)4FeCO 3+O 22Fe 2O 3+4CO 2;6(1)减小颗粒直径,增大浸取时的反应速率和提高铁浸取率 (2)① Fe 3O 4+4H 2SO 4FeSO 4+Fe 2(SO 4)3+4H 2O ②将FeSO 4氧化为Fe 2(SO 4)3③温度超过100℃明显加快了Fe 3+水解反应的速率,导致Fe 3+浓度降低 (3)C 和SiO 2 (4)6Fe 2++Cr 2O 72-+14H +=6Fe 3++2Cr 3++7H 2O7(1)Cl -+6e -+3H 2O==ClO 3-+6H +(2)A (3)温度过高H 2O 2将分解 (4)2CIO 2+2CN -=2CI -+2CO 2+N 2↑ 250aN A /13高温△。
