第8章 芳环取代09
芳环亲核取代反应专项文档

0
0
0
9
OCH3 2.3× 104 0.25
5.5× 10 4
氯苯的三个分速度因数均小于1,卤素是致钝基团, 且 fm << fp, E+进入间位的可能性很小。
苯甲醚:
fp ≈ fo >> fm
-OCH3 对邻、对位具有+C, +I效应,+C > +I 对间位,只有+I, 而无+C效应。
2〕Hammett 方程
第二类定位基:
+
N (C H 3)3
N O 2C NSO 3HC +H OC O C H 3
C O O HC O O RC O N H 2 N H 3
具有-I或-C效应 使芳环上的电子云密度降低。
定位效应 (Orientation):
芳环上取代基对于E+进入芳环位置的影响。 第一类定位基-邻对位定位基 第二类定位基-间位定位基
3. 取代基的定量关系
取代基效应与化学活性之间存在一定的定量关系
1) 分速度因数与选择性
从定量关系上考虑邻、对、间位取代难易程度
(6) (k取代)(z产物的百分比)
分速度因数 (f) =
y (k苯)
y-位置的数目
通过每一个位置取代苯的活性与苯比较,把总的 速率乘以邻位、间位或对位产物的百分比,CH2 H
邻对位
E
CH CH2 H
CH CH2 H
E
E
CH CH2 H E
+E
间位 CH CH2 CH CH2
共振式越多,
H
H
正电荷分散
E
E
程度越大,芳正离子越稳定。
CH CH2
H E
芳环的取代反应
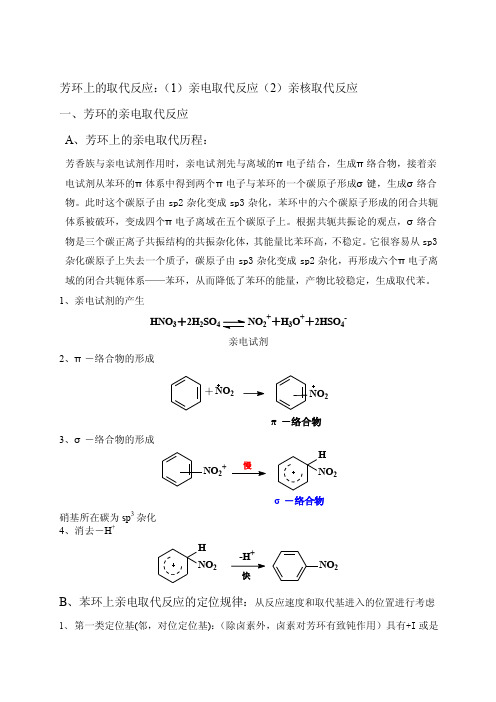
芳环上的取代反应:(1)亲电取代反应(2)亲核取代反应 一、芳环的亲电取代反应 A 、芳环上的亲电取代历程:芳香族与亲电试剂作用时,亲电试剂先与离域的π电子结合,生成π络合物,接着亲电试剂从苯环的π体系中得到两个π电子与苯环的一个碳原子形成σ键,生成σ络合物。
此时这个碳原子由sp2杂化变成sp3杂化,苯环中的六个碳原子形成的闭合共轭体系被破环,变成四个π电子离域在五个碳原子上。
根据共轭共振论的观点,σ络合物是三个碳正离子共振结构的共振杂化体,其能量比苯环高,不稳定。
它很容易从sp3杂化碳原子上失去一个质子,碳原子由sp3杂化变成sp2杂化,再形成六个π电子离域的闭合共轭体系——苯环,从而降低了苯环的能量,产物比较稳定,生成取代苯。
1、亲电试剂的产生HNO 3+2H 2SO4NO 2++H 3O ++2HSO 4-亲电试剂2、π-络合物的形成+NO 2π-络合物23、σ-络合物的形成NO 2+HNO2σ-络合物硝基所在碳为sp 3杂化 4、消去-H ++NO 2H NO 2快B 、苯环上亲电取代反应的定位规律:从反应速度和取代基进入的位置进行考虑1、 第一类定位基(邻,对位定位基):(除卤素外,卤素对芳环有致钝作用)具有+I 或是+C 效应,其作用是增大芳环的电子云密度。
致活基NH 2NHR2OHORNHCROPhR致钝基F Cl BrI2、 第二类定位基(间位定位基):具有-I 或-C 效应,使芳环上的电子云密度降低,均为致钝基NO 2NR 3COOHCOORSO 3HCNCHOCROCCl 3C 、影响亲电取代的因素:(1)芳环上取代基对于E +进入芳环位置的影响第一类定位基-邻对位定位基第二类定位基-间位定位基共振式越多, 正电荷分散程度越大,芳正离子越稳定。
(2) 动力学控制与热力学控制: α位取代-动力学控制产物; β位取代-热力学控制产物。
(3) 邻位和对位定向比:a 亲电试剂的活性越高,选择性越低。
芳环亲核取代反应

③、按SN1机理进行的亲核取代反应
当环上有吸电子基团内时, 重氮盐的分解速率减慢;
当环上有供电基团时: 若取代基处于间位,提高反应速率; 若取代基处于对位,降低反应速率。
2、 离去基团对活性的影响
离去基团离去能力的大致次序是
F > N O 2 > O T s > S O C 6 H 5 > C l,B r,I, > N 3 > N R 3 > O R ,O A r,S R ,S O 2 R ,N H 2
Note: 在芳香亲核取代反应中离去能力是 F > Cl , Br , I , 这不同于脂肪族亲核取代反应SN1和SN2 的取代顺序。
原因:芳香取代反应机理常常是第一步是决定速率的, 在该步中,强的 -I 基团有利于反应的进行, 这也解释了F和NO2是那样容易离去的原因。
离去基团离去的难易,不仅和基团离去后生成的 负离子的稳定性有关,还与亲核试剂的性质有关
NO2 H+
OH NO2
O2N
NO2
NO2
NO2
Cl
ONa
OH
NO2Na2 CO3O2N 35℃
NO2 H+O2N
NO2
NO2
N O2
N O2
B.芳基重氮离子的单分子亲核取代(SNAr1)
在芳环上按照SN1机理进行的反应很少,重氮盐的重氮基 被取代的反应认为是按SN1机理进行的。
NN slow fast
+
NH2
50%
50%
B r
N aN H 2.液 液氮 氨
C H 3 - 35℃ N H 2
C H 3+
N H 2
CH3O
57%
芳环上的取代反应

Cl
OH
OH-
435500M℃Pa
O2N
Cl NO2 OH- O2N
25℃
NO2
OH NO2
NO2
L
N
NO2
NO2
N
NO2
H
NO2
L=Cl Br I SO2Ph p-O2NC6H5O-
L Nu-
L Nu Nu
快
F 》Cl,Br, I
OCH3
H3CO OC2H5
OC2H5
O2N
NO2 KOC2H5 O2N
螯合效应:
CH2 O CH3 CH2
NO2 O NO2-NO3-
CH2 OCH3
CH2
69%(邻)
NO2 28%(对)
能够发生螯合 效应旳条件: 1〕杂原子能与 试剂结合; 2)所形成环为 五员环或六员 环。
CH2 CH2
O
CH3
NO2
CH2 O CH3
CH2
H -H+
NO2
产物
原位取代 (Ipso取代):
卤代反应:
Br2 + FeBr3
δ
Br
Brδ
FeBr3
溴分子在FeBr3旳作用下发生极化
Br
R
Br Br FeBr R
H + Br + FeBr3
生成芳正离子
Br
Br
R
HR
+H
脱去质子
试验已经证明芳正离子旳存在:
H3C
CH3 C2H5F/BF3
-80℃
CH3
H C2H5
H3C
CH3 BF4-
CH3 m. p: -15℃
在芳环上已经有取代基旳位置上,发生取代作用- Ipso效应:
药物分析课件第八章杂环类药物的分析

取供试液Ⅰ和对照液Ⅱ各20μl,分别进样记录色谱图至主成分
峰保留时间的2倍。供试液Ⅰ如出现与对照液Ⅱ中杂质A和B相对应
的峰,其峰面积不得大于对照液Ⅱ中杂质A和B的峰面积;如出现除
杂质A和B以外的其他杂质峰,其峰面积不得大于对照液Ⅱ中硝苯地
平的峰面积;各杂质总量不得大于0.5%。供试液Ⅰ中小于对照液Ⅱ
此法专属性差,因异烟肼(慢)和硫酸肼均生成腙而
析出沉淀。
2.比浊法
3. 差示分光光度法
肼 异烟肼
+ 对-二甲氨基苯甲醛
黄色缩合物对-二甲氨基苯甲醛连氮 (λmax = 456nm 有最大吸收)
形成的缩合产物对-二甲氨基苄叉 (于λmax =456nm波长处无吸收)
6
显色剂:乙醇制对-二甲氨基苯甲醛试液
7
BP的检查方法:
于254nm紫外光下检测,供试品中的杂质斑点强度应
小于对照溶液中异烟肼色谱斑点;再喷以对-二甲氨基苯
甲醛溶液,并在日光下检视,对照溶液中硫酸肼斑点的
强度大于供试液中的杂质斑点。
检测结果:
JP(14)采用样品中加水杨醛的乙醇溶液观察混浊
的方法来控制游离肼的限量。
三、有关物质检查
供试品溶液制备: 取异烟肼1.0g,加丙酮-水(1:1)制成10ml.
1
对照溶液制备: 取硫酸肼50mg,加水50ml使溶解后,加丙酮稀
2
释至100ml;量取10ml,加供试品溶液0.2ml,
3
加丙酮-水(1:1)稀释至100ml。
4
薄层板:硅胶GF254薄层板
5
展开剂:醋酸乙酯-丙酮-甲醇-水(50:20:20:10)
吡啶环的特性 异烟肼和尼可刹米的吡啶环
苯取代机理5个学时

CH3和烷基:弱致活基,邻对位定位基。
ortho-
CH3 E H
CH3 E H
CH3 E H
particularly stable
CH3
para-
EH
CH3
meta-
E
H
particularly stable CH3
EH CH3 E H
CH3
EH CH3 E H
OH, OR;NH2, NHR, NR2:强致活基,邻对位定位基。
二、取代基对芳环亲电取代反应的影响
2. The effect of substituents on reactivity
二、取代基对芳环亲电取代反应的影响
Relative reactivity:
Strongly activating substituents
致活基 Moderately activating substituents
— Therefore, the electrophile that can effect aromatic subsitution of benzene must be more reactive than those addition to alkenes. 因此, 与苯环反应的亲电试剂需要更高的反应活性
一、芳环的亲电取代反应及机制
2. Reaction coordinate diagrams:
一、芳环的亲电取代反应及机制
3.The five most common electrophilic aromatic substitution reactions are the following:
O
② Deactivating substituents (致钝基) —— Electron-withdrawing substituents (吸电子 基) decrease the reactivity of the benzene ring toward electrophilic aromatic substitution.
第四章_芳环上的取代反应
6)原位取代 (Ipso取代):
在亲电取代反应中,亲电试剂取代苯环上原有的取代 基,称为原位取代。
CH3 NO2 +
CH3
NO2OAc Ac2O
CH3
CH3
CH(CH3)2
CH(CH3)2 82%
+ NO2 CH(CH3)2 NO2 8% 10%
苯环上原有取代基被取代的难易,取决于离去基团
带有正电荷的稳定性或形成产物的难易程度。
_
因为一级正丙基正离子重排为 更稳定的二级异丙基正离子: CH3CHCH2 H 正丙基正离子 重排 CH3CHCH3 异丙基正离子
B). 酰基化
O AlCl3 O CR + HCl 烷基 苯 基 酮
+ R CC l O O
( RCOOH)
(or RCOCR)
酰基化反应不会发生重排
酰基化历程
O RCC l + A lC l 3 O + O CR H RC AlCl 4 O RC AlCl4 O CR H + A lC l 4
fa st
E
+ s lo w σ-络合物芳正离子
E
fa st
p-络合物
芳正离子生成的一 + + H 步是决定反应速率 的一步
实验已经证实芳正离子的存在:
CH3 C2H5F/BF3 H3C CH3
-80℃
H C2H5 CH3 H3C BF4CH3 m. p: -15℃
苯环亲电取代反应进程-位能变化曲线图
+
5)螯合效应:当环上的取代基与亲电试剂发 生配位时,通常发生邻位取代。
H2 C HNO3 / H2 SO4 H2 C H2 C O CH 3 H2 C + NO 2 59% H2 C H2 C O CH 3
物理化学 林树坤 第8章 化学动力学 习题答案
第8章化学动力学习题1. 请依据质量感化定律写出下列基元反响的反响速度暗示式(试用各类物资分离暗示).(1(2)(3(4解:(1(2(3(42.试求k c与k p之间的关系,设气体为幻想气体.解:因为p A=c B R T=c A R T则3. 298K时N2O5(g) 5.7h,此值与N2O5的肇端浓度无关,试求:(1)该反响的速度常数.(2)感化完成90%时所需时光.解:依据题意断定该分化反响为一级反响,是以可求得(1(24. ,半衰期为15min,试问该试样有80%分化,需时若干?解:依据题意断定该放射反响为一级反响,是以可求得(1(25.把必定量的PH3(g)敏捷引入温度为950K的已抽空的容器中,待反响物达到该温度时开端计时(此时已有部分分化),测得实验数据如下:t/s 0 58 108 ∞p/kPa,求该反响的速度常数k 值.(设在t=∞时反响根本完成).解:应用一级反响的公式,c0正比于p0,c正比于p t,所以当t=58s时当t=108s时6.在298K时,NaOH与CH3COOCH3皂化感化的速度常数k2与NaOH与CH3COOC2H5k试问在雷同的实验前提下,当有90%的CH3COOCH3被分化时,CH3COOC2H5的分化百分数为若干?(设碱与酯的浓度均相等)解:由二级反响的动力学方程=76.27%7. 某放射性元素经14天后,活性下降了6.85%.试求:(1)该放射性元素的半衰期;(2)若要分化失落90%,需经多长时光? 解:放射性元素的衰变相符一级反响纪律. 设反响开端时,其活性组分为100%,14天后,残剩的活性组分为100%─6.85%,8. 在某化学反响中随时检测物资A 的含量,1小时后,发明A 已感化了75%,试问2小时后A 还残剩若干没有感化?若该反响对A 来说是:(1)一级反响.(2)二级反响(设A 与另一反响物B 肇端浓度雷同). (3)零级反响(求A 感化所需时光). 解:(1)由一级反响速度公式,k -1x =6.25%(2)=14.3%(3) c 0─c 0=k k=0.75 c 09. ,开端时A 和B 的物资的量之比为2:1,肇端总压为3.0,在400K时,60s后容器中的总压力为 2.0,设该反响的速度方程为:求400K时,150s后容器中B的分压..解:因为温度.体积雷同,即P A=2p B2A(g)+B(g)=G(g)+H(s)t=t 2p B p对二级反响有当t=150s时求得P B10.某物资A的分化是二级反响.恒温下反响进行到A消费失落初浓度的1/3所须要的时光是2min,求A消费失落初浓度的2/3所须要的时光.解:11. 反响的级数为n(且),证实其半衰期暗示式为(式中k为速度常数):解:, ,积分得,当x =a21时,)1(121)1(211112/1-⎥⎥⎦⎤⎢⎢⎣⎡-⎪⎭⎫ ⎝⎛=--⎪⎭⎫ ⎝⎛-=----n k a n k aa a t n n n n=)1(1211----n k a n n12.氯化醇和碳酸氢钠反响制取乙二醇: CH 2OHCH 2Cl (A)+ NaHCO 3 (B)CH 2OHCH 2OH + NaCl + CO 2已知该反响的微分速度方程为:AA B d d c kc c t -=,且测得在355K 时反响的速度常数115.20mol L h k --=.试盘算在355 K 时:(1) 假如溶液中氯乙醇.碳酸氢钠的初始浓度雷同,-1A,0B,0 1.2mol L c c == ,氯乙醇转化95%须要若干时光?(2) 在同样初始浓度的前提下, 氯乙醇转化率达到99.75%须要若干时光?(3) 若溶液中氯乙醇和碳酸氢钠的开端浓度分离为-1A,0 1.2mol L c =,-1B,0 1.5mol L c =,氯乙醇转化99.75%须要若干时光?解:(1) 由速度方程知反响为二级反响, 且两反响物开端浓度雷同, 则 (2) 同理2AA,0111111()[]63.9h 5.20(199.75%) 1.20 1.20t k c c =-=-=-⨯(3)因为两反响物开端浓度不合, 则13.已知HCl(g)在 1.013×105Pa 和298K 时的临盆热为─92.3KJ·mol -1,临盆反响的活化能为113KJ·mol -1,试盘算其逆反响的活化能.解:反响热与活化能之间的关系为:即:,=113─(─92.3)=205.3(KJ·mol-1)14. 某一级反响在340K时完成20%需时3.20min,而在300K时同样完成20%需时12.6min,试盘算该反响的实验活化能.解:因为初始浓度和反响程度都雷同,所以可直接应用公式依据Arrhenius得15. 已知在540~727K 时之间产生定容反响,其速度常数k的暗示为k/( mol-1·dm3·s-1×1010exp(─132kJ·mol-1/R T)若在600K时,CO(g)和NO2(g)的初始压力分离为667和933Pa,试盘算:(1)该反响在600K时的k p值.(2)反响进行10h今后,NO的分压为若干.解:(1)(2解得p=141.5Pa16. 已知构成蛋的蛋白蛋白的热变感化为一级反响,其活化能约为85kJ·mol-1,在与海平面雷同高度处的滚水中“煮熟”一个蛋须要10min.试求在海拔2213m高的山顶上的滚水中“煮熟”一个蛋须要多长时光.假设空气的体积构成为80%N2和20%O2,空气按高g -1.解:先求2213m 凌驾的压力p×10-3㎏·mol -1为空气的平均摩尔质量.因为压力不合所引起的沸点不合─解得 T=366.1K,因为温度不合而引起的速度常数不合17.硝基异丙烷在水溶液中与碱的中和反响是二级反响,其速度常数可用下式暗示:时光以min 为单位,. (1)盘算反响的活化能,及指前因子(2)在283K 时,求反响的半衰期.解:(1对比已知公式(2)附加.已知HCl(g)在 1.013×105Pa 和298K 时的临盆热为─92.3KJ·mol -1,临盆反响的活化能为113KJ·mol -1,试盘算其逆反响的活化能.解:反响热与活化能之间的关系为:即:=113─(─92.3) =205.3(KJ·mol -1) 18. 已知某气相反11AB+Ck k -在25℃时的k 1和k -1-1和3.938×10-3Pa -1·s -1,在35℃时正逆反响的速度常数k 1和k -1均增长为本来的 2倍.求: (1)25℃时的均衡常数K C ; (2)正逆反响的活化能; (3)反响的热效应Q . 解:(1)-141510.2s 5.06610Pa 3.94810c k K k --===⨯⨯(2)⎪⎪⎭⎫ ⎝⎛-=211211lnT T R E k k ,111153(kJ mol 53kJ mol E E ---=⋅=⋅);(3)011=-=-E E Q 19. N 2O(g)(g)O (g)2N O(g)2N 22k2+−→−,从实验测出不合温度时各个肇端压力与半衰期值如下:反响温度T /K初始压力kPa p /0半衰期s t /2/1967 380 967 1520 1030 1440 1030212(1)求反响级数和两种温度下的速度常数. (2)求活化能E a 值.(3)若1030K 时N 2O(g)的肇端压力为54.00kPa,求压力达到64.00kPa 时所需时光.解:(1)因为则又因为(2)(3) 2N 2O(g)=2N2(g)+O 2(g) 5400─20. 实验在恒温恒容下进行,稀有据如表所示.(1)求表中方框内空白处的半衰期值.k 值(kPa -2·s -1).(3)盘算活化能.解:(1)实验1.2中,A 是大大过量的,可将速度方程简化为一级反响B B A M p k p kp dt dp 12≈=, 因一级反响的2/1t 与0B p 无关,所以实验2的2/1t 与实验1雷同,为19.2s.实验3.4中,B 是大大过量的,速度方程可简化为二级反响 二级反响的2/1t 为ak 21,)3()4()4()3(002/12/1A A p p t t =333.1666.2)4(8352/1=t ,2/1t ((2)12/110361.02.192ln 2ln -===s t k(3)比较实验1.5,肇端浓度雷同,92.1102.19)1()5(2/12/115===t t k k ,⎪⎪⎭⎫ ⎝⎛-=511511lnT T R E k k a ,即 ⎪⎭⎫ ⎝⎛-=2.111312.1093192.1ln R E aE a =330kJ ·mol -121. 已知对立反响,在不合温度下T /K1621min --⋅⋅dm mol k1311min ---⋅dm mol k600 ×105 645×105试盘算:(1)不合温度下反响的均衡常数值.(2)该反响的m r U ∆(设该值与温度无关)和600K 时的m r H ∆.解:(1))600()600()600(11K k K k K K -=应用下述公式 22. 某一气相反响,已知在298K 时,k 1-1,k 2=5×10-9Pa -1·s -1,当温度升至310K 时,k 1和k 2值均增长1倍,试求:(1)298K 时的均衡常数K p,(2)正.逆反响的实验活化能,(3)反响的mrH ∆kPa 时,问需时若干?解: (1)Pa k k K p 7921102.410521.0⨯=⨯==-(2) E a (正)=E a (逆)=122112)()(lnT T T T T k T k R -⨯×ln2×298310310298-⨯·mol -1(3)2ln RT H dTK d m r p∆=,因为ln =dTK d p,所以m r H ∆=0.(4)t=0θp 0 0t=tθp ─xxxkPax p p 99.151=+=θ总 , x=50.66kPa,221)(x k x p k dtdx--=θ)(1x p k -≈θ (21k k << ) ⎰⎰=-tx dtk xp dx10θ,tk xp p 1ln=-θθ,s kPap p s x p p k t 3.366.50ln 21.01ln 111=-=-=-θθθθ23. 当有碘消失作为催化剂时,氯苯(C 6H 5Cl )与氯在CS 2溶液中有如下的平行反响:设在温度和碘的浓度一准时, C 6H 5Cl 和Cl 2在溶液中的肇端浓度均为0.5 mol ·dm -3,30min 后有15%的C 6H 5Cl 转化为邻- C 6H 4Cl 2,有25%的C6H5Cl改变成对- C6H4Cl2,试盘算k1和k2.解:由平行反响××解得k13·mol-1·s-1 ,k23·mol-1·s-1 24. 乙醛的离解反响CH3CHO=CH4+CO是由下面几个步调构成的(1(2(3(4试用稳态近似法导出:证实:产品CH4的生成速度为反响的中央产品为生动的自由基,故按稳态法处理25. 气相反响H2(g)+Br2(g)=2HBr(g)的反响过程为(1)(2(3)(4)(5)试证实反响的动力学方程式为证实①-③得②+③得以⑤代入②式移项得:以⑥代入④式得:⑦式分子.并令:26.由反响C 2H 6+H 2=2CH 4,其反响过程可能是设反响(1)为快速对立反响,对H 可作稳态近似处理,试证实②+① 因为 所以27. 光气热分化的总反响为,COCl 2=CO+Cl2该反响的过程为个中反响(2)为速决步,(1).(3)是快速对立反响,试证实反响的速度方程为证实:因为反响速度取决于最慢的一步,所以 由(1)式得所以28.蔗糖在酸催化的前提下,水解转化为果糖和葡萄糖,经实验测蔗糖(右旋) 果糖(右旋)葡萄糖(左旋)这种实验一般不剖析浓度,而是用旋光仪测定反响进程中溶液的旋光角.反响开端时,在t =8min 时,测得旋光,即蔗糖已水解完毕,因为葡萄糖的左旋大于果糖的右旋,所以最后溶液是左旋的.试求该水解反响的速度系数和半衰期.t时刻的浓度之比.因为旋光度与溶液的浓度成正比,是以可以应用旋光度之比来代替溶液的浓度比,即:,t时刻的旋光度.。
高等第8章 芳环取代
NO2 O NO2
能够发生螯合 效应的条件: 1〕杂原子能与 试剂结合; 2)所形成环为 五员环或六员 环。
-NO3-
CH3 CH2 O CH2 NO2
CH2 O CH3 CH2 H -H+ 产物 NO2
原位取代 (Ipso取代):
CH CH2 H E CH CH2 H E
CH
CH2 + E
邻对位
间位
CH
CH2 CH
CH2 H E
CH
CH2 H E
H 共振式越多, 正电荷分散 E 程度越大,芳正离子越稳定。
动力学控制与热力学控制
H
80 ℃ 165 ℃
SO3H
+ H2SO4
165 ℃
H
SO3H
α位取代-动力学控制产物; β位取代-热力学控制产物。
1. 加成-消除机理
X Nu
-慢
X
决定步骤
Nu
Nu X-
X=卤素 NO2 OR 等 Nu-=OH- NH2- RNH- RO-
芳烃亲核取代反应负离子机理
Meisenheimer络合物
Cl
OH
OH350℃ 450 MPa
Cl O2N NO2 OH O2N
25℃
OH NO2 NO2
NO2
L NO2 NO2 N H
第8章 芳环亲电和亲核取代反应 ( )
一. 亲电取代反应 ( )
1. 反应机理 芳正离子的生成 加成-消除机理 2. 反应的定向与反应活性 ( ) a. 反应活性与定位效应 b. 动力学控制与热力学控制 ( ) c. 邻、对位定向比 ( ) 亲电试剂活性 空间效应。 极化效应
烷基化反应及其工艺
能够接受电子形成带负电荷的碱性试剂,同时形成活泼的亲电质点
第65页/共83页
AlCl3使卤烷转变为活泼的亲电质点—烷基正离子
第66页/共83页
液态烃溶剂中
• AlCl3能与HCl作用生成络合物,这种络合物又能 与烯烃反应,形成活泼的亲电质点。
第44页/共83页
第45页/共83页
氨或脂肪胺与环氧乙烷的反应,用于制备乙醇胺类化合物:
第46页/共83页
• -CN、-COOH、-COOR
2,用烯烃衍生物烷化
• 第47页/共83页
以丙稀腈为例的反应
第48页/共83页
• 伯胺一般可以引入两个烷基,但在引入第一个烷基衍生物后,反应活性下降 二烷基化时要加入铜盐作Cat,如氯化铜、氯化亚铜、醋酸铜 或者极性Cat:如乙酸、三乙胺、吡啶等
第5页/共83页
第6页/共83页
三氯化铝与盐酸生成络合物以后,其质子与烯烃的加成 符合马尔科夫尼科夫规则
CH3 CH CH3
第7页/共83页
CH3 C CH3 CH3
2,卤烷的烷基化
第8页/共83页
• (1)C-烷基化是连串反应
3,芳烃烷基化反应的特点
• (2)C-烷基化反应是可逆反应烷基的转移和歧化 • (3)烷基可能重排 1-氯丙烷与苯反应产物
第13页/共83页
(2)抗氧剂264的制备
HO
+ CH3 2 H2C
CH3浓H 2SO4 C
C(CH 3)3
HO
CH3
CH3
C(CH 3)3
第14页/共83页
第15页/共83页
• 醇类、醛类和酮类弱烷基化剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苯分子的结构
芳环易于发 芳环易于发 生亲电取代反 生亲电取代反 应,只有当芳 环上引入了强 吸电子基团, 吸电子基团, 才能发生亲核 取代反应。 取代反应。
一. 亲电取代反应
加成- (一) 加成-消除机理
+E
E
快
+
快
E
+ 慢
H
+
E
π-络合物 络合物
σ-络合物
芳正离子
取代苯
二个实例: 二个实例: 1.
X 具有-I效应,使邻位的电子云密度降低。 具有- 效应 使邻位的电子云密度降低。 效应,
F Cl Br I 电负性 依次 降低 -I 效应 依次 减小
电子云密度 降低的位置 是不利于E 是不利于 + 进攻的。 进攻的。
6. 溶剂效应
CS2 O CH3C Cl AlCl3 PhNO2
O CCH3 O CCH3
m. p: -15℃ ℃
亲 电 取 代 反 应 机 理
(二) 亲电取代反应的特性与相对活性 1. 反应活性: 反应活性: 致活效应: 致活效应:取代基的影响使芳环的反应活 性提高; 性提高; 第一类定位基: 第一类定位基:
N(CH3)2, NH2, OH, OCH3, NHCOCH3, OCOCH3, Br, I, CH3, CH2COOCH3 Cl,
Cl NaNH2 NH2NH2 NH2
Br OCH3 NaNH2
OCH3 NH2 OCH3
NH2-
Z
I,NH3 ,
NH3
-
+
Z X
Z Z
I,NH3 ,
-
NH3
Z
I,NH3 ,
+
Z
Z
-
NH3
+
Z X
I,NH3 ,
+NH3
Z H X H
Z H X H
OCH3 NaNH2 Br
优先消去酸性强的质子
Z
Z
3. 动力学控制与热力学控制
H
80 ℃ 165 ℃
SO3H
+ H2SO4
165 ℃
H SO3H
α位取代-动力学控制产物; 位取代-动力学控制产物; 位取代 β位取代-热力学控制产物。 位取代- 位取代 热力学控制产物。
4. 邻位和对位定向比: 邻位和对位定向比: 1)亲电试剂的活性越高,选择性越低: 亲电试剂的活性越高,选择性越低: 亲电试剂的活性越高
第8章 芳环亲电和亲核取代反应 章 芳环亲电和亲核取代反应 亲电和
一. 亲电取代反应 1. 反应机理 2. 反应的定向与反应活性 3. 取代效应的定量关系 二. 芳环上亲核取代反应 1. 加成-消除机理 加成- 2. SN1机理 机理 3. 消除-加成机理 (苯炔机理) 消除- 苯炔机理) 三. 芳环上的取代反应及其应用
kX lg kH
底物不同, 不同 不同; 底物不同,ρ不同; 反应条件不同, 不同 不同。 反应条件不同, ρ不同。 ρ只与反应性质相关, 只与反应性质相关, 只与反应性质相关 称为反应常数。 称为反应常数。
σx
ρ 表示了取代基对反应 速率的影响。 速率的影响。
σ>0, 取代基为吸电子基团; 取代基为吸电子基团; σ< 0, 取代基为供电子基团。 取代基为供电子基团。 当ρ > 0时, 吸电子基团加速反应; 时 吸电子基团加速反应; 当ρ <0时,供电子基团加速反应; 时 供电子基团加速反应; 当ρ= 0时,取代基对反应影响不大。 时 取代基对反应影响不大。 根据σ值 可以预测取代基性质; 根据 值,可以预测取代基性质; 根据ρ值 可以预测反应机理。 根据 值,可以预测反应机理。OHOH NO2
NO2
O2N
OCH3 H3CO OC2H5 NO2 NO2 KOC2H5 O2N NO2 NO2
OC2H5 OCH3 O2N NO2 NO2
2. SN1 反应
N N
+ +
N2
+
H2O
快
OH2+ -H+
OH
NH2
NaNO2 HCl
N2+ClKI
I
3. 消除-加成反应机理 (苯炔机理 消除- 苯炔机理) 苯炔机理
CH3
NO2OAc Ac2O
CH3 NO2 + CH(CH3)2 82%
CH3
CH3
CH(CH3)2
+ NO2 CH(CH3)2 NO2 8% 10%
取代基消除的难易程度取决于其容纳正电 的能力。 比较稳定, 荷的能力。+CH(CH3)2比较稳定,异丙基容 易作为正离子消除。 易作为正离子消除。
(三)取代基的定量关系 取代基效应与化学活性之间存在一定的 定量关系。 定量关系。 1) 分速度因数与选择性 从定量关系上考虑邻、对、间位取代难易 从定量关系上考虑邻、 程度。 程度。 分速因数: 分速因数:取代苯中某一位置的二元取代速 度与苯的一个位置的一元取代速度之比。 度与苯的一个位置的一元取代速度之比。
比较各种化合物活泼性的方法——竞争硝 竞争硝 比较各种化合物活泼性的方法 化法: 化法: 比如:以乙酐为溶剂, 比如:以乙酐为溶剂,在30℃下,用乙酰硝 ℃ 酸酯硝化苯和甲苯的等摩尔溶液( 酸酯硝化苯和甲苯的等摩尔溶液(反应物大 大过量)。反应完成后,分析产物, )。反应完成后 大过量)。反应完成后,分析产物,硝基甲 苯与硝基苯的摩尔比为20/1。 苯与硝基苯的摩尔比为 。 kt Kr= = 20×6/5 = 24 = × kb 此法优点:只需测定两种硝化产物的比例, 此法优点:只需测定两种硝化产物的比例, 不必测定反应常数的绝对值。 不必测定反应常数的绝对值。
Z
进攻邻位
Z
Z E H E H
Z E H
... .
E H
较常稳定极限结构
Z
Z
Z
Z
Z
E+
进攻对位
E H H E H
E
Z
进攻间位
H
E
较常 稳定极限 结构
Z H E Z H E Z H E
H E
Z为供电基,亲电试剂进攻邻对位有利;Z为吸电 为供电基,亲电试剂进攻邻对位有利; 为吸电 为供电基 子基,亲电试剂进攻间位有利。 子基,亲电试剂进攻间位有利。
CH3
NO2+BF4-/CH3CN HNO3 H2SO4 相 对速率 o % 17 60 2.3 69
m% p%
3 2 37 29
2) 空间效应越大,对位产物越多: 空间效应越大,对位产物越多:
C(CH3)3 H2SO4 C(CH3)3
100 %
SO3H
5. 极化效应: 极化效应:
X
X F Cl I o% p% m% 12 30 32 88 69 60 0 1 8
除卤素外)具有+I或是 或是+ 第一类取代基 (除卤素外)具有 或是+C 效应,其作用是增大芳环的电子云密度。 效应,其作用是增大芳环的电子云密度。
致钝效应: 致钝效应:取代基的影响使芳环的反应活性 降低。 降低。 第二类定位基: 第二类定位基:
N(CH3)3 NO2 CN SO3H CHO COCH3 + COOH COOR CONH2 NH3
I 优先
I 优先
OCH3 NH2
OCH3 OCH3 NH3 NH3
+
4. 底物结构对活性的影响
Cl O2N NO2 NO2 Cl Cl NO2 NO2 Cl
>
Cl ≈ NO2
>
>
>
NO2
NO2 O NO2
-NO3-
CH3 CH2 O CH2 NO2
能发生螯合效应的条件: 〕 能发生螯合效应的条件:1〕杂原子能与试 剂结合; )所形成环为五员环或六员环。 剂结合;2)所形成环为五员环或六员环。
8. 原位取代 (Ipso取代 取代): 取代 在芳环上已有取代基的位置上, 在芳环上已有取代基的位置上,发生取代 作用- 效应: 作用-Ipso效应: 效应
HNO3
H2SO4
+
NO2
H3O
NO2 H
2H 2SO4 HNO3
NO2+
2HSO4
-
NO2+
2.
Br Br FeBr3
Br H + Br
+
FeBr3
Br H
Br + H
实验已经证实芳正离子的存在: 实验已经证实芳正离子的存在:
CH3 C2H5F/BF3 H3C CH3
-80℃
H C2H5 CH3 H3C BF4CH3
二. 芳环上亲核取代反应
p π 共扼 Cl
当芳环上连 NO2 CN COCH3 CF3 时,也可发 生亲核取代反应
1. 加成-消除机理 加成-
X Nu慢
X
Nu
Nu X-
X=卤素 NO2 OR 等 Nu-=OH- NH2- RNH- RO-
Cl OH350℃ , 450 MPa
Cl O2N NO2 OH25 ℃ NO2 O 2N
2)加合性规则 ) 二取代物的分速因数可以由一取代物的 分速因数求得,称为加合性规则。 分速因数求得,称为加合性规则。
X a b c a b p q r Y p q aq br cq X Y bp
一取代分速因数
二取代分速因数
例:
CH3
50 1.3 60 1.3*1.3=1.69 50*60=3000
氯苯的三个分速度因数均小于1,卤素是 氯苯的三个分速度因数均小于 , 致钝基团, 致钝基团,且 fm << fp, E+进入间位的可能性 很小。 很小。 苯甲醚: 苯甲醚: fp ≈ fo >> fm
