水的溶解度计算
溶解度计算公式

溶解度计算公式
1.定义:溶解度,符号S,在一定温度下,某固态物质在100g溶剂
中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
物质的溶解度属于物理性质。
1.1溶解度的单位是克(或者是克/100克溶剂)而不是没有单位。
1.2在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
举例:在20°C的时候,100克水里溶解0.165克氢氧化钙,溶液就饱和了,氢氧化钙在20°C的溶解度就是0.165克,也可以写成
0.165克/100克水。
又如,在20°C的时候,100克水里要溶解36
克食盐或者溶解203.9克蔗糖才能饱和,食盐和蔗糖在20°C的溶解度就分别是36克和203.9克,也可以写成36克/100克水和203.9克/100克水。
1.3扩展:气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积溶剂里的体积数。
也常用“g/100g溶剂”作单位(自然也可用体积)。
2.计算公式:
溶质质量分数=溶质质量/溶液质量×100%
溶解度=溶质质量/溶剂质量×100g (必须选取饱和溶液)
溶液质量=溶质质量(克)+溶剂质量(克)
对于饱和溶液,溶液质量分数w = S/(S+100)
所以溶解度S = 100/(1/w - 1)。
有关溶解度计算题讲解

初三有关溶解度计算专题溶解度计算公式:溶质质量/溶剂质量=溶解度(S) /100g (理解记忆)溶解度(S)=溶质质量/溶剂质量* 100g推论:溶质质量1 /溶剂质量仁溶质质量2 /溶剂质量2溶质质量1 /溶液质量仁溶质质量2 /溶液质量2溶剂质量1 /溶液质量仁溶剂质量2/溶液质量2【典型例题精讲】1、20C时,把50克的硝酸钾饱和溶液蒸干,得到12克硝酸钾。
求20C时硝酸钾的溶解度。
(31.6 g)2、20 C时,把53.6克氯化钾饱和溶液蒸干,得到13.6克氯化钾。
求20 C时氯化钾的溶解度(34g)3、20 C时,把4克氯化钠固体放入11克水中,恰好形成饱和溶液。
求20C时氯化钠的溶解度(36.4g)探4、把100克20 C时硝酸钾的饱和溶液蒸干,得到24克硝酸钾。
则:(1)若配制350克20C的硝酸钾的饱和溶液,需硝酸钾和水各多少克(84g , 266g)(2)若将78克硝酸钾配成20C时的饱和溶液,需水多少克(247g)探5、已知氯化铵在30C时的溶解度为45.8克。
30C时将68.7克氯化铵配制成400克的溶液,通过计算:(1)溶液是否饱和(不饱和溶液)(2 )若不饱和,为了使其饱和,可用下面的方法:①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液()②加溶质法:需再加入多少克氯化铵,溶液才能成为饱和溶液()6、tC时,NaNQ的溶解度是25g,现向盛有200g 10%NaNO s溶液的烧杯中,加入30g NaN03固体,则此时烧杯中(D )A.溶液质量是230gB.溶质质量是50gC.溶剂质量是170gD.溶质质量是45g解析:此时NaNQ 饱和溶液中m (NaN03)=45g, m (H2O) = 180g, m (溶液)=225g又有7gA 析出,则在20 C 时A 物质的溶解度是(35g )探9、tC,将一定量A (不含结晶水)的不饱和溶液分成 三等份,分别加热蒸发水,然后冷却至 tC,已知三份溶液分别蒸发水 10g 、20g 、30g ,析出A 依次为ag 、bg 、eg,则a 、b 、c 三者之间的关系是 (B )A. e=a+bB. e=2b — aC. e=2a+bD. e=2a — b解析:由于原溶液为不饱和溶液,因此在确定三者关系时应作如下理解:tC 时不饱和溶液 1饱和溶液2饱和溶液3,由以上过程可知:e= a+2 (b — a ) =2b — a 。
一理解,二分析,三计算-------三步解决溶解度基本计算

一理解,二分析,三计算 -------三步解决溶解度基本计算摘要:溶解度是中考化学必考的内容,是学生必须要掌握的知识点。
因此,教师在教学过程中要注意学生对溶液度概念以及计算等相关内容的理解与掌握。
大部分学生认为溶解度的计算较难,究其原因是学生对溶解度的概念理解不够;无法对不同形式的实验操作下溶液变化进行分析理解其变化的本质;在计算时直接套用公式,并没有真正的理解溶解度计算公式的含义。
本文以几道溶解度计算的习题为例,剖析题目的本质,帮助学生更好的理解溶解度概念、会对溶液进行分析并掌握溶解度的基本计算方法。
关键词:溶解度初中化学饱和溶液一、理解溶解度的概念溶解度是一个定量分析的概念,较为抽象,且涉及多个变量,使得混淆概念的情况时有发生,需要加强对概念的理解。
溶解度的含义涉及变量有:温度、溶剂类型、以及溶质类型等。
溶液最多可以溶解的状态也可以理解为溶质不能再继续溶解,此时所得到的溶液就是该溶质的饱和溶液。
溶液是否饱和的标志是:在这特定的温度下,溶液中有不再继续溶解的溶质固体,且溶质固体的质量不发生变化。
在此温度下,某溶质的不同溶度的溶液中,饱和溶液必然是溶质质量分数最大的状态。
二、溶液分析在进行溶解度的相关计算时,在掌握溶解度的概念的基础上,学生要分析不同实验操作(恒温蒸发溶剂、加溶质或溶剂)后溶液的状况(是否为饱和溶液)、溶剂和溶质变化等情况、理解溶液发生变化的本质,然后才能进行溶解度计算。
其中,不饱和溶液与饱和溶液之间的相互转化是解题核心,解题实质上就是分析不同变量之下溶液的变化。
三、计算方法针对溶解度的计算,教师在教学过程中应强调两个概念:一是由于溶液的均一性,从溶液中取任意质量的溶液时,溶质与溶剂的质量比是固定的。
而溶解度则是要求在饱和溶液中,并固定了溶剂的质量为100 g,此时溶质的质量即为溶解度,所以当温度一定时,饱和溶液中就应存在这样的关系式:。
第二个要强调的概念是当溶液中有溶质析出后,此时的溶液处于饱和状态。
相关计算浓度、密度、溶解度的计算

相关计算浓度、密度、溶解度的计算溶解度、质量分数、物质的量浓度的计算和换算⼀、知识概要(⼀)有关溶解度的计算在⼀定温度下的饱和溶液中,溶质、溶剂、溶液间有⼀定量的关系。
由此可进⾏以下计算:(1)根据饱和溶液溶质、溶剂的量推算溶解度;(2)根据溶解度求算饱和溶液所含的溶剂和溶质量;(3)根据溶解度求算饱和溶液在蒸发掉⼀定量溶剂后析出的结晶量;(4)由于物质在不同温度下溶解度不同,可以根据不同温度下的溶解度求算出⼀定量饱和溶液由于温度改变(或同时有溶剂量改变),析出结晶的量。
(5)饱和溶液中溶解度与溶质的质量分数的换算。
⼀定温度下,某饱和溶液溶质的溶解度:解题时要熟练运⽤下列⽐列关系:饱和溶液中(⼆)有关质量分数、物质的量浓度的计算有关质量分数的计算⽐较简单,但注意两点:⼀是含结晶⽔化合物的浓度均按⽆⽔物含量计算;⼆是有些溶质溶解后与⽔发⽣了反应,其不能直接按原物质的量表⽰,如SO3、Na2O2溶于⽔,溶液浓度按H2SO4、NaOH含量计算。
与物质的量浓度有关的计算有:(1)配制⼀定物质的量浓度所需溶质、溶剂量或浓溶液稀释⽤量的计算;(2)根据所溶溶质的量求算物质的量浓度、离⼦物质的量浓度;(3)物质的量浓度与质量分数的换算。
四.有关物质的量浓度的计算1.根据公式及公式变形可计算物质的量浓度、体积和溶质物质的量。
2.溶质的质量分数与物质的量浓度换算依溶质的质量分数(a%)和密度()可计算物质的量浓度。
计算⽅法:取1升溶液进⾏计算,即:3.溶液的稀释(配制)因在稀释过程中溶质的量不变,所以可设未知数列等式,解出所求。
4.溶液混合后的浓度1) 同浓度溶液的混合,浓度不变。
2)不同浓度溶液混合,浓度改变。
应求出混合液中溶质物质的量和混合液的体积。
n(混)=n1+n2+……(即各溶液中溶质物质的量之和)(即混合液的总质量除混合液的密度,再把单位转化为升)因溶液混合时,体积会发⽣改变,故不能简单地将⼆种溶液的体积加和,必须⽤上述的⽅法来求。
初中化学中溶解度的计算解读

初中化学中溶解度的计算一定温度下,一定量的溶剂中所溶解物质的质量是一定的,反之,任意量的饱和溶液里溶质质量与溶剂质量或溶质质量与溶液的质量比是一定的,如果把一定温度下溶剂的量规定为100g,此时所溶解溶质形成饱和溶液时的质量称为溶解度。
由此可得以下关系:溶解度————100g溶剂————100+溶解度(溶质质量 (溶剂质量 (饱和溶液质量可得出以下正比例关系:式中W溶质、W溶剂、W饱和溶液分别表示饱和溶液中溶质、溶剂和溶液的质量,S表示某温度时该溶质的溶解度。
在以上的比例式中,100是常量,其它3个量中只要知道其中2个量就可求出另外一个量。
由此,不仅明确了溶解度的解题的基本思路就是比例关系,从而避免质量混淆的现象,而且也使学生明确溶解度计算的一题多种解法,并从中找出最佳解法。
一、已知一定温度下某物质饱和溶液里的溶质和溶剂的质量,求溶解度例1 在一定温度下,ng某物质恰好溶于一定量的水中形成mg饱和溶液,求该物质在此温度下的溶解度。
解;由题意可知,W溶液=W溶质+W溶剂,因此mg该物质的饱和溶液中含水的质量为:(m-ng,此题可代入分式(1:设某温度下该物质的溶解度为Sg也可代入分式(2二、已知一定温度下某物质的溶解度,求此温度下一定量的饱和溶液中含溶质和溶剂的质量例2 已知在20℃时KNO3的溶解度为31.6g。
现要在20℃时配制20gKNO3饱和溶液,需KNO3和H2O各几克?解:设配制20℃20g硝酸钾饱和溶液需硝酸钾的质量为xg。
此题若代入公式(1,列式为:若代入公式(2,列式为:需水的质量为20-4.8=15.2g答:配制20℃时20gKNO3的饱和溶液需KNO34.8g和水15.2g。
三、已知一定温度下某物质的溶解度,求一定量溶质配制成饱和溶液时,所需溶剂的质量例3 已知氯化钠在20℃的溶解度是36g,在20℃时要把40g氯化钠配制成饱和溶液,需要水多少克?解:从题意可知,在20℃时36g氯化钠溶于l00g水中恰好配制成氯化钠的饱和溶液。
新初二科学衔接讲义之十:10溶解度的计算

学生: 科目: 科学 第 二 阶段第 次课(13、根据上述关系式,可以进行有关溶解度的计算。
但计算时还应注意格式的规范化。
【例题1】已知一定温度下,饱和溶液中溶质的质量和溶剂的质量。
求该温度下的溶解度。
例如:把50克20℃时的硝酸钾饱和溶液蒸干,得到12克硝酸钾。
求20℃时硝酸钾的溶解度。
解析:溶液的质量为溶质质量和溶剂质量之和,因此50克硝酸钾饱和溶液中含水的质量是:50克-12克=38克设:20℃时100克水里溶解硝酸钾达到饱和状态时所溶解的质量为x掉10克水,又析出2克晶体,则t℃硝酸钾的溶解度为__________ At1t2t3NtSP80BC课后巩固:【课后练习】1、 20℃时,甲物质的溶解度是30克,50℃时乙物质的溶解度为86克,则30℃时,两者的溶解度关系正确的是( )A.S甲>S乙 B.S甲<S乙 C.S甲=S乙 D.不能确定2、在一定温度下的氯化钠不饱和溶液,加入一定的硝酸钾晶体溶解后,所得到的溶液是( )A、氯化钠可能是饱和溶液B、仍是不饱和溶液选项质量A B C D 加入食盐质量/g 10203040所得溶液质量/g110120130136C、氯化钠溶液的质量不变D、氯化钠溶液变浓3.如图所示是a、b、c的不饱和溶液,分别通过增加溶质,蒸发溶剂或升高温度三种方法,均可变成饱和溶液的是( )。
A. a溶液B. b溶液C. c溶液D. a溶液和c溶液4.可以证明烧杯内有硝酸钾溶液是饱和溶液的方法是( )。
A. 蒸发掉1g水,有少量固体析出B.降低温度,有少量固体析出C.加入少量硝酸钾固体,固体不再溶解D.加入少量水,没有固体析出5. 时,将不同质量的食盐固体分别放入100g水中,充分溶解后过滤,所得溶液质量与加入食盐质量的对应关系如下,其中所得溶液属于饱和溶液的是( )。
6.20℃时硝酸钾的溶解度为31.6克,20℃的饱和硝酸钾溶液65.8克,含有水( )A.15.8克 B.31.6克 C.47.4克 D.50克7.有时浓度相同的两份溶液A和B,A为100g,B为80g,将其恒温蒸发20g水后,A刚好饱和,对所得B溶液正确的说法是( )。
溶解度的计算
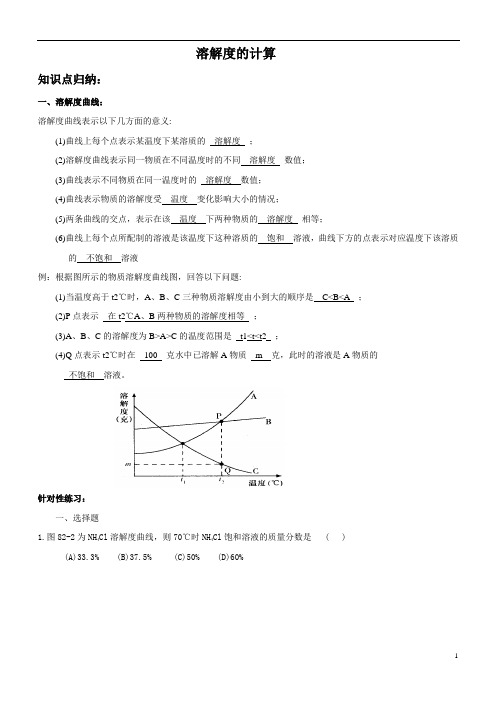
溶解度的计算知识点归纳:一、溶解度曲线:溶解度曲线表示以下几方面的意义:(1)曲线上每个点表示某温度下某溶质的溶解度;(2)溶解度曲线表示同一物质在不同温度时的不同溶解度数值;(3)曲线表示不同物质在同一温度时的溶解度数值;(4)曲线表示物质的溶解度受温度变化影响大小的情况;(5)两条曲线的交点,表示在该温度下两种物质的溶解度相等;(6)曲线上每个点所配制的溶液是该温度下这种溶质的饱和溶液,曲线下方的点表示对应温度下该溶质的不饱和溶液例:根据图所示的物质溶解度曲线图,回答以下问题:(1)当温度高于t2℃时,A、B、C三种物质溶解度由小到大的顺序是C<B<A ;(2)P点表示在t2℃A、B两种物质的溶解度相等;(3)A、B、C的溶解度为B>A>C的温度范围是t1<t<t2 ;(4)Q点表示t2℃时在100 克水中已溶解A物质m 克,此时的溶液是A物质的不饱和溶液。
针对性练习:一、选择题1.图82-2为NH4Cl溶解度曲线,则70℃时NH4Cl饱和溶液的质量分数是 ( )(A)33.3% (B)37.5% (C)50% (D)60%2.某固体物质的溶解度曲线如图82-3所示,在40℃时将75克物质放入150克水中,则溶液的质量分数是( )(A)28.6% (B)33.3% (C)40.0% (D)50.0%3.如图82-4所示,配制33.33%的NH4Cl饱和溶液的最低温度是( )(A)0℃(B)30℃(C)50℃(D)70℃4.如图82-5所示,m克KNO3的不饱和溶液,恒温蒸发水份,直到有少量晶体析出,则在此变化过程中,纵坐标溶液的质量分数(a%)与横坐标时间(t)的变化关系是 ( )5.图82-6为X和Y两种物质的溶解度曲线。
X、Y的混合溶液在100℃时都达到饱和,高温时降低到70℃时,得到的固体成分是 ( )(A)纯净的X(B)纯净的Y(C)等量的X和Y(D)大量的X和少量的Y二、填空题1.如图82-7所示:(1)在时,A和B的溶解度相等。
水的溶解度与溶解过程的计算

在环境科学中的应用
溶解过程对水体中污染物迁移的影响 溶解过程在水处理中的应用 溶解过程在土壤污染修复中的作用 溶解过程在气候变化研究中的意义
THANKS
汇报人:XX
热力学溶解平衡 常数:在一定温 度下,物质在一 定溶剂中的溶解 度与压力之间的 关系,表示物质 在溶解过程中的 平衡状态
溶解过程的热力 学计算公式:根 据热力学基本定 律推导出的溶解 过程的计算公式, 可以用于计算溶 解热、溶解熵等 热力学参数
Part Three
溶解过程的应用
在化学工业中的应用
溶解过程用于制备溶液和溶剂,如稀硫酸、稀盐酸等。 溶解过程在化学反应中起到重要作用,如酸碱中和反应、盐的水解等。 溶解过程用于分离和提纯物质,如蒸发结晶、重结晶等。 溶解过程用于制备新材料,如纳米材料、高分子材料等。
在食品工业中的应用
溶解过程用于 提取食品中的 有效成分,如 咖啡因、茶多
酚等。
溶解过程用于 食品添加剂的 制备,如甜味 剂、防腐剂等。
影响因素:温度、溶质和溶剂的种类
溶解度的影响因素
温度:温度越高,溶解度 越大
压力:压力越大,溶解度 越大
溶质性质:不同溶质的溶 解度不同
溶剂性质:不同溶剂的溶 解度不同
溶解度的测定方法
实验法:通过实验测定溶解度 计算法:根据溶解度公式进行计算 图表法:通过溶解度曲线图进行比较 经验法:根据经验公式或图表进行估算
水的溶解度与溶解过程 的计算
XX,a click to unlimited possibilities
汇报人:XX
目录
01 水 的 溶 解 度
02 溶 解 过 程 的 计 算
03 溶 解 过 程 的 应 用
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水的溶解度计算
水的溶解度是指单位质量溶剂在一定温度下能够溶解的溶质的最大量。
溶解度与温度、压力、溶剂性质等因素有关,是一个重要的物理
化学性质。
正确计算水的溶解度对于许多领域的研究和应用有着重要
的意义。
首先,我们来看一下溶解度与温度的关系。
一般来说,固体溶解于
液体时,随着温度的升高,其溶解度也会增加。
这是因为在较高的温
度下,分子之间的热运动加剧,导致固体晶格的结构变得相对不稳定,有利于溶解。
但是在某些情况下,溶解度随温度的变化可能会出现反
转现象,这是因为溶解过程涉及到溶质和溶剂之间的相互作用,当溶
质-溶剂间的结合能较大时,溶解度会呈现出反转现象。
在计算水的溶解度时,可以利用一些基本的物理化学公式和数值方法。
对于不同的溶质,要根据其化学性质和物理性质选择合适的计算
方法。
以下以常见的无机盐类为例,来介绍一下水的溶解度的计算方法。
首先,我们需要了解溶解度的定义和单位。
溶解度通常用摩尔溶解度、质量溶解度和体积溶解度来表示。
摩尔溶解度是指单位溶剂中溶
质的摩尔量;质量溶解度是指单位溶剂中溶质的质量;体积溶解度是
指单位溶剂中溶质的体积。
摩尔溶解度常用mol/L表示,质量溶解度
常用g/100g表示,体积溶解度常用cm³/100g表示。
接下来,我们以氯化钠为例,来计算其在不同温度下的质量溶解度。
首先,我们需要收集实验数据,包括氯化钠在不同温度下的溶解度实
验数据。
然后,根据这些数据绘制出溶解度与温度的关系曲线。
通过对曲线的分析,可以得出溶解度与温度的定量关系。
一般来说,可以使用一些拟合函数,如多项式函数、指数函数等,来拟合实验数据,得到溶解度与温度的数学表达式。
在计算时,可以通过输入合适的温度值,利用拟合函数,计算出相应的溶解度。
此外,在计算水的溶解度时,还需要考虑压力的影响。
随着压力的升高,气相的溶解度也会增加。
这是因为在较高的压力下,气体的分子更容易被液体中的分子吸引和包围。
所以,在计算水的溶解度时,也要注意考虑压力因素,并采取相应的计算方法。
综上所述,水的溶解度计算涉及到温度、压力、溶质和溶剂的性质等多个因素。
通过收集实验数据,绘制溶解度与温度、压力的关系曲线,进行拟合和数学表达式的推导,可以准确计算水的溶解度。
在不同的研究和应用领域中,正确计算水的溶解度对于深入理解和探索溶解过程的机理、提高工艺效率等方面有着重要的意义。
