溶液、溶解度知识点
溶液知识点总结归纳

溶液知识点总结归纳一、溶液的定义和特点1. 溶液的定义:溶液是由溶质溶解在溶剂中形成的混合物。
其中,溶质是被溶解的物质,而溶剂是用来溶解溶质的物质。
2. 溶液的特点:(1)溶质分子之间的作用力并未完全破坏,在溶液中仍然存在;(2)溶质和溶剂分子之间形成了新的相互作用力;(3)溶质和溶剂之间达到了平衡状态;(4)溶质和溶剂之间的物理性质并未改变,而化学性质可能会发生变化。
二、溶解度和溶解过程1. 溶解度的概念:溶解度是指在一定温度和压力下溶液中溶质的最大溶解量。
通常用溶质的摩尔浓度或质量浓度来表示。
2. 影响溶解度的因素:(1)温度:一般来说,溶解度随着温度的升高而增加。
但对于不同物质来说,情况可能不同。
(2)压力:对于气体溶解在液体中的情况来说,压力会影响溶解度。
根据亨利定律,溶解度与气体分压成正比。
3. 溶解过程:溶解过程可以分为溶质分子离开晶体表面、在溶剂中扩散和溶质分子与溶剂分子相互作用等阶段。
溶质溶解的过程是一个动态平衡的过程,即溶解和析出同时进行。
三、溶液的分类1. 按溶解度来分类:(1)可逆溶液:在一定条件下,溶质可以完全溶解在溶剂中,而且在溶液中具有一定的离子活度。
例如盐类溶解在水中的情况。
(2)不可逆溶液:在一定条件下,溶质不能完全溶解在溶剂中。
例如饱和溶液。
2. 按溶剂的种类来分类:(1)气体溶液:气体可以溶解在液体中形成气液溶液,也可以溶解在固体中形成气固溶液。
(2)固体溶液:固体溶质可以溶解在液体或者另一个固体中形成固液溶液或者固固溶液。
(3)液体溶液:液体可以与其他液体形成混合物。
四、溶液的浓度和表示方法1. 溶液的浓度:溶质在溶液中的存在形式一般有摩尔浓度、质量浓度、体积分数、体积百分比等。
因此,浓度是评价溶液稀浓程度的重要参数。
2. 摩尔浓度的计算公式:c = n/V,其中c代表摩尔浓度,n代表溶质的物质量,V代表溶液的体积。
3. 质量浓度的计算公式:C = m/MV,其中C代表质量浓度,m代表溶质的质量,M代表溶质的摩尔质量,V代表溶液的体积。
八年级上册科学知识点溶液

八年级上册科学知识点溶液八年级上册科学知识点——溶液一、什么是溶液溶液是指固体、液体、气体中的某些物质与另一种物质混合后所形成的混合物。
其中,原来的物质称为溶质,将其溶解的物质称为溶剂。
二、溶解度溶解度是指在一定温度下,一个固体在溶剂中溶解所达到的最大量。
一般来说,溶解度与温度呈正相关关系,即随着温度的升高,溶解度会增大。
三、质量分数质量分数是指在一个溶液中,溶质质量所占的比例。
计算公式为:溶质质量÷溶液总质量×100%。
如果溶质和溶剂的质量同时变化,质量分数就不会改变。
四、浓度浓度是指溶液中溶质的质量分数、体积分数、摩尔浓度等表示方法。
如果要将溶液中的浓度提高,可以增加溶质的质量或者减少溶剂的体积。
五、饱和溶液饱和溶液是指在一定温度下,溶液中溶质的浓度达到了溶解度的最大值,此时再向其中加入溶质,无法再被溶解并会沉淀出来。
六、压力和溶解度对于气体,其溶解在液体中的能力与气体压强呈正比关系。
即当气体压强升高时,在相同温度下,气体元素会更容易地被液体吸收。
七、影响溶解度的因素除了温度和压力外,还有其他因素也会影响溶解度。
例如,若将溶液的外部压力改变,也会引起其溶解度的变化。
此外,溶液中溶剂和溶质的物理状态也会对其溶解度产生影响。
比如说,通常情况下,固体在液体中比在气体中更容易被溶解。
八、特殊溶液酸碱溶液:指具有酸性或碱性的溶液。
饱和溶液:指达到溶解度上限的溶液。
过饱和溶液:指在某些溶液中,溶质已经超过了其正常的溶解度,但仍然没有达到饱和状态的溶液。
九、小结在化学中,涉及到溶液的知识点非常重要,这不仅关系到日常生活中的饮食、化妆品等问题,还涉及到工业生产和环境保护等方面的重要问题。
因此,对于八年级的同学来说,掌握这些溶液相关知识,将会对他们今后的学习和工作产生积极的影响。
化学中的溶液与溶解度(化学知识点)

化学中的溶液与溶解度(化学知识点)溶液是化学中常见的一种物质状态,它由溶质和溶剂组成。
在化学反应和研究中,溶液的溶解度是一个重要的概念。
本文将介绍溶液和溶解度的相关知识点。
一、溶液的定义和分类溶液是由两种或多种物质混合而成的均匀体系,其中溶解物质称为溶质,溶解介质称为溶剂。
溶液可以分为固体溶液、液体溶液和气体溶液等多种类型。
溶液的形成是由于溶质的分子或离子与溶剂中的分子之间发生了相互作用。
二、溶解度的概念与影响因素溶解度是指在一定温度下,单位体积溶剂中所能溶解的最大溶质量。
溶解度可以用质量分数、摩尔分数和摩尔浓度等方式来表示。
影响溶解度的因素包括温度、压力、溶质和溶剂的性质。
1. 温度对溶解度的影响一般来说,溶解度随温度升高而增加。
这是因为温度升高会使溶质和溶剂的分子运动加快,从而增强它们之间的相互作用力,有利于溶解过程的进行。
但有些物质的溶解度在升温过程中会出现异常变化,例如碳酸钠在25℃时溶解度最大,超过该温度后溶解度反而下降。
2. 压力对溶解度的影响对于固体和液体溶质来说,压力对溶解度的影响通常可以忽略不计。
而对于气体溶质来说,溶解度随压力的增加而增加。
根据亨利定律,气体溶质在液体中的溶解度与气体的分压成正比。
3. 溶质和溶剂的性质对溶解度的影响溶质和溶剂之间的相互作用力对溶解度起着决定性的作用。
相互作用力较强的溶质和溶剂能够更好地相互吸引,从而有利于溶解。
例如极性溶质在极性溶剂中的溶解度往往较高,而非极性溶质则偏好溶解于非极性溶剂中。
三、饱和溶液和过饱和溶液当溶剂已经溶解了尽可能多的溶质时,称为饱和溶液。
饱和溶液的溶解度是恒定的,并且在一定温度下与溶质的种类无关。
相反,如果溶液中含有超过饱和度的溶质,称为过饱和溶液。
过饱和溶液的形成常常需要某种条件,例如快速冷却或加入适量的其他物质。
四、溶解度曲线和溶解度积溶解度曲线是指在一定温度范围内,溶质在单位体积溶剂中的溶解度随溶质浓度变化的曲线。
人教版初三上册化学溶液的基本概念、溶解度、溶质的质量分数

溶液的基本概念溶解度【知识梳理】1.溶液(1)概念:一种或几种物质到另一种物质里,形成的的混合物。
(2)组成:溶质:的物质,可以是体,也可以是体或体。
溶剂:的物质,水是常见的溶剂,酒精,汽油也可以做溶剂。
一般来说,如果溶液组成中有水存在,则把水当作溶剂,如果是固体和液体形成溶液,则固体为溶质,液体为溶剂,如果两种液体形成溶液,则量多的为溶剂,量少的为溶质.(3)特征:均一性、稳定性、混合物均一性:溶液中各部分的都相同。
如:稳定性:外界条件(,,气体压强)不变时,溶液不会2、乳浊液由小液滴分散到液体里形成的混合物是乳浊液.由于小液滴是许多分子的集合体,无论在质量还是体积上都比单个分子大的多.所以无法均一地分散到水分子中,因而不稳定,静置一段时间后会分层.乳浊液的应用也十分广泛,日常生活中常遇到的牛奶、油漆、橡胶的乳胶等都是乳浊液.但是这些乳浊液往往都有一个共同的缺点——难以清洗,一旦沾到衣物上,很难被水清洗掉,怎么办泥?其实这个问题也好解决,加点儿乳化剂就可以,常用的乳化剂有肥皂、洗涤剂等,乳化剂能使小液滴分散成无数细小的液滴,而不聚集成油珠.这些细小的液滴比单个分子略大,能随水流走,衣服、餐具上的油污可以用加入洗涤剂的水洗掉,就是这个道理。
3、溶解时的吸热或放热现象:物质NaCl、NH4NO3、NaOH三种物质:溶解后放出热量,使温度升高的是;吸收热量,使温度降低的是;温度没有明显变化的是。
4、饱和溶液和不饱和溶液1)饱和溶液在一定下,向一定量的里加入某种溶质,当溶质时,所得到的溶液叫做这种溶质的饱和溶液。
如:2)不饱和溶液在一定下,向的溶剂里加入某种溶质,当溶质时,所得到的溶液叫做这种溶质的不饱和溶液。
如:3)判断溶液是否饱和:①、溶液中没有固体时,加入,若说明溶液是饱和的;②、溶液中有固体时,看固体质量是否减少,若说明溶液是饱和的;4)③、当溶液中有晶体析出时,析出晶体后的溶液是溶液。
5)饱和溶液与不饱和溶液的转化:饱和溶液不饱和溶液6)浓溶液与稀溶液a)浓溶液是在一定的溶液中含溶质的溶液。
溶解度知识点

溶解度知识点溶解度是描述物质在溶液中的溶解性质的重要参数,它是指在一定温度下,单位体积溶剂中最多可以溶解的物质的量,通常用克/升(g/L)表示。
溶解度不仅与物质本身的性质有关,还与溶剂的性质和温度有关。
1. 影响溶解度的因素1.1 物质的性质物质的极性是影响溶解度的重要因素之一。
极性分子之间的相互作用力较强,容易溶解,而非极性分子的溶解度较低。
此外,分子间的键合方式、晶格结构等也会影响溶解度。
1.2 溶剂的性质溶剂的极性与溶解度密切相关。
通常,极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。
另外,溶剂的溶解度也与溶剂的饱和蒸汽压、溶剂分子大小等因素有关。
1.3 温度温度对溶解度的影响因物质而异,一般来说,大多数固体在溶解时需吸收热量,因此随着温度的升高,溶解度会增加。
而对于气体溶解于液体中,溶解度随温度升高而降低。
2. 溶解度的表示方法2.1 饱和溶解度饱和溶解度是指在特定温度下,溶液与未溶解物质之间的平衡状态达到一定的浓度。
当溶液中加入更多的溶质时,将无法再溶解,此时称为饱和溶液。
2.2 饱和溶解度曲线饱和溶解度曲线是描述溶质在不同温度下溶解度随溶质质量分数的变化关系的曲线。
通常是在坐标轴上绘制溶质质量分数和温度,通过实验测定得出。
3. 应用3.1 药学药物的溶解度是评价其溶解性的重要指标之一。
药物的溶解度决定了它在体内的吸收速度和效果。
通过研究药物的溶解度,可以优化药物的给药方式和剂型。
3.2 化学工程在化学反应和工业生产过程中,溶解度对原料溶解、反应速度、反应平衡等有重要影响。
通过研究溶解度,可以指导工程师合理设计设备和控制条件,提高生产效率。
3.3 环境科学溶解度对环境中的污染物迁移和转化过程具有重要影响。
了解溶解度可以帮助科学家预测污染物在水体、土壤中的分布和迁移规律,为环境保护和污染治理提供理论依据。
总结:溶解度是描述物质在溶液中溶解性质的重要参数,受到物质本身、溶剂和温度等因素的影响。
溶解度知识点

溶解度知识点溶解度是指在一定温度和压力下,溶质能够在溶剂中溶解的最大量。
它是描述物质在溶液中溶解性质的重要物理化学参数之一。
溶解度的测定方法主要有两种:重量法和容积法。
重量法是通过测定已知质量的溶剂中能溶解的溶质最大质量,从而计算溶解度的。
容积法是通过测定已知体积的溶剂中能溶解的溶质最大体积,从而计算溶解度的。
溶解度与溶质、溶剂、温度和压力等因素有关。
一般而言,溶解度随着溶质和溶剂之间的相互作用力增强而增大,随着温度的升高而增大。
但是有一些溶质在一定范围内的溶解度却随温度的升高而减小,这是由于在温度升高的过程中,致使溶质在溶液中的活动度增大,从而导致部分溶质分子离开溶液,溶解度减小。
另外,一些气体在溶解度随着压力的增加而增大,这是由于增加压力会增加气体分子与溶剂分子之间的接触机会,促使气体溶解于溶剂中。
溶解度也可以用饱和溶解度来描述。
饱和溶解度是指在特定温度和压力下,溶质在溶剂中达到饱和状态所能溶解的最大量。
当溶液含有的溶质量超过饱和溶解度时,就会发生过饱和现象,溶质会析出形成晶体。
溶解度对于很多实际应用具有重要意义。
例如,在制药工业中,了解药物的溶解度可以帮助调控其药效和给药方式;在环境科学研究中,了解物质的溶解度可以帮助评估和预测其在环境中的行为和迁移规律;在冶金工业中,了解金属的溶解度可以帮助设计和改进金属合金的制备工艺。
进一步研究溶解度的影响因素也是科学研究的热点之一。
科学家们通过实验和理论模拟,不断揭示各种溶质和溶剂之间的相互作用机制,预测和解释溶解度的变化规律。
这些研究成果不仅对理解溶解现象的基本规律具有重要意义,也为工业生产和环境保护等领域提供了科学依据。
总而言之,溶解度是描述物质在溶液中溶解性质的重要参数,它与溶质、溶剂、温度和压力等因素密切相关。
研究溶解度的影响因素和变化规律对于实际应用和科学研究都具有重要意义。
相信随着科学技术的不断发展,我们对于溶解度的认识会越来越深入。
初三化学溶液(一)溶液、溶解度
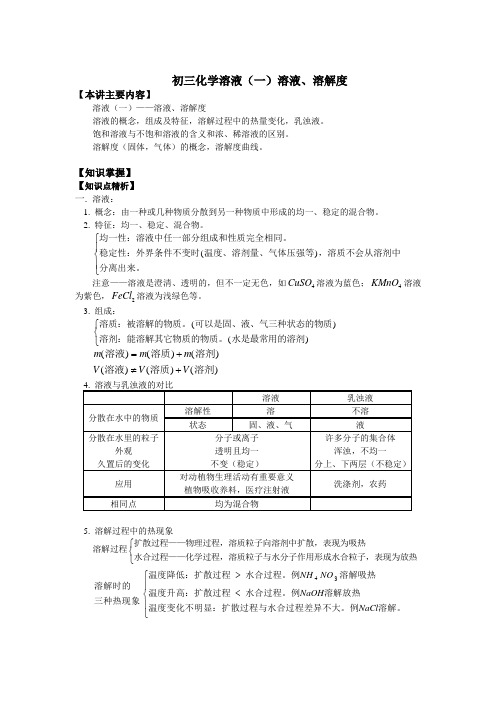
初三化学溶液(一)溶液、溶解度【本讲主要内容】溶液(一)——溶液、溶解度溶液的概念,组成及特征,溶解过程中的热量变化,乳浊液。
饱和溶液与不饱和溶液的含义和浓、稀溶液的区别。
溶解度(固体,气体)的概念,溶解度曲线。
【知识掌握】 【知识点精析】 一. 溶液:1. 概念:由一种或几种物质分散到另一种物质中形成的均一、稳定的混合物。
2. 特征:均一、稳定、混合物。
均一性:溶液中任一部分组成和性质完全相同。
稳定性:外界条件不变时温度、溶剂量、气体压强等,溶质不会从溶剂中分离出来。
()⎧⎨⎪⎩⎪注意——溶液是澄清、透明的,但不一定无色,如CuSO 4溶液为蓝色;KMnO 4溶液为紫色,FeCl 2溶液为浅绿色等。
3. 组成: 溶质:被溶解的物质。
可以是固、液、气三种状态的物质溶剂:能溶解其它物质的物质。
水是最常用的溶剂()()⎧⎨⎩m m m V V V ()()()()()()溶液溶质溶剂溶液溶质溶剂=+≠+5. 溶解过程中的热现象溶解过程扩散过程——物理过程,溶质粒子向溶剂中扩散,表现为吸热水合过程——化学过程,溶质粒子与水分子作用形成水合粒子,表现为放热⎧⎨⎩溶解时的三种热现象温度降低:扩散过程水合过程。
例溶解吸热温度升高:扩散过程水合过程。
例溶解放热温度变化不明显:扩散过程与水合过程差异不大。
例溶解。
><⎧⎨⎪⎩⎪NH NO NaOH NaCl 43二. 溶液的分类:(一)饱和溶液与不饱和溶液。
1. 概念:在一定温度下,向一定量的溶剂里加入某种溶质,不能继续溶解,则该溶液称为此温度下,该溶质的饱和溶液,若还能继续溶解,则称为该温度下,这种溶质的不饱和溶液。
(辨析)一定温度,一定量溶剂——概念前提某种溶质——概念描述对象⎧⎨⎩2. 相互转化: 增加溶剂或升高温度 饱和溶液不饱和溶液增加溶质或降低温度(此转化条件对于大多数固体物质适用,因为大多数固体物质在一定量水中溶解的最大量随温度升高而增大)。
九年级下化学溶液知识点

九年级下化学溶液知识点
九年级下化学溶液的知识点包括:
1. 溶液的定义:溶液是由溶质和溶剂组成的均匀混合物。
2. 溶解度:溶解度是指在一定温度下,单位体积溶剂中能溶解的溶质的最大量。
3. 饱和溶液:溶解度达到最大值的溶液称为饱和溶液。
4. 浓度:溶液中溶质的质量或体积与溶液总质量或总体积的比。
5. 质量分数:溶液中溶质质量与溶液总质量的比。
6. 体积分数:溶液中溶质体积与溶液总体积的比。
7. 摩尔浓度:溶液中溶质物质的摩尔数与溶液的体积之比。
8. 离子浓度:溶液中离子的浓度。
9. 溶解过程:溶质分子或离子与溶剂分子之间的相互作用过程。
10. 溶剂的种类:常见的溶剂有水、酒精、醚等。
11. 溶解度与温度的关系:一般来说,固体在液体中的溶解度随温度升高而增大,气体在液体中的溶解度随温度升高而减小。
12. 溶解度与压力的关系:固体在液体中的溶解度一般与压力无关,而气体在液体中的溶解度随压力升高而增大。
13. 溶解热:溶解质在溶剂中溶解时吸收或释放的热量。
14. 溶解度曲线:描述溶解度随温度或压力变化的曲线。
15. 溶液的稀释:向已有溶剂中加入一定量的溶质,使溶液体积增加,浓度减小的过程。
这些是九年级下化学溶液的主要知识点,希望对你有帮助!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三化学:溶液、溶解度知识点梳理
要点梳理:
一、溶液
1.溶液的定义:一种或几种物质分散在另一种物质中,形成均一、稳定的混合物叫做溶液。
2,溶液的特征
(1)均一性:是制溶液各部分组成、性质完全相同。
(2)稳定性:是指外界条件不变(温度、压强等),溶剂的量不变时,溶液长期放置不会分层也不会析出固体或气体。
二、、饱和溶液与不饱和溶液
1,概念:
(1)饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种绒织的溶液,叫做这种溶质的饱和溶液。
(2)不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
2.饱和溶液与不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,且可以相互转化:
饱和溶液不饱和溶液
三、、固体物质的溶解度以及溶解度曲线
1.概念:
在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。
2.影响固体溶解度大小的因素
(1)溶质、溶剂本身的性质
(2)温度
3.溶解度曲线
(1)溶解度曲线的意义:
①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。
此时,溶液必定是饱和溶液。
③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。
在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。
④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液,也就是说,在溶液中存在未溶解的溶质。
(2)溶解度曲线变化的规律
大多数固体物质的溶解度随温度的升高而增大,一般表现在曲线“坡度”比较“陡”,如硝酸钾;少数固体物质的溶解度受温度的影响较小,表现在曲线的“坡度”比较“平缓”,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,表现在曲线的“坡度”下降,如熟石灰。
四、结晶的方法:
(1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。
适用范围:溶解度受温度变化影响不大的物质,如氯化钠。
(2)降温结晶(冷却热饱和溶液法)冷却热的饱和溶液,使溶质从溶液中结晶析出。
适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。
溶解度知识点
概念:
1、固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的克数。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
2、气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积水里的体积数。
通常把在室温(20度)下:
溶解度在10g/100g水以上的物质叫易溶物质;
溶解度在1~10g/100g水叫可溶物质;
溶解度在0.01g~1g/100g水的物质叫微溶物质;
溶解度小于0.01g/100g水的物质叫难溶物质.
可见溶解是绝对的,不溶解是相对的。
影响溶解度大小的因素;
物质溶解与否,溶解能力的大小,一方面决定于物质的本性;另一方面也与外界条件如温度、溶剂种类等有关。
在相同条件下,有些物质易于溶解,而有些物质则难于溶解,即不同物质在同一溶剂里溶解能力不同。
通常把某一物质溶解在另一物质里的能力称为溶解性。
例如,糖易溶于水,而油脂不溶于水,就是它们对水的溶解性不同。
溶解度是溶解性的定量表示。
气体的溶解度还和压强有关。
压强越大,溶解度越大,反之则越小;温度越高,气体溶解度越低。
溶解度曲线:
1点
溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。
2线
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
根据溶解度曲线,选择分离某些可溶性混合物的方法。
3交点
两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
大部分固体随温度升高溶解度增大,如硝酸钾;少部分固体溶解度受温度影响不大,如食盐;极少数物质溶解度随温度升高反而减小,如氢氧化钙。
