金属互化物
材料概论

第二章1 普通的混凝土中有几种相?请分别写出各种相的名称。
若在其中加入钢筋,则钢筋起到什么作用?此时又有几种相?答:3相;砂子、碎石、水泥浆;增强作用;4。
2 比较晶体与非晶体的结构特性,了解晶体的结构不完整性有哪些类型?并区分三大材料的结构类型与比较其各自的特点。
答:晶体结构的基本特征是原子或分子在三维空间呈周期性的规则而有序地排列,即存在长程的几何有序。
结构的不完整性:实际上,极大多数晶体都有大量的与理想原子排列的轻度偏离存在,依据其几何形状而分为点缺陷、线缺陷和面缺陷。
金属材料的结构:一般都是晶体。
金属键无方向性,晶体结构具有最致密的堆积方式。
体心立方、面心立方和紧密堆积六方结构,金刚石结构。
无机非金属材料的结构:金刚石型结构;硅酸盐结构; 玻璃结构; 团簇及纳米材料高分子材料的结构包括高分子链的结构及聚集态结构各自的特点:3 高分子材料其聚集态结构可分为:晶态和非晶态(无定形)两种,与普通的晶态和非晶态结构比较有什么特点?答:晶态有序程度远小于小分子晶态,但非晶态的有序程度大于小分子物质液态。
4 如何区分本征半导体与非本征半导体材料?答:本征半导体:材料的电导率取决于电子-空穴对的数量和温度的材料。
非本征半导体:通过加入杂质即掺杂剂而制备的半导体,杂质的多少决定了电荷载流子的数量。
5 极大多数晶体实际上都存在有种种与理想原子排列的轻度偏离,依据结构不完整性的几何形状可分为哪几种缺陷类型?按溶质原子在溶剂晶格中的位置不同,固溶体可分成哪几种类型?答:依据其几何形状而分为点缺陷、线缺陷和面缺陷。
按溶质原子在溶剂晶格中的位置不同,固溶体可分成:置换型固溶体(或称取代型):溶剂A晶格中的原子被溶质B的原子取代所形成的固溶体。
原子A同B的大小要大致相同。
填隙型固溶体(也称间隙型):在溶剂A的晶格间隙内有溶质B的原子填入(溶入)所形成的固溶体。
B原子必须是充分小的,如C和N等是典型的溶质原子。
6 比较热塑性高分子材料和热固性高分子材料的结构特点,并说明由于结构的不同对其性能的影响。
有机过渡金属化合物

Ni(CO)3等,可利用CO与金属原子在稀有气体基质中低温合成,这种技术称为基质隔离法。
CO: 2 8.
(C5H5)Fe(C5H4CH2NMe2)+H2O
3 σ ,最高占据轨道为
次烷基(carbine)
W(CO)6+NaC5H5
计算CO的电子数,端从基表配位可价看电出子:
18
2,当N22配桥基位:形总价成电双子氮数为配2合,分物别后对,每N个≡金N属键提供长一都个略电子有增加(最大增加25pm),
Cr(NO)4的合成:在戊烷中存在过量NO时光分解
Cr(CO)6 NO的混配物:
NO h
Cr(NO)4
Ni(C5H5)2
NO (C5H5)NiNO
(C5H5)Mo(CO)3H NO (C5H5)Mo(CO)2NO+CO
亚硝酰基配合物18电子规则
一般都遵守18电子规则(NO作为3电子配体),红外光谱测定在Mn(CO)4NO 中NO位于三角双锥的赤道平面,具有C2v对称性。而Cr(CO)3(NO)2的两个NO在 轴向,具有D3h对称性
第5章 有机过渡金属化合 物
§1 有机金属化学基础知识
1 背景
▪ Zeise 丹麦
▪ 1827 第一个有机金属化合物: 铂的 有机化合物
Cl
P
214pmC
Cl Pt
135pm
C
Cl
P
[PtCl3C2H4]–
Natta ziegler
▪ Karl Ziegler (1898-1973) & Giulio Natta (1903-1979)
例如: Be(CH3)2 的多聚体
Me Me
Be
Be
Be
Me
2021届高考化学三轮复习 物质的结构与基础(A)检测训练

2021届高考化学三轮复习检测训练 物质的结构与基础(A )1.亚铁氰化钾[]{}462K Fe(CN)3H O ⋅俗称黄血盐,是一种重要的化工原料。
回答下列问题:(1)下列氮原子的电子排布图表示的状态中,能量最低的是_________________(填字母)。
(2)[]46K Fe(CN)中的作用力除普通共价键外,还有______________和_______________。
含有12 molσ键的[]46K Fe(CN)的物质的量为_________________mol 。
(3)检验3Fe +可用亚铁氰化钾,其反应原理为:[][]4636K Fe(CN)FeCl KFe Fe(CN)+↓(普鲁士蓝)+ 3KCl 。
此外在实验室还常用KSCN 溶液、苯酚()来检验3Fe +。
其中N 、O 、S 的第一电离能由大到小的顺序为___________________(用元素符号表示),苯酚中碳原子的杂化轨道类型为_____________________。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,但铁的熔沸点远高于钙,其原因是_______________。
(5)一种含有Fe 、Cu 、S 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形)。
此矿物的化学式为_____________________。
若晶胞的底面边长为pm a ,高为pm?c ,阿伏加德罗常数的值为A N ,则该晶体的密度为_________________3g cm -⋅(用含A a c N 、、的式子表示)。
2.H 、N 、F 、Ca 、Cu 是中学阶段常见的元素。
回答下列问题:(1)写出基态Cu 原子核外电子排布式________________________。
(2)N 元素的第一电离能比O 元素的第一电离能_______________(填“大”或“小”)。
(3)酞菁铜的分子结构如图所示。
金属互化物

金属互化物
金属互化物是由金属原子组成的混合物,它能和其他化学物质形成化合物。
金属互化物能产生许多耐腐蚀性、结构稳定性、耐热性、可塑性好等优点,因此在各行各业都得到了广泛的应用。
二、产生原理
金属互化物的产生原理是由金属原子混合形成的化合物,在金属原子之间形成共价键,从而形成一种新的物质。
这种物质有自己独特的性质,它的结构比原来的金属原子更加稳定,因此金属互化物的抗腐蚀能力要比单一的金属原子要强很多。
三、分类
根据金属互化物的成分和用途,金属互化物可以分为以下几种: 1、合金:由多种金属原子组成,它们可以形成多种配方,从而产生不同的效果。
常见的合金有钢铁、铜铅、铝镁等。
2、结晶体:有金属离子和非金属离子构成,形成类似于晶体结构,可以用来生产高强度耐热物质。
3、涂料:以金属磷酸盐、溴化金属、氧化物为主要成分,可以用来涂覆外部表层,提高金属的耐腐蚀和耐热性。
4、氧化物:由金属原子和氧原子组成,可以提高金属的耐热性和防腐蚀性。
四、应用
金属互化物的应用非常广泛,它可以用来生产各种机械零部件、建筑和桥梁材料、汽车零部件、航空航天材料和许多其他电子产品。
此外,它还可以用来提高金属的耐热性和防腐蚀性,保护金属不受腐蚀。
五、总结
金属互化物是由金属原子混合形成的化合物,具有特殊的性质。
它具有耐腐蚀性、结构稳定性、耐热性、可塑性好等特点,可以用来生产各种机械零部件、建筑和桥梁材料、汽车零部件、航空航天材料和许多其他电子产品。
此外,它还可以用来提高金属的耐热性和防腐蚀性,保护金属免受腐蚀。
初中化学知识点总结:合金的类型及通性

初中化学知识点总结:合金的类型及通性合金类型主要是:
(1)共熔混合物,如焊锡、铋镉合金等;
(2)固熔体,如金银合金等;
(3)金属互化物,如铜锌组成的黄铜等。
合金的许多性能优于纯金属,故在应用材料中大多使用合金(参看铁合金、不锈钢)。
各类型合金都有以下通性:
(1)熔点低于其组分中任一种组成金属的熔点;
(2)硬度比其组分中任一金属的硬度大;
(3)合金的导电性和导热性低于任一组分金属。
利用合金的这一特性,可以制造高电阻和高热阻材料。
还可制造有特殊性能的材料,如在铁中掺入15%铬和9%镍得到一种耐腐蚀的不锈钢,适用于化学工业。
2022年高考化学晶胞的相关计算专项训练之知识梳理与训练附解析

2022年高考化学晶胞的相关计算专项训练之知识梳理与训练附解析一、晶胞的相关计算1.根据下列结构示意图,判断下列说法中正确的是A.在CsCl晶体中,距Cs+最近的Cl-有6个B.在CaF2晶体中,Ca2+周围距离最近的F-有4个C.在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子D.在铜晶体中,每个铜原子周围距离最近的铜原子有12个2.Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。
回答下列问题:(1)Mg、Ni、Cu 等金属可能形成金属互化物。
金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、“等于”或“小于”),理由是_____________________。
(3)[Ni(NH3)6](NO3)2中不存在的化学键为___________(填序号)。
a.离子键 b.金属键 c.配位键 d.氢键(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
该合金储氢后,H2与 Ni 的物质的量之比为___________。
②Mg2NiH4 是一种储氢的金属氢化物。
在 Mg2NiH4晶胞中,Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。
Mg2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。
晶体的密度为ρg·cm-3,N A表示阿伏加德罗常数,Mg2+和 Ni 原子的最短距离为__________cm(用含ρ和 N A的代数式表示)。
3.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。
制备石墨烯方法有石墨剥离法、化学气相沉积法等。
石墨烯的球棍模型及分子结构示意图如下:(1)下列有关石墨烯说法正确的是_____。
新的金矿物系列—金和铅的金属互化物

新的金矿物系列—金和铅的金属互化物
吴尚全
【期刊名称】《黄金科技动态》
【年(卷),期】1991(000)009
【摘要】一、概述金矿物可分为自然元素类,金属互化物类,金—银的碲、锑、铋、硒、硫化物类三个大的类别。
金属互化物类根据与金互化的其它组份,可将本类矿物进一步划分为三个亚类:1)金(银)—汞互化物亚类;2)金—铜互化物亚类;3)金—其它金属互化物亚类。
在许多有关金矿物学的著作中,都未将金与铅的金属互化物列入其中,但近年来有关这类新的含金矿物有不少报道,现仅就已搜集到的资料,作一简要介绍。
【总页数】10页(P13-22)
【作者】吴尚全
【作者单位】无
【正文语种】中文
【中图分类】P618.510.1
【相关文献】
1.陕西省双王金矿床中自然金属与金属互化物 [J], 刘家军;齐峰;刘冲昊;程锋;王建平;翟德高;曹瑞荣;程建军;杨永荣;王罗
2.铅及铅银合金,铅锡合金和铅铜合金的表面张力的研究 [J], Lawso.,F;李建忠
3.金—汞系列两种矿物,铅金碲铋化物,黑铋金矿等金矿物的发现和研究 [J], 田澍章;陈静渝
4.金一汞系列两种矿物.铅金碲铋化物.黑铋金矿等金矿物的发现和研究 [J], 田澍章;陈静渝
5.陕西省双王金矿床中自然金属与金属互化物 [J], 刘家军;刘冲昊;程锋;王建平;翟德高;曹瑞荣;程建军;杨永荣;王罗;齐峰;;;;;;;;;;;;;;
因版权原因,仅展示原文概要,查看原文内容请购买。
物质的相互转化
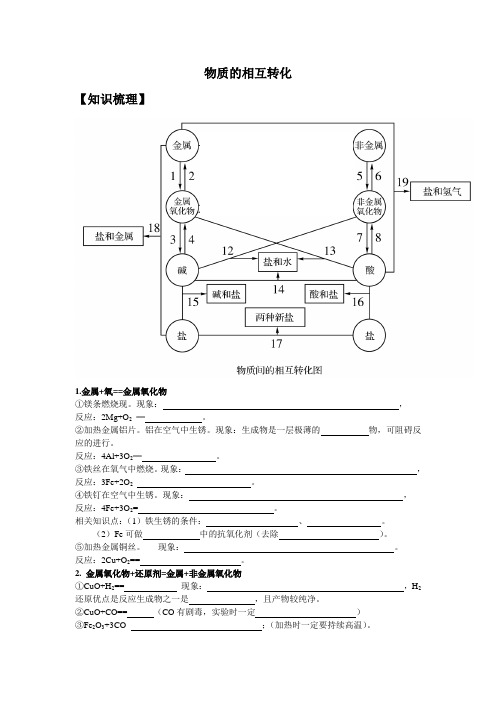
相关知识点:反应后的产物可用来进行检验。
⑤碳在氧气中不充分燃烧:2C+O2。
5.非金属氧化物+水==酸
①CO2+H2O==(CO2通入紫色石蕊试液,溶液)。
②SO3+H2O==。
③SO2+H2O==(生成酸雨的主要反应。H2SO3与氧进一步反应生成,PH值)。
④酸与碱的反应是中和反应,反应实质是H++OH-=;盐是反应的产物。
⑤复分解反应指由的反应。复分解反应前后,各物质所含元素的化合价。
14.金属+盐=新盐+新金属(置换反应)
①Fe+CuSO4==现象:。
相关知识点:(1)炼铜的方法。炼铜时,铁应煅成片状,提高铁的利用效率和反应速度。(2)电镀工业中铁表面镀的方法。
②Na2CO3+H2SO4==现象:。
相关知识点:泡沫灭火器原理之一。
③Na2CO3+2HCl=现象:。
相关知识点:泡沫灭火器原理之一。
④AgNO3+HCl==现象:。
相关知识点:生成白色沉淀不溶解于,检验的原理。
⑤BaCl2+H2SO4==现象:生成白色沉淀。
相关知识点:检测SO42-时加BaCl2有可能生成AgCl,所以要慎重。
②Cu+2AgNO3=现象:。
总结:
①反应物中的金属在金属活动顺序表中必须位于盐中金属的面,盐应是溶或微溶于水的盐溶液。
②金属不包括K、Ca、Na、Mg。这些金属能与所有盐溶液发生反应,但反应的本质均是先与水反应生成氢气和碱。
③Fe与盐反应,生成。
④如一种金属与多种盐反应,则金属与最不活泼金属的离子反应优先进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属互化物
金属互化物(intermetallic compound)或金属间化合物是一种被用来表示一种特殊情况的术貄。
指的是固体相涉及金属,以及一种完全不同的配位化学,它被用来解释由两种或两种以上金属所构成的复合物。
请注意,豏多金属间化合物通常简称合金,尽管严格来说他们不是。
就像复杂金属合金这种非常大的金属间化合物。
研究上的定义
这是由1967年的舒尔滋提出的,其定义为固相金属间化合物拥有两个或两个以上的金属元素,它们的晶体结构有别于一般的分子晶体或离子晶体。
这定义包含以下内容:
电子化合物- 化合物形成时由原子的价电子担任重要角色
σ相化合物、拉夫斯相化合物- 成份的金属元素堆积成特殊结构
金属的定义是指:
所谓的贫金属,如铝、镓、铟、铊、锡和铅
部份的类金属元素,如矽、锗、砷、锑和碲。
合金,这是指均匀混合金属,以及间隙化合物,但碳化物和氮化物被排除在外。
