残留溶剂测定的要求和测定方法
SOP-06-QC-032-02残留溶剂测定法操作规程(EP、BP)

目录1.目的:--------------------------------------------------------------------22.范围:--------------------------------------------------------------------23.职责:--------------------------------------------------------------------24.内容:--------------------------------------------------------------------2 4.1简述:-------------------------------------------------------------------2 4.2仪器与用具:-------------------------------------------------------------2 4.3试剂:-------------------------------------------------------------------3 4.4操作:-------------------------------------------------------------------34.5结果与判定:-------------------------------------------------------------65.相关程序:---------------------------------------------------------------106.相关记录:---------------------------------------------------------------107.参考资料:---------------------------------------------------------------108.附件:-------------------------------------------------------------------109.历史和修订记载:---------------------------------------------------------201.目的:建立残留溶剂测定法操作规程(EP、BP),使测定过程按规定程序有序进行,确保检验结果的准确性和可靠性。
包装材料溶剂残留量测定法

包装材料溶剂残留量测定法国家食品药品监督管理局国家药品包装容器(材料)方法标准(试行) YBB00312004 包装材料溶剂残留量测定法Baozhuangcailiao Rongji Canliuliang Cedingfa The test method for residue of solvent in Packaging Materials本法适用于药品包装材料中残留溶剂的测定。
本法以气一固平衡为基础,取一面积的试样置于密封容器内,在一定的湿度和时间条件下,试样中残留的有机溶剂受热挥发,达到平衡后,取定量顶空气气体注入色谱仪中分析,以保留时间定性,峰面积(或峰高)定量。
结果以mg/m2表示。
色谱条件与系统适用性试验色谱柱可选用能满足待测溶剂分离要求的填充色谱柱或毛细管色谱柱。
填充色谱柱:一般用聚乙二醇PEG-20M。
理论板数:不得低于1000。
毛细管色谱柱除另有规定外,极性相近的同类色谱柱之间要吧互代使用。
理论板数:不得低于5000。
1、非极性色谱柱:100%的二甲基聚硅氧烷。
2、极性色谱柱:聚乙二醇PEG-20M。
3、中极性色谱柱:6%氰丙基苯基-94%二甲基聚硅氧烷。
4、弱极性色谱柱:5%苯基-95%甲基聚硅氧烷。
一般选用:色谱柱:100%的二甲基聚硅氧烷0.53mm乘以1.2µm乘以30m检测器:氢火焰离子检测器测定条件(供参考):柱温70℃,汽化温度180℃,检测温度190℃。
分流比:5:1 氮气5ml/min,氢气40 ml/min,空气450 ml/min 分离度:大于1.5 可分离乙醇、异丙醇、要酮、乙酸乙酯、甲苯、乙酸丁酯、二甲苯。
供试品的制备按内表面积3~5cm2/ml,的比例取样,按产品项下规定制备供试品,置于适宜体积的玻璃容器内,密闭。
对照品的制备1、微量进样器取适量待测有机溶剂,注入已密封的适当体积的玻璃容器内(容器内装有3颗玻璃珠)。
根据待测有机溶剂的密度和体积,计算有机溶剂的量。
残留溶剂检查方法的选择和验证要点

残留溶剂检查方法的选择和验证要点一、概述药物中的残留溶剂系指在原料药或辅料的生产中,以及制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。
按有机溶剂的毒性和对环境的危害,ICH将有机溶剂分为避免使用、限制使用、低毒和毒性依据尚不足四种情况。
因残留溶剂会影响产品的安全性,故需对其进行研究。
二、残留溶剂检查方法的选择残留溶剂的测定一般采用气相色谱法,推荐使用毛细管色谱柱-顶空进样系统,当然也可以使用普通填充柱,溶液直接进样方法。
对不宜采用气相色谱法测定的含氮碱性化合物,如N-甲基吡咯烷酮等可采用其它方法,如离子色谱法等。
测定残留溶剂应从以下几个方面考虑:确定被测的有机溶剂、选择合适的色谱柱、制备供试品溶液和对照品溶液、选择合适的进样方法和满足检测灵敏度要求的检测器,下面分别进行介绍:1、确定被测的有机溶剂根据制备工艺确定被测有机溶剂的范围。
通常应对制备工艺过程中使用的二类以上溶剂和重结晶用溶剂,以及根据工艺特点要求的其它溶剂进行残留量的研究。
建议对合成最后三步使用的三类溶剂也进行研究,这样能更好地对未知峰进行归属;对制剂过程中使用的有机溶剂也建议考察其残留情况,特别是缓、控释微丸包衣过程使用的有机溶剂更应引起注意。
残留溶剂的限度要求同ICH的规定。
2、选择合适的色谱柱按照相似相溶的原理选择色谱柱。
毛细管柱有极性柱、非极性柱、弱极性柱和中等极性柱。
填充柱有高分子多孔小球或涂渍适宜固定液的填充柱。
测定含氮的碱性有机溶剂时,由于普通气相色谱仪的不锈钢管路、进样器衬管等对有机胺等含氮的碱性化合物具有较强的吸附作用,致使其检出的灵敏度降低。
通常采用弱极性色谱柱或经碱处理过的色谱柱分析含氮的碱性有机溶剂,如果采用胺分析专用柱进行分析,则效果更好。
3、供试品和对照品的制备顶空进样方法通常以水为溶剂,对于非水溶性的药物,可采用DMF、DMSO或其他适宜溶剂。
溶液直接进样方法用水或合适的溶剂溶解样品。
制备供试品的溶剂的选择应兼顾供试品和被测有机溶剂的溶解度,且所用溶剂应不干扰被测有机溶剂的测定。
溶剂残留测定法

温时柱子高温烧一段时间。
三、残留溶剂的测定方法
④ 系统适用性试验
(1)用待测物的色谱峰计算,毛细管色谱柱的理论板数一般不低于 5000;填充柱的理论板数一般不低于1000。
(2)色谱图中,待测物色谱峰与其相邻色谱峰的分离度应大于1.5。拖 尾因子应≤2.0。
检测灵敏度即可; 对于沸点过高的溶剂,如N,N-二甲基甲酰胺(DMF),二甲亚砜
(DMSO),聚乙二醇等,用顶空进样测定的灵敏度不如直接进样,不适宜 采用顶空法 。
三、残留溶剂的测定方法
2.溶液的制备:空白溶液,供试品溶液和对照品溶液
A. 溶解性(应重视)
供试品要能完全溶解 (特殊情况下,常温下不能溶解的能热溶解的也 行),对照品也要能完全溶解。通常以水为溶剂;对于非水溶性药物,可 采用N,N-二甲基甲酰胺(DMF)、二甲亚砜(DMSO)或其他适宜溶剂。
三、残留溶剂的测定方法
B. 配制浓度的确定
① 限度检查:根据通则残留溶剂的限度规定(附表1)确定对照品溶液的浓 度;
② 定量测定:为保证定量结果的准确性,应根据供试品中残留溶剂的实 际残留量确定对照品溶液的浓度;通常对照品溶液色谱峰面积不宜超 过供试品溶液中对应的残留溶剂色谱峰面积的2倍,同时应根据实际情 况调整,并确保浓度在方法学验证的有效范围内。必要时,应重新调 整。
二、气相色谱柱的分类
1. 毛细管柱 除另有规定外,极性相近的同类色谱柱之间可以互相使用。
(1)非极性色谱柱:固定液为100%二甲基聚硅氧烷的毛细管柱(DB-1)。 (2)极性色谱柱:固定液为聚乙二醇(PEG-20M)的毛细管柱(DB-WAX)。
溶剂残留检测操作规程
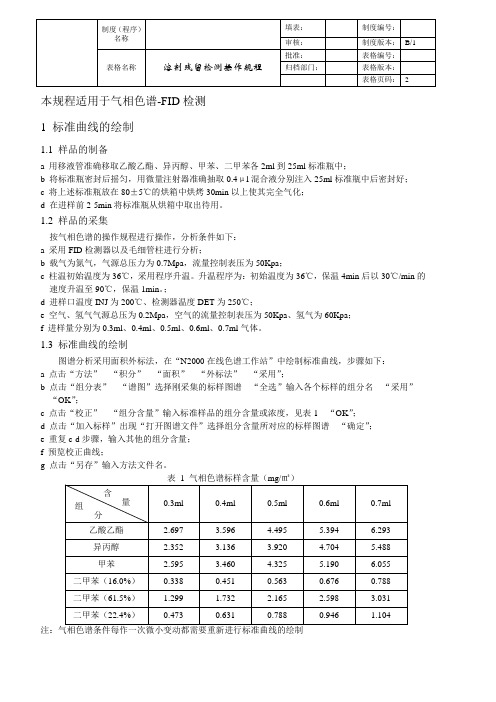
本规程适用于气相色谱-FID检测1 标准曲线的绘制1.1 样品的制备a 用移液管准确移取乙酸乙酯、异丙醇、甲苯、二甲苯各2ml到25ml标准瓶中;b 将标准瓶密封后摇匀,用微量注射器准确抽取0.4μl混合液分别注入25ml标准瓶中后密封好;c 将上述标准瓶放在80±5℃的烘箱中烘烤30min以上使其完全气化;d 在进样前2-5min将标准瓶从烘箱中取出待用。
1.2 样品的采集按气相色谱的操作规程进行操作,分析条件如下:a 采用FID检测器以及毛细管柱进行分析;b 载气为氮气,气源总压力为0.7Mpa,流量控制表压为50Kpa;c 柱温初始温度为36℃,采用程序升温。
升温程序为:初始温度为36℃,保温4min后以30℃/min的速度升温至90℃,保温1min。
;d 进样口温度INJ为200℃、检测器温度DET为250℃;e 空气、氢气气源总压为0.2Mpa,空气的流量控制表压为50Kpa、氢气为60Kpa;f 进样量分别为0.3ml、0.4ml、0.5ml、0.6ml、0.7ml气体。
1.3 标准曲线的绘制图谱分析采用面积外标法,在“N2000在线色谱工作站”中绘制标准曲线,步骤如下:a 点击“方法”---“积分”---“面积”---“外标法”---“采用”;b 点击“组分表”---“谱图”选择刚采集的标样图谱---“全选”输入各个标样的组分名---“采用”---“OK”;c 点击“校正”---“组分含量”输入标准样品的组分含量或浓度,见表1---“OK”;d 点击“加入标样”出现“打开图谱文件”选择组分含量所对应的标样图谱---“确定”;e 重复c-d步骤,输入其他的组分含量;f 预览校正曲线;g 点击“另存”输入方法文件名。
注:气相色谱条件每作一次微小变动都需要重新进行标准曲线的绘制2 待测样的溶剂残留测定2.1 待测样的制备a 取待测样膜10cm×10cm,剪碎后装入25ml的标准瓶中密封;b 将标准瓶放在80±5℃的烘箱中烘烤30min以上使其残留溶剂完全气化;c在进样前2-5min将标准瓶从烘箱中取出冷却待用。
有机溶剂残留测定法标准操作规程
1.目的:规范有机溶剂残留测定法检验操作,保证检验的质量。
2.范围:适于本公司成品的重金属测定检验。
3.责任:质量管理科、中心化验室、检验员。
4.检验依据:《中国药典》2015年版四部有机溶剂残留测定法检查方法。
5.内容:5.1 仪器:气相色谱仪、顶空进样器。
5.2 试剂:丙酮、乙酸乙酯、乙酸丁酯、正丁醇、N、N-二甲基甲酰胺、二甲基亚砜为分析纯。
5.3 溶液配制◆样品溶液:精密称取本品0.2g于顶空瓶中,加二甲基亚砜2ml溶解,摇匀,即得。
◆对照溶液:精密称取丙酮约0.05g、乙酸乙酯约0.05g、乙酸丁酯约0.05g、正丁醇约0.05g、N,N-二甲基甲酰胺约0.0088g于100ml容量瓶中,加二甲基亚砜溶解并稀释至刻度,摇匀,制成每1ml分别约含丙酮0.5mg、乙酸乙酯0.5mg、乙酸丁酯 0.5mg 、正丁醇0.5mg、N.N—二甲基甲酰胺 0.088mg。
精密量取2ml两份,分别置于20ml顶空瓶中,即得。
5.4 色谱条件与系统适用性试验◆色谱条件●色谱柱:DB-FFAP石英毛细管色谱柱(30m×0.32mm×0.5um)●载气:高纯N2 恒流1.0ml/min 分流比:1:10●柱温: 初温40℃, 保持5min, 以15℃/min 的速率升温,升至220℃, 保持5min●分流汽化温度 SPL 250℃●氢焰检测器温度 DFID 280℃◆操作方法:取对照溶液顶空进样注入气相色谱仪,按丙酮峰、乙酸乙酯峰、乙酸丁酯峰、正丁醇峰、N,N-二甲基甲酰胺峰、二甲基亚砜峰的顺序出峰,各峰间的分离度均应符合规定,理论板数不低于5000。
5.5 测定方法:精密量取对照溶液和样品溶液各2ml分别顶空注入气相色谱仪,记录色谱图。
5.6 标准规定:按外标法以峰面积计算出样品中各检测溶剂的含量,丙酮应不得过0.5%、乙酸乙酯应不得过0.5%、乙酸丁酯应不得过0.5%、正丁醇应不得过0.5%、N,N-二甲基甲酰胺应不得过0.088%。
药物中的残留溶剂测定

有机溶剂的分类
分类依据: 允许日暴露量(permitted daily exposure PDE) 定义: 是指某一有机溶剂被允许摄入而不产生毒性的日平 均最大剂量,单位为mg/天
有机溶剂的分类
类别 第一类溶剂 毒性 人体致癌物、疑为人 体致癌物或环境危害 物 有非遗传致癌毒性或 其他不可逆毒性、或 其他严重的可逆毒性 对人体低毒 没有足够毒性资料 PDE( mg/天) 0.1以下(1,1,1) 三氯乙烷除外 0.5-50
PDE : mg/天
剂量: g/天
有机溶剂的引入
根据研究对象具体情况 分析有机溶剂的引入 有机溶剂毒性
确定何种有机溶剂需要进行研究
研究方法的建立及方法学验证
研究结果的分析及质量标准的建立
有机溶剂的引入
原料药/辅料:合成过程中引入 包括: 作为合成原料或反应溶剂引入 作为反应副产物引入 由其他合成原料或其他溶剂带入 制剂 各种成份(原料药、辅料)带入 制剂制备过程中引入
有机溶剂的引入
研究集中在:原料药的第一种情况 影响因素: 有机溶剂在合成过程中使用的步骤 后续步骤中使用的有机溶剂对之前使用的溶剂的影 响 中间体的影响(中间体的纯化方法、干燥条件) 终产品精制方法和条件等等
有机溶剂的引入
制剂 控制原料药的残留溶剂,最终目的是控制制剂的残留 溶剂,使之符合规定。有时候根据制剂的一些特点, 可能对原料药残留溶剂的研究和限度要求进行特殊性 的考虑。
药物中的残留溶剂测定
浙江省药品检验所 高素英
前 言
定义:药物中的残留溶剂( Residual Solvent )系指 在原料药或辅料的生产中,以及在制剂制备过程中使 用的,但在工艺过程中未能完全去除的有机溶剂。 研究的性质:杂质研究的范畴 研究的目的:控制药物质量,保障病人用药安全。 在原料药合成中,溶剂的选择是合成中非常关键的因 素,选择适当的溶剂可提高得率或决定药物的性质,如 晶型、纯度和溶解度,从而影响疗效。同时,在某些 特定的制剂生产中,其工艺也要求使用特定的溶剂。 但由于溶剂没有疗效,故所有残留溶剂均应尽可能除 去,以使产品符合其规范、GMP或其他基本的质量要 求 。
中国药典溶剂残留检测方法

中国药典溶剂残留检测方法药典是一种规范化的文献,用于确保药品的质量、安全和有效性。
中国药典(Chinese Pharmacopoeia,简称ChP)是中国药物及医疗器械行业的权威标准,其中包含了对药品质量的要求和检测方法。
溶剂残留检测是其中一个重要的方面,主要用于检测药品中可能残留的有机溶剂。
下面是一般用于中国药典中药品溶剂残留检测的一些常见方法:气相色谱法(Gas Chromatography,GC):使用气相色谱仪检测有机溶剂的残留。
药物样品通常在高温条件下蒸发,然后通过气相色谱柱进行分离,最后使用检测器进行检测。
气相质谱法(Gas Chromatography-Mass Spectrometry,GC-MS):结合气相色谱和质谱技术,可提高对溶剂残留的分析灵敏度和准确性。
液相色谱法(High-Performance Liquid Chromatography,HPLC):使用液相色谱仪检测溶剂残留。
药物样品在高压液相色谱柱中进行分离,然后通过检测器进行检测。
液相质谱法(High-Performance Liquid Chromatography-Mass Spectrometry,HPLC-MS):结合液相色谱和质谱技术,也是一种常用的高灵敏度、高准确性的检测方法。
头空气色谱法(Headspace Gas Chromatography,HS-GC):样品在封闭的容器中加热,挥发出来的气体通过气相色谱进行分离和检测。
适用于挥发性有机物的检测。
核磁共振法(Nuclear Magnetic Resonance,NMR):虽然不是常规的溶剂残留检测方法,但核磁共振技术也可用于一些特殊情况下的有机溶剂残留的定性和定量分析。
这些方法可以根据药物的性质和具体要求进行选择。
检测结果需要符合中国药典中规定的合格标准,以确保药品在生产和使用过程中不含有害的有机溶剂残留。
这些检测方法的选用通常受到法规、行业标准以及具体产品的特点等多方面因素的影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
企标控制溶剂 DMF
实际检出 乙醇
A B C D
无
乙醇
DMF 甲醇、氯仿、甲 苯
乙醇、甲苯 无
30040701 30040702 30040703
E
041101 041102 041103
甲醇、乙醇、环 乙醇、乙醚 己烷、DMF、 DMSO
盐酸头孢他美酯残留溶剂的控制
厂家 A B C D E F G 申报生产工艺中涉及的溶剂 甲苯、二氯甲烷 甲苯、二氯甲烷 乙醇、丙酮 乙酸乙酯 实际检出的残留溶剂 异丙醇 异丙醇、石油醚 异丙醇 异丙醇
色谱条件 柱 温 先 在 30℃ 维 持 7min, 再 以
8℃/min 的速度升至 120℃, 维持 15min ;以
氮 气 为 载 气 , 流 速 为 2.0ml/min, 分 流 比
1:1 ;顶空瓶温度为 70℃, 顶空时间 30 -
60min ;进样口温度为 200℃;采用FID 检测 器,温度为250℃。
• 第二法(顶空进样法) 精密量取标准溶液和供试品溶液各3~ 5ml,分别置于容积为8ml的顶空取样瓶中, 瓶外径17mm,长60mm,带螺扣具孔盖。 瓶口带隔膜垫,与顶部空气接触的隔膜垫 上应有聚四氟乙烯膜使与橡胶垫隔开,各 瓶在60℃的水浴中加热40~80分钟,用在 同一水浴中的空试管中加热的注射器抽取 顶空气适量(通常为1ml),进样,重复进样3 次,按第一法中所述方法测定、计算与处 理。
药品中残留溶剂分析 的技术要求和测定方法
王 玉 江苏省药品检验所
技术要求
• ICH(人用药品注册技术要求国际协调会)已经通过
了控制药品中残留溶剂的指导原则,将药品生产
中常用的69种有机溶剂按照对人体和环境的危害
程度分为四类,并规定了每种溶剂的限值。
• 《欧洲药典》第5版、《日本药局方》第14版、
《美国药典》第28版和《中国药典》2005版均已
峰面 3.01
RRT 1.926
知识库数据 2.028 2.03
可能的残留溶剂 三氯乙烯 二氧六环
12
13 14 15 16 17
9.789
10.532 10.992 11.824 13.398 14.311
23.36
10.01 5.74 63.53 3.02 3.67
2.159
2.322 2.424 2.607 2.954 3.156
标准溶液和供试品液的制备 CHP05版之三
•
精密称取各药品项下规定的有机溶剂和 内标物质适量,分别加入无有机物的水溶 解并配制成浓度为10.0μg/ml的标准及内标 贮备液。精密量取上述标准及内标贮备液 各0.1~1ml,加无有机物的水稀释至 10.0ml,混匀,即得。用外标法测定时只 量取标准贮备液稀释。 精密称取供试品0.1~1g,加无有机物的 水或合适的无有机物的水溶液使溶解,并 稀释至10.0ml,混匀,即得。
初筛结果:7个企业的盐酸头孢他美酯中均
可能含有异丙醇。
(2)证明:以初筛结果作为检测对象(本例
为异丙醇),参考知识库选择等温色谱系 统和色谱条件(本例选择SPB-1色谱柱, 在40℃条件下测定);将供试品中测得的 色谱峰的保留时间与相应对照品(本例为 异丙醇)的保留时间比较;并通过标准加 入法进一步证明初筛结果的正确性。
初步判定:将两个色谱柱系统下得到的RRT
与知识库中诸有机溶剂的RRT参考值进行
比较,选择出数值相近(相对误差小于5
%)者;而在两个色谱柱系统中均出现的
有机溶剂即可初步判定为药品中可能存在
的残留溶剂。
SPB-1柱程序升温实验结果
峰号 1 2 3 4 5 tR(min) 1.776 2.053 2.179 2.452 2.701 峰面积 4.87 28.31 177.88 12.32 159.19 RRT 0.392 0.453 0.480 0.541 0.596 数据库中数据 无相应数据 0.453 无相应数据 0.539 0.595 乙醇 丙酮 甲醇 可能的残留溶剂
GC条件与系统适用性试验 CHP05版之二
• 以直径为0.25~0.18mm的二乙烯苯-乙基乙 烯苯型高分子多孔小球作为固定相,柱温为80~ 170℃;并符合下列要求: (1) 用待测物的色谱峰计算的理论板数应大于 1000; (2) 以内标法测定时,内标物与待测物的两个 色谱峰的分离度应大于1.5; (3) 以内标法测定时,每个标准溶液进样5次, 所得待测物与内标物峰面积之比的 相对标准偏差 不大于5%;若以外标法测定,所得待测物峰面积 的相对标准偏差不大于10%。
二氯甲烷、乙醇、丙酮、乙酸乙酯
二氯甲烷 异丙醇、乙酸乙酯、乙酸丁酯、甲 醇
异丙醇、石油醚
异丙醇、石油醚 异丙醇
残留溶剂测定一般程序
确定药品涉及的残留溶剂 种类 建立残留溶剂检测方法
残留溶剂检测方法的验证
一、确定药品中涉及的残留溶剂种 类
1. 利用“药品残留溶剂测定知识库”确定样 品中实际存在的残留溶剂
顶空毛细管气相色谱法
• 建立了测定药品中残留溶剂的知识库;
• 实现了计算机辅助计算,优化残留溶剂测
定的色谱条件;
• 对药品中残留溶剂测定中的影响因素进行
了考察。
•
(1) 内标物的选择 二氧六环与吡啶可以互为内标,苯与甲苯可以互为内 标,氯仿的内标物为1,2-二氯乙烷。 (2) 温度选择 测定二氧六环、吡啶、苯、甲苯时柱温为170℃,测定 氯仿、二氯甲烷时柱温为140℃,测定环氧乙烷时柱温为 80℃。进样口及检测器温度应高出柱温30℃。 (3) 测定方法 从方法的精密度考虑,二氧六环、吡啶宜用第一法; 苯、甲苯、氯仿、二氯甲烷可以用第一法或第二法;环氧 乙烷直接用第二法;其中在用第二法测定苯、甲苯时,在 水浴中加热时间为30分钟,测定环氧乙烷时在水浴中加热 时间为5分钟。 如果用第一法时,样品本身会给色谱系统带来干扰或 严重污染,则宜采用第二法。 (4) 供试品取用量决定于其溶解度,如供试品在水中 难溶,可以改用酸、碱溶液溶解。标准贮备液的取用量取 决于供试品取用量及残留有机溶剂的限度。
极性色谱柱(HP-FFAP)系统
色 谱 条 件 : 柱 温 先 在 60℃ 维 持 6min ; 再 以 8℃/min 的速度升温速率升至 100℃,维持 20 min;以氮气为载气,流速为2.0ml/min, 分流比 1:1 ;顶空瓶温度为 70℃, 顶空时间 30-60min ;进样口温度为200℃;采用FID 检测器,温度为250℃。
中国药典2010版的要求
• 修订残留有机溶剂的检测方法 • 参照ICH已协调的规范进一步修订和完善, 并简化方法 • 进一步推进在品种中的应用。
原有方法简介
• • • • GC法-填充柱法 样品制备方法 溶液法 顶空法
有机溶剂残留量测定法 CHP05版之一
•
检查药物在生产过程中引入的有 害有机溶剂残留量,包括苯、氯仿、 1,4-二氧六环、二氯甲烷、吡啶、甲 苯及环氧乙烷。如有其他需要检查的 有害有机溶剂,则应在各品种项下另 作规定。
2.163
2.164 2.32 无相应数据 2.617 2.953 3.152
正庚烷
乙酸丙酯 吡啶
甲苯 乙酸丁酯 氯苯
18
丁酮
16.538
1.97
9.34
3.647
3.653
异丙基苯
HP-FFAP柱程序升温实验结果
峰号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 16 17 19 丁酮 tR(min) 1.243 1.296 1.353 1.401 1.472 1.535 1.606 1.692 1.846 1.926 2.077 2.142 2.25 3.304 6.208 8.155 12.071 1.97 峰面积 14.7 515.1 1.6 2.9 13.2 10 174.4 62.8 1 59 1.3 18.3 2 23.9 3.2 3.6 2.7 RRT 0.631 0.658 0.687 0.711 0.747 0.779 0.815 0.859 0.937 0.978 1.054 1.087 1.142 1.677 3.151 4.140 6.127 数据库中数据 0.63 0.657 无相应数据 0.711 0.747 无相应数据 0.816 无相应数据 0.935 0.976 1.052 1.088 1.146 无相应数据 无相应数据 无相应数据 无相应数据 可能的残留溶剂 正己烷 异辛烷or异丙醚 二甲氧基甲烷 甲基环己烷 丙酮 四氯化碳 甲醇 异丙醇 氯仿or乙醇 苯
药品质量标准残留溶剂检查方法
• 建立药品质量标准残留溶剂检查方法不同
于对样品中的残留溶剂进行检测。后者只
要检测出样品中实际存在的残留溶剂即可,
但前者应适用于对所用企业、不同时期的
同品种产品的测定。
统一残留溶剂检测方法的难点
• 残留溶剂在具体的样品中具有不确定性:
不同的生产企业可以采用不同的生产工艺 生产相同药品,导致相同药品所含有的残 留溶剂种类可能不同。
2. 在等温色谱系统中进一步判断产品中可能
使用过的其它溶剂及其它可能存在的干扰
3. 结合企业提供的工艺信息确定药品质量标
准中应控制的残留溶剂
1. 利用“药品残留溶剂测定知识库”确定样 品中实际存在的残留溶剂 (1)初筛:供试品溶液浓度为0.1g.ml-1;分 别使用非极性的SPB-1和极性的HP- FFAP毛细管柱,按照知识库中各自的程序 升温条件,用顶空气相色谱法分别测定药 品中挥发性组分的保留时间,以丁酮为参 比溶剂,计算各挥发性组分色谱峰相对于 丁酮色谱峰的相对保留时间(RRT)。
接受了ICH关于残留溶剂的指导原则。
• Why do we need to determine Organic solvent residue? • ICH的要求和各国药典要求 • 安全性 • 临床数据 • 药理、毒理实验
