2015片剂
《中国药典》2015年版制剂通则变化比较

《中国药典》2015年版制剂通则变化⽐较《中国药典》2015年版制剂通则变化⽐较2015年版《中国药典》⽆论是在品种收载、标准增修订幅度、检验⽅法完善、检测限度设定,还是在标准体系的系统完善、质控⽔平的整体提升都上了⼀个新的台阶。
通过学习、熟悉2015 年版《中国药典》制剂通则的变化,了解⽬前我国⽤药⽔平、制药⽔平和监管⽔平现状,解读未来我国药品⾏业的趋势。
学习重点:熟悉药典制剂通则,掌握其标准的提升。
第⼀部分制剂通则⽐较2015年版《中国药典》已于2015年6⽉5⽇由国家⾷品药品监督管理总局正式颁布,于2015年12⽉1⽇正式实施。
新版药典是国家药品标准的组成部分,是国家药品标准体系的核⼼。
按照党中央提出的“四个最严”要求,新版药典的制修订始终坚持“科学、先进、实⽤、规范”的原则,依据试验数据、研究结果、专家评估,体现药典编制的科学性和严谨性,以持续改进提⾼药品质量。
新版药典的颁布标志着我国⽤药、制药以及监管⽔平的全⾯提升,将促进药品质量的整体提⾼,对于保障公众⽤药安全有效意义重⼤。
《中国药典》2015年版进⼀步扩⼤药品品种的收载和修订,共收载品种5608种。
其中,⼀部收载品种2598种,⼆部收载品种2603种,三部收载品种137种。
本版药典是将三部药典的附录合⼀,加强共性的系统化、完善化及规范化,新版《中国药典》的附录调整为凡例、通则与⽅法、指导原则、药⽤辅料等单独成卷,为第四部。
第四部的名称为“《中国药典》2015 年版总则”,包括现有药典⼀部、⼆部、三部的附录(现改为“通则”)内容和药⽤辅料品种正⽂。
⼀、《中国药典》2015 年版总则(四部)项⽬组成:1、前⾔2、第⼗届药典委员会委员名单3、⽬录4、中国药典沿⾰5、品种及通则变化名单6、凡例(三部合⼀)7、品名⽬次(保留笔画索引,品种正⽂拟改为按拼⾳排序)8、通则(原药典附录内容):包括导引图、制剂通则、通⽤⽅法/检测⽅法及指导原则9、附表:包括原⼦量表、国际单位换算表及新旧附录/通则编码对照表10、药⽤辅料品种正⽂(原收载于药典⼆部正⽂品种第⼆部分)11、总索引(中英⽂索引)⼆、修订说明1、使分类更加清晰明确,药典标准更加系统化、规范化将上⼀版药典中中药、化学药、⽣物制品三部分别收载的附录(凡例、制剂通则、分析⽅法、指导原则、药⽤辅料等)三合⼀,独⽴成卷作为第四部。
2015年一部全部价格
00 6.50 4.00 2.80 1.20 12.60 5.00 6.50 6.00 4.20 5.80 2.60 6.50 5.70 45.00 8.00 17.00 7.60 6.00 7.80 4.80 3.40 1.40 15.10 6.00 7.80 7.20 5.00 7.00 3.40 7.80 6.80 54.00 9.00 50.00 16.00 12.00 15.00 10.00 7.00 5.00 30.00 12.00 16.00 14.20 10.00 14.00 8.40 16.00 14.00 138.00 18.00 68.00 28.00 24.00 28.00 18.00 14.00 10.00 58.00 20.00 29.00 28.00 18.00 28.00 16.80 29.00 28.00 198.00 36.00
生产厂家
延边 延边 延边 延边 延边 延边 延边 延边 力源 力源 延边 延边 延边 延边 力源 力源 延边 力源 延边 延边 延边
规格
60片/瓶×200盒 10ml×12支×50盒 11g×10袋×60包 10g×20袋×60包 5g×10袋×100盒 复方×12片×400盒 复方×12片×400盒 10ml×10支×60盒 0.45g×24粒×200盒 0.4g×24片×200盒 0.37g×36片×200盒 0.4g×24片×200盒 0.4g×36片×200盒 0.2g×14片×400盒 0.58g×24片×200盒 0.35g×24粒×200盒 10ml×10支×60盒 0.5g×24粒×200盒 24粒×200盒 0.25g×24粒×200盒 0.5g×24粒×200盒
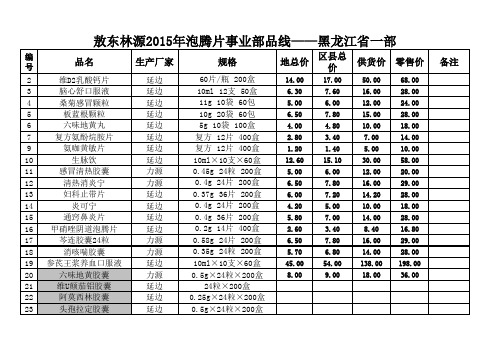
敖东林源2015年泡腾片事业部品线——黑龙江省一部
阿仑膦酸钠片药典标准(2015)

中国药典2015年版谱柱);检测器为电导检测器,检测方式为抑制电导检测,柱温30"C,以水为流动相A,50mmol/L氢氧化钾溶液为流动相B,按下表进行梯度洗脱,流速为每分钟1.0ml。
适当调整梯度,使磷酸盐峰的保留时间约为6分钟,亚磷酸盐峰的保留时间约为19分钟,磷酸盐峰、亚磷酸盐峰与相邻杂质峰之间的分离度均应符合要求。
精密量取供试品溶液与对照品溶液各20^1,分别注人离子色谱仪,记录色谱图。
按外标法以峰面积计,并折算为磷酸盐与亚磷酸盐的量,均不得过 0. 5%。
时间(分钟)流动相M%)流动相B(%)08515785157 1742619. 0742619 1010025. 0010025. 185153585154-氨基丁酸取本品,加水溶解并定量稀释制成每lml 中约含lO m g的溶液,作为供试品溶液;另取4-氨基丁酸对照品,加水溶解并定量稀释制成每l m l中约含0. 05mg的溶液,作为对照品溶液。
照薄层色谱法(通则0502)试验,吸取上述两种溶液各5卩1,分别点于同一硅胶G薄层板上,以水-冰醋酸-正丁醇(2:2:6)为展开剂,展开至15cm以上,取出,晾干,喷以茚三酮溶液[称取茚三酮约0.2g,加稀醋酸(冰醋酸12g,加水至100ml,摇匀)-正丁醇(5:95)的混合溶液100ml 使溶解],置105°C加热15分钟,立即检视。
供试品溶液如显与对照品溶液相应的杂质斑点,其颜色与对照品溶液的主斑点比较,不得更深(0.5%)。
干燥失重取本品,在150a C干燥至恒重,减失重量应为16. 1%〜17. 1%(通则 0831)。
重金属取本品l.O g,依法检查(通则0821第三法),含重金属不得过百万分之十。
【含量测定】取本品约0.6g,精密称定,加新沸过的冷水75ml,温热使溶解,放冷,照电位滴定法(通则0701),用氢氧化钠滴定液(0. lm o l/L)滴定。
每l m l的氢氧化钠滴定液(0. lm o l/U相当于 27. llm g的 C4H12NNa07Pz0【类别】抗骨质疏松药D【贮藏】密封保存。
片剂脆碎度通则-2015药典

筛 分 法 一 般 分 为 手 动 筛 分 法 、机械筛分法与空气喷射
筛 分 法 。手动筛分法和机械筛分法适用于测定大部分粒径 大 于 7 5 p m 的 样 品 。对 于 粒 径 小 于 75/^111的 样 品 ,则应采
用空气喷射筛分法或其他适宜的方法。
机 械 筛 分 法 系 采 用 机 械 方 法 或 电 磁 方 法,产生垂直振 动 、水平圆周运 动、拍 打 、拍 打 与 水 平圆周运 动 相结 合等
1. 手动筛分法 (1) 单 筛 分 法 称 取 各 品 种 项 下 规 定 的 供 试 品 ,置规
定 号 的 药 筛 中 (筛 下 配 有 密 合 的 接 收 容 器 ),筛 上 加 盖 。 按 水 平 方 向 旋 转 振 摇 至 少 3 分 钟 ,并不时在垂直方向轻叩
筛 。取 筛 下 的 颗 粒 及 粉 末 ,称 定 重 量 ,计 算 其 所 占 比
标示装量 以上
不少于 标示装量 的 97%
不少于 标示装量
不少于标示 装 量 的 97%
【附 注 】 对 于 以 容 量 计 的 小 规 格 标 示 装 量 制 剂 ,可改 用重量法或按品种项下的规定方法检查。
平 均 装 量 与 每 个 容 器 装 量 (按 标 示 装 量 计 算 百 分 率 ), 取三位有效数字进行结果判断。
片 全 部 视 野 ,应 无 凝 聚 现 象 ,并不得检出该剂型或各品种 项 下 规 定 的 5 0 p m 及 以 上 的 粒 子 。再 在 200〜 50 0 倍的显
微镜下检视该剂型或各品种项下规定的视野内的总粒数及
规 定 大 小 的 粒 数 ,并 计 算 其 所 占 比 例 (% ) 。 第 二 法 (筛 分 法 >
分 钟 。取不能通过大孔径筛和能通过小孔径筛的颗粒及粉
尼群地平片 2015年版 检验标准

【类别】同尼群地平。
【规格】10mg
【贮藏】遮光,密封保存。
其他应符合片剂项下有关的各项规定(通则0101)。
【含量测定】照高效液相色谱法(通则0512)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-水(20:24:56)为流动相;检测波长为237nm。理论板数按尼群地平峰计算不低于3000,尼群地平峰与相邻杂质峰的分离度应符合要求。
(4)避光操作。取本品(约相当于尼群地平100mg),研细,加丙酮10ml,振摇使溶解,滤过,滤液暗处挥干,残渣经减压干燥,依法测定。本品的红外光吸收图谱应与对照的图谱(光谱集600图)一致。
【检查】有关物质避光操作。取含量测定项下的细粉,精密称取适量(约相当于尼群地平50mg),置50ml量瓶中,加四氢呋喃12ml,振摇10分钟,再加溶剂[乙腈-水(20:56)混合溶液]适量,振摇使尼群地平溶解并稀释至刻度,摇匀,用0.45μm滤膜滤过,取续滤液作为供试品溶液;另取杂质I对照品,精密称定,加四氢呋喃适量使溶解,用溶剂定量稀释制成每1ml中约含0.1mg的溶液,精密量取1ml,置100ml量瓶中,精密加入供试品溶液1ml,用流动相稀释至刻度,摇匀,作为对照溶液。照尼群地平有关物质项下的方法测定。供试品溶液的色谱图中如有与杂质I峰保留时间一致的色谱峰,按外标法以峰面积计算,不得大于尼群地平标示量的0.1%;其他单个杂质峰面积不得大于对照溶液中尼群地平峰面积(1.0%),其他杂质峰面积的和不得大于对照溶液中尼群地平峰面积的2.5倍(2.5%)。
2015年黑龙江省公立医院药品集中采购目录(第二批)修订版(1)

普通粉针剂 注射用炎琥宁 24 炎琥宁 第 2 页
160mg 200mg
普通粉针剂 注射用炎琥宁 24 炎琥宁 冻干粉针剂 400mg 40mg 80mg 160mg 200mg 2ml:40mg 5ml:80mg 10ml:200mg 10ug 5ug
炎琥宁注射液 25 前列地尔干乳剂 注射用前列地尔干乳剂
注射液 干乳剂
第 3 页
注射液 冻干粉针剂 冻干粉针剂 普通粉针剂 冻干粉针剂
10ml 0.625g(0.5g/0.125g) 1.25g(1.0g/0.25g) 2.5g(2.0g/0.5g) 0.625g(0.5g/0.125g) 1.25g(1.0g/0.25g) 2.5g(2.0g/0.5g) 0.625g(0.5g/0.125g) 1.25g(1.0g/0.25g) 2.5g(2.0g/0.5g) 0.25g:5ml 0.5g:5ml 0.5g:10ml 100ml:0.25g 100ml:0.5g 250ml:0.5g 0.25g 0.25g 0.5g 1.0g 0.5g 1.0g 0.25g 0.5g 1.0g 300mg 600mg 900mg 1.0g 1.2g 2ml:15mg 4ml:30mg 50ml:7.5mg 50ml:15mg 50ml:30mg 100ml:15mg 100ml:30mg 15mg 30mg 15mg 30mg 1ml:1mg 1ml:10mg 1mg 10mg 80mg:76mg 40mg:38mg 1ml:20mg 2ml:40mg 4ml:80mg 5ml:30mg 10ml :60mg 16.7ml:100mg 25ml:150mg 30mg 100mg 0.5g 1.0g 0.5g 1.0g 40mg 80mg
片剂的崩解时限

片剂的崩解时限一、定义片剂是指以固体、粉末或颗粒为原料,通过压片工艺制成的剂型。
片剂的崩解时限是指片剂在给定测试条件下从外观上完全崩解的时间。
二、作用片剂的崩解时限是评定片剂药物释放速度和吸收特性的一个重要指标。
如果片剂崩解时间过长,则片剂释放药物的速度也会变慢,不利于药物的吸收。
三、相关法规1.中国药典2015版卷三《片剂》(指标性质):在水中完全崩解,应在规定时间内崩解(10min)。
2.美国药典2015版《片剂》(一般章程):-所有片剂在酸性介质和缓冲介质中至少在30分钟内崩解。
-所有片剂在强酸性介质中至少在45分钟内崩解。
-所有片剂在弱酸性介质(pH为5.0-7.0)中至少在60分钟内崩解。
四、测试方法1.中国药典方法:将片剂置于100ml的模拟胃液( pH=1.2, 37±2℃)中,时限10min;或将片剂置于900ml的模拟胆汁液(pH=6.8, 37±2℃)中,时限30min。
2.美国药典方法:将片剂置于1000ml的介质中(酸性介质pH=1.2,弱酸性介质pH为5.0-7.0,缓冲介质pH=6.8),时限均为30min。
五、影响因素片剂崩解时限受到多种因素影响,如:1.原料特性:原料的粉末特性(如粒度、密度、流动性等)会影响片剂的崩解时间。
2.配方特性:配方中的助剂种类和比例,尤其是增塑剂、润滑剂等,也会影响片剂的崩解时间。
3.制备工艺:片剂的成型工艺参数,如压片压力、速度、温度和湿度等均可以影响片剂的崩解时间。
4.贮存条件:片剂在不同的贮存条件下(如温度、湿度、光照等)也会产生不同程度的变化,这些变化可能会引起片剂的崩解时间变化。
六、总结片剂崩解时限是片剂的一个重要品质指标,对评估其药效具有重要作用。
片剂的崩解时限受到多种因素影响,包括原料、配方、制备工艺和贮存条件等。
制剂厂应当根据不同药物的特性,合理设计制剂并进行合适的测试,保证片剂的质量与安全性。
2015版药典片剂

0101 片剂片剂系指原料药物或与适宜的辅料制成的圆形或异形的片状固体制剂。
中药片剂的原料药物,可以是全粉、浸膏、半浸膏、有效部位、有效成分等。
片剂以口服普通片为主,另有含片、舌下片、口腔贴片、咀嚼片、分散片、 可溶片、泡腾片、阴道片、阴道泡腾片、缓释片、控释片、肠溶片与口崩片等。
含片 系指含于口腔中缓慢溶化产生局部或全身作用的片剂。
含片中的药物一般是易溶性的,主要起局部消炎、杀菌、收敛、止痛或局部 麻醉等作用。
舌下片 剂。
舌下片中的药物应易于直接吸收,主要适用于急症的治疗。
口腔贴片 系指粘贴于口腔,经黏膜吸收后起局部或全身作用的片剂。
系指置于舌下能迅速溶化, 药物经舌下黏膜吸收发挥全身作用的片口腔贴片应进行溶出度或释放度检查。
咀嚼片 系指于口腔中咀嚼后吞服的片剂。
咀嚼片一般应选择甘露醇、山梨醇、蔗糖等水溶性辅料作填充剂和黏合剂。
咀嚼片的硬度应适宜。
分散片 系指在水中能迅速崩解并均匀分散的片剂。
分散片中的药物应是难溶性的。
分散片可加水分散后口服,也可将分散片含 于口中吮服或吞服。
分散片应进行溶出度和分散均匀性检查。
可溶片 系指临用前能溶解于水的非包衣片或薄膜包衣片剂。
可溶片应溶解于水中,溶液可呈轻微乳光。
可供口服、外用、含漱等用。
泡腾片 系指含有碳酸氢钠和有机酸,遇水可产生气体而呈泡腾状的片剂。
泡腾片中的药物应是易溶性的,加水产生气泡后应能溶解。
有机酸一般用枸 橼酸、酒石酸、富马酸等。
阴道片与阴道泡腾片 系指置于阴道内使用的片剂。
阴道片和阴道泡腾片的形状应易置于阴道内, 可借助器具将阴道片送入阴道。
阴道片在阴道内应易溶化、 溶散或融化、崩解并释放药物,主要起局部消炎杀菌作用,也可给予性激素类药 物。
具有局部刺激性的药物,不得制成阴道片。
阴道片应进行融变时限检查 (通则 0922) 。
阴道泡腾片还应进行发泡量检查。
缓释片 系指在规定的释放介质中缓慢地非恒速释放药物的片剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0101 片剂
片剂系指原料药物或与适宜的辅料制成的圆形或异形的片状固体制剂。
中药还有浸膏片、半浸膏片和全粉片等。
片剂以口服普通片为主,另有含片、舌下片、口腔贴片、咀嚼片、分散片、 可溶片、泡腾片、阴道片、阴道泡腾片、缓释片、控释片、肠溶片与口崩片等。
含片 系指含于口腔中缓慢溶化产生局部或全身作用的片剂。
含片中的药物一般是易溶性的,主要起局部消炎、杀菌、收敛、止痛或局部 麻醉等作用。
舌下片 剂。
舌下片中的药物应易于直接吸收,主要适用于急症的治疗。
口腔贴片 系指粘贴于口腔,经黏膜吸收后起局部或全身作用的片剂。
系指置于舌下能迅速溶化, 药物经舌下黏膜吸收发挥全身作用的片
口腔贴片应进行溶出度(通则 0931)或释放度(通则 0931)检查。
咀嚼片 系指于口腔中咀嚼后吞服的片剂。
咀嚼片一般应选择甘露醇、山梨醇、蔗糖等水溶性辅料作填充剂和黏合剂。
咀嚼片的硬度应适宜。
分散片 系指在水中能迅速崩解并均匀分散的片剂。
分散片中的药物应是难溶性的。
分散片可加水分散后口服,也可将分散片含 于口中吮服或吞服。
分散片应进行溶出度(通则 0931)和分散均匀性检查。
可溶片 系指临用前能溶解于水的非包衣片或薄膜包衣片剂。
可溶片应溶解于水中,溶液可呈轻微乳光。
可供口服、外用、含漱等用。
泡腾片 系指含有碳酸氢钠和有机酸,遇水可产生气体而呈泡腾状的片剂。
泡腾片中的药物应是易溶性的,加水产生气泡后应能溶解。
有机酸一般用枸 橼酸、酒石酸、富马酸等。
阴道片与阴道泡腾片 系指置于阴道内使用的片剂。
阴道片和阴道泡腾片的
形状应易置于阴道内, 可借助器具将阴道片送入阴道。
阴道片在阴道内应易溶化、 溶散或融化、崩解并释放药物,主要起局部消炎杀菌作用,也可给予性激素类药
物。
具有局部刺激性的药物,不得制成阴道片。
阴道片应进行融变时限检查 (通则 0922) 。
阴道泡腾片还应进行发泡量检查。
缓释片 系指在规定的释放介质中缓慢地非恒速释放药物的片剂。
缓释片应
符合缓释制剂的有关要求(通则 9013)并应进行释放度(通则 0931)检查。
控释片 系指在规定的释放介质中缓慢地恒速释放药物的片剂。
控释片应符
合控释制剂的有关要求(通则 9013)并应进行释放度(通则 0931)检查。
肠溶片 系指用肠溶性包衣材料进行包衣的片剂。
为防止药物在胃内分解失效、对胃的刺激或控制药物在肠道内定位释放,可 对片剂包肠溶衣;为治疗结肠部位疾病等,可对片剂包结肠定位肠溶衣。
肠溶片除另有规定外,应进行释放度(通则 0931)检查。
口崩片 系指在口腔内不需要用水即能迅速崩解或溶解的片剂。
一般适合于小剂量药物,常用于吞咽困难或不配合服药的患者。
可采用直接 压片和冷冻干燥法制备。
口崩片应在口腔内迅速崩解或溶解、口感良好、容易吞咽,对口腔黏膜无刺 激性。
除冷冻干燥法制备的口崩片外,口崩片应进行崩解时限检查(通则 0921) 。
对于难溶性药物制成的口崩片,还应进行溶出度检查(通则 0931) ,对于经肠溶 材料包衣的颗粒制成的口崩片,还应进行释放度检查(通则 0931) 。
采用冷冻干燥法制备的口崩片可不进行片剂脆碎度检查。
片剂在生产与贮藏期间应符合下列规定。
一、原料药物与辅料应混合均匀。
含药量小或含毒、剧药物的片剂,应根据 药物的性质采用适宜方法使药物分散均匀。
二、凡属挥发性或对光、热不稳定的药物,在制片过程中应采取遮光、避热 等适宜方法,以避免成分损失或失效。
三、压片前的物料、颗粒或半成品应控制水分,以适应制片工艺的需要,防 止片剂在贮存期间发霉、变质。
四、 根据依从性需要片剂中可加入矫味剂、 芳香剂和着色剂等, 一般指含片、 口腔贴片、咀嚼片、分散片、泡腾片等。
五、为增加稳定性、掩盖药物不良臭味、改善片剂外观等,可对制成的药片
包糖衣或薄膜衣。
对一些遇胃液易破坏、刺激胃黏膜或需要在肠道内释放的口服 药片,可包肠溶衣。
必要时,薄膜包衣片剂应检查残留溶剂。
六、片剂外观应完整光洁,色泽均匀,有适宜的硬度和耐磨性,以免包装、 运输过程中发生磨损或破碎,除另有规定外,非包衣片应符合片剂脆碎度检查法 (通则 0923)的要求。
七、片剂的微生物限度应符合要求。
八、根据原料药物和制剂的特性,除来源于动、植物多组分且难于建立测定 方法的片剂外,溶出度、释放度、含量均匀度等应符合要求。
九、除另有规定外,片剂应密封贮存。
生物制品应在 2-8℃保存和运输。
生 物制品原液、半成品和成品的生产及质量控制应符合相关品种要求。
除另有规定外,片剂应进行以下相应检查。
【重量差异】照下述方法检查,应符合规定。
检查法 取供试品 20 片,精密称定总重量,求得平均片重后,再分别精密
称定每片的重量,每片重量与平均片重比较(凡无含量测定的片剂或有标示片重 的中药片剂,每片重量应与标示片重比较) ,按表中的规定,超出重量差异限度 的不得多于 2 片,并不得有 1 片超出限度 1 倍。
平均片重或标示片重 0.30g 以下 0.30g 及 0.30g 以上 重量差异限度 ±7.5% ±5%
糖衣片的片心应检查重量差异并符合规定,包糖衣后不再检查重量差异。
薄 膜衣片应在包薄膜衣后检查重量差异并符合规定。
凡规定检查含量均匀度的片剂,一般不再进行重量差异检查。
【崩解时限】除另有规定外,照崩解时限检查法(通则 0921)检查,应符 合规定。
含片的溶化性照崩解时限检查法(通则 0921)检查,应符合规定。
舌下片照崩解时限检查法(通则 0921)检查,应符合规定。
阴道片照融变时限检查法(通则 0922)检查,应符合规定。
口崩片照崩解时限检查法(通则 0921)检查,应符合规定。
咀嚼片不进行 崩解时限检查。
凡规定检查溶出度、释放度的片剂,一般不再进行崩解时限检查。
【发泡量】阴道泡腾片照下述方法检查,应符合规定。
检查法 除另有规定外,取 25ml 具塞刻度试管(内径 1.5cm,若片剂直径
较大,内径可改为 2.0cm)10 支,按表中规定加水一定量,置 37℃±1℃水浴中 5 分钟,各管中分别投入供试品 1 片,20 分钟内观察最大发泡量的体积,平均发 泡体积不得少于 6ml,且少于 4ml 的不得超过 2 片。
平均片重 1.5g 及 1.5g 以下 1.5g 以上 加水量 2.0ml 4.0ml
【分散均匀性】分散片照下述方法检查,应符合规定。
检查法 采用崩解时限检查装置,不锈钢丝网的筛孔内径为 710um,水温
为 15~25℃;取供试品 6 片,应在 3 分钟内全部崩解并通过筛网。
【微生物限度】以动物、植物、矿物来源的非单体成分制成的片剂,生物制 品片剂,以及粘膜或皮肤炎症或腔道等局部用片剂(如口腔贴片、外用可溶片、 阴道片、 阴道泡腾片) , 照非无菌产品微生物限度检查: 微生物计数法 (通则 1105) 和控制菌检查法(通则 1106)及非无菌药品微生物限度标准(通则 1107)检查, 应符合规定。
生物制品规定检查杂菌的片剂,可不进行微生物限度检查。
。
