HPLC法测定左亚叶酸钙中的右旋异构体
高效液相色谱法测定磷酸左奥硝唑酯二钠中异构体的含量

高效液相色谱法测定磷酸左奥硝唑酯二钠中异构体的含量【摘要】目的:探讨测定磷酸左奥硝唑酯二钠异构体含量的方法。
方法:采用高效液相色谱法。
色谱柱:ULTRON ES-OVM (150mm×4.6mm,5μm),SHINWA CHEMICAL INDUSTRIES.LTD;流动相:以0.02 mol·L-1磷酸盐缓冲液(pH值为3.0)-甲醇(65:35);流速为每分钟1ml;检测波长为321nm;柱温:25℃。
结果:该方法专属性强,在较大范围内线性关系良好,精密度高,RSD为2.1%。
结论:高效液相色谱法可用于测定磷酸左奥硝唑酯二钠原料中异构体的含量。
【关键词】磷酸左奥硝唑酯二钠;异构体;高效液相色谱法磷酸左奥硝唑酯二钠为我公司研发的化学1.1类新药,在体内可以迅速分解为有效成分左旋奥硝唑而起到抗厌氧菌的作用。
本品作为一种手性药物,为有效监控检查其中的异构体杂质,需建立一种完善的异构体测定方法。
迄今为止,尚未见磷酸左奥硝唑酯二钠异构体的含量方法的相关报道,鉴于此,我们研究开发了高效液相色谱法测定磷酸左奥硝唑酯二钠异构体含量的方法,旨在寻找一种更加科学合理的异构体杂质的控制方法。
1.仪器与试药仪器:美国 Thermo U3000高效液相色谱仪, 包括 U3000四元泵, U3000可变检测波长, U3000柱温箱,U3000自动进样器。
试药:磷酸左奥硝唑酯二钠,由华创合成制药股份有限公司提供。
对照品:磷酸左奥硝唑酯二钠,由华创合成制药股份有限公司提供。
异构体杂质对照:磷酸右奥硝唑酯二钠,由华创合成制药股份有限公司提供。
甲醇为色谱纯,其他试剂均为分析纯。
2.方法与结果2.1方法选择高效液相色谱法,由于HPLC方法具有较好的灵敏度及较强的专属性,故建立HPLC方法测定本品的右旋异构体杂质的含量。
2.2检测波长的选择选择磷酸左奥硝唑酯二钠的最大吸收波长321nm作为异构体检测波长。
2.3色谱柱的选择磷酸左奥硝唑酯二钠结构中含强极性的磷酯基团,使得其手性分离较难,目前常用的纤维素类衍生物、淀粉衍生物类型的色谱柱难以对其作出有效分离。
高效液相色谱法测定亚叶酸钙含量的不同色谱柱筛选
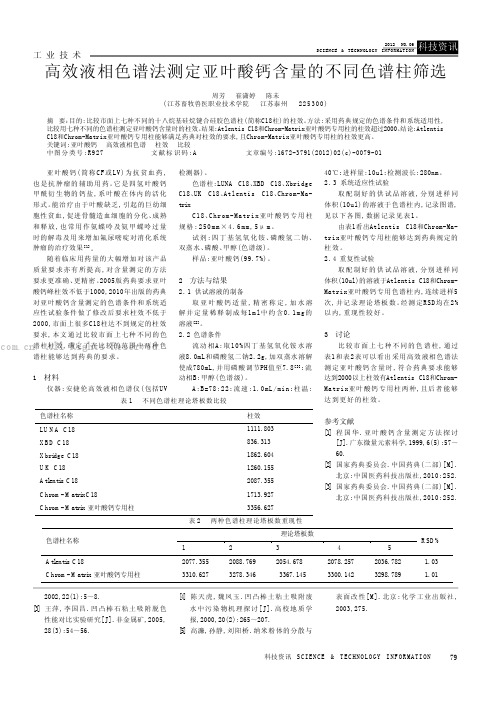
79科技资讯 S CI EN CE & T EC HNO LO GY I NF OR MA TI ON 工 业 技 术亚叶酸钙(简称CF 或LV)为抗贫血药,也是抗肿瘤的辅助用药。
它是四氢叶酸钙甲酰衍生物的钙盐,系叶酸在体内的活化形式。
能治疗由于叶酸缺乏,引起的巨幼细胞性贫血,促进骨髓造血细胞的分化、成熟和释放,也常用作氨蝶呤及氨甲蝶呤过量时的解毒及用来增加氟尿嘧啶对消化系统肿瘤的治疗效果[1]。
随着临床用药量的大幅增加对该产品质量要求亦有所提高,对含量测定的方法要求更准确、更精密。
2005版药典要求亚叶酸钙峰柱效不低于1000,2010年出版的药典对亚叶酸钙含量测定的色谱条件和系统适应性试验条件做了修改后要求柱效不低于2000,市面上很多C18柱达不到规定的柱效要求,本文通过比较市面上七种不同的色谱柱柱效,确定了在比较的范围中两种色谱柱能够达到药典的要求。
1 材料仪器:安捷伦高效液相色谱仪(包括UV检测器)。
色谱柱:LUNA C18、XBD C18、Xbridge C18、UK C18、Atlentis C18、Chrom-Ma-trixC18、Chrom-Matrix亚叶酸钙专用柱规格:250m m ×4.6mm ,5μm 。
试剂:四丁基氢氧化铵、磷酸氢二钠、双蒸水、磷酸、甲醇(色谱级)。
样品:亚叶酸钙(99.7%)。
2 方法与结果2.1供试溶液的制备取亚叶酸钙适量,精密称定,加水溶解并定量稀释制成每1m l中约含0.1m g的溶液[2]。
2.2色谱条件流动相A:取10%四丁基氢氧化铵水溶液8.0mL和磷酸氢二钠2.2g,加双蒸水溶解使成780mL,并用磷酸调节PH值至7.8[3];流动相B:甲醇(色谱级)。
A:B=78:22;流速:1.0mL/min;柱温:40℃;进样量:10ul;检测波长:280nm。
2.3系统适应性试验取配制好的供试品溶液,分别进样同体积(10ul)的溶液于色谱柱内,记录图谱,见以下各图,数据记录见表1。
左亚叶酸钙

劣 势
亚叶酸钙已经在临床广 泛应用 机 临床需要更精准/更能 会 提高病人生活质量的药 物。
威 胁
同类产品竞争激烈,亚 叶酸钙价格优势 肿瘤患者治疗受费用限 制。
适应症推荐
用于5-FU化疗的增效药及MTX(甲氨喋呤)过量 或大剂量治疗的解救剂。
用法用量
左亚叶酸钙100mg加入生理盐水100ml中静脉 点滴1小时,之后予以5-FU375-425mg/m2静脉 点滴4-6小时。
总 结
注射用左亚叶酸钙,更合理的左旋结构,将治疗 价值提升至更高; 注射用左亚叶酸钙联合5-FU的化疗方案,疗效确 切,总有效率更高; 注射用左亚叶酸钙,使用更安全,不良反应发生 率较少,严重程度较低; 注射用左亚叶酸钙,更完美的减毒增效剂。
常见问题汇总
1. 左亚叶酸钙比亚叶酸钙有何优势?
2. 左亚叶酸钙推荐的临床适应症是什么?
注射用左亚叶酸钙,更合理的左旋 结构,将治疗价值提升至最高。
同奥欣®(注射用左亚叶酸钙) 隆重上市!
注射用左亚叶酸钙的药代动力学
试验设计:经SFDA批准的开放、随机、交叉(3*3) 的临床研究
试验单位:湖南省肿瘤医院国家药品临床研究基地
试验结论:健康成年志愿志在单剂量多次滴注100300mg注射用左亚叶酸钙后,血药浓度与给药剂量 呈线性关系。
左亚叶酸钙(L-LV)是亚叶酸钙的药学活性异构体,几
乎具有亚叶酸钙的所有药理学活性。
L-LV向细胞的转运能力高于亚叶酸,能更好增强5 -FU 的抗肿瘤活性,具有药效和安全性方面的优势。
叶酸在肝脏和骨髓转换为亚叶酸才能起作用,而L-LV
是亚叶酸的活性形式。 无论静推还是静注,血浆L-LV的T1/2为 0.5h,LV为67h,且L-LV分布容积远高于亚叶酸。
高效液相色谱法测定叶酸片的含量

高效液相色谱法测定叶酸片的含量高效液相色谱法测定叶酸片的含量【摘要】叶酸是由喋呤啶、对氨基苯甲酸和谷氨酸等组成的化合物,是一种水溶性B族维生素,相当于蝶酰谷氨酸。
固定相为:依利特hypersil BDSC18 色谱柱(4.6*250*5u ),乙腈-甲醇-水-冰醋酸(25:10:65∶0.1)为流动相,检测波长为254nm;叶酸在20~280μg·mL-1范围内呈良好的线性关系。
叶酸的平均回收率为99.3%。
本法简便、重现性好、回收率高,可用于叶酸片中叶酸的含量测定。
【关键词】叶酸片;叶酸;测定叶酸是由喋呤啶、对氨基苯甲酸和谷氨酸等组成的化合物,是一种水溶性B 族维生素,相当于蝶酰谷氨酸[1-2]。
叶酸从菠菜叶中提取纯化的,故而命名为叶酸。
叶酸对孕妇尤其重要。
叶酸用于预防胎儿神经管畸形,准妈妈在备孕期间就服用0.4毫克叶酸可以下降胎儿神经管畸形率85%[3-4]。
如在怀孕头3个月内缺乏叶酸,可导致胎儿神经管发育缺陷,从而增加裂脑儿,无脑儿的发生率。
人类如缺乏叶酸可引起巨红细胞性贫血以及白细胞减少症,还会导致身体无力、易怒、没胃口以及精神病症状[5-7]。
本文用高效液相法对叶酸片中的叶酸的进行了含量测定。
1.仪器与试药1.1仪器LC-100(梯度配置)高效液相色谱仪(上海伍丰科学仪器有限公司);CO-1000型色谱柱温箱(武汉恒信世纪科技有限公司);制冷和加热循环槽(上海汗诺仪器有限公司);UV-1800紫外/可见分光光度计(上海美谱达仪器有限公司);ELGA超纯水器(上海澜锐仪器科技有限公司);ABS 220-4分析天平(德祥科技有限公司);3升基本型超声波清洗器(天津市瑞普电子仪器公司);TΜ-1901 双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2试药乙腈(杭州兴成化工有限公司)、磷酸(江西省新干县金成化工厂)、盐酸(襄樊金译成精细化工有限公司)、磷酸氢二铵(淄博市淄川区鑫川化工厂)、冰醋酸(吴江市龙申化工有限公司)、甲醇(江西省新干县金成化工厂)、冰乙酸(杭州兴成化工有限公司)、四氢呋喃(吴江市龙申化工有限公司)。
一种快速测定注射用亚叶酸钙中亚叶酸钙含量的方法

一种快速测定注射用亚叶酸钙中亚叶酸钙含量的方法王春怡;任亚东【摘要】目的建立紫外-可见分光光度法测定注射用亚叶酸钙中间体亚叶酸钙含量的方法.方法采用UV法测定亚叶酸钙含量,检测波长为282 nm,并对UV法与HPLC法测定结果进行比较.结果亚叶酸钙质量浓度在1.0~10.0μg·mL-1范围内与吸光度呈良好的线性关系,r=0.999 9,平均回收率为99.87%,RSD为0.87%.UV 法与HPLC法在测定同一批注射用亚叶酸钙样品时,两者差异无统计学意义(P>0.05).结论该方法操作简便、快速、准确,可用于亚叶酸钙中间体质量控制.%Objective To establish ultraviolet spectrometry method to determine the intermediate for calcium folinate injection. Methods Ultraviolet spectrometry was applied with 282 nm detection wavelength, and the determination results with UV and HPLC methods were compared and analyzed. Results The calibration curve of calciun folinate was in a good linearity within the range of 1.0 - 10.0 μg · mL-1 ,and the average recovery was 99. 87% with RSD of 0. 87%. No significant difference was observed between the determination results with UV and HPLC methods ( P > 0. 05 ). Conclusion This method is convenient,rapid and accurate,and can be used in quality control of calcium folinate intermediate for injection.【期刊名称】《广东药学院学报》【年(卷),期】2011(027)002【总页数】3页(P154-156)【关键词】注射用亚叶酸钙;亚叶酸钙;UV法【作者】王春怡;任亚东【作者单位】广州中医药大学中药学院,广东,广州,510006;扬子江药业集团,广东,广州,510663【正文语种】中文【中图分类】R927.1注射用亚叶酸钙为亚叶酸钙的无菌冻干品,为类白色至黄色的疏松块状物或粉末,主要成分为亚叶酸钙,常用作氨蝶呤及氨甲蝶呤过量时的解毒剂,具有对抗叶酸拮抗剂(如氨甲蝶呤、乙胺嘧啶和甲氧苄氨嘧啶等药)毒性作用。
右旋佐匹克隆中手性杂质含量测定的方法学研究

右旋佐匹克隆中手性杂质含量测定的方法学研究
王国成;杨芳;杨丽萍;郭立民
【期刊名称】《沈阳药科大学学报》
【年(卷),期】2004(21)2
【摘要】目的建立右旋佐匹克隆中手性杂质含量的测定方法。
方法RP HPLC法 ,色谱柱为CHI RALCELOD R( 2 5 0mm× 4 6mm ,5 μm) ;流动相为乙腈磷酸氢二钠缓冲液( pH =6 5 ,V∶V =5 0∶5 0 ) ;流速0 6mL·min-1;检测波长为 3 0 5nm ;柱温3 5℃。
结果右旋佐匹克隆质量浓度在 0 5~8 0mg·L-1内 ,线性关系良好(r=0 9998)。
结论可用于右旋佐匹克隆中手性杂质的含量测定。
【总页数】3页(P124-125)
【关键词】右旋佐匹克隆;手性杂质;含量测定
【作者】王国成;杨芳;杨丽萍;郭立民
【作者单位】天津天士力集团化学制药研究所
【正文语种】中文
【中图分类】R94
【相关文献】
1.柱前手性衍生化-高效液相色谱法测定棉籽仁中左旋和右旋棉酚含量 [J], 何晓文;李新霞;姚军;张煌涛;薛海燕
2.固相萃取-手性气相色谱法测定醒脑静注射液中右旋龙脑和麝香酮的含量 [J], 张莉;陈飞;红玉;高展;孙玉侠;王家成;郭青
3.手性流动相添加剂法测定苯磺酸左旋氨氯地平片的含量及其右旋杂质 [J], 刘志辉
4.2种分析测定右旋苯醚菊酯原药中右旋体含量的方法比对研究 [J], 史卫莲;陈萍;孙春燕;张春妮
因版权原因,仅展示原文概要,查看原文内容请购买。
亚叶酸钙检验操作规程

亚叶酸钙检验操作规程
《亚叶酸钙检验操作规程》
一、实验目的
通过本次实验,掌握亚叶酸钙检验的操作方法,学习化学分析的基本原理和技能,提高实验操作的能力。
二、实验仪器与试剂
1. 仪器:pH计、天平、恒温槽等
2. 试剂:硝酸亚铁溶液、食盐溶液、硝酸铁溶液、硫代硫酸钠溶液、硫酸亚铁溶液、巯基乙酸、亲水树脂等
三、实验步骤
1. 取亚叶酸钙样品0.5g,加入试管中,用硝酸亚铁溶液溶解,再加入食盐溶液,定容至25ml。
2. 取一部分试液,空白对照用硝酸亚铁定容至25ml。
3. 两管试液中加入硝酸铁溶液,振荡混匀,再加入硫代硫酸钠和硫酸亚铁溶液。
4. 在试管中分别加入巯基乙酸,振荡混匀,过滤,收集滤液,测定pH值。
5. 将收集的滤液加入亲水树脂中,将树脂滴入的那部分液体与另一部分用盐酸溶解的标准叶酸相对照,用紫外分光光度计分析。
四、实验注意事项
1. 实验操作过程中需要仔细,遵循实验规程,注意安全。
2. 实验中使用的仪器和试剂需要及时清洗清理,保持良好状态。
3. 实验中需要精确控制操作时间和温度,确保实验数据的准确性。
通过本次实验,不仅可以掌握亚叶酸钙检验的操作方法,还可以加深对化学分析原理和技能的理解,为今后的实验操作积累经验。
26723385_HPLC_法测定叶酸原料中光学异构体的含量

㊀基金项目:山东省重点研发计划(No.2018GSF118132)ꎻ∗同为通信作者㊀作者简介:赵琦ꎬ女ꎬ主管药师ꎬ研究方向:药学ꎬE-mail:828zhaoqi@163.com㊀通信作者:李永贵ꎬ男ꎬ高级工程师ꎬ研究方向:新药研发ꎬTel:135****2390ꎬE -mail:lyg-1230@163.comꎻ孙清ꎬ女ꎬ副主任药师ꎬ研究方向:化药质量研究ꎬTel:0531-88562292ꎬE-mail:1483476147@qq.comHPLC法测定叶酸原料中光学异构体的含量赵琦1ꎬ邹云红2ꎬ李永贵2∗ꎬ孙清2∗(1.山东省荣军总医院ꎬ山东济南250014ꎻ2.山东省药学科学院ꎬ山东省化学药物重点实验室ꎬ山东济南250101)摘要:目的㊀建立高效液相色谱(HPLC)法测定叶酸原料药中光学异构体(D-叶酸)的检测方法ꎮ方法㊀采用QN-AX手性色谱柱(4.6mmˑ150mmꎬ5μm)ꎬ甲醇-乙腈-乙酸-三乙胺(50ʒ50ʒ2ʒ3)为流动相ꎬ流速0.6mL min-1ꎬ检测波长280nmꎬ柱温35ħꎮ结果㊀D-叶酸与叶酸之间的分离度良好ꎬD-叶酸浓度在0.2497~1.9974μg mL-1范围内线性关系良好(R2=0.9998)ꎬ平均回收率为97.24%ꎬRSD为1.20%ꎮ结论㊀该方法简单㊁快速㊁专属性强ꎬ可用于叶酸原料中D-叶酸的检测ꎮ关键词:叶酸ꎻD-叶酸ꎻ异构体ꎻ高效液相色谱法ꎻ含量测定中图分类号:R927.2㊀文献标识码:A㊀文章编号:2095-5375(2022)03-0162-003doi:10.13506/j.cnki.jpr.2022.03.006DeterminationofopticalisomersinfolicacidbyHPLCZHAOQi1ꎬZOUYunhong2ꎬLIYonggui2∗ꎬSUNQing2∗(1.ShandongRongjunGeneralHospitalꎬJinan250014ꎬChinaꎻ2.ShandongProvincialKeyLaboratoryofBiomedicalPolymersꎬShandongAcademyofPharmaceuticalScienceꎬJinan250101ꎬChina)Abstract:Objective㊀ToestablishanHPLCmethodforthedeterminationoftheopticalisomer(D-folicacid)infolicacid.Methods㊀ThechromatographicseparationwasperformedonchiralchromatographycolumnQN-AX(4.6mmˑ150mmꎬ5μm).Themobilephasewasconsistedofmethanol-acetonitrile-aceticacid-triethylamine(50ʒ50ʒ2ʒ3)andtheflowratewas0.6mL min-1.Thedetectionwavelengthwas280nmandthecolumntemperaturewas35ħ.Results㊀TheseparationwasgoodbetweenD-folicacidandfolicacid.ThelinearrangofD-folicacidwas0.2497~1.9974mL min-1(R2=0.9998)andtheaveragerecoverywas97.24%ꎬwithRSDof1.20%.Conclusion㊀Themethodwassimpleꎬrapidandhighlyspecific.ItcanbeusedforthedeterminationofD-folicacidinfolicacid.Keywords:FolicacidꎻD-folicacidꎻOpticalisomersꎻHPLCꎻDetermination㊀㊀叶酸(folicacid)是B族维生素的一种ꎬ又称维生素B9㊁维生素Bc㊁维生素Mꎬ是一种抗贫血及预防新生儿出生缺陷的药物[1-3]ꎮ它集预防㊁治疗和保健于一身ꎬ是机体细胞生长和繁殖所必需的物质ꎬ在体内以四氢叶酸的形式起作用ꎬ参与嘌呤核酸和嘧啶核苷酸的合成和转化ꎮHouse等[4-9]对叶酸对妇女孕育生命及不良生育新生儿神经管畸形的发生方面做了研究ꎬ缺乏叶酸会引起神经缺陷㊁动脉硬化㊁高血压㊁心血管疾病甚至癌症等ꎮ叶酸由蝶啶环㊁对氨基苯甲酸和谷氨酸组成ꎬ分子中含有手性结构ꎬ存在光学异构体D-叶酸ꎮ药物的光学异构体在活性㊁代谢过程及药理毒理学方面与药物本身常常有显著差异ꎬ为提高药物活性㊁减小副作用ꎬ需要对药物中的光学异构体进行分离研究[10]ꎮ国家药品监督管理局药品审评中心发布的«第一批拟不推荐参比制剂化药品种药学研究技术要求»(征求意见稿)中明确要求对叶酸片(0.4mg)中光学异构体进行研究ꎬ但目前叶酸各国药典标准中ꎬ均未提供叶酸光学异构体D-叶酸的检测方法ꎮ本研究建立了高效液相色谱法测定叶酸中光学异构体D-叶酸的检测方法ꎬ弥补了药典缺陷ꎬ为药典标准提供补充ꎬ更好的控制叶酸质量ꎬ保证叶酸的用药安全[11-13]ꎮ1㊀仪器与试药1.1㊀仪器㊀高效液相色谱仪(岛津LC-20AT泵㊁SPD-M20A型PDA检测器)ꎻ分析天平(SartoriusBT125D)ꎻpH计(梅特勒SevenExcellence)ꎻ超纯水机(上海杲森仪器设备有限公司)ꎮ1.2㊀试药㊀D-叶酸对照品(KLSSstandards纯度:96.46%)ꎻ叶酸(河北冀衡集团有限公司)ꎻ甲醇(山东禹王实业有限公司ꎬ色谱纯)ꎻ乙腈(天津赛孚瑞科技有限公司ꎬ色谱纯)ꎻ三乙胺(天津大茂化学试剂厂ꎬ分析纯)ꎻ乙酸(天津市富宇精细化工有限公司ꎬ分析纯)ꎮ2㊀方法与结果2.1㊀色谱条件㊀色谱柱为大赛璐QN-AX手性色谱柱(4.6mmˑ150mmꎬ5μm)ꎻ流动相为甲醇-乙腈-乙酸-三乙胺(50ʒ50ʒ2ʒ3)ꎬ流速0.6mL min-1ꎻ检测波长为280nmꎬ柱温为35ħꎬ进样体积20μL[14]ꎮ2.2㊀样品制备㊀配样溶剂:3%三乙胺甲醇溶液ꎮD-叶酸对照品溶液:精密称取D-叶酸对照品约10mg置100mL量瓶中ꎬ加配样溶剂适量使溶解ꎬ用配样溶剂稀释至刻度ꎬ摇匀ꎬ作为D-叶酸储备液ꎮ精密量取D-叶酸储备液1mL置100mL量瓶中ꎬ加配样溶剂稀释至刻度ꎬ摇匀ꎬ作为对照品溶液ꎮ供试品溶液:精密称取叶酸约10mg置50mL量瓶中ꎬ加配样溶剂溶解并稀释至刻度ꎬ摇匀ꎮ2.3㊀专属性试验㊀分别取 2.2 项下配样溶剂㊁对照品溶液㊁供试品溶液各20μL注入液相色谱仪ꎬ记录色谱图及峰面积ꎮ结果表明ꎬ在本检测条件下ꎬ配样溶剂对D-叶酸测无干扰ꎬD-叶酸与叶酸分离良好ꎮ2.4㊀定量限与检测限㊀量取 2.2 项下对照品溶液ꎬ加配样溶剂稀释成不同浓度梯度的溶液ꎬ分别取20μL注入液相色谱仪ꎬ测得D-叶酸定量限为2.50ng(S/Nʈ10)ꎬ检测限为1.00ng(S/Nʈ3)ꎮ2.5㊀线性试验㊀量取 2.2 项下叶酸对照品储备液5mL置100mL量瓶中ꎬ用配样溶剂稀释至刻度ꎬ摇匀ꎬ作为线性储备液ꎮ分别精密量取线性储备液0.5㊁1.0㊁2.0㊁3.0㊁4.0mL置10mL量瓶中ꎬ用配样溶剂稀释至刻度ꎬ摇匀ꎬ作为线性溶液1~5ꎮ精密量取上述溶液各20μL注入液相色谱仪ꎬ记录色谱图及峰面积ꎮ以D-叶酸浓度C为横坐标ꎬD-叶酸峰面A.配样溶剂ꎻB.D-叶酸对照品溶液ꎻC.供试品溶液图1㊀专属性试验HPLC图谱积A为纵坐标做线性回归ꎬ求得回归方程Y=87137X-5179ꎬR2=0.9998ꎬ说明D-叶酸浓度在0.2497~1.9974μg mL-1浓度范围内线性关系良好ꎮ图2㊀D-叶酸峰面积与浓度线性关系图2.6㊀溶液稳定性试验㊀取 2.2 项下对照品溶液ꎬ分别于0㊁2㊁4㊁6㊁8㊁12㊁24h量取20μL注入液相色谱仪ꎬ记录色谱图及峰面积ꎮ结果D-叶酸平均峰面积为81122ꎬRSD为0.99%ꎬ说明D-叶酸对照品溶液24h内稳定ꎮ2.7㊀仪器精密度试验㊀量取 2.2 项下D-叶酸对照品溶液20μL注入液相色谱仪ꎬ连续进样6次ꎬ记录色谱图中D-叶酸峰面积Aꎬ结果D-叶酸平均峰面积为80277ꎬRSD为0.63%ꎬ表明仪器精密度良好ꎮ2.8㊀回收率试验㊀精密量取 2.2 项下D-叶酸对照品储备液0.8㊁1.0㊁1.2mL(约相当于D-叶酸限度的80%㊁100%㊁120%)置100mL量瓶中ꎬ分别加入叶酸20mg用配样溶剂溶解并稀释至刻度ꎬ摇匀ꎬ各浓度平行配制3份ꎬ依法测定ꎬ计算回收率ꎬ结果见表1ꎮ表1㊀D-叶酸回收率试验结果(n=9)加入量/μg测得量/μg回收率(%)平均回收率(%)RSD(%)79.9576.3895.5379.9576.8796.1579.9577.4096.8199.9397.2097.2799.9397.3597.4297.241.2099.9399.6599.72119.92117.3897.88119.92116.5697.20119.92116.5197.162.9㊀样品检测㊀取叶酸3批ꎬ按照 2.2 项下方法配制供试品及D-叶酸对照品溶液ꎬ按照 2.1 项下色谱条件ꎬ分别取20μL注入色谱仪ꎬ记录色谱图及峰面积ꎬ按外标法计算ꎬ结果D-叶酸含量分别为0.049%㊁0.046%㊁0.043%ꎮ3 讨论3.1㊀检测波长选择㊀对D-叶酸对照品溶液进行全波长扫描ꎬ结果显示D-叶酸在280nm波长处有最大吸收ꎬ因此选用280nm检测波长进行检测ꎮ3.2㊀配样溶剂选择㊀叶酸在水㊁乙醇㊁乙腈中溶解性差ꎬ在碱性溶液中易溶ꎮ研究过程中分别选用流动相㊁甲醇㊁乙腈㊁5%氨水溶液㊁四氢呋喃-甲醇-水-醋酸-三乙胺(10ʒ80ʒ10ʒ2.4ʒ3)㊁3%三乙胺甲醇溶液作为配样溶剂ꎬ结果叶酸在流动相㊁甲醇㊁乙腈均不能完溶解ꎬ在5%氨水溶液㊁四氢呋喃-甲醇-水-醋酸-三乙胺(10ʒ80ʒ10ʒ2.4ʒ3)㊁3%三乙胺甲醇溶液中可以完全溶解ꎮ由于叶酸在3%三乙胺甲醇溶液中溶解快速且与流动相接近ꎬ因此最终选用3%三乙胺甲醇溶液作为最终配样溶剂ꎮ3.3㊀目前«欧洲药典»«日本药典»«美国药典»«英国药典»«中国药典»等多国药典均已收录叶酸质量标准ꎬ但均未对叶酸光学异构体进行控制ꎮ本研究建立了高效液相色谱法测定叶酸异构体D-叶酸的检测方法ꎬ并进行了方法学研究ꎬ结果表明该方法专属性强ꎬ可用于检测叶酸中异构体D-叶酸的含量ꎮ参考文献:[1]㊀吴宏富ꎬ黄卫平ꎬ刘放.高效液相色谱法测定叶酸片的含量与有关物质[J].医药导报ꎬ2014ꎬ33(3):389-392. [2]赵洪霞ꎬ梁劲松.高效液相色谱法测定叶酸片有关物质方法学研究[J].安徽农业科学ꎬ2011ꎬ39(28):17139-17140.[3]魏炜.色质联用分析叶酸杂质谱和未知残留溶剂[D].杭州:浙江工业大学ꎬ2016.[4]HOUSESHꎬNICHOLSJAꎬRAESꎬetal.Folatesꎬfolicacidandpreconceptioncare-areview[J].JRSMOpenꎬ2021ꎬ12(5):2054270420980875.[5]袁碧波ꎬ王秋霞ꎬ李增彦ꎬ等.叶酸代谢障碍与复发性流产相关性研究进展[J].国际妇产科学杂志ꎬ2021ꎬ48(2):191-195.[6]段梅红.叶酸不仅是孕育生命的需要[J].百科知识ꎬ2021(8):44-48.[7]胡浩梅ꎬ杨华.叶酸与不良生育的相关研究[J].国际妇产科学杂志ꎬ2021ꎬ48(1):89-94.[8]DELAFOURNIÈREBꎬDHOMBRESFꎬMAURICEPꎬetal.PreventionofNeuralTubeDefectsbyFolicAcidSup ̄plementation:ANationalPopulation-BasedStudy[J].Nu ̄trientsꎬ2020ꎬ12(10):3170.[9]BROWNLLꎬCOHENBEꎬEDWARDEꎬetal.Physiologi ̄calNeedforCalciumꎬIronꎬandFolicAcidforWomenofVariousSubpopulationsDuringPregnancyandBeyond.[J].JWomensHealthꎬ2021ꎬ30(2):207-211.[10]唐琴ꎬ宋航ꎬ付超ꎬ等.高效液相色谱手性固定相法拆分克伦特罗对映体[J].分析化学ꎬ2004ꎬ32(6):755-758. [11]康文怀ꎬ叶晓利ꎬ李慧ꎬ等.食品中叶酸分析方法及稳定性研究进展[J].河北科技大学学报ꎬ2019ꎬ40(5):446-453.[12]李娜ꎬ黄挺ꎬ全灿ꎬ等.叶酸标准物质中杂质的分析研究[J].化学试剂ꎬ2016ꎬ38(11):1077-1080.[13]徐陈凤ꎬ惠文凯ꎬ孙莉莉ꎬ等.基于超滤离心前处理的液相色谱-串联质谱法手性拆分人血浆中的亚叶酸和5-甲基四氢叶酸非对映异构体及其药代动力学应用[J].色谱ꎬ2019ꎬ37(6):581-588.[14]周书荣ꎬ李冰洁ꎬ陈雯ꎬ等.分离检测叶酸中叶酸及叶酸光学异构体的方法:112649524A[P].2021-04-13.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
s e p a r a t i o n w a s p e r f o me r d o n a h u m a n a l b u m i n c o a t e d s i l i c a g e l c o l u m n ( 1 5 0 mi nx 4 . 0 m m, 5 1 x m) . he T m o b i l e p h a s e w a s 0 . 1 m o l ・ L 0
s o d i u m d i h y d r o g e n P h o s p h a t e b u f e r( a d j u s t t o p H 5 . 0 w i t h s o d i u m h y d r o x i d e s o l u t i o n ) 一 2 - p op r a n o l — a c e t o n i t r i l e ( 8 9 0 : 9 5 : 1 5 ) . T h e l f o w
De  ̄r mi n a i f o n o f d e x t r o i s o me r i n Ca l c i u m l e v o f o l i n a t e b y HPLC
L i u F e n g l j S h e n Y u a n y u a n ( S c h o o l o f p h a r m a c y , S h a n g h a i J i a o T o n g U n i v e r s i t y , S h a n g h a i 2 0 0 2 4 0 , C h i n a )
Ke y wo r d s : HP L C C a l c i u m l e v o ol f i n a t e De x t oi r s o me r
碱破坏 、 氧化破坏 、 光照破 亚叶酸钙相关制剂很早就 应用于临床 ,在 2 0世 纪 5 0 年 定容。左 亚叶酸钙原料药在酸破坏 、 代, 就被用作 甲氨喋呤 的解救剂与 5 一 氟尿 嘧啶的增 效剂l 1 1 。然 坏和高温破坏 的条件下产生 的降解产 物 , 在选 定色谱条件下 , 而后 期研究表 明 , 只有左旋体 ( 左 亚叶酸钙 , C a l c i u m L e v o ol f i — 均可与右旋异构体色谱峰 、 左亚 叶酸钙色谱峰达到 良好分离。 h a t e ) 才具有 药理活性 , 使 用左旋体 的治疗剂 量仅 为亚叶酸钙 2 3. 2标准曲线 和范围试验 :精密称取亚 叶酸钙 消旋 体对照品 消旋 体的 5 0 %。本文建立 了测定左亚 叶酸钙原料 药 中右旋异 适 量 , 用水 溶解制成 0 。 5 m g ・ m L 的溶液 , 分别 精密量取适 量 , 构体 的 H P L C方法 。经过一系列 的方法验证试验证明 , 该方法 用水稀释制成质量浓度分别为 1 . 5 、 2 . 5 、 5 . 0 、 7 . 5和 1 0 . 0 1 x g ・ mL - 操作简便 、 灵敏度高 、 重复性好闭 。 的溶液 , 进样分析。以质量浓度 x为横坐标 , 峰面积 Y为纵 坐 标, 进行 线性 回归 , 右旋异构体 线性 回归 方程为 : Y = 2 9 . 1 2 5 X一 1 仪器与试药 1 . 1 仪器 : A g i l e n t 1 1 0 0高效液 相色谱仪 ( 安捷 伦公 司 ) :四元 1 . 0 0 2 5 ( r = 1 . 0 0 0 0 ) , 由r 值可知, 右旋 异构体 质量 浓 度在 1 . 5 ~ 泵、 自动进样 器 、 紫外检测 器 、 二极管 阵列检测 器 、 柱温箱 、 工 1 0 . 0 g ・ mL - 范围内 , 峰面积与质量浓度线性关 系 良好 。 . 3 - 3 定量 限和检测 限试验 :精密量取亚叶酸钙消旋体对 照品 作站 , B T 1 2 5 D电子天平 ( 赛多利斯公 司 ) , P B — l 0 酸度计 ( 赛多 2 溶 液适量 , 用水稀 释进样 , 测 得本法最低 定量质量 浓度 为 1 . 5 利斯公 司) 。 1 . 2 试药 :样品 :左 亚叶酸 钙原料 ( 由相关 药厂 提供 ,批 号 I x g ・ mL ( S / N—l O ) , 进样 量 为 1 5 n g ( 1 . 5 g ・ m L  ̄ 1 0  ̄ L x l 0 。 ) , 1 1 1 0 0 1 , 1 1 1 0 0 2 , 1 1 1 0 0 3 ) ; 对照 品 : 亚 叶酸钙消旋体对 照品( 欧 所 以本方法的定量限为 1 5 n g 。 继续用水稀释该溶液 , 测得检测 洲药 典 委员会 , 批号 5 . 0 ) ; 试剂 : 水 为重 蒸馏 水 ( 自制 ) , 异 丙 限为 5 n g 。 醇、 乙腈为 色谱纯 , 磷酸二氢钠 、 氢氧化钠为分析纯。 2 . 3 . 4精密度试验 : 精密量取亚叶酸钙消旋体对照 品溶液 , 连续 2 方法 与结果 进样 6次 ,记 录峰 面积 。计算右旋 异构 体峰 面积 的 R S D为 9 %。 2 . 1色谱条件 与系统适用性试验 :色谱柱 : C HI R A L — H S A( 1 5 0 0. m mx 4 . 0 mm, 5 1 x m) ; 流动相 : 0 . 1 mo l ・ L 磷酸 二氢 钠缓 冲液 ( 用 2 3. 5重复性试验 : 同“ 2 . 2 ” 项下方法 配制 左亚叶酸钙供试 品溶 氢氧化钠溶 液调节 p H至 5 . 0 ) 一 异丙 醇一 乙腈 ( 8 9 0 : 9 5 : 1 5 ) ; 流 液 6份 , 在上述 色谱 条件下进样 , 记 录峰面积 。计算 右旋 异构 速: 1 . 0 mL ・ a r i n 。 ; 检测波 长 : 2 8 6 n m; 柱温: 4 O ℃; 进样 量 : l 0 。 体 峰面积 的 R S D为 0 . 6 %。 2 . 3 . 6稳定性试验 : 取“ 2 . 2 ” 项下方法 配制的左亚 叶酸钙供 试品 左亚叶酸钙和右旋异构体色谱 峰的分离度应不小于 2 . 0 。 2 . 2溶 液 的制 备 溶液 , 保存 于室温条件下 , 于 0 、 1 、 2 、 4 、 6 、 8 、 1 0和 1 2小 时分别 0 t x L注入液相 色谱仪 , 记录色谱 图。计算右旋异 构体 峰面 2 . 2 . 1 对照品溶液的制备 :精密称取 亚叶酸钙消旋体对照 品适 取 1 量 ,用水溶解制
北方药学 2 0 1 3 年第 1 O 卷第 8 期
・
药品 质 量 及 检 验 ・
H P L C法测定左 亚 叶酸钙 中的右 旋异构体 △
刘凤丽 沈 园园( 上海交 通大学药学院 上海 2 0 0 2 4 0 )
摘要 : 目的 : 建立测定左 亚叶酸钙原料 药中右旋异构体含 量的 高效液相 色谱方 法。方法 : 采用 C HI R A L — HS A 色谱柱 ( 1 5 0 mm x 4 . 0 am, r 5 m) ,流动相 为 0 . 1 mo l ・ L - 磷 酸二 氢钠缓 冲液 ( 用氢氧化钠溶液调 节 p H至 5 . 0 ) 一 异 丙醇一 乙腈 ( 8 9 0 : 9 5 : 1 5 ) ;流速 为 1 . 0 mL ・ Bi n - ・ : 检测波长为 2 8 6 n m; 柱温为 4 0 。结果: 在1 . 5 — 1 0 . O l x g ・ mL - 范围内线性回归方程 为 Y = 2 9 . 1 2 5 X 一 1 . 0 0 2 5 ( r - = 1 . 0 0 0 0 ) , 平均 回收率 为 1 0 9 ) 。结论: 该 方法操作 简便 、 灵敏度 高、 重复性好。 关键词 : 高效液相 色谱法 左亚叶酸钙 右旋异构体 中图分类号 : R 9 2 7 . 2 文献标识码 : A 文章编号 : 1 6 7 2 - 8 3 5 1 ( 2 0 1 3 J 0 8 — 0 0 0 1 - 0 2
Ab s t r a c t :0b i i e t i v e : T o e s t a b l i s h a HP L C me t h o d f o r d e t e r mi n a t i o n t h e c o n t e n t o f d e x t r o i s o me r i n Ca l c i u m l e v o f o l i n a t e .Me t h o d s : T h e
r a t e w a s 1 . 0 mL・ mi n~ .Ul t r a v i o l e t a b s o r p t i o n d e t e c t o r wa s s e t a t 2 8 6 n m a n d c o l u mn t e mp e r a t u r e wa s a t 4 0 ℃ .Re s u l t s : h e T l i n e a r
r a n g e o f d e x t r o i s o me r w a s b e t w e e n 1 . 5 a n d 1 0 . 0 g ・ mL ( r = 1 . o 0 0 0 ) . he T a v e r a g e e r c o v e r y w a s 1 0 0 . 1% w i t h R S D w a s 0 . 8 %.
